МІКРОЕЛЕМЕНТОЗ ПРИ МІКРОСКОПІЧНОМУ ПОЛІАНГІЇТІ
Синяченко О.В., Герасименко А.М. , Синяченко П.О.
Резюме. Резюме. Мета і завдання. Дослідити вміст мікроелементів (МЕ) у волоссі та крові хворих на мікроскопічний поліангіїт (МПА), оцінити клініко-патогенетичну значущість мікроелементозу та зв’язок його з рівнем МЕ у довкіллі (у ґрунті).
Об’єкт і методи дослідження. Обстежено 47 хворих на МПА віком від 19 до 77 років. У волоссі та сироватці крові досліджено рівень 23 МЕ, використано метод атомно-абсорбційної спектрометрії (апарат з електрографітовим атомізатором «SolAAr-Mk2-MOZe»). Виконано порівняльну оцінку рівнів МЕ в організмі пацієнтів із параметрами МЕ (Ba, Be, Bi, Co, Cr, Cu, Hg, Li, Mn, Mo, Ni, Pb, Sn, Ti, V, Zn) у ґрунті.
Результати. При МПА спостерігається виражений мікроелементоз, який проявляється порушеннями концентрації у волоссі та крові багатьох токсичних та есенціальних МЕ, що визначається ступенем активності і тяжкістю перебігу захворювання, змінами з боку серця та зниженням ниркових функцій. МЕ мають прогностичну значущість, впливають на формування антинейтрофільних цитоплазматичних антитіл, беруть участь у патогенетичних побудовах уражень нервової системи, скелетних м’язів і нирок, при цьому концентрація МЕ в організмі залежить від рівня МЕ у ґрунті регіонів проживання хворих.
Висновки. Встановлено характер мікроелементозу при МПА, його зв’язок із рівнем МЕ у довкіллі.
Объект и методы исследования. Обследованы 47 больных МПА в возрасте от 19 до 77 лет. В волосах и сыворотке крови исследован уровень 23 МЭ, использован метод атомно-абсорбционной спектрометрии (аппарат с электрографитовым атомизатором «SolAAr-Mk2-MOZe»). Выполнена сравнительная оценка уровней МЭ в организме пациентов с параметрами МЭ (Ba, Be, Bi, Co, Cr, Cu, Hg, Li, Mn, Mo, Ni, Pb, Sn, Ti, V, Zn) в почве.
Результаты. При МПА наблюдается выраженный микроэлементоз, который проявляется нарушениями концентраций в волосах и крови многих токсичных и эссенциальных МЭ, что определяется степенью активности и тяжестью течения заболевания, изменениями со стороны сердца и снижением почечных функций. МЭ обладают прогностической значимостью, влияют на формирование антинейтрофильных цитоплазматических антител, участвуют в патогенетических построениях поражений нервной системы, скелетных мышц и почек, при этом концентрация МЭ в организме зависит от уровня МЭ в почве регионов проживания больных.
Выводы. Установлены характер микроэлементоза при МПА, его связь с уровнем МЭ в окружающей среде.
Введение
Микроскопический полиангиит (МПА) — некротизирующий системный васкулит, поражающий мелкие сосуды (капилляры, артериолы) с отсутствием или незначительным количеством иммунных комплексов (Aydin Z. et al., 2011; Markovic A., 2012; Ruperto N., 2012; Дядык А.И. и соавт., 2013). Все системные васкулиты отмечают у 0,02% взрослого населения, из них доля МПА составляет ≈46% случаев (Mohammad A.J. et al., 2009). Распространенность этого заболевания в странах Европы составляет от 0,5 до 13 человек на 10 тыс. населения (Panagiotakis S.H. et al., 2009; Watts R.A. et al., 2012), а в государствах Азии МПА является самым частым вариантом системного васкулита (Fujimoto S. et al., 2011; Tsuchiya N., 2012).
Постоянное воздействие на организм высоких концентраций токсичных и некоторых эссенциальных микроэлементов (МЭ) окружающей среды проживания людей повышает в этих регионах риск развития системного васкулита (Moyer C.F. et al., 2009; Hosseini S.V. et al., 2012). Существует связь возникновения таких заболеваний с Cu, Fe, Mn, Pb и Zn (Er-Deng-Sang E. et al., 2011). Экзогенное воздействие высокого содержания в атмосфере, почве и грунтовых водах Al, Cu и Si способствует формированию в организме людей антинейтрофильных цитоплазматических антител (АНЦА), а те, в свою очередь — развитию МПА (Ebihara I., Kawami M., 2009; Seike M. et al., 2009; Miyazaki K. et al., 2010; Shibuya H. et al., 2010). Содержание МЭ в волосах и крови больных МПА, клинико-патогенетическая значимость микроэлементоза и связь его с уровнем МЭ в окружающей среде (в частности в почве) остаются неизвестными. Изучение этого стало целью и задачами данного исследования.
Объект и методы исследования
Показатели МЭ в волосах, которые являются накопителями МЭ в организме, и в сыворотке крови изучены у 47 больных МПА в возрасте от 19 до 77 лет (в среднем — 44,2±1,83 года). Среди обследованных пациентов было 55% мужчин и 45% женщин. Длительность заболевания составила 6,0±1,2 года, острое или подострое течение МПА констатировано в 28% наблюдениях, хроническое — в 72%, І степень активности патологического процесса отмечена в 11% случаев, ІІ — в 34%, ІІІ — в 55%. На момент обследования поражение кожи диагностировано у 92% количества пациентов, почек — у 72%, суставов — у 68%, сердца — у 60%, печени — у 58%, нервной системы — у 51%, легких — у 49%, скелетных мышц — у 45%, селезенки — у 13%. Артериальная гипертензия установлена в 58% наблюдений, усредненные показатели среднего артериального давления составили 118±2,3 мм рт. ст., общего периферического сосудистого сопротивления — 2776±96,1 дин · с · см–5. Снижение функции почек имело место у 62% числа больных с нефропатией (І стадии у 35%, ІІ — у 18%, ІІІ — у 9%), параметры скорости клубочковой фильтрации (по формуле Кокрофта — Голта) — 97±4,6 мл/мин. Анемия отмечена у 58% количества больных, лейкоцитоз — у 12%, АНЦА выявлены в 87% наблюдений, в том числе антитела к миелопероксидазе — у 70% количества обследованных, к протеиназе-3 — у 26% (в 21% случаев — одновременно оба варианта антител). Кроме того, у 40% количества обследованных пациентов выявлены антитела к нативной дезоксирибонуклеиновой кислоте (ДНК), у 30% — антитела к кардиолипину.
В волосах больных МПА исследован уровень 23 МЭ (Al, As, B, Ba, Be, Bi, Cd, Co, Cr, Cu, Fe, Li, Mn, Mo, Ni, Pb, S, Sb, Se, Sn, Sr, V, Zn), а в сыворотке крови — 11 из них (B, Ba, Co, Cu, Fe, Li, Mn, Pb, S, Sr, Zn). Использован метод атомно-абсорбционной спектрометрии (аппарат с электрографитовым атомизатором «SolAAr-Mk2-MOZe», Великобритания). В качестве контроля МЭ изучены у 44 практически здоровых людей в возрасте от 20 до 60 лет. Во всех случаях не отмечено каких бы то ни было профессиональных вредностей, способных оказывать влияние на состав МЭ в волосах (обследованные были студентами и служащими — медицинскими, педагогическими, финансовыми, торговыми и техническими работниками). Выполнена сравнительная оценка уровня МЭ в волосах и крови больных с параметрами 16 МЭ (Ba, Be, Bi, Co, Cr, Cu, Hg, Li, Mn, Mo, Ni, Pb, Sn, Ti, V, Zn) в почве, которые были получены санитарно-гигиеническими станциями и региональными отделениями Комитета по гидрометеорологии, контролю природной среды и экологической безопасности.
Статистическая обработка полученных результатов исследований проведена с помощью компьютерного вариационного, непараметрического, корреляционного, одно- (ANOVA) и многофакторного (ANOVA/MANOVA) дисперсионного анализа (программы «Microsoft Excel» и «Statistica-Stat-Soft»). Оценивали средние значения (M), их стандартные отклонения (SD) и ошибки (m), коэффициенты корреляции, критерии дисперсии, Стьюдента (t), Уилкоксона — Рао, Макнемарам — Фишера и отличия статистических показателей (p).
Результаты исследования
Только содержание Cu и Sn в волосах больных МПА не отличалось от аналогичных параметров у здоровых (рис. 1). Микроэлементоз у таких пациентов проявляется достоверным повышением показателей Al, As, B, Fe, Mo и Sb на фоне сниженных концентраций Ba, Be, Bi, Cd, Co, Cr, Li, Mn, Ni, Pb, S, Se, Sr, V и Zn. Таким образом, регистрируется снижение уровня в волосах не только эссенциальных, а и токсичных МЭ.
По данным многофакторного анализа Уилкоксона — Рао, на интегральный состав МЭ в волосах больных МПА оказывают воздействие степень активности заболевания, тяжесть течения болезни и поражение нервной системы (проявляется дисциркуляторной энцефалопатией, кортиконуклеарным и пирамидным синдромами, цервикокраниалгией и полинейропатией). По результатам выполненного ANOVA, степень активности МПА влияет на содержание в волосах Cd, длительность заболевания — на параметры Cd, Co и Cu, характер его течения — на Sb, интегральная тяжесть патологического процесса — на Li. С тяжестью кожного синдрома связана концентрация в волосах Mo, а от наличия патологии почек зависят уровни Al, Co и Li. Скорость клубочковой фильтрации определяет значения Al, Cd, Cr, Fe, Pb, Sn, Sr, V и Zn.
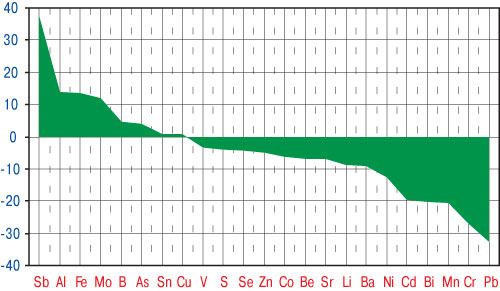
Рис. 1. Степень отличий параметров МЭ в волосах больных МПА от значений у здоровых людей (критерий Стьюдента)
С возрастом больных снижается содержание в волосах As, что демонстрирует корреляционный анализ. Степень активности МПА прямо коррелирует с параметрами Al, Be, Sb и Sn, а обратно соотносится с Se и Zn. Тяжесть течения заболевания позитивно связана с уровнем в волосах Li, а скорость клубочковой фильтрации (то есть показатель функции почек) — негативно с Al и Sn. Как видно из табл. 1, ухудшение функции почек сопровождается достоверным повышением на 49% уровня Al, на 35% Fe, на 42% Mo, в 2,5 раза Pb и в 2,1 раза Sn при снижении на 32% Li, на 6% S, на 57% Sr и на 39% Zn.
С учетом выполненного вариационного, дисперсионного и корреляционного анализа сделаны заключения, имеющие определенную практическую значимость: 1) показатели в волосах Li >17 нг/г (>M+SD всех больных МПА) свидетельствуют о тяжелом течении заболевания; 2) параметры в волосах Al >11 мкг/г и Sn >3 нг/г (>M+SD больных с почечной недостаточностью) являются прогнознеблагоприятными в отношении снижения функции почек.
По результатам выполненного ANOVA/MANOVA, при МПА на интегральное содержание МЭ в крови оказывают высокодостоверное воздействие пол больных, степень активности заболевания, поражение почек и сердца. МПА проявляется повышением концентраций в крови Li на 74%, на 11% Sr и Zn при снижении на 63% В, на 53% Mn и на 12% S. Эти сведения отражены на рис. 2, а как видно из табл. 2 и рис. 3, снижение функции почек у больных МПА сопровождается достоверным повышением в крови параметров Со на 8%, S на 15% и Zn на 12%. Как показывает однофакторный дисперсионный анализ, интегральная тяжесть течения болезни влияет на содержание в сыворотке крови Ва и Fe, активность патологического процесса — на значения Со и Fe, выраженность суставной патологии — на уровень Li, наличие почечной недостаточности — на Со, Fe, Li и Zn.
Таблица 1. Показатели МЭ в волосах больных МАП с сохраненной и сниженной функцией почек (M±SD±m)
| Показатели | Функция почек | Отличия | ||
|---|---|---|---|---|
| сохранена (n=26) |
снижена (n=21) |
t | p | |
| Al, мкг/г As, нг/г B, мкг/г Ba, мкг/гBe, нг/гBi, нг/г Cd, нг/г Co, нг/г Cr, нг/г Cu, мкг/г Fe, мкг/г Li, нг/г Mn, нг/г Mo, нг/г Ni, мкг/г Pb, мкг/г S, мг/г Sb, нг/г Se, мкг/г Sn, нг/г Sr, мкг/г V, нг/г Zn, мкг/г |
6,3±2,28±0,45 393,3±229,61±45,03 0,7±0,50±0,10 0,4±0,21±0,042,8±0,11±0,020,4±0,05±0,01 103,9±4,13±0,81 3,8±4,14±0,81 267,0±53,41±10,48 11,7±2,69±0,53 12,3±5,25±1,03 13,3±5,63±1,10 0,5±0,23±0,05 48,9±21,59±4,23 0,6±0,30±0,06 2,9±2,11±0,41 41,3±4,51±0,89 221,7±12,94±2,54 0,4±0,16±0,03 1,0±0,83±0,16 4,7±3,83±0,75 50,8±4,01±0,79 148,8±55,99±10,98 |
9,4±1,60±0,35 409,2±146,24±31,910,9±0,51±0,11 0,4±0,20±0,04 2,8±0,08±0,02 0,3±0,07±0,02 159,8±137,71±30,05 5,4±5,52±1,21 273,8±50,15±10,94 13,3±3,22±0,70 16,6±6,45±1,41 9,0±4,35±0,95 0,6±0,36±0,08 69,5±37,59±8,20 0,6±0,19±0,04 7,2±6,82±1,49 38,8±1,46±0,32 225,7±9,22±2,01 0,5±0,14±0,03 2,1±1,19±0,26 2,0±3,33±0,73 49,5±4,65±1,01 90,1±24,64±5,38 |
5,32 0,28 1,36 0,120,991,34 1,93 1,14 0,44 1,77 2,55 2,84 1,09 2,36 0,15 3,02 2,48 1,20 1,13 3,58 2,54 1,01 4,47 |
<0,001 0,784 0,180 0,9050,3250,188 0,060 0,262 0,662 0,083 0,014 0,007 0,282 0,023 0,882 0,004 0,017 0,238 0,265 0,001 0,015 0,317 <0,001 |
Таблица 2. Показатели МЭ в крови больных МАП с сохраненной и
сниженной функцией почек (M±SD±m)
| Показатели | Функция почек | Отличия | ||
|---|---|---|---|---|
| сохранена (n=26) |
снижена (n=21) |
t | p | |
| B, мкг/л Ba, мкг/л Co, мкг/л Cu, мкг/лFe, мг/лLi, мкг/л Mn, мкг/л Pb, мкг/л S, мг/мл Sr, мкг/л Zn, мг/л |
22,3±8,55±1,68 3,8±0,12±0,02 7,7±0,66±0,13 1,0±0,26±0,05413,7±75,50±14,814,0±0,72±0,14 8,5±1,16±0,23 35,8±32,53±6,38 1,3±0,08±0,02 37,8±8,07±1,58 6,5±0,82±0,16 |
19,4±1,50±0,33 3,7±0,20±0,04 8,3±0,42±0,09 1,0±0,26±0,06416,4±116,32±25,384,0±1,04±0,26 8,6±1,57±0,34 36,5±26,64±5,81 1,5±0,12±0,03 34,7±4,27±0,93 7,3±0,83±0,18 |
1,50 1,32 3,56 0,520,100,04 0,42 0,08 2,48 1,60 3,71 |
0,140 0,194 0,001 0,6030,9240,966 0,679 0,940 0,017 0,116 0,001 |
Степень активности МПА обратно соотносится с показателем ферремии, тяжесть течения болезни имеет негативную корреляционную связь с концентрацией в крови Ва, а скорость клубочковой фильтрации — с содержанием Zn. C учетом проанализированных данных сделаны следующие заключения: 1) высокую степень активности МПА отражают параметры в крови Fe <320 мг/л (<M–SD всех больных); 2) уровень в сыворотке крови Ва <3 мкг/л соответствует тяжелому течению болезни; 3) показатели Zn >8 мг/л (>M+SD пациентов с почечной недостаточностью) являются прогностически неблагоприятными в отношении снижения функции почек.
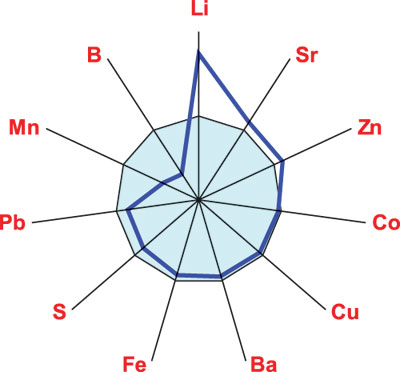
Рис. 2. Отличия уровня МЭ в крови больных МПА и здоровых людей, которые приняты за 100%
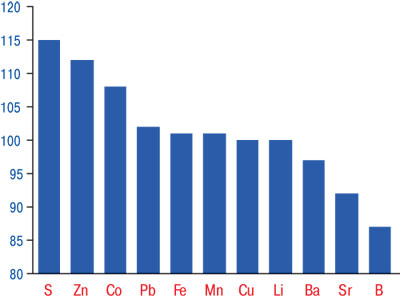
Рис. 3. Отличия уровня МЭ в крови больных МПА со сниженной и сохраненной функцией почек, которые приняты за 100%
Следующим этапом нашей работы стала оценка патогенетической значимости микроэлементоза при МПА. Степень активности заболевания зависит от уровня в волосах Al, Be, Sb, Se, Sn и Zn, a в крови — от Co и Pb. Тяжесть течения заболевания тесно связана с содержанием в волосах антиоксидантного Se, артериальное давление — c показателями в волосах Sr, а в крови Pb, общее периферическое сосудистое сопротивление — с Be, Sb, Sn в волосах и Li в крови, функция почек — соответственно с Mo и Li. Как показывает выполненный нами дисперсионный анализ, формирование АНЦА в крови больных МПА связано с параметрами ферремии, антител к ДНК — с уровнем в крови марганца. На показатели антител к миелопероксидазе влияет содержание в волосах Al и Co, а антител к протеиназе-3 — уровень V.
Параметры Li как в волосах, так и в крови влияют на поражение скелетных мышц, Со — нервной системы, Zn — почек. В этой связи представим некоторые комментарии. Щелочной металл Li влияет на тканевое дыхание, углеводный и кальциевый обмен, активирует протеинкиназу-С, способен дозозависимо усиливать синтез некоторых цитокинов (например интерлейкинов-2, -6, -12). Со входит в состав цианокобаламина, оказывающего влияние на кроветворение, усвоение Fe и витаминов, ферментную деятельность, углеводный обмен, синтез мышечных белков и тиреоидных гормонов (Синяченко О.В., 2008). Данный МЭ относится к факторам риска развития аллергических реакций и формирования противоядерных антител с возникновением аутоиммунных заболеваний (Leem J.H. et al., 2009). Zn регулирует активность более 200 ферментных систем, участвует в процессах биосинтеза белка и аминокислот, в регуляции свойств клеточных мембран, входит в состав иммуноглобулинов, определяет дифференцировку Т-лимфоцитов, стимулирует продукцию интерлейкина-2, является кофактором матриксных металлопротеиназ (аггреканазы, желатиназы, коллагеназы, стромелизины, эластазы), концентрация его в крови возрастает при некоторых системных васкулитах, а снижается при заболеваниях почек (Синяченко О.В., 2008; Kidd P., 2009).
Многоцентровые исследования, проведенные в разных регионах земного шара, свидетельствуют о происходящем постоянном повышении концентрации в организме людей токсичных As, Cd, Hg и Pb вследствие большого поступления этих МЭ с вдыхаемым воздухом, питьевой водой и пищей (Horton L.M. et al., 2013). К так называемым экологическим ядам, оказывающим влияние на развитие сосудистой патологии, относятся высокие концентрации в атмосфере ряда тяжелых металлов (Kim M. et al., 2012; Yang X. et al., 2013). С учетом этого нами при МПА проанализирована связь концентраций изученных токсичных и эссенциальных МЭ в волосах и крови с уровнем МЭ в почве регионов проживания больных.
Ранее нами показано накопление МЭ в волосах, находящихся в почве, что определяет распространенность и течение заболеваний ревматологического профиля (Синяченко О.В., 2007; Пушкарева Е.Е. и соавт., 2010; Петренко Е.А. и соавт., 2012; Синяченко О.В. и соавт., 2012). У больных МПА установлена достоверная связь параметров Cr и Li в волосах с содержанием соответствующих МЭ в почве. В процессе работы были отобраны концентрации тех МЭ в волосах и крови обследованных пациентов, которые одновременно подтверждались достоверными дисперсионными и прямыми корреляционными связями с уровнями грунтовых МЭ. Оказалось, что показатели в волосах В зависят от параметров в почве Hg, Be — от Cu, Cu — от Cr, Hg, Li и Mn. Существует четкое влияние на значения кобальтемии у больных МПА уровня в почве Cu.
Выводы
1. При МПА наблюдается выраженный микроэлементоз, который проявляется нарушениями концентрации в волосах и крови многих токсичных и эссенциальных МЭ (одновременно в этих двух объектах исследования — Fe, Li, Mo, Pb, S, Sr, Zn).
2. Изменения МЭ в организме больных МПА определяются степенью активности и тяжестью течения заболевания, изменениями со стороны сердца и снижением почечных функций, причем, показатели Al, Ba, Fe, Li, Sn и Zn обладают прогностической значимостью.
3. Параметры Al, Co, Fe, Sb и V при МПА влияют на формирование АНЦА (антител к миелопероксидазе и протеиназе-3), а содержание Со участвует в патогенетических построениях поражений нервной системы, Li — скелетных мышц, Zn — почек.
4. Концентрация в организме больных МПА В зависит от уровня в почве регионов проживания больных Hg, Be и Co — Cu, Cu — Cr, Hg, Li и Mn.
Список использованной литературы
- Дядык А.И., Холопов Л.С., Зборовский С.Р. (2013) Системные васкулиты в современной клинической практике. Издатель Заславский, Донецк, 248 с.
- Петренко Е.А., Науменко Н.В., Синяченко О.В. (2012) Особенности течения ревматоидного артрита в зависимости от уровней микроэлементов в почве регионов проживания больных. Арх. клин. експеримент. мед., 21(2): 69–72.
- Пушкарева Е.Е., Синяченко О.В., Ермолаева М.В. (2010) Влияние микроэлементов окружающей среды на течение псориатического артрита. Вестн. гигиен. эпидемиол., 14(1): 33–37.
- Синяченко О.В. (2007) Ревматические заболевания и экология. Укр. ревматол. журн., 30(4): 64–68.
- Синяченко О.В. (2008) Металлы при остеоартрозе. Норд-Пресс, Донецк, 404 с.
- Синяченко О.В., Петренко Е.А., Науменко Н.В. и др. (2012) Зависимость распространенности ревматоидного артрита от экологических факторов внешней среды. Укр. ревматол. журн., 47(1): 30–34.
- Aydin Z., Gursu M., Karadag S. еt al. (2011) Role of plasmapheresis performed in hemodialysis units for the treatment of anti-neutrophilic cytoplasmic antibody-associated systemic vasculitidesю Ther. Apher. Dial., 15 (5): 493–498.
- Ebihara I., Kawami M. (2009) Mineral dust exposure and systemic diseases. J. Environ Pathol. Toxicol. Oncol., 19(1–2): 109–127.
- Er-Deng-Sang E., Hang G.B., Ba T. (2011) Determination of trace elements in Mongolian medicine Zidianling curing allergic purpura disease by ICP-AES. Guang Pu Xue Yu Guang Pu Fen Xi, 28(11): 2679–2683.
- Fujimoto S., Watts R.A., Kobayashi S. еt al. (2011) Comparison of the epidemiology of anti-neutrophil cytoplasmic antibody-associated vasculitis between Japan and the U.K. Rheumatology, 50(10): 1916–1920.
- Horton L.M., Mortensen M.E., Iossifova Y. еt al. (2013) What do we know of childhood exposures to metals (arsenic, cadmium, lead, and mercury) in emerging market countries? Int. J. Pediatr., 20: R.872596.
- Hosseini S.V., Aflaki F., Sobhanardakani S. еt al. (2012) Analysis of mercury, selenium, and tin concentrations in canned fish marketed in Iran. Environ Monit. Assess., 12(12): 117–119.
- Kidd P. (2009) Th1/Th2 balance: the hypothesis, its limitations, and implications for health and disease. Altern. Med. Rev., 8(3): 223–246.
- Kim M., Bae M., Na H. еt al. (2012) Environmental toxicants — induced epigenetic alterations and their reversers. J. Environ Sci. Health Environ Carcinog. Ecotoxicol. Rev., 30(4): 323–367.
- Leem J.H., Hong Y.C., Song J.S. (2009) Pulmonary fibrosis in a steel mill worker. J. Korean Med. Sci., 15(2): 224–228.
- Markoviс A. (2012) Vasculitis and vasculopathy. Acta Med. Croatica, 66(1): 19–24.
- Miyazaki K., Fukuzumi M., Aizawa T. еt al. (2010) Patient with MPO-ANCA-associated disease with interstitial pneumonia and lower cranial nerves palsy who was previously exposed to asbestos. Nihon Kokyuki Gakkai Zasshi, 48(11): 876–882.
- Mohammad A.J., Jacobsson L.T., Westman K.W. еt al. (2009) Incidence and survival rates in Wegener’s granulomatosis, microscopic polyangiitis, Churg-Strauss syndrome and polyarteritis nodosa. Rheumatology, 48(12): 1560–1565.
- Moyer C.F., Kodavanti U.P., Haseman J.K. еt al. (2009) Systemic vascular disease in male B6C3F1 mice exposed to particulate matter by inhalation: studies conducted by the National Toxicology Program. Toxicol. Pathol., 30(4): 427–434.
- Panagiotakis S.H., Perysinakis G.S., Kritikos H. еt al. (2009) The epidemiology of primary systemic vasculitides involving small vessels in Crete (southern Greece): a comparison of older versus younger adult patients. Clin. Exp. Rheumatol., 27(3): 409–415.
- Ruperto N. (2012) Paediatric rheumatology international trials organisation (PRINTO). Classification criteria and diagnostic tests for vasculitides. J. Rheumatol., 39(8): 1503–1505.
- Seike M., Enomoto T., Henmi S. еt al. (2009) Microscopic polyangiitis accompanying interstitial pneumonia with aluminum lung. Nihon Kokyuki Gakkai Zasshi, 38(5): 408–412.
- Shibuya H., Sano H., Osamura K. еt al. (2010) Microscopic polyangiitis accompanied by pleuritis as the only pulmonary manifestation of occupational silica exposure. Intern. Med., 49(10): 925–929.
- Tsuchiya N. (2012) Genetics of ANCA-associated vasculitis in Japan: a role for HLA-DRB1*09:01 haplotype. Clin. Exp. Nephrol., 23(11): 132–136.
- Watts R.A., Mooney J., Skinner J. еt al. (2012) The contrasting epidemiology of granulomatosis with polyangiitis (Wegener’s) and microscopic polyangiitis. Rheumatology, 51(5): 926–931.
- Yang X., Shen Z., Zhang B. еt al. (2013) Silica nanoparticles capture atmospheric lead: implications in the treatment of environmental heavy metal pollution. Chemosphere, 90(2): 653–656.
Адрес для переписки:
Синяченко Олег Владимирович
83003, Донецк-3, просп. Ильича, 16
Национальный медицинский университет
им. Максима Горького,
кафедра пропедевтики внутренней медицины и общей практики — семейной медицины
Е-mail: synyachenko@ukr.net

Leave a comment