Випадок абдомінального ішемічного синдрому атеросклеротичного генезу у хворої на системний червоний вовчак
Волошин О.І.1, Копчак В.М.2, Копчак К.В.2, Гончар Л.В.1, Кондратюк В.А.2, Андронік С.В.2
- 1Буковинська державна медична академія, Чернівці
- 2Національний інститут хірургії та трансплантології ім. О.О. Шалімова НАМН України
Резюме. У статті наведено опис клінічного випадку абдомінального ішемічного синдрому атеросклеротичного походження у хворої на системний червоний вовчак (СЧВ) з успішним лікуванням шляхом стентування верхньої брижової артерії. Диференційна діагностика та підтвердження атеросклеротичного ураження грудного і черевного відділів аорти та її гілок досягнуті шляхом рентгено- та магнітно-резонансної комп’ютерної діагностики, вазоконтрастних методів. Доведена ефективність патогенетично-обґрунтованої комбінованої пульс-терапії (преднізолон 1000 мг, циклофосфамід 1000 мг) повторними курсами при загостреннях (загальним числом більше 90 пульс-інфузій впродовж 12 років) з подальшим призначенням підтримувальної терапії преднізолоном від 120 до 50–30 мг/добу з відповідним прикриттям гастропротекторними, гіпотензивними, коректорами калієвого, кальцієвого обміну, симптоматичними. Ціна такої терапії — переведення з підгострого перебігу СЧВ з високою активністю та ураженням нирок з нефротичним синдромом, серця, легень, суглобів, шкіри та цереброваскулітом у хронічний перебіг з мінімальною активністю з ураженням нирок без нефротичного синдрому, шкіри та суглобів, подовження тривалості життя на 32 роки, але з розвитком раннього і вираженого атеросклеротичного ураження судин переважно черевної порожнини, стероїд-індукованого остеопорозу кісткового апарату, компресією LІ–LІІІ, кушингоїдним синдромом.
Особливостями імунокомплексного ураження судин при дифузних захворюваннях сполучної тканини (ДЗСТ) здавна приділялася значна увага [5, 6, 10]. В останнє десятиріччя посилені наукові акценти звернуті на дослідження раннього розвитку атеросклеротичного нашарування на попередньо структурно та функціонально змінені судинні шари, переважно ендотелій [2, 9, 10]. У клінічному аспекті зазначається про серцево-судинні прояви атеросклерозу (стенокардія, інфаркт міокарда), церебральні (транзиторні ішемічні атаки, інсульти) [5, 6, 7] і доволі рідко — про ураження судин черевної порожнини.
За допомогою інструментальних, біохімічних та імуноферментних методів ранньої діагностики атеросклеротичного ураження судин доведено, що цей процес починається навіть у підлітковому віці [8].
У більшості зазначених повідомлень наведено докази існування цієї залежності, проводяться глибокі дослідження ймовірних патогенетичних механізмів виникнення атеросклерозу, з яких видно, що порушення ліпідного обміну не є визначальними. Однак ще недостатньо даних для розуміння, при якому ступені активності ДЗСТ, його тривалості, вікостатевої залежності формується атеросклероз, який можливий «внесок» здійснюваної терапії, у тому числі для запобігання побічним діям та ускладненням від застосування базисних препаратів [1, 3, 4]. Відповіді на ці запитання, ймовірно, сформуються згодом, з накопиченням нових клінічних матеріалів і тривалих клінічних спостережень. Найбільше публікацій подібного спрямування відзначається стосовно ревматоїдного артриту та системного червоного вовчака (СЧВ) [2, 6, 7, 9].
Наводимо приклад нашого клінічного спостереження розвитку глибокого атеросклерозу та кальцинозу судин черевної порожнини з явищами вираженого абдомінального ішемічного синдрому у хворої на СЧВ.
Хвора Д., 42 років (історія хвороби № 5545), інвалід ІІ групи з приводу СЧВ, поступила в ревматологічне відділення Міської клінічної лікарні № 3 м. Чернівці в листопаді 2011 р. з вираженим постійним болем по всьому животі, переважно у верхній ділянці, що різко посилювався при найменшому прийомі навіть дієтичної їжі, води або чаю, виражену слабкість, запаморочення, схуднення на 20 кг за останні півроку, боязкість вживання їжі.
З анамнезу вияснено, що з 10-річного віку хворіє на СЧВ з частими і тяжкими рецидивами, які в основному компенсувалися численними курсами пульс-терапії преднізолону та циклофосфаміду, а в останні 5–6 років досягнуто стану неповної ремісії на 30 мг постійного прийому преднізолону. Абдомінальний больовий синдром проявився 6 міс тому, повільно наростав, була чітка залежність його посилення від прийому їжі, внаслідок чого пацієнтка вимушена була задовольнятися менше ніж дитячими дозами (порціями) надміру дієтичної їжі 1–2 рази на день, внаслідок чого за 6 міс схудла на 20 кг. Будь-які ліки від звичайних спазмолітиків до трамадолу не зменшували вираженість болю. Госпіталізацій та звернень до лікарів уникала, боячись респіраторних інфекцій, до яких здавна відзначала високу схильність та провокуючий їх вплив на загострення СЧВ.
Об’єктивно: стан хворої середньої тяжкості, зниженого живлення, свідомість ясна; шкірні покриви бліді, тургор знижений, відзначаються еритематозні зміни шкіри обличчя (не метелик), шиї, поліморфні висипання на тулубі, кінцівках, долонях. Дрібні ерозивні ураження слизової оболонки ротової порожнини, носових ходів. Незначне збільшення лімфатичних вузлів шиї, над-, підключичних та пахвових, без болючості. Помірні артритичні зміни суглобів верхніх і нижніх кінцівок, особливо стоп та кистей, з помірним порушенням їх функцій, субатрофічні ураження м’язів з помірним зниженням їх тонусу. Кістки гомілок, плечові, грудні та поперекові хребці при надавлюванні та перкусії помірно болючі. Маса тіла 38 кг при зрості 156 см (ІМТ = 15,6).
Пульс 106 уд./хв, ритмічний, напружений. Ліва межа серця на 0,5 см вліво від лівої середньо-ключичної лінії, верхня та права — у межах норми. Аускультативно тахікардія, тони серця ослаблені, помірний систолічний шум на верхівці, акцент ІІ тону на аорті, артеріальний тиск 170/90 мм рт. ст. Фізикально з боку органів дихання патології не виявлено. Язик обкладений білим нашаруванням, сухуватий. Живіт правильної форми, бере участь в акті дихання, при поверхневій пальпації м’який, значна болючість при глибокій пальпації по всій епігастральній, мезогастральній ділянках, помірна — в гіпогастрії, по ходу висхідного, низхідного відрізків товстої кишки. Симптомів подразнення очеревини не виявлено. Печінка незначно збільшена, 2 см нижче ребрової дуги, щільнувата, неболюча; болючість у ділянці жовчного міхура не відрізняється від болючості в інших місцях епігастрію. Симптоми Грекова — Ортнера, Мюссі — Георгієвського слабопозитивні. Селезінка не збільшена. Нирки не пальпуються, симптом Пастернацького сумнівний з обох боків. У неврологічному статусі відхилень не виявлено.
Впродовж 12 днів здійснено такі дослідження:
Загальний аналіз крові: Ер — 4,0*10; Нb — 120 г/л; КП — 0,9; Л — 7,4•10; е — 1; п — 2; с — 64; л — 32; м — 1; тромбоцити — 240•10; ШОЕ — 6 мм/год.
Загальний аналіз сечі: світло-жовта, мутна, реакція кисла, питома щільність — 1,017; білок — 1,65‰, глюкоза — не виявлена, епітелій пл. — 7–8 в п/з, лейкоцити — 6–8 в п/з.
Ан. калу на яйця; гельмінтів — не виявлено.
Ревмопроби: титр АСЛО — 250 од, СРБ +++, серомукоїд — 545 од, сіаловий тест — 438 од, РФ — негативний. LE-клітини у крові 10 на 100 клітин.
Глюкоза крові — 4,9 ммоль/л. Біохімічний аналіз крові: білірубін загальний — 5,8 мкмоль/л, прямий — 2,2 мкмоль/л, загальний холестерин — 3,8 ммоль/л, тригліцериди — 1,52 ммоль/л, сечова кислота — 415 ммоль/л, сечовина — 5,3 ммоль/л, креатинін — 92 мкмоль/л; загальний білок — 51,0 г/л; альбумін — 33 г/л; активність ферментів: АлАТ — 18 од/л, АсАТ — 25 од/л, ЛДГ — 454 од/л, ГГТП — 113 од/л, лужної фосфатази — 96 од/л; рівень кальцію — 2,02 ммоль/л, заліза — 9,7 мкмоль/л, фосфору — 1,47 ммоль/л.
Імунограма: Т-лімфоцити: Е-РОК — 35%; А-Е-РОК — 27%; Ts — 16%; Th — 18%; Th/Ts — 1,1; В-лімфоцити — 28%; IgA — 2,8 г/л; IgM — 1,3 г/л; IgG — 14 г/л; фагоцитарна активність — 68%; фагоцитарне число — 4,8; НСТ-тест спонтанний — 10; НСТ-тест стимульований пірогеналом — 32; ЦІК — 78 од; титр нормальних антитіл 1:32; титр комплементу — 0,08.
ЕКГ: ритм синусовий, електрична вісь серця не відхилена. Значно виражені зміни передньосептальних, нижніх і бокових відділів лівого шлуночка, гіпертрофія лівого шлуночка.
ЕхоКГ: незначне збільшення порожнини лівого передсердя, помірна гіпертрофія лівого шлуночка, в базальному відділі міжшлуночкова перегородка потовщена до 1,68 см, що дещо звужує вихідний тракт лівого шлуночка, але при допплер-ехоКГ обструкції не виявлено. Фракція викиду — 61%. Стулки аортального, мітрального клапанів (МК) помірно ущільнені, мінімальна регургітація на МК, на трикуспідальному клапані — 1–2 ст. Виявлені помірні ознаки атеросклерозу.
Рентгенографія органів грудної клітки: легеневий малюнок без вогнищевих та інфільтративних змін, корені структурні. Серце — гіпертрофія лівого шлуночка, помірний атеросклероз дуги аорти, виражений атеросклероз грудного її відділу.
УЗД органів черевної порожнини та нирок: УЗ-ознаки калькульозного холециститу, панкреатиту, нефроптозу, ліпоми правої нирки, кісти лівої нирки.
Гастродуоденофіброскопія: ерозивний гастрит, поверхневий дуоденіт.
Комп’ютерна рентгенотомографія: картина хронічного калькульозного холециститу, панкреатиту без ознак загострення, ознак пієлонефриту, лівобічного мікроуролітіазу, вираженого атеросклерозу черевного відділу аорти (рис. 1, 2).
Згідно з анамнестичними даними, інформацією з клінічного, лабораторно-інструментального, імунобіохімічного досліджень за час перебування в ревматологічному відділенні звернута увага на невідповідність абдомінального больового синдрому проявам активності СЧВ, набутій патології системи травлення переважно медикаментозного генезу, встановлено діагноз: СЧВ, активність І ступеня, хронічний перебіг, з ураженням нирок (люпус-нефрит, хронічна ниркова недостатність (ХНН) І ступеня, симптоматична артеріальна гіпертензія), артрит суглобів кистей та ступнів з функціональною недостатністю суглобів І ступеня, шкіри (рецидивуюча ексудативна еритема обличчя, шиї, поліморфні висипання шкіри тулуба, кінцівок, капілярити), серця (міокардіофіброз, серцева недостатність (СН) І, функціональний клас (ФК) ІІ).
Конкуруючий діагноз: генералізований атеросклероз із переважним ураженням грудного та черевного відділів аорти та її гілок (черевного стовбура, нижньої брижової артерії) та вираженим абдомінальним ішемічним синдромом; ішемічна хвороба серця (ІХС), атеросклероз аорти і вінцевих артерій, кардіосклероз, СН І, ФК ІІ.
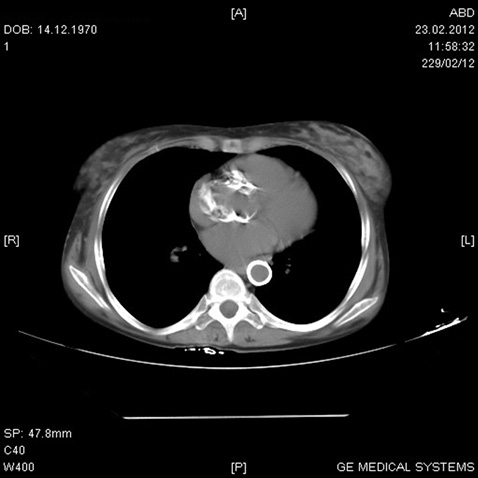
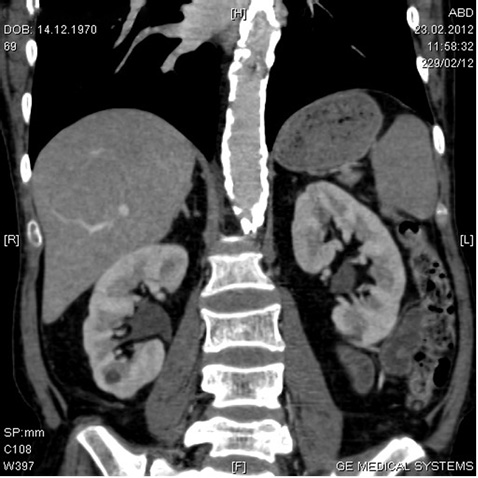
Супутні: хронічний калькульозний холецистит у період нестійкої ремісії; хронічний ерозивний гастрит, поверхневий дуоденіт, помірне загострення; хронічний панкреатит, нестійка ремісія з явищами субкомпенсованої екзокринної недостатності, синдромом подразненого кишечнику з переважанням діареї. Ліпома лівої нирки. Зниження живлення помірного ступеня, полінутрієнтна недостатність. Стероїд-індукований остеопороз із переважним ураженням поперекового відділу хребта.
Діагноз підтверджено консиліумом у складі ревматологів, нефролога, гастроентеролога, судинного хірурга та зроблено висновок відповідно неефективності консервативного лікування та рекомендовано направити хвору в Національний інститут хірургії ім. О.О. Шалімова для подальшого уточнення діагнозу та можливого хірургічного втручання.
У Національний інститут хвора поступила 12.02.2012 р. (історія хвороби № 1135) з такими ж клінічними проявами, де впродовж 3 тиж проведено повторні загальноклінічні, лабораторні й біохімічні дослідження, а також ЕКГ, УЗД органів черевної порожнини, КТ органів черевної порожнини, дані яких майже повністю відповідали даним з Чернівецької клініки.
Консультативний висновок ревматолога 02.03.2012 р.: СЧВ, активність І ступеня, гормонозалежний варіант. Ураження шкіри, нирок (амілоїдоз? ХНН 0–І), ІХС, атеросклероз аорти і вінцевих артерій, перевантаження передньо-перегородкової ділянки міокарда, СН І.
УЗД судин черевної порожнини 05.03.2012 р. висновок: абдомінальний ішемічний синдром. Критичний стеноз верхньої брижової артерії (70–90%); стеноз нижньої брижової артерії близько 50%.
06.03.2012 р. аортографія, целіакомезентерикографія: аорта та її гілки дифузно змінені; оклюзія черевного стовбура, стеноз верхньої брижової артерії на 80–90%; заповнення гілок черевного стовбура через колатералі.
14.03.2012 р. виконано стентування верхньої брижової артерії. Витяг із протоколу операції: виконано предилатацію стенозу балоном діаметром 5 мм, залишковий стеноз більше 50%; на рівні звуження встановлено стент діаметром 6 мм, довжиною 18 мм. Контроль — просвіт верхньої брижової артерії відновлено.
Стан хворої впродовж 1-ї доби на фоні інфузійної та пероральної терапії значно покращився, повністю купірувався больовий синдром, з’явився апетит, з кожним днем відновлювалися сили, і на 5-й день після операції хвора в задовільному стані виписана для подальшого лікування та спостереження за місцем проживання.
Впродовж перших 10 міс після операції стан хворої задовільний, больових відчуттів у животі майже немає (окрім періодичного помірного болю в правому підребер’ї при огріхах у харчуванні), сон і апетит хороші, нормалізувалися випорожнення, маса тіла збільшилася на 20 кг, зменшилися шкірні прояви СЧВ, з’явився легкий кушингоїдний синдром, періодично відзначала підвищення артеріального тиску до 160–170 мм рт. ст. при переміні погоди та відповідно головний біль, запаморочення, погіршення зору. Продовжує застосовувати преднізолон 30 мг/добу під прикриттям інгібіторів протонної помпи, препаратів калію, дезагрегатнів та ацетилсаліцилову кислоту. Така позитивна динаміка як з боку органів черевної порожнини, так і симптоматики СЧВ свідчила про визначальну роль атеросклеротичної абдомінальної ішемії на цьому етапі перебігу взаємозалежної мікст-патології та важливість своєчасного правильного інвазивного втручання для кардинальної зміни клінічної ситуації.
Однак не менш цікавою з попередніх етапів спостереження є історія хвороби цієї пацієнтки з урахуванням особливостей перебігу лікування від початку хвороби до розвитку у неї виражених атеросклеротичних явищ із вищезазначеним тяжким абдомінальним синдромом.
Нами проаналізовано 12 витягів з історії хвороби із провідних московських клінік з 1982 (10-річний вік пацієнтки) по 1993 р., в яких вона перебувала на лікуванні в середньому від 2 до 4 міс за кожну госпіталізацію. Найбільш критичний стан хворої був при первинній госпіталізації в Дитячу клініку Першого Московського медичного інституту (І ММІ) у 1982 р., де за клініко-лабораторно-імунологічними та інструментальними даними встановлено діагноз: СЧВ, підгострий перебіг, активність ІІІ ступеня, цереброваскуліт, прекома, ураження ретикулоендотеліальної системи, кардит, пульмоніт, дерматит, поліартрит, гепатит. У реанімаційному відділенні дівчинці масою тіла 32 кг була проведена пульс-терапія 1320 мг преднізолону, переважно завдяки чому виведена з коми, на 2-й день — 800 мг преднізолону внутрішньовенно і 75 мг per os; на 3-тю добу та впродовж 4 наступних місяців — 120 мг/добу, а з досягненням ефекту рекомендоване поступове зниження добової дози преднізолону до 50 мг під прикриттям гіпотензивних, гастропротекторних засобів, препаратів калію, препаратів симптоматичної терапії, цільова доза зниження преднізолону пропонувалася лікарями дитині до 50 мг.
Однак мати певною мірою поспішно знижувала дозу преднізолону через явища вираженого кушингоїдного синдрому (маса тіла зросла до 120 кг) і у 1983–1986 рр. щорічно по 2–3 рази спостерігалися помірні загострення у вигляді лихоманки, суглобового синдрому, які купірувалися підвищенням дози преднізолону до 40 мг/добу, а у зв’язку з появою болю у попереку та недоцільностю подальшого підвищення дози преднізолону додатково призначений азатіоприн у дозі 100 мг/добу.
З 16-річного віку хвора потрапляє під спостереження і стаціонарне лікування клініки терапії і професійних захворювань І ММІ, включаючи консультації професора І.Є. Тареєвої, доцентів клініки. За результатами відповідного до захворювання комплексного обстеження виявлено нові особливості клініки, відображені у діагнозі: СЧВ, хронічний перебіг, активність ІІ ступеня, вовчаковий нефрит із вираженим нефротичним синдромом (добова протеїнурія 12–15 г), ХНН І, артрит суглобів ступнів (вже не зазначалися ураження легень, серця та шкіри).
Ускладнення стероїдної терапії: синдром Іценко — Кушинга. Остеопороз грудного і поперекового відділів хребта з компресією І–ІІІ поперекових хребців.
Активність процесу була знижена іншим варіантом пульс-терапії: циклофосфамід 1000 мг та преднізолон 500 мг внутрішньовенно № 7 під відповідним адекватним застосуванням гастропротекторів, коректорів калієвого обміну, гіпотензивних та симптоматичних засобів, препаратів кальцію. Хвору орієнтують на поступове зниження дози преднізолону до 20 мг/добу та 100 мг циклофосфаміду, а також на прийом препаратів кальцію в період відносного благополуччя щорічно тривалістю до 4–6 міс.
У 16–17-річному віці (пубертат) у хворої до 4 разів щорічно спостерігалося загострення активності процесу зі стаціонарним лікуванням та ефективною пульс-терапією від № 2 до № 7, де домінуючим чинником був циклофосфамід 1000 мг, преднізолон лише 500 мг у зв’язку зі стероїдним ураженням кісток хребта. Хвора виписувалася для подальшого лікування за місцем проживання з рекомендаціями щомісячного проведення одного сеансу пульс-терапії циклофосфамідом 1000 мг та преднізолоном 500 мг на фоні щоденного прийому не менше 20 мг преднізолону, 100 мг циклофосфаміду та препаратів кальцію. Дотримання цих рекомендацій привело до усунення явищ нефротичного синдрому впродовж 1,5 року і досягнення стану ремісії впродовж 3,5 року, зокрема зменшення вираженості болю в попереку, гомілкових, стегнових кістках.
У 1991–1993 рр. при спробах утримування стану ремісії на дозі преднізолону 20 мг/добу, а також внаслідок нашарувань інфекційних процесів (гострих респіраторних вірусних інфекцій, загострення хронічного бронхіту, пієлонефриту, з приводу яких здійснювалися неодноразові курси антибіотикотерапії) у хворої знову щорічно спостерігалися періоди підвищення активності СЧВ до ІІ ступеня з рецидивами нефротичного синдрому, артриту нижніх кінцівок (ступні, колінні суглоби), шкірних уражень із нашаруванням стероїдного розацеа, піодермії та грибів демодекодес (обличчя, шия). Тільки потужні курси комбінованої пульс-терапії преднізолоном 1000 мг та циклофосфамідом 1000 мг від 3 до 7 разів (які проводилися в клініці терапії і професійних захворювань І ММІ, лікувальна тактика узгоджувалася з професором І.Є. Тареєвою) дозволяли змінити ситуацію на краще, усунути нефротичний синдром (добова протеїнурія коливалася в межах 0,8–2,4 г). Тривалість госпіталізації стала коротшою: 1,5–2 міс. Виписувалася у задовільному стані з рекомендаціями постійного прийому преднізолону від 120 мг/добу з поступовим зниженням дози не нижче 30 мг/добу та проведенням підтримувальної пульс-терапії 1 раз у 2–3 міс залежно від клінічної ситуації преднізолоном 800 мг та циклофосфамідом 1000 мг.
У всіх виписках з історії хвороби зазначалося, що пацієнтка переносила пульс-терапію різної тривалості задовільно, без особливих негативних змін з боку крові. У 1993 р. в останніх виписках з історії хвороби звернута увага на цільову підтримувальну добову дозу преднізолону не менше 30 мг і при найменших ознаках активації СЧВ — підвищення її до 50–60 мг, за потреби — повторні курси пульс-терапії, які виправдали себе за 10-річний період їх застосування, а пацієнтка цілком задовільно їх переносила.
У 1993 р. при рентгенологічному дослідженні кульшових суглобів вперше констатовано остеопороз тазових та стегнових кісток. З цього періоду хворій у комплексному лікуванні СЧВ рекомендовано щорічні 3–6-місячні курси корекції остеопорозу препаратами кальцію, які в наступні 10–15 років хвора виконувала лише частково. Триразові спроби перевести базисне лікування з преднізолону на відповідні дози метилпреднізолону завжди закінчувалися активацією СЧВ, і з 1995 р. хвора підтримує стан мінімальної активності СЧВ лише за допомогою преднізолону.
Відпрацьована в московських клініках тактика підтримувального лікування СЧВ виправдовувала себе впродовж майже 20 років. З отриманням інвалідності ІІ групи (1993 р.) хвора уникала спілкування з колективами через боязкість інфікування респіраторними хворобами, дотримувалася дієти з акцентом на калійвмісні продукти, грамотно користувалася гіпотензивними, гастропротекторними, поліферментними препаратами, уникала фізичних навантажень, тривалої ходьби, стояння.
Калькульозний холецистит, хронічний панкреатит, констатовані при УЗД з 2003 р., схильність до діарейного синдрому з’явились в останні 3 роки; з цього періоду користується періодично додатково поліферментними, пре-, пробіотичними засобами.
Період відносного благополуччя перебігу СЧВ у хворої закінчився етапом розвитку тяжкого атеросклеротичного абдомінального синдрому, описаного нами в першій частині спостереження.
Випадок є унікальним та повчальним з наступних позицій.
Демонстративний у тому аспекті, що правильна агресивна комбінована повторними курсами пульс-терапія СЧВ здатна змінити перебіг цієї хвороби з підгострого, з вираженим ураженням нирок (гломерулонефрит із нефротичним синдромом), серця, судин головного мозку, шкіри та легень, на хронічний навіть у особливо вразливому дитячому (майже підлітковому) віці.
Однак ціна такого підходу серйозна: у пацієнтки розвився генералізований стероїд- та циклофосфамід-індукований остеопороз, ускладнений компресійним переломом хребців поперекового відділу хребта, кушингоїдним синдромом, хоча хвора завдяки такій терапії прожила з СЧВ 32 роки.
Короткотривалий регрес проявів (не більше як на 2–3 міс) та часті рецидиви СЧВ у дитячому віці ймовірно були зумовлені надміру швидким зниженням добової дози преднізолону з цільовою установкою лікарями 10 мг, оскільки більш повільне зниження та цільова установка 20 мг преднізолону на добу, а згодом — 30 мг дала більш стійкий перебіг у хронічному варіанті СЧВ.
Тривала терапія остеопорозу кальційвмісними препаратами може дати клінічний ефект навіть на тлі постійного застосування кортикостероїдів у середніх і високих дозах, однак чи вагомим є внесок кальційвмісних препаратів у розвиток атерокальцинозу черевного відділу аорти, черевного стовбура і верхньої та нижньої брижової артерії, калькульозного холециститу? Питання до роздумів.
Домінуюче глибоке ураження судин черевної порожнини зумовило клініку прогресуючого абдомінального больового синдрому з неспецифічною картиною, що на тлі верифікованих раніше хронічного калькульозного холециститу, панкреатиту (теж із компонентом ішемії), ерозивного гастродуоденіту, стенозуючого папіліту спонукало хірургів провідного науково-дослідного центру до здійснення в першу чергу ендоскопічної, лапароскопічної діагностики і превентивних міні-інвазивних втручань і тільки в другу чергу — вазоконтрастних методів діагностики патології черевних судин із верифікацією вираженого атерокальцинозу черевної аорти, оклюзії черевного стовбура, декомпенсованого (90%) стенозу верхньої брижової та субкомпенсованого стенозу нижньої брижової артерій.
Здійснені ангіопластика та стентування верхньої брижової артерії суттєво покращили стан хворої, повністю усунувши явища больової ішемії, покращили діяльність органів травлення, якість життя пацієнтки, що відобразилося у відновленні її маси тіла на втрачені 20 кг впродовж півроку і навіть позитивно позначилися на перебігу СЧВ. Проте подальший прогноз для здоров’я і життя пацієнтки на цьому етапі більше залежатиме від генералізації атеросклерозу та його ускладнень, ніж від активності СЧВ.
У разі стійкого абдомінального больового синдрому у хворих на СЧВ, крім набутих та медикаментозно-індукованих уражень органів травлення, слід мати на увазі нашарування раннього атеросклеротичного ішемічного компонента і реалізувати відповідний алгоритм інструментальної діагностики.
Список використаної літератури
- 1. Анохіна Г.А. (2005) Абдомінальний ішемічний синдром. Сучасна гастроентерологія, 1(21): 42–47.
- 2. Бенца Т.М. (2010) Клініко-патогенетичні особливості атеросклеротичного ураження судин і захворювань органів травлення у хворих на ревматичні захворювання та обґрунтування диференційованого лікування. Автореф. дис. … д-ра мед. наук. Київ, 31 с.
- 3. Волошин О.І. Сплавський О.І., Руснак І.О. та ін (2009) Ішемічний коліт як прояв абдомінальної ішемічної хвороби: дискусійні питання клініки, діагностики, лікування (огляд літератури та власні дослідження). Внутр. медицина, 1–2: 47–59.
- 4. Губергриц Н.Б. (2009) Недигестивные причины абдоминальной боли: этиология, патогенез, классификация. Суч. гастроентерологія, 5(49): 13–16.
- 5. Сигидин А.Я. Гусева Н.Г., Иванова М.М. (2004) Диффузные болезни соединительной ткани. Медицина, Москва, 234 с.
- 6. Дядык А.И., Багрий Э.А., Ракитская И.В. и др. (2009) Системная красная волчанка: некоторые вопросы этиологии и патофизиологии. Укр. ревматол. журн., 2(36): 61–66.
- 7. Насонова В.А. (ред.) (2008) Современные аспекты глюкокортикоидной терапии ревматических заболеваний. Пособие для врачей, Луганск, Орион, 68 с.
- 8. Тараненко Т.В. (2010) Васкулярна патологія при системному червоному вовчаку у дітей. Соврем. педиатрия. 5(33): 1–9.
- 9. Шевчук С.В. (2008) Ураження судин у хворих на системний червоний вовчак. Автореф. дис. … д-ра мед. наук, 27 с.
- 10. Abusamieh M., Ash J. (2004) Atherosclerosis and systemic lupus erythematosus. Rev., 12(5): 267–275.
Случай абдоминального ишемического синдрома атеросклеротического генеза у больной системной красной волчанкой
Резюме. В статье представлено описание клинического случая выраженного абдоминального ишемического синдрома атеросклеротического генеза пациентки с системной красной волчанкой (СКВ), успешно пролеченной путем стентирования верхней брыжеечной артерии. Дифференциальная диагностика и подтверждение атеросклеротического поражения грудного и абдоминального отделов аорты и ее ветвей достигнуты путем компьютерных рентгенологического, магнитно-резонансного, вазоконтрасных методов иследования. Доказана эффективность патогенетически обоснованной агрессивной комбинированной пульс-терапии (преднизолон 1000 мг, циклофосфамид 1000 мг) повторными курсами от 3 до7 инфузий при обострениях (общим числом более 90 пульс-инфузий за 12 лет) и последующей поддерживающей терапии суточной дозой от 120 до 50–30 мг с соответствующим прикрытием гастропротекторами, гипотензивными средствами, корректорами калиевого, кальциевого обмена, симптоматическими. Цена такой терапии — перевод с подострого течения СКВ с высокой активностью, поражением почек с нефротическим синдромом, сердца, легких, суставов, кожи, цереброваскулитом в хроническое течение с минимальной активностью, поражением почек без нефротического синдрома, суставов, кожи, увеличение продолжительности жизни на 32 года, но с развитием раннего выраженного атеросклероза преимущественно сосудов брюшной полости, стероид-индуцированного остеопороза костного аппарата, компрессией LІ–LІІІ, кушингоидным синдромом.
Ключевые слова: системная красная волчанка, атеросклероз, абдоминальный ишемический синдром, стентирование, консервативное лечение.
Адреса для листування:
Волошин Олесандр Іванович
58002, Чернівці, пл. Театральна, 2
Буковинський державний
медичний університет
E-mail: office@bsmu.edu.ua

Leave a comment