Склеродермоподібний паранеопластичний синдром у пацієнта з раком шлунка: опис клінічного випадку
Чіпко Т.М., Головач І.Ю., Вельма І.В., Лазоренко О.О. , Матійко В.М., Михальська Л.В., Мухомор О.І., Рибка В.М., Власенко А.М.
Резюме. У статті наведено опис клінічного випадку пізньої діагностики раку шлунка у чоловіка віком 60 років, що проявився паранеопластичним склеродермоподібним синдромом. Перебіг склеродермоподібного синдрому характеризувався вираженим прогресуванням, відсутністю типових уражень внутрішніх органів і синдрому Рейно, значною індурацією шкіри.
Паранеопластичний синдром (грец. para «близько» + neos «новий» + plasma «щось утворене») (ПНС) — термін, введений у 1948 р., що об’єднує будь-які неонкологічні прояви, зумовлені опосередкованим впливом пухлинного процесу на метаболізм, імунітет і високофункціональну активність регуляторних систем організму. Це патологічний симптомокомплекс або реакція, що патогенетично пов’язана з наявністю в організмі пухлини, але не є наслідком безпосереднього впливу цієї пухлини чи її метастазів на орган чи систему органів [1, 6, 15]. ПНС прийнято позначати клініко-лабораторні прояви, зумовлені не локальним ростом первинної чи метастатичної пухлини, а неспецифічними реакціями з боку різних органів і систем або ектопічною продукцією пухлиною біологічно активних речовин [2]. ПНС не залежить від маси пухлини, нерідко може бути дебютом пухлинного росту та може регресувати після радикального лікування. Паранеопластичні процеси є результатом дистанційного впливу новоутворення, не пов’язаного з прямою інвазією, чи з компресією тканин чи органів пухлиною, чи з метастазами [5, 15].
Серед ПНС з високою частотою відзначають паранеопластичні ревматичні реакції. Так, найбільш відомим є поєднання дерматоміозиту зі злоякісними пухлинами, що виявляють у 15% хворих, а в пізніх стадіях — у 50–70% випадків [3, 6]. Вважається, що у підґрунті більшості ревматичних ПНС лежать гіперергічні імунозапальні реакції реагінового, імунокомплексного чи аутоімунного типу на метастазуючі злоякісні клітини або поступаючі в кровотік «інородні» пухлинні антигени, які можуть перехресно реагувати з антигенами нормальних тканин.
Ревматичні ПНС частіше передують появі клінічних ознак низькодиференційованих злоякісних новоутворень епітеліального походження (бронхогенного раку, гіпернефроми тощо) і пухлинних уражень імунної системи (тимоми, лімфоми). Ревматичні ПНС, що виникають у процесі пухлинного росту, можуть передувати онкологічному діагнозу на декілька років, з’являтися одночасно із клінічними проявами злоякісності або маніфестувати через деякий час після діагностики новоутворення. Часто буває важко відрізнити їх від ідіопатичної форми ревматичного захворювання [8, 13].
Зв’язок між новоутворенням та системною склеродермією (ССД) із легеневим фіброзом вперше описано у 1953 р. [16]. Частота розвитку раку в пацієнтів із ССД оцінюється у 3–7% [4], а в деяких дослідженнях сягає 11,4% [11]. Стандартизований показник захворюваності на рак усіх локалізацій для цих пацієнтів в 2,1 раза вищий, а для раку легені — у 7,4–16,5 вищий, ніж у загальній популяції [14].
Найбільш поширеними злоякісними новоутвореннями, що асоціюються з ССД, є рак легені й молочної залози, а також пухлини кровотворної та лімфатичної систем. При цьому провідну роль відіграє похилий вік пацієнтів і тривалість перебігу ССД. Була описана залежність між тривалістю перебігу ССД і типом новоутворення: на ранній стадії ССД може асоціюватися з раком молочної залози, а при перебігу більше 10 років — з раком легені, при цьому факт куріння не має істотного значення [5]. Водночас склеродермоподібні зміни шкіри як ПНС описані при раку шлунка, легені, молочної залози, назофарингеальної ділянки, меланомі й саркомі [7–10, 12].
Паранеопластичний псевдосклеродермічний (склеродермоподібний) синдром проявляється атиповим перебігом основних проявів ССД, відсутністю типових вісцеральних ознак захворювання, швидким розвитком симптомів, нерідко їх швидкою мінливістю, переважанням індуративних змін, фіброзитів, контрактур, високою активністю, неефективністю базисної терапії, нестероїдних протизапальних препаратів і глюкокортикоїдів [8]. У будь-якому варіанті має місце атиповий перебіг ССД із неефективністю традиційної хворобомодифікуючої терапії, що може наштовхнути на думку про існування ПНС.
У нашій ревматологічній клініці у квітні 2013 р. спостерігали пацієнта Я., 1953 року народження, що поступив із діагнозом: Системне захворювання сполучної тканини. При госпіталізації пацієнт подавав скарги на задерев’янілість шкіри і м’язів шиї, плечового поясу, грудної клітки, верхньої частини живота, правої руки і лівої гомілки, виражений індуративний набряк правого передпліччя і кисті, що призвів до згинальної контрактури кисті, розпираючий біль у правій руці, схуднення, слабкість, періодично субфебрильну температуру тіла.
З анамнезу відомо, що пацієнт захворів раптово у жовтні 2012 р. після важкої фізичної праці. Відчув біль у ділянці правого ліктьового суглоба з порушенням розгинання та нагрубання шкіри навколо суглоба; пізніше больовий синдром мігрував у плечовий пояс, та поступово пацієнт відзначив значну закам’янілість м’язів шиї та плечового поясу, що обмежувало рухи та викликало біль. Процес неухильно прогресував, поступово захоплюючи «нові території»: індуративний процес поширювався на грудну клітку, праве плече, передпліччя; у березні — квітні 2013 р. з’явилося індуративне ураження шкіри лівої гомілки та верхньої частини живота. За цей період пацієнт звертався в медичні заклади, де спостерігався з різними діагнозами: Саркома? Альвеолярна рабдоміосаркома? Лімфома? Було проведено 3 біопсії шкірно-м’язового шматка правого передпліччя (з перервою у 2 тиж) та біопсія аксилярного лімфатичного вузла, утім патогістологічні висновки не дозволили остаточно зробити висновки про будь-яку патологію.
Біопсія шкірно-м’язового шматка правого передпліччя 27.11.2012: цитологічне дослідження: кров, одиничні лейкоцити, слизово-волокнисті маси, сполучнотканинні обривки.
Біопсія шкірно-м’язового шматка правого передплічя 12.12.2012: цитологічне дослідження: на фоні крові виявлено скупчення базофільної субстанції, значна кількість клітин м’язового типу, часто з вираженими ознаками проліферації, обривки сполучної тканини. Цитологічно важко виключити малігнізацію.
Біопсія шкірно-м’язового шматка правого передпліччя від 21.12.2013: гістологія шкіри: в епітелії вакуольна дистрофія, потовщення базальної мембрани. Атрофія додатків шкіри. У дермі дезорганізація сполучної тканини, фібриноїдні зміни у вигляді глибок еозинофільної речовини в чарунках гіалінізованих волокон. Набряк. Подібні зміни можливі при судинних захворюваннях плазморагічного типу, а також при ревматологічних захворюваннях, системному червоному вовчаку.
Пункційна біопсія лімфатичного вузла від 27.03.2013. Цитологічне дослідження: на фоні крові виявлено одиничні дрібні альвеолярні структури з ексцентричними гіперехогенними ядрами. Підозра на альвеолярну рабдоміосаркому.
Пацієнт також був консультований ревматологом, який зазначив, що системної ревматологічної патології у пацієнта не виявлено на час огляду.
Через півроку спостережень і консультацій остаточний клінічний діагноз так і не був встановлений. Підозрюючи системну патологію сполучної тканини пацієнту на амбулаторному етапі було призначено 40 мг медролу без клінічного ефекту.
Пацієнт курить понад 20 років. Контакт із хімічними і токсичними речовинами заперечує. Хворобу пов’язує із фізичним перенавантаженнями (робота вантажника).
При об’єктивному огляді 19.04.2013: Пацієнт астенічної тілобудови, пониженого відживлення. Температура — 36,7 °С. Шкірні покриви звичайного забарвлення з незначною гіперпігментацією ділянки шиї та надпліччя. Права верхня кінцівка збільшених розмірів, щільний значно виражений набряк правої руки, більше в дистальних відділах з індуративним набряком кисті, що призвело до згинальної контрактури кистій ліктьового суглоба. Шкіра на передпліччі й кисті натягнута, гладка, блискуча, бліда. Відведення, згинання і розгинання в плечовому суглобі майже неможливі через набряк і натягнутість шкіри (рис. 1). Ліва верхня кінцівка звичайних розмірів, шкіра і м’язи не змінені. Права та ліва верхні кінцівки суттєво розрізняються в розмірах (рис. 2). Наявна значна індурація шкіри шиї, плечового поясу, передньої грудної стінки, спини впритул до «парафінової щільності». Верхні краї обох трапецієподібних м’язів пальпуються як валики кам’янистої щільності, добре контуруються. Шкіра і м’язи спини також кам’янистої щільності, що складає враження «пласкої» спини. Шкіру на зазначених ділянках взяти у складку неможливо. Шкіра епігастрія щільна, у складку не береться, пальпація внутрішніх органів неможлива. Ліва нижня кінцівка збільшена в розмірах, індуративний набряк шкіри лівої гомілки, кам’яниста твердість м’язів гомілки, згинальна контрактура лівого колінного суглоба під кутом 25°. Поодинокі папульозно-уртикарні елементи Ø 2–3 см на шкірі грудної клітки, блідо-рожевого кольору. Чутливість збережена. Телеангіектазії відсутні. Синдром Рейно відсутній. Суглоби ззовні не змінені, їх припухлості не відзначається, температура над групами суглобів не підвищена. Обмеження рухів пов’язано із контрактурами внаслідок вираженої індурації шкіри.
Екскурсія легень суттєво обмежена: справа — 1,5 см, зліва — до 1 см. Дихання черевного типу. При диханні ширина міжреберних проміжків практично не змінюється. Пальпаторно виявляється ригідність грудної клітки. Аускультативно на всьому протязі вислуховується ослаблене везикулярне дихання внаслідок обмеження екскурсії та фокуси відсутності дихання справа і зліва нижче VIII i IX ребер. Перкуторно в цих ділянках — притуплення звуку впритул до тупості. Межі серця не розширені. Тони серця аритмічні, пониженої звучності, патологічні шуми та зміни звучності тонів не вислуховуються. ЧСС — 76–80 уд./хв. АТ на лівій руці — 120/70 мм рт. ст. Язик звичайних розмірів, вкритий білим нальотом. Слиновиділення нормальне. Пальпація можлива лише нижнього поверху живота. Відрізки кишечнику, доступні пальпації, без особливостей. Печінка перкуторно біля краю реберної дуги, селезінка перкуторно не збільшена, на рівні IX–XI ребер по середній аксилярній лінії. Перкуторно притуплення звуку по фланках живота — по 3 см. Сечовипускання утруднене. Добова кількість сечі —до 1000 мл. Схильність до закрепів. Пульсація артерій ступень збережена.
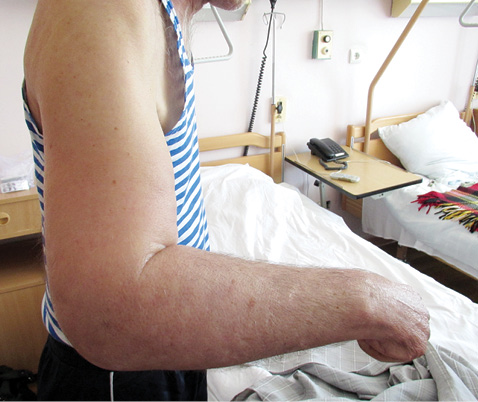
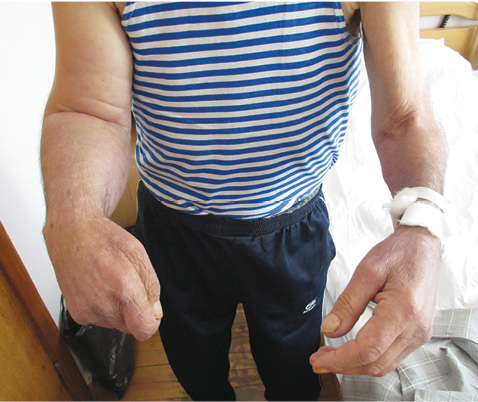
Коло захворювань для диференціації охоплювало системний склероз і групу склеродермоподібних захворювань, насамперед дифузний еозинофільний фасцит і склередему Бушке, пізню шкірну порфирію, прогерію дорослих, а також виявлені зміни розглядалися як паранеопластичний синдром. З цієї метою пацієнту проведено додаткові обстеження: лабораторний скринінг на ревматичну групу захворювань, ультразвукове дослідження (УЗД) органів черевної порожнини, мультиспіральну комп’ютерну томографію (МСКТ) грудної та черевної порожнини, стернальну пункцію з подальшим імуногістохімічним дослідженням, езофагофіброгастродуоденоскопію (ЕФГДС).
Диференціальний діагноз із ССД доволив заперечити це захворювання, зважаючи на відсутність синдрому Рейно і уражень внутрішніх органів, виражену щільність шкіри без ознак її атрофії, відсутність телеангіектазій, нетипові шкірні прояви, відсутність специфічних лабораторних змін. Також відсутність будь-якої реакції на прийом 40 мг медролу.
Еозинофільний фасцит був виключений у зв’язку із нетиповим клінічним синдромом, відсутністю підвищення запальних маркерів, а також типових змін в аналізах крові (відсутність гіпереозинофілії та гіпергаммаглобулінемії). Попередньо проведені гістологічні дослідження шкірно-м’язових шматків також не виявили патогномонічних змін (потовщення підшкірної фасції, лімфоцитарна і плазматична її інфільтрація). Це дозволило повністю виключити діагноз «еозинофільний фасцит».
Склередема Бушке характеризується вираженим щільним набряком шкіри і підшкірної клітковини впритул до «парафінової щільності», що вражає насамперед обличчя, шию, поширюючись на грудну клітку, кінцівки; при цьому дистальні відділи не втягуються у процес. Гістологічні зміни шкіри також відрізняють певні особливості: значне потовщення епідермісу, дифузний склероз дерми із фрагментацією колагенових волокон і гіперплазією еластичних, наявність скупчень муциноподібної речовини, що фарбується альціановим синім, із відсутністю запальних інфільтратів і ознак васкуліту. При застосуванні глюкокортикоїдів спостерігається позитивний ефект.
Симптоматика пізньої шкірної порфірії характеризується пігментацією, міхурями і гіпертрихозом. Пігментація виникає на відкритих ділянках шкіри — обличчі, шиї, верхній ділянці грудей, тилу кистей, вона дифузна, колір шкіри коливається від землисто-сірого до червонувато-синюшного і бронзового відтінків. Одночасно пізню шкірну порфірію обов’язково супроводжує ураження печінки, що проявляється клінічними і лабораторними симптомами. Труднощі в диференціації зазвичай виникають при склеродермоподібній формі шкірної порфірії, проте правильно зібраний анамнез (бульозні ураження шкіри в анамнезі), склеротичні ураження зазвичай обличчя і шиї, які закінчуються атрофією шкіри, а також відсутність симптомів ураження печінки дозволяють виключити і цей діагноз.
Щодо прогерії дорослих, то це генетично детерміноване захворювання найчастіше дебютує в період статевого дозрівання, а потім неухильно прогресує. Зміни шкіри проявляються витоншенням і атрофією, з вогнищами склеродермоподібного ущільнення і надалі хронічними ранами, що погано гояться. Ці зміни найбільш виражені на обличчі та в дистальних відділах кінцівок. А в поєднанні з алопецією, тонким дзьобовидним носом, звуженим ротовим отвором, тонкою атрофічною шкірою на обличчі, що ніби «просвічується», створюється зовнішній вигляд пацієнта, властивий лише прогерії дорослих. Гістологічна картина в цьому випадку характеризується потовщенням епідермісу, гомогенізацією і склерозом сполучної тканини, атрофією підшкірної клітковини із заміщенням її сполучнотканинними волокнами.
При лабораторному обстеженні пацієнта суттєвих відхилень в аналізах крові й сечі не виявлено.
Загальний аналіз крові: еритроцити 4,2 ⋅ 10/л, гемоглобін 120 г/л, лейкоцити 14,4 ⋅ 10/л, тромбоцити 234 ⋅ 10/л, паличкоядерні 1%, сегментоядерні 88%, лімфоцити 6%, моноцити 5%, ШОЕ 13 мм/год.
Загальний аналіз сечі: 100 мл, колір жовтий, прозора, питома вага 1018, рН слабкокисла, білок 0,1 г/л, глюкоза не виявлена, слиз (++), лейкоцити 7–9 у полі зору, епітелій плаский у невеликій кількості в полі зору.
Біохімічний аналіз крові: загальний білок 60 г/л, креатинін 76 мкмоль/л, сечовина 8,0 ммоль/л, сечова кислота 306 мкмоль/л, білірубін загальний 10,0 мкмоль/л, АлАТ 9 о/л, АсАТ 15 о/л, ГГТП 13 о/л, тимолова проба 1,0 од. SH, лужна фосфатаза 213 о/л, калій 4,0 ммоль/л, натрій 145 ммоль/л, кальцій загальний 2,11 ммоль/л, кальцій іонізований 0,96 ммоль/л, магній 0,81 ммоль/л, холестерин загальний 5,8 ммоль/л, тригліцериди 1,39 ммоль/л, β-ліпопротеїди 51 од., ревматоїдний фактор негативний, С-реактивний білок >0,6, КФК 54 о/л, МВ-КФК 13%, ЛДГ 277 о/л.
Альбуміни 52%, α1-глобулін 6,7%, α2-глобулін 9,8%, β-глобулін — 14,2%, γ-глобулін 17,3%.
Коагулограма: протромбіновий індекс 96%, фібриноген 2,66 г/л, етанолів тест (–).
Результати досліджень на антитіла до ВІЛ методом імуноферментного аналізу — антитіла до ВІЛ не виявлено. HBsAg — 0,558 (<1,0 — негативна).
При проведенні ревмоскринінгу не виявлено будь-яких відхилень: LE-клітини тричі не виявлені; антинуклеарні антитіла негативні, антитіла до дволанцюгової ДНК (ADNA 2) негативні, антитіла IgG до Jo-1, Scl-70, Sm, Sm/RNP, SS-A (52/60), SS-B, центроміру В, хроматину, рибосомального протеїну — всі результати негативні.
При УЗД органів черевної порожнини виявлено незначну гепатомегалію, двобічні великі гідроторакси, асцит. Ці дані підтвердили результати МСКТ грудної та черевної порожнини із внутрішньовенним підсиленням. При МСКТ органів черевної порожнини (25.04.2013) верифіковано вільну рідину в навколопечінковому та навколоселезінковому просторах, паранефрально, що поширюється каудально до рівня малого таза; значну інфільтрацію жирової клітковини черевної порожнини та обох клубових м’язів; у лівому клубовому м’язі включення кальцифікатів. Ущільнення та набряк підшкірної клітковини передньої черевної стінки, м’яких тканин спини. Звертали особливу увагу на пошук збільшених лімфатичних вузлів. У жодних групах їх не виявлено. Усі лімфовузли, доступні візуалізації, були в межах 10–12 мм, нормальної структури, не спаяні з прилеглими тканинами.
З метою виключення гематологічної патології та розвитку ПНС проведено стернальну пункцію кісткового мозку з подальшим імуногістохімічним дослідженням: У крові помірний лейкоцитоз, нейтрофільоз, без суттєвого зсуву вліво. У кістковому мозку кількість клітин підвищена. Переважають незрілі та зрілі клітини гранулоцитарного ряду. Незначно підвищена кількість плазматичних клітин. Редукція клітин еритробластичного і мегакаріоцитарного ряду. Кількість бластів не збільшена. Специфічних ознак гематологічної патології не виявлено. Рекомендовано провести цитологічне дослідження плеврального ексудату.
При проведенні плевральної пункції відзначено значні ускладнення при проколюванні шкіри і м’язів міжреберних проміжків, голка з важкістю проходила крізь тканини, що вимагало прикладання фізичних зусиль для виконання маніпуляції. Отримано 200 мл рідини світло-жовтого кольору. При цитологічному дослідженні виявлено атипові клітини.
Цитологічне дослідження плеврального пунктату від 24.04.2013 — препарат представлений великою кількістю проліферуючого мезотелію, на фоні якого наявні численні атипові клітини. Мікроскопія нативного препарату — еритроцити незмінені 6–12 в полі зору, лейкоцити поодинокі в полі зору, епітеліальні клітини (мезотелій) рясно покривають поле зору. Мікроскопія фарбованого препарату — переважно однорідні базофільні клітини з різко базофільними ядрами, велика кількість поліморфних клітин зі світло-голубою цитоплазмою, рваними краями, ядра світлі, рихлі з чітко вираженими голубими ядерцями.
Онкопошук включав проведення ЕФГДС, колонофіброскопії, УЗД передміхурової залози, МСКТ грудної клітки і черевної порожнини.
При відеоезогастродуоденоскопії (24.04.2013) виявлено суттєве ущільнення стінки шлунка з боку малої кривизни з ділянками екзофітного росту. При гістологічному дослідженні верифіковано дифузний перснеподібноклітинний рак шлунка.
Рентгенологічне дослідження стравоходу, шлунку та дванадцятипалої кишки від 29.04.2013: стравохід вільно пропускає барієвий контраст на всьому протязі. Контури стінок чіткі. Функція кардії не порушена. Кардіальний відділ та склепіння шлунка без особливостей. Шлунок гіпертонічний, горизонт розміщений звичайно. У ділянці субкардії та синусу спостерігається дефект наповнення з бугристою поверхнею і нерівним контуром. Контури стінок шлунка в цьому відділі ригідні. Рельєф слизової оболонки представлений продольними нерівномірно потовщеними складками. Перистальтика хвилями середньої глибини і частоти. Евакуація не порушена. Цибулина дванадцятипалої кишки неправильної трикутної форми, середніх розмірів, контури чіткі, рівні, натще містить незначну кількість слизу. Висновок: Пухлина шлунка.
Консиліум у складі онколога, променевого терапевта, хірурга та ревматолога встановив такий діагноз: Рак шлунка, генералізація процесу, стадія ІV, Т3NхM1,
метастатичний плеврит, асцит, ускладнений паранеопластичним склеродермоподібним синдромом, кл. гр. ІV. Больовий синдром, лімфостаз. Casus incurrabilis.
Пацієнту з метою зменшення проявів склеродермоподібного синдрому призначено D-пеніциламін за висхідною схемою та циклофосфан по 200 мг внутрішньом’язово через день, знеболювальну терапію.
У описаному випадку наявна пізня діагностика онкологічного захворювання (раку шлунка) із субклінічним перебігом, основним клінічним проявом якого був ревматологічний ПНС. На амбулаторному етапі увага була зосереджена на з’ясуванні причини надмірного і прогресуючого ущільнення шкіри, тому не було проведено банального онкоскринінгу. Утім, слід завжди пам’ятати про високу частоту «ревматологічних масок» онкологічної патології [2] і зважати на атипові стигми, що відрізняють класичний перебіг ревматичних захворювань від паранеопластичного:
- Перші прояви системних проявів уражень сполучної тканини у віці старше 50 років та, навпаки, поява в більш молодому віці ознак захворювання, що зазвичай наявні в похилому віці (наприклад хвороба Хортона, ревматична поліміалгія).
- Відсутність окремих типових клінічних і лабораторних ознак, властивих системним захворюванням сполучної тканини.
- Упертий перебіг або нехарактерне для конкретного ревматичного захворювання прогресування клінічних симптомів, що нерідко значно випереджає маніфестацію злоякісного новоутворення.
- Немотивоване різке погіршення загального стану хворого на тлі стабілізації ревматичного процесу, а також поява нових, не властивих цьому захворюванню симптомів.
- Резистентність до специфічної протизапальної терапії певного ревматичного захворювання.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
1. Дервянкин Ю.С., Терещенко Ю.А. (2003) Паранеопластические синдромы. Красноярск, 48 с.
2. Сидорова Л.Л., Спасская А.А., Мясников Г.В. и др. (2010) Паранеопластический синдром. Ревматологические маски онкологических заболеваний. Therapia, 2(44): 24–28.
3. Фомина Л.Л. (2002) Паранеопластические синдромы в ревматологии. Науч.-практ. ревматол., 2: 17–21.
4. Abu-Shakra M., Guillemin F., Lee P. (1993) Cancer in systemic sclerosis. Arthritis Rheum., 36: 460–464.
5. Benedek T.G. (1988) Neoplastic associations of rheumatic diseases and rheumatic manifestations of cancer. Clin. Geriatr. Med., 4: 333–355.
6. Bojinca V., Janta I. (2012) Rheumatic diseases and malignancies. Maedica (Buchar)., 7(4): 364–371.
7. Botsios C., Ostuni P., Cozzi F. et al. (2003) Systemic sclerosis in a patient with recent nasopharyngeal carcinoma: an unusual combination. Joint Bone Spine, 70: 396–400.
8. Ciołkiewicz M., Domysławska I., Ciołkiewicz A. et al. (2008) Coexistence of systemic sclerosis, scleroderma-like syndromes and neoplastic diseases. Pol. Arch. Med. Wewn., 118(3): 119–126.
9. Forbes A.M., Woodrow J.C., Verbov J.L. et al. (1989) Carcinoma of the breast and scleroderma: four further cases and a literature review. Br. J. Rheumatol., 28: 65–69.
10. Gruber B.L., Miller F., Kaufman L.D. (1992) Simultaneous onset of systemic sclerosis (scleroderma) and lung cancer: a case report and histologic analysis of fibrogenic peptides. Am. J. Med., 92: 705–708.
11. Kyndt X., Hebbar M., Queyrel V. et al. (1997) Sclerodermie systemique et cancer. Recherche de facteur predictifs de cancer chez 123 patients sclerodermiques. Rev. Med. Interne., 18: 528–532.
12. Pineda V., Salvador R., Soriano J. (2003) Bilateral breast cancer associated with diffuse scleroderma. Breast, 12: 217–219.
13. Racanelli V., Prete M., Minoia C. et al. (2008) Rheumatic disorders as paraneoplastic syndromes. Autoimmun. Rev., 7(5): 352–358.
14. Rosenthal A.K., McLanghlin J.K., Linet M.S. et al. (1993) Scleroderma and malignancy: an epidemiologic study. Ann. Rheum. Dis., 52: 531–533.
15. Szekanecz Z., Szekanecz E., Bakó G. et al. (2011) Malignancies in autoimmune rheumatic diseases — a mini-review. Gerontology, 57(1): 3–10.
16. Zatuchni J., Campbell W.J., Zarafonetis C.J.D. (1953) Pulmonary fibrosis and terminal bronchiolar carcinoma in scleroderma. Cancer., 6: 1147–1158.
СКЛЕРОДЕРМОПОДОБНЫЙ ПАРАНЕОПЛАСТИЧЕСКИЙ СИНДРОМ У ПАЦИЕНТА С РАКОМ ЖЕЛУДКА: ОПИСАНИЕ КЛИНИЧЕСКОГО СЛУЧАЯ
Резюме. В статье представлено описание клинического случая поздней диагностики рака желудка у мужчины в возрасте 60 лет, который проявился паранеопластическим склеродермоподобным синдромом. Течение склеродермоподобного синдрома характеризовалось выраженным прогрессированием, отсутствием типичных поражений внутренних органов и синдромом Рейно, значительной индурацией кожи.
: паранеопластический синдром, склеродермоподобный синдром, рак желудка, опухоль, системный склероз.
Адреса для листування:
Чіпко Тетяна Миронівна
03680, Київ, вул. Академіка Заболотного, 21
Клінічна лікарня «Феофанія» ДУС,
відділення ревматології і внутрішньої патології
E-mail: chipko.t@yandex.ru

Leave a comment