Остеопенія та гастроезофагеальний рефлюкс у хворих на ревматоїдний артрит У світлі концепції кластеризації позасуглобових проявів
Заздравнов А.А. , Пасиешвили Л.М.
Резюме. Резюме. У статті розглянуто взаємозв’язки між остеопенічним синдромом (ОПС) та гастроезофагеальним рефлюксом (ГЕР) у хворих на ревматоїдний артрит (РА). Обстежено 149 хворих на РА, з яких 99 мали прояви ГЕР (основна група); у 50 пацієнтів із РА ознак патології стравоходу не відзначалося (група порівняння). У всіх випадках ГЕР діагностовано не раніше, ніж через 1 рік після встановлення діагнозу РА. Статистична обробка результатів клініко-інструментального обстеження виявила позитивний асоціативний зв’язок між позасуглобовими проявами РА — ГЕР і ОПС. Встановлено, що за наявності ГЕР у хворих на РА спостерігається підвищення частоти ОПС, поглиблюються порушення мінеральної щільності кісткової тканини. Виявлено пряму залежність між тяжкістю перебігу езофагеальної патології та ОПС, з одного боку, й ступенем активності РА — з іншого. Динаміка прозапального цитокіну фактора некрозу пухлини-α та універсального маркера запалення — С-реактивного білка свідчила на користь того, що основним механізмом, який реалізує генез патологічного кластеру позасуглобових проявів «остеопенічний синдром і гастроезофагеальний рефлюкс», у хворих на РА є імунозапальний процес.
ВВЕДЕНИЕ
Возникновение и прогрессирование внесуставных висцеральных проявлений у больных ревматоидным артритом (РА) не является сугубо арифметической суммой патологий; в данном случае имеет место переход количественного «накопления болезней» в новое качество функционирования организма в измененной системным заболеванием среде. Иными словами, больной РА с висцеральными проявлениями и без таковых — это два принципиально разных пациента, требующих различных диагностических и лечебно-реабилитационных подходов. Нередко именно висцеральные проявления РА (амилоидоз почек, системный атеросклероз, легочный фиброз) определяют продолжительность жизни и ее качество у данных пациентов. Выделенный А.В. Garrod еще в 1858 г. в виде отдельной нозологии, РА довольно поздно стал рассматриваться в качестве системного заболевания. Определенной точкой отсчета можно считать конец ХІХ в., когда G.A. Bannatyne (1896) описал у больного РА васкулит и полинейропатию. До этого момента и, впрочем, достаточно долгое время после него, различные внесуставные проявления РА рассматривались как коморбидная патология при основном заболевании. Лишь со средины прошлого столетия формируется четкое понятие о РА как о системном заболевании соединительной ткани с внесуставными проявлениями (Sokoloff L. et al., 1950).
В настоящее время аксиомой представляется то, что РА является не локальным суставным заболеванием, а представляет собой сложный общепатологический иммуновоспалительный процесс, затрагивающий все органы и системы больного человека. В одних случаях клинические проявления болезни ограничиваются собственно суставной патологией, а в других она исходно имеет или по мере развития приобретает черты истинного системного заболевания, характеризующегося полиорганным поражением (Фоломеева О.М. 2008). На сегодняшний день, безусловно, ожидаемый процесс «висцерализации» РА не является в должной мере ни управляемым, ни прогнозируемым. В течение 11,8 года существования РА внесуставные проявления развиваются у 42,7% больных (Turesson C., 2008).
Сегодня сформирована концепция кластеризации внесуставных проявлений РА, суть которой заключается в сосуществовании стабильных комплексов разнообразных внесуставных проявлений у пациентов с системными ревматическими заболеваниями. Так, наличие ревматоидных узелков у больного РА очень часто сопровождается перикардитом, плевритом, васкулитом, поражением глаз и легких; васкулит сочетается с нейропатией и поражением легких. Концепция кластеризации предполагает наличие общих механизмов формирования определенных патологических состояний (Turesson C., 2008). Поиск и исследование данных механизмов и медиаторов, их реализующих, является актуальной проблемой ревматологии.
РА сопровождается облигатными генерализованными нарушениями структурно-функционального состояния костной ткани. Снижение показателей минеральной плотности костной ткани (МПКТ) наблюдается у 68% больных РА (Нейко Є.М., Яцишин Р.І., 2007). Остеопенический синдром (ОПС) является имманентной характеристикой РА и носит универсальный характер: наблюдаются потери как компактного, так и губчатого костного вещества, поражается как осевой, так и периферический скелет. Данные изменения являются важным патогенетическим компонентом течения РА и в определенной степени отражают активность воспалительного процесса (Свінціцький А.С. та співавт., 2006). Сочетания ОПС с различными висцеральными проявлениями РА не являются стохастическими. Так, низкие показатели МПКТ у больных РА достоверно чаще наблюдаются при нефропатии, лимфаденопатии, поражении легких (Клубова А.Ф. и соавт., 2002).
Гастроэзофагеальный рефлюкс (ГЭР) — нередкое внесуставное проявление РА. Изжога, основной клинический симптом ГЭР, наблюдается у больных РА в 2,4 раза чаще, чем в популяции (Вдовиченко В.І. та співавт., 2006).
Учитывая столь высокую распространенность, как ОПС, так и ГЭР, в среде больных РА, следует ожидать и сочетания данных внесуставных проявлений у конкретного больного.
Цель работы — определить наличие и характер взаимосвязей между ОПС и ГЕР у больных РА, выявить механизмы их реализации.
Объекты и методы исследования
Обследованы 149 больных РА, из которых 99 имели проявления ГЭР (основная группа); у 50 пациентов с РА признаков патологии пищевода не отмечалось (группа сравнения). Во всех случаях ГЭР диагностирован не ранее чем через 1 год после установления диагноза РА. Возраст больных основной группы составлял 49,0±1,19 года, группы сравнения — 49,4±1,44 года. Среди обследованных участников основной группы было 82 (82,8%) женщины и 17 (17,2%) мужчин; в группе сравнения — 42 (84%) и 8 (16%) соответственно. Анамнез РА в основной группе составил 8,7±0,36 года, в группе сравнения — 8,1±0,37 года. В основной группе ревматоидный фактор был выявлен у 77,8% больных, в группе сравнения — у 78,0%.
Диагностика РА проводилась в соответствии с дополнением № 11 к приказу Минздрава Украины от 12.10.2006 г. № 676 «Клинический протокол оказания медицинской помощи больным ревматоидным артритом». ГЭР диагностировали в соответствии с дополнением к приказу Минздрава Украины от 13.06.2005 г. № 271 «Клинический протокол оказания медицинской помощи больным гастроэзофагеальной рефлюксной болезнью». При выявлении рефлюкс-эзофагита степень его тяжести оценивали по результатам эндоскопического исследования с использованием Лос-Анджелесской классификации (1998).
Состояние костной ткани (пяточная кость) оценивали с помощью ультразвукового денситометра Ahilles Express (USA), вычисляли индекс прочности костной ткани (ИПК), индекс Z (отклонение МПКТ от среднего значения больных контрольной группы соответствующего возраста), индекс Т (отклонение от референтного значения пиковой костной массы у здоровых лиц молодого возраста). При оценке МПКТ руководствовались рекомендациями ВОЗ, согласно которым снижение Т-индекса на >1 стандартное отклонение (SD) рассматривается как собственно остеопения, а на >2,5 SD — как остеопороз.
Концентрацию фактора некроза опухоли (ФНО)-α в крови исследовали иммуноферментным методом, содержание С-реактивного белка (СРБ) определяли в реакции агглютинации латекса, покрытого антителами к этому белку.
Больные, которым была назначена системная глюкокортикоидная терапия, в исследование не включались. Полученные результаты сравнивали с результатами исследований у 20 практически здоровых лиц (группа контроля) в возрасте 40–55 лет.
Статистическую обработку результатов исследования проводили методами параметрической статистики с вычислением средней арифметической величины (М) и средней квадратической ошибки (m). Достоверность различий оценивали по критерию Стьюдента, критический уровень значимости при проверке статистических гипотез составлял 0,05. Также использовали вычисление критерия χ², критерия φ (угловое преобразование Фишера), метод ассоциативного анализа с вычислением коэффициента Юла.
Результаты и их обсуждение
Среди обследованных пациентов основной группы с РА 52,5% больных имели эндоскопические проявления эзофагита. При оценке связей между активностью РА и степенью тяжести эзофагита выявлена достоверно значимая прямая зависимость (df=6, χ=14,119; р=0,028) между данными показателями (табл. 1).
| Степень тяжести эзофагита | Степень активности РА | ||
|---|---|---|---|
| І (n=11) | ІІ (n=28) | ІІІ (n=13) | |
| A (n=15) | 6 | 8 | 1 |
| B (n=16) | 3 | 11 | 2 |
| C (n=13) | 2 | 6 | 5 |
| D (n=8) | 0 | 3 | 5 |
Подобные результаты свидетельствовали в пользу того, что выраженность эзофагеальной патологии у обследованных пациентов зависит от активности иммуновоспалительного процесса и является внесуставным проявлением РА, а не коморбидным состоянием.
Результаты денситометрии показали, что в основной группе больных РА признаки ОПС присутствовали у 76 (76,8%) пациентов, в группе сравнения — у 30 (60%). Различия в экспрессивности данного синдрома между группами были достоверными (df=1, χ=4,549, р=0,033; φ=2,098, зона значимости φ — 0,01<p<0,05). Наряду с этим различий в структуре ОПС в сравниваемых группах не выявлено (рис. 1, 2).
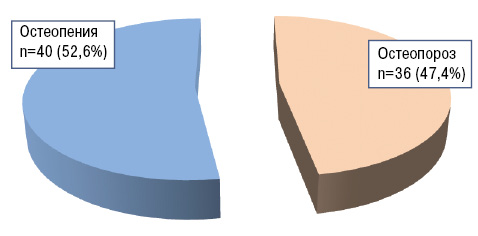
Рис. 1. Структура ОПС у больных РА основной группы
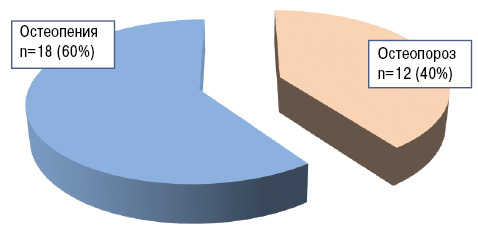
Рис. 2. Структура ОПС у больных РА группы сравнения
При оценке отдельных денситометрических показателей установлено, что в обеих группах больных РА наблюдалось достоверное уменьшение всех исследуемых параметров по сравнению с контролем (табл. 2). Снижение МПКТ, нарушение микроархитектоники кости у больных РА по сравнению со здоровыми лицами проявлялось как изменениями отдельных звуковых параметров (SOS, BUA), так и снижением интегрального индекса прочности костной ткани (ИПК). Именно ИПК, который по сути является эквивалентом комбинации SOS та BUA, наиболее полно с клинической точки зрения отображает выраженность ОПС.
При исследовании взаимосвязей в структуре осложнений РА выявлено наличие прямой ассоциативной зависимости (Q=+0,376) между ГЭР и ОПС, что предполагало существование различий в МПКТ у пациентов основной группы при сопоставлении с больными группы сравнения. При обработке результатов денситометрии выявлены более выраженные проявления ОПС именно у больных основной группы (см. табл. 2).
| Показатель | Группа | ||
|---|---|---|---|
| основная (n=99) | сравнения (n=50) | контроля (n=20) | |
| SOS, м/с | 1475±3,1*** | 1491±4,6*** | 1563±9,0 |
| BUA, дб/МГц | 97,0±0,60 | 101,6±1,01 | 106,6±1,09 |
| ИПК, % | 58,1±0,32 | 65,4±0,46 | 89,4±0,52 |
| Индекс Z, SD | –0,98±0,043 | –0,73±0,066 | 0,34±0,074 |
| Индекс Т, SD | –2,60±0,095 | –2,12±0,122 | 0,62±0,126 |
Различия достоверны при сравнении с аналогичным показателем: *группы контроля (t=10,808; p<0,001); **группы сравнения (t=2,961; p=0,004);***группы контроля (t=7,494; p<0,001); группы контроля (t=5,701; p<0,001); группы сравнения (t=4,113; p=0,001); группы контроля (t=2,050; p=0,044); группы контроля (p<0,001); группы сравнения (t=8,744; p<0,001); группы контроля (t=6,262; p<0,001);группы контроля (p<0,001);группы сравнения (t=3,173; p=0,002); группы контроля (p<0,001);группы контроля (p<0,001); группы сравнения (t=3,105; p=0,003); группы контроля (p<0,001).
С учетом роли воспалительного процесса в формировании ОПС у больных РА проведено исследование показателей МПКТ у больных РА, осложненным ГЭР с различными степенями активности основного заболевания. Установлено, что выраженность ОПС прямо зависит от активности РА и достигает максимума у больных с ІІІ степенью активности. Достоверные различия наблюдались и при сравнении каждого из исследуемых денситометрических показателей (табл. 3).
| Показатель | Степень активности РА | ||
|---|---|---|---|
| І (n=27) | ІІ (n=53) | ІІІ (n=19) | |
| SOS, м/с | 1499±5,2*** | 1472±3,7*** | 1448±3,4 |
| BUA, дб/МГц | 101,8±1,07 | 96,4±0,7 | 92,1±0,92 |
| ИПК, % | 68,7±0,62 | 57,2±0,51 | 47,4±0,73 |
| Индекс Z, SD | –0,70±0,062 | –0,99±0,063 | –1,23±0,096 |
| Индекс Т, SD | –2,01±0,138 | –2,62±0,129 | –2,81±0,165 |
Различия достоверны при сравнении с аналогичным показателем: *при ІІ степени активности (t=4,205; p<0,001); **при ІІІ степени активности (t=7,452; p<0,001); ***при ІІІ степени активности (t=3,676; p<0,001); при ІІ степени активности (t=4,357; p<0,001); при ІІІ степени активности (t=6,520; p<0,001); при ІІІ степени активности (t=3,318; p=0,001); при ІІ степени активности (p<0,001); при ІІІ степени активности (p<0,001); при ІІІ степени активности (p<0,001); при ІІ степени активности (t=3,281; p=0,002);при ІІІ степени активности (t=4,637; p<0,001); при ІІІ степени активности (t=2,090; p=0,041);при ІІ степени активности (t=3,229; p=0,002); при ІІІ степени активности (t=3,820; p<0,001).
В пользу ведущей роли иммуновоспалительного процесса в генезе кластера внесуставных проявлений «ГЭР + ОПС» у больных РА свидетельствовала и динамика универсального провоспалительного цитокина — ФНО-α. В группе больных РА с вышеуказанным кластером уровень данного цитокина (94,5±1,49 нг/л) был достоверно выше (t=2,312; р=0,023), чем у пациентов с РА и ГЭР, но без ОПС (87,6±2,37 нг/л). Наряду с этим концентрация ФНО-α у больных РА с ГЭР (92,7±1,32 нг/л) превышала (t=2,454; р=0,015) аналогичный показатель у пациентов группы сравнения (86,3±2,67 нг/л). Подобная картина наблюдалась и при исследовании другого независимого маркера воспаления — СРБ. У больных РА с кластером «ГЭР + ОПС» содержание данного белка составило 33,20±1,203 мг/л, что достоверно (t=5,512; р<0,001) превышало аналогичный показатель у пациентов с РА и ГЭР, но без ОПС — 20,39±1,398 мг/л.
Выводы
При наличии ГЕР у больных РА наблюдается повышение частоты ОПС, что подтверждается наличием положительной ассоциативной связи между данными внесуставными проявлениями. Наряду с этим нарушения МПКТ у больных РА усугубляются при наличии ГЕР. Все вышеизложенное позволяет утверждать, что у данных пациентов имеет место формирование кластера внесуставных проявлений «ГЭР + ОПС». Механизмом, реализующим генез данной патологической конструкции, является иммуновоспалительный процесс.
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
- Вдовиченко В.І., Острогляд А.В., Денисюк Я.С. та ін. (2006) Поширеність гастроезофагеальної рефлюксної хвороби серед хворих ревматологічного профілю. Укр. терапевт. журн., 4: 65–67.
- Клубова А.Ф., Борткевич О.П., Дейкун А.И. (2002) Нарушение минеральной плотности костной ткани в зависимости от клинического течения ревматоидного артрита. Укр. мед. часопис, 3(29): 142–144.
- Нейко Є.М. Яцишин Р.І. (2007) Особливості перебігу та лікування остеопорозу у хворих на ревматоїдний артрит. Укр. ревматол. журн., 29(3): 82–83.
- Свінціцький А. С., Яременко О. Б., Пузанова О. Г., Хомченкова Н. І. (2006) Ревматичні хвороби та синдроми. Книга-плюс, Київ, 680 с.
- Фоломеева О. М. (2008) К проблеме определения внесуставных проявлений ревматоидного артрита. Науч.-практ. ревматол., 2: 74–82.
- Bannatyne G.A. (1896) Rheumatoid Arthritis: its Pathology, Morbid Anatomy, and Treatment. John Wright, Boston, 214 p.
- Sokoloff L., Wilens S.L., Bunim J.J., McEwen C. (1950) Diagnostic value of hystologic lesions of striated muscule in rheumatoid arthritis. Amer. J. Med., 219: 174.
- Turesson C., McClelland R. L., Christianson T. (2008) Clustering of extraarticular manifestations in patients with rheumatoid arthritis. J. Rheumatol., 35(1): 179–180.
Адреса для листування:
Заздравнов Андрій Анатолійович
Україна, 61015, Харків, пров. Внуківський, 10

Leave a comment