Оліго- та поліартикулярний варіанти ювенільного ідіопатичного артриту: дослідження патогенезу
- 1Львівський державний медичний університет
- 2Комунальний заклад Львівської обласної ради «Західноукраїнський спеціалізований дитячий медичний центр», Львів
Резюме. Мета виконаної роботи — дослідження патогенезу оліго- та поліартикулярного варіантів ювенільного ідіопатичного артриту (ЮІА) методом визначення рівнів цитокінів, їх рецепторів і антагоністів у сироватці крові цих хворих. Результати досліджень показали підвищення рівнів інтерферону (IFN)-γ та інтерлейкіну (IL)-17 з одночасним зниженням рівня IL-10 у сироватці крові хворих на поліартикулярний варіант ЮІА. При олігоартикулярному варіанті ЮІА виявлено підвищення концентрації фактора некрозу пухлини (TNF)-α у крові та значне зниження рівня протизапального цитокіну IL-10. Виявлені зміни імунітету у хворих відображають дисбаланс між Th-1/Th-17 і Treg-клітинами.
Хронічний артрит у дітей — важлива проблема сучасної педіатрії, оскільки має хронічний перебіг і суттєво впливає на якість життя хворої дитини та її родини. Одним із найважчих і найчастіших ревма-тичних захворювань у дитячому віці є ювенільний ідіопатичний артрит (ЮІА). Це поняття об’єднує гетерогенну групу хронічного артриту у дітей віком до 16 років. Етіологія цього захворювання до сьогодні недостатньо вивчена. Існують гіпотези щодо патогенетичного підґрунтя окремих варіантів ЮІА. Із впровадженням у практичну ревматологію методів біологічної терапії набули особливої ваги подальші дослідження патогенезу цієї патології. Особливо актуальним є дослідження ролі цитокінів у патогенезі окремих варіантів ЮІА.
Нині обговорюється гіпотеза, що патогенез ЮІА залежить від варіанта перебігу ЮІА. Сучасні дослідження свідчать про те, що патогенез оліго- та поліартикулярного варіантів ЮІА принципово відрізняється від системного ЮІА. Вважають, що у хворих на оліго- та поліартикулярний варіанти ЮІА відбуваються зміни в адаптативному імунітеті. Проводяться активні наукові дослідження розвитку дисбалансу між автореактивними Th-1/Th-17 і Тreg-клітинами як одного із можливих причин появи цих варіантів ЮІА [1, 10, 19, 20].
Олігоартикулярний варіант ЮІА становить близько 30–60% серед варіантів ЮІА та характеризується пошкодженням ≤4 суглобів [15].
Для поліартикулярного варіанта ЮІА з негативним ревматоїдним фактором (РФ) характерний артрит >5 суглобів і відсутність РФ у крові [15].
Об’єкт і методи дослідження
У Західноукраїнському спеціалізованому дитячому медичному центрі протягом останніх 4 років під динамічним спостереженням перебували 105 хворих на ЮІА. Варіант перебігу ЮІА верифікували згідно з критеріями ILAR (Durban, 1997; Edmonton, 2001) [22]. У 105 хворих на ЮІА верифікованими були такі варіанти перебігу захворювання: системний варіант — у 16 (15%) осіб, поліартрит із негативним РФ — у 19 (18%), поліартрит із позитивним РФ — у 2 (2%), олігоартрит — у 38 (36%), ентезит-артрит — у 27 (26%), псоріатичний артрит — у 3 (3%).
Сироватку крові у цих пацієнтів відбирали у різні періоди захворювання та заморожували при температурі –70 °C до моменту одноденного проведення дослідження рівнів усіх цитокінів. Проведено дослідження рівня цитокінів інтерлейкіну (IL)-1β, -4, -6, -8, -10, -17; інтерферону (IFN)-γ та їхніх розчинних рецепторів і антагоністів: антагоніста рецептора IL (IL-1Ra), розчинного рецептора IL-2 (sCD25), розчинного рецептора IL-6 (sIL6R), розчинного рецептора фактора некрозу пухлини (sTNFR1). Дослідження цитокінів проводили імуноферментним методом у лабораторії імунології ДУ «Інститут педіатрії, акушерства і гінекології НАМН України» (керівник — професор В.П. Чернишов), використовуючи комерційні тест-системи «BD Biosciences Pharmingen», Сан Дієго, США.
Статистичну оцінку отриманих даних виконували за допомогою пакета «STATISTIC 8.0». Для оцінки різниці між 2 незалежними вибірками використовували U-критерій Манна — Уїтні, який не потребує перевірки на нормальність розподілу і придатний для порівняння невеликих вибірок.
Результати досліджень
та їх обговорення
У 38 хворих на олігоартикулярний варіант ЮІА (олігоартрит) проведено 43 дослідження в активний період захворювання. Серед пацієнтів із олігоартритом було 17 хлопчиків і 21 дівчинка, середній вік початку захворювання становив 7,5±4,9 року.
Серед 19 хворих на поліартикулярний варіант ЮІА з негативним РФ (поліартрит із негативним РФ) було 7 хлопчиків і 12 дівчаток із середнім віком початку захворювання 6,0±4,5 року. У цій групі здійснено 31 дослідження в активний період захворювання.
Проведено порівняння рівнів цитокінів між контрольною групою (здорові діти) і групами хворих на олігоартрит і поліартрит (таблиця).
| Цитокін, пг/мл | Контроль, cереднє±SD | Олігоартрит, cереднє±SD |
Поліартрит, РФ-негативний, cереднє±SD |
|---|---|---|---|
| sCD25 | 407,3±258,2 | 526,3±410,1 | 568,4±321,3* |
| sIL6R | 8470,7±1183,7 | 8492,1±1089,5 | 8400,3±1480,8 |
| IL-1 | 1,2±0,5 | 4,7±10,9 | 3,7±7,9 |
| IL-6 | 1,8±4,4 | 30,0±85,7* | 30,0±41,2* |
| IL-17 | 4,3±12,4 | 173,5±689,8 | 111,4±268,0* |
| IL-10 | 45,8±49,5 | 22,8±37,8* | 18,5±28,4* |
| IL-4 | 6,6±15,2 | 72,6±216,1 | 18,8±44,1 |
| IL-8 | 8,1±14,6 | 17,9±69,8 | 23,8±55,9 |
| IFN-γ | 2,9±4,2 | 11,1±27,6 | 10,9±13,3* |
| TNF-α | 2,3±6,8 | 33,4±98,0* | 15,5±39,3* |
| IL-1Ra | 1155,5±789,0 | 2443,1±4184,1 | 2720,1±3291,0 |
| sTNFR1 | 680,4±428,0 | 1866,6±1110,1* | 2276,1±1272,4* |
SD — стандартне відхилення; *достовірна різниця між показниками у здорових і хворих дітей.
Аналіз рівнів цитокінів у дітей, хворих на олігоартрит, порівняно з контрольною групою показав істотне підвищення рівнів TNF-α (p<0,01), sTNFR1 (p<0,001), IL-6 (р<0,005) та зниження рівня IL-10 (p<0,005) (див. таблицю).
У хворих на поліартрит із негативним РФ порівняно з контрольною групою виявлено істотне підвищення TNF-α (p<0,005), sTNFR1 (p<0,001), IL-6 (p<0,001), IFN-γ (p<0,05), IL-17 (p<0,05), sCD25 (p<0,05) та зниження рівня IL-10 (p<0,005) (див. таблицю).
При дослідженні виявлено високі рівні TNF-α та IFN-γ у сироватці крові при полі- та олігоартикулярному варіантах ЮІА (рис. 1). При цьому у хворих на поліартрит був істотно підвищений рівень IL-17 — його, як і IL-22, відносять до прозапальних цитокінів, що продукуються Th-17-клітинами (рис. 2). Th-17-клітини відіграють важливу роль в ініціації та підтриманні автоімунного процесу при оліго- та поліартикулярному ЮІА [12–14]. Згідно з даними літератури велику кількість Th-17-клітин і високий рівень цитокінів IL-17 та IL-22 виявляють у хворих на оліго- та поліартикулярний варінти ЮІА. Ступінь підвищення IL-17 і IL-22 корелює з тяжкістю захворювання [12, 13]. IL-17-рецептори експресуються на епітеліальних клітинах, В- і Т-лімфоцитах, мієломоноцитарних клітинах, клітинах кісткового мозку та на синовіальних фібробластах і хондроцитах [4, 10]. Діючи на синовіальні фібробласти, IL-17 сприяє виділенню матриксметалопротеїнази, яка безпосередньо пошкоджує хрящову тканину в суглобі [11]. Він синергічно діє разом із IL-1, індукуючи активацію рецепторів ліганд ядерного фактора — kB(RANK) і рецепторів RANK, які стимулюють остеобласти і спричинюють кісткові ерозії [8]. IL-17 проявляє синергічний ефект дії разом зTNF-α, що веде до вивільнення прозапальних цитокінів і хемокінів із моноцитів і синовіальних фібробластів [3, 9, 16, 18]. Визначення концентрації IL-17 зазвичай проводили у синовіальній рідині хворих на ЮІА. Shildi Agarwal (2008) виявив значне підвищення IL-17 у синовіальній рідині хворих на ЮІА при поліартикулярному варіанті, а також позитивну кореляцію між ступенем підвищення рівня IL-17 і тяжкістю перебігу хвороби [2].
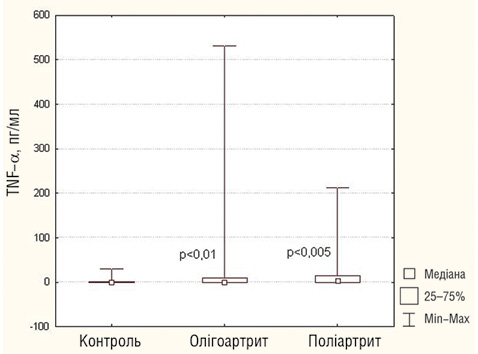
Рис. 1. Рівень TNF-α у сироватці крові хворих на оліго- та поліартикулярний варіанти ЮІА й здорових осіб (тест Манна — Уїтні)
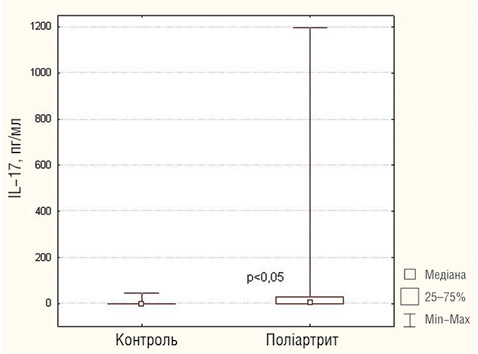
Рис. 2. Рівень IL-17 у сироватці крові хворих на поліартикулярний варіант ЮІА з негативним РФ і здорових осіб (тест Манна — Уїтні, p<0,05)
Поряд із підвищенням рівнів тих чи інших прозапальних цитокінів у крові хворих із цими варіантами ЮІА виявлено істотне зниження рівня протизапального цитокіну IL-10 (рис. 3), який синтезується Treg-клітинами, що належать до субпопуляцій CD4-T-клітин із функцією пригнічення ефекторних Т-клітин. Недостатність функції Treg-клітин може призводити до втрати імуносупресорного ефекту з подальшим розвитком аутоімунних захворювань [17]. Імуносупресивна дія Treg-клітин реалізується через синтез IL-10 [21, 24]. Існує два типи Treg-клітин: природні й активовані. Природні Treg-клітини є в організмі людини від народження, вони експресують на своїй поверхні фактор Foxp3 [5]. Активовані Treg-клітини продукують протизапальний цитокін IL-10, тому Treg-клітини є важливим регулятором імунної відповіді [6, 7].
Останнім часом обговорюється гіпотеза патогенетичної ролі дисбалансу між прозапальними і протизапальними Th-1/Th-17 і Treg-клітинами, що супроводжується дисбалансом між IFN-γ/IL-17 і IL-10 і відіграє провідну роль у розвитку оліго- та поліартикулярного варіантів ЮІА [23] (рис. 4).
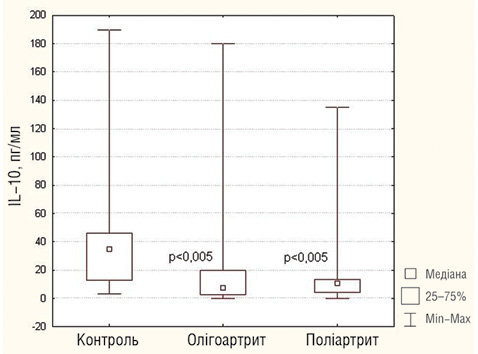
Рис. 3. Рівень IL-10 у сироватці крові хворих на оліго- та поліартикулярний варіанти ЮІА та здорових осіб (тест Манна — Уїтні)
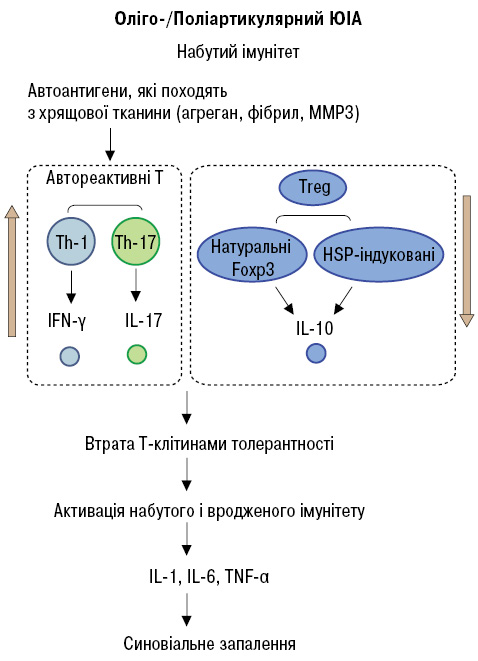
Рис. 4. Патогенез оліго- та поліартикулярного варіантів ЮІА [23]
Отримані нами результати щодо підвищення рівнів IFN-γ і IL-17 з одночасним зниженням рівня IL-10 у сироватці крові хворих на поліартикулярний варіант ЮІА підтверджують цю гіпотезу. Згідно з нею розвиток дисбалансу автореактивних Th-1/Th-17 і Treg-клітин в організмі веде до втрати Т-клітинами толерантності до автоантигенів. Т-клітинна активація адаптативної імунної системи, включаючи гіперпродукцію прозапальних цитокінів IFN-γ/IL-17, у свою чергу, активізує вроджену імунну систему, включаючи активацію нейтрофілів, макрофагів, синовіоцитів, та індукує синтез великої кількості інших прозапальних цитокінів, хемокінів і медіаторів, зокрема IL-6 та TNF-α, достовірне підвищення рівнів яких виявлено у хворих на поліартрит. При олігоартриті виявлено достовірне підвищення TNF-α зі зниженням рівня IL-10, що також вказує на дисбаланс між Th-1 і Treg.
Висновки
При РФ-негативному полі- та олігоартикулярному варіантах ЮІА патогенетичну роль відіграє дисбаланс між Th-1/Th-17 і Treg-клітинами.
При РФ-негативному поліартикулярному варіанті ЮІА у хворих підвищується рівень прозапальних цитокінів IFNγ, TNF-α та IL-17 і знижується рівень IL-10.
Підвищення рівня IL-17 є маркерною ознакою поліартикулярного варіанта ЮІА.
При олігоартикулярному варіанті ЮІА характерним є підвищення концентрації TNF-α у крові пацієнтів та значне зниження рівня протизапального цитокіну IL-10.
Список використаної літератури
1. Бойко Я.Є., Чернишов В.П., Омельченко Л.І. (2012) Показники цитокінового профілю у хворих на різні клінічні варіанти ювенільного ідіопатичного артриту. Соврем. педиатрия., 4(44): 61–66.
2. Agarwal S., Misra R., Agarwal A. (2008) Interleukin 17 levels are increased in juvenile idiopathic arthritis synovial fluid and induce synovial fibroblasts to produce proinflammatory cytokines and matrix metalloproteinases. J. Rheumatol., 35: 515–519.
3. Chabaud M., Fossiez F., Taupin J.L. et al. (1998) Enhancing effect of IL-17 on IL-1-induced IL-6 and leukemia inhibitory factor production by rheumatoid arthritis synoviocytes and its regulation by Th2 cytokines J. Immunol., 161: 409–414.
4. Honorati M.C., Meliconi R., Pulsatelli L. et al. (2001) High in vivo expression of interleukin-17 receptor in synovial endothelial cells and chondrocytes from arthritis patients. Rheumatology (Oxford) 40: 522–527.
5. Hori S., Nomura T., Sakaguchi S. (2003) Control of regulatory T cell development by the transcription factor Foxp3. Science, 299: 1057–1061.
6. Horwitz D.A., Zheng S.G., Gray J.D. (2008) Natural and TGF-beta-induced Foxp3(+)CD4(+)CD25(+) regulatory T cells are not mirror images of each other. Trends Immunol., 29: 429–435.
7. Vukmanovic-Stejic M., Zhang Y., Cook J. et al. (2006) Human CD4+ CD25hi Foxp3+ regulatory T cells are derived by rapid turnover of memory populations in vivo. J. Clin. Invest., 116: 2423–2433.
8. Lubberts E., van den Bersselaar L., Oppers-Walgreen B. et al. (2003) IL-17 promotes bone erosion inmurine collagen-induced arthritis through loss of the receptor activator of NF-kappa B ligand/osteoprotegerin balance. J. Immunol., 170: 2655–2662.
9. Jovanovic D.V., Di Battista J.A., Martel-Pelletier J. et al. (1998) IL-17 stimulates the production and expression of proinflammatory cytokines, IL-1beta and TNF-alpha, by human macrophages. J. Immunol., 160: 3513–3521.
10. Zrioual S., Toh M.L., Tournadre A. et al. (2008) IL-17RA and IL-17RC receptors are essential for IL-17A-induced ELR+CXC chemokine expression in synoviocytes and are overexpressed in rheumatoid blood. J. Immunol. 180: 655–663.
11. Koshy P.J., Henderson N., Logan C. et al. (2002) Interleukin 17 induces cartilage collagen breakdown: novel synergistic effects in combination with proinflammatory cytokines. Ann. Rheum. Dis., 61: 704–713.
12. Chabaud M., Durand J.M., Buchs N. et al. (1999) Interleukin-17: A T cell-derived proinflammatory cytokine produced by the rheumatoid synovium. Human. Arthritis. Rheum., 42: 963–970.
13. Nistala K., Moncrieffe H., Newton K.R. et al. (2008) Interleukin-17-producing T cells are enriched in the joints of children with arthritis, but have a reciprocal relationship to regulatory T cell numbers. Arthritis Rheum., 58: 875–887.
14. Hemdan N.Y., Birkenmeier G.,Wichmann G. et al. (2010) Interleukin-17-producing T helper cells in autoimmunity. Autoimmun. Rev., 9: 785–792.
15. Petty R.E., Southwood T.R., Manners P. et al. (2004) International League of Associations for Rheumatology classification of juvenile idiopathic arthritis: second revision, Edmonton, 2001. J. Rheumatol., 31(2): 390–392.
16. Katz Y., Nadiv O., Beer Y. (2001) Interleukin-17 enhances tumor necrosis factor alpha-induced synthesis of interleukins 1, 6, and 8 in skin and synovial fibroblasts: a possible role as a «fine-tuning cytokine» in inflammation processes. Arthritis Rheum., 44: 2176–2184.
17. Langier S., Sade K., Kivity S. (2010) Regulatory T cells: the suppressor arm of the immune system. Autoimmun. Rev. 10: 112–115.
18. Miossec P. (2011) Interleukin-17 and Th17 cells: from adult to juvenile arthritis — now it is serious! Arthritis. Rheum. 63(8): 2168–2171.
19. Miossec P., van den Berg W. (1997) Th1/Th2 cytokine balance in arthritis. Arthritis Rheum. 40: 2105–2115.
20. Macaubas C., Nguyen K., Milojevic D. et al. (2009) Oligoarticular and poliarticular JIA: epidemiology and pathogenesis. Nat. Rev. Rheumatol. 5: 616–626.
21. Sakaguchi S., Yamaguchi T., Nomura T. et al. (2008) Regulatory T cells and immune tolerance. Cell., 133: 775–787.
22. Cassidy J., Petty R., Laxer R.M. et al. (2010) Textbook of pediatric rheumatology. Philadelphia : Saunders Elsevier, 6 ed., 794 p.
23. Yu-Tsan Lin, Chen-Ti Wang, M Eric Gershwin et al. (2011) The pathogenesis of oligoarticular/polyarticular vs systemic juvenile idiopathic arthritis. Autoimmunity Reviews. 10: 482–489.
24. Vignali D.A., Collison L.W., Workman C.J. (2008) How regulatory T cells work. Nat. Rev. Immunol., 8: 523–532.
ОЛИГО- И ПОЛИАРТИКУЛЯРНыЙ ВАРИАНТЫ ЮВЕНИЛЬНОГО ИДИОПАТИЧЕСКОГО АРТРИТА: ИССЛЕДОВАНИЕ ПАТОГЕНЕЗА
Резюме. Цель выполненной работы — исследование патогенеза олиго- и полиартикулярного вариантов ювенильного идиопатического артрита (ЮИА) методом определения уровней цитокинов, их рецепторов и антагонистов в сыворотке крови у таких больных. Результаты исследований выявили повышение уровня интерферона (IFN)-γ и интерлейкина (IL)-17 с одновременным снижением уровня IL-10 в сыворотке крови у пациентов с полиартикулярным вариантом ЮИА. При олигоартикулярном варианте ЮИА отмечено повышение концентрации фактора некроза опухоли (TNF)-α в крови и значительное снижение уровня противовоспалительного цитокина IL-10. Выявленные изменения иммунитета у больных отражают дисбаланс между Th-1/Th-17 и Treg-клетками.
ювенильный артрит, цитокины, патогенез.
Адреса для листування:
Бойко Ярина Євгенівна
79035, Львів, вул. Дністерська, 27
Комунальний заклад Львівської обласної ради
«Західноукраїнський спеціалізований дитячий медичний центр»
Е-mail: jboyko@ukr.net

Leave a comment