Ефективність осеїн-гідроксиапатитного комплексу порівняно з карбонатом кальцію у запобіганні втрати кісткової маси: метааналіз
Camil Castelo-Branco, MD, PhD
Manel Ciria-Recasens, MD, PhD
María J. Cancelo-Hidalgo, MD, PhD
Santiago Palacios, MD, PhD
Javier Haya-Palazuelos, MD, PhD
Jordi Carbonell-Abelló, MD, PhD
Josep Blanch-Rubió, MD, PhD
María J. Martinez-Zapata, MD, PhD
José Manasanch, PhD
Lluís Pérez-Edo, MD, PhD
Отделение акушерства и гинекологии, Госпитальная клиника Provincial
Отеделение ревматологии, Госпиталь университета del Mar y de la Esperança, Барселона
Отделение акушерства и гинекологии, Госпиталь университета de Guadalajara, Universidad de Alcalá de Henares, Guadalajara
Palacios Институт женского здоровья и медицины, Мадрид
Отделение акушерства и гинекологии, Госпиталь General de Ciudad Real
Epidemiology and Public Health Service, CIBER of Epidemiology and Public Health (CIBERESP), Госпиталь de la Santa Creu i Sant Pau, Барселона
Pierre Fabre Ibérica S.A., Барселона, Испания
Перевод подготовлен кандидатом медицинских наук
М.Г. Романюк, ГУ «Институт урологии НАМН Украины»
Цель. Появляется все больше данных, свидетельствующих о том, что оссеин-гидроксиапатитный комплекс (ОГК) более эффективный, чем препараты кальция для сохранения костной массы. Цель данного метаанализа — определить, имеет ли ОГК различия в клиническом влиянии на минеральную плотность костной ткани (МПКТ) по сравнению с карбонатом кальция (КК).
Методы. Для оценки влияния ОГК по сравнению с КК на трабекулярную МПКТ проведен метаанализ рандомизированных контролируемых клинических исследований. Поиск публикаций клинических исследований выполнен в электронных базах данных, включая MEDLINE (1966 — ноябрь 2008), EMBASE (1974 — ноябрь 2008) и Кокрановский регистр контролируемых клинических исследований. Главным критерием оценки было процентное изменение МПКТ по сравнению с начальным показателем. Результаты собраны в модель рандомизация — эффект и определена средневзвешенная разница. Проведен анализ чувствительности, который исключал исследования без полного набора данных.
Результаты. Из 18 контролируемых исследований, найденных первично, в метаанализ были включены 6. Не отмечено достоверной гетерогенности между включенными исследованиями. Процентное изменение МПКТ было значительно выше в группе ОГК (1,02% (95% ДИ 0,63–1,41); р<0,00001). Эти результаты подтверждены в анализе чувствительности.
Выводы. ОГК является значительно более эффективным в предупреждении потери костной массы, чем КК.
Несколько исследований продемонстрировали связь между показателями минеральной плотности костной ткани (МПКТ) и риском переломов [1–3], хотя до сих пор не существует единого мнения, насколько повышение МПКТ может снижать риск развития переломов [4–5]. Соли кальция могут повышать МПКТ, хоть и в несколько меньшей степени, чем некоторые антирезорбтивные препараты, и неизвестно, помогают ли они предотвратить переломы костей [6–8]. Кроме повышения МПКТ, некоторые другие факторы могут играть роль в обеспечении качества кости и риска перелома. К ним относятся сохранение трабекулярной и соединительной ткани, микроархитектура костей, степень биохимического замещения и толщина кортикальной ткани [9]. Общепринятым является то, что кальций необходимо назначать пациентам с остеопорозом и остеопенией [10]. Пациентам с остеопорозом кальций часто назначают дополнительно к другим видам лечения.
Оссеин-гидроксиапатитный комплекс (ОГК) также используют для профилактики и лечения остеопороза и для регуляции кальциево-фосфорного баланса в таких ситуациях, как период беременности и кормления грудью или как адъювантная терапия для ускорения сращения переломов. Данный комплекс широко исследован и используется для профилактики и лечения остеопороза.
Компоненты ОГК продемонстрировали значительный эффект на регенерацию костей [11, 12]. Когда ОГК был сравнен на животной модели с минеральным компонентом препарата в отдельности (гидроксиапатит, содержащий кальций и фосфор) и с карбонатом кальция (КК), изучение гистологических срезов костей на флюоресцентном микроскопе показало улучшение формирования костей в группе ОГК [11, 12]. Результаты других исследований свидетельствуют о том, что ОГК стимулирует костный метаболизм [13], в частности, когда остеобластическая активность снижена, путем стимуляции дифференцировки, активности и пролиферации остеобластов посредством оссеина [14].
Некоторые предварительные исследования предполагали, что ОГК значительно более эффективный в отношении поддержания МПКТ, чем КК [15–19]. Для проверки гипотезы, что ОГК более эффективен в поддержании МПКТ, чем КК, нами проведен систематический обзор существующих исследований и сделан метаанализ для оценки влияния ОГК на МПКТ, по сравнению с КК у пациентов с остеопорозом или повышенным риском его развития.
Методы
Участники исследования и проводимая терапия
Участниками исследования были мужчины и женщины в возрасте старше 18 лет с клиническим диагнозом «остеопения» или «остеопороз», или с факторами риска развития остеопороза. Участники с желудочно-кишечными проблемами, которые могут нарушить абсорбцию исследуемых препаратов, исключались из исследования.
Одна таблетка ОГК (Остеопор/Оссопан/Остеогенон, 830 мг ОГК в таблетке; «Pierre Fabre Médicament», Кастр, Франция) содержит кальций (178 мг), фосфор (82 мг), и протеины, связанные с костным метаболизмом (остеокальцин: 5,8 мкг; коллаген 1-го типа : 216 мг; инсулиноподобный фактор роста I типа: 168 нг; инсулиноподобный фактор роста II типа: 84 нг; трансформирующий фактор роста-β: 21 нг).
В систематическом обзоре нашей целью было определить исследования длительностью не менее 1 года, сравнивающие ОГК и КК для лечения и профилактики остеопороза и остеопении. Включались только те исследования, в которых ОГК и КК принимали перорально, с/без витамина D. Режим дозирования был описан в каждом исследовании.
Систематический обзор и отбор исследований
Для нахождения необходимых исследований для обзора использовались такие термины поиска: гидроксиапатит или оссеин-гидриксоапатитный комплекс; Остеопор или оссеин-гидроксиапатитный комплекс; Оссопан или Остеогенон; остеопороз или остеопения; рандомизированное клиническое исследование. Поиск проводился в базах MEDLINE (октябрь 1996 — ноябрь 2008), EMBASE (1974 — ноябрь 2008) и в Кокрановском регистре контролируемых исследований и был ограничен англо- и испаноязычными публикациями и исследованиями на людях. Была необходимость связаться с некоторыми авторами отобранных статей [15–17, 20] и фармацевтическими компаниями, которые продают ОГК, для получения дополнительной информации по некоторым исследованиям. Отдельно проанализированы списки литературы систематических обзоров, метаанализов и рандомизированных контролируемых исследований (РКИ) для выявления дополнительных РКИ.
РКИ, сравнивающие эффективность ОГК и КК, могли быть направлены либо на профилактику либо на лечение потери костной массы, или и на то и на другое. Также включались только клинические исследования, использующие денситометрию для определения процентного изменения в трабекулярных костях (позвонки или дистальная часть лучевой кости). Исследования, использующие радиограмметрию исключались.
Два обозревателя (M.J.M.Z. и J.M.) независимо друг от друга оценивали соответствие исследований критериям включения в метаанализ. При несоответствии их мнений, решение о том, включать или не включать исследование, принималось консенсусом двух других обозревателей (L.P.E. и M.C.R.). Все авторы участвовали в анализе и интерпретации данных, редактировали статью и утверждали окончательный вариант.
Один обозреватель (M.J.M.Z.) выбирал данные из подходящих статей с использованием стандартного протокола, согласованного с исследовательской командой. Отбиралась информация по характеристикам пациентов, лечению и критериям эффективности. Главным критерием было процентное изменение МПКТ по сравнению с начальным уровнем.
Оценка исследований
Качество отобранных исследований оценивалось по тому, как проходила рандомизация, по заслеплению терапии, по выходам из исследований, и по тому, как проводился анализ (по протоколу или по пациентам, «собирающимся начать лечение»). Эту информацию использовали для классификации исследований на одну из категорий Шотландской межколлегиальной рекомендательной сети: ++ (высокое качество), + (среднее качество), и — (плохое качество). Для определения качества исследования также использовалась шкала A.R. Jadad и соавторов [22]. Она обеспечивает рейтингование от 0 (низкое качество) до 5 (высокое качество) на основании качества рандомизации, на основании того, было ли исследование двойным слепым, по количеству выходов из исследования и по качеству маскировки исследуемого препарата.
Статистические методы
Данные анализировались при помощи компьютерной программы RevMan 4.2. [23]. Перед общей оценкой полученного эффекта проводился анализ на гетерогенность данных. Гетерогенность считалась адекватной при р<0,1.
Анализ эффективности проводили при помощи модели рандом-эффект [24], потому что исследования, включенные в обзор, оценивали МПКТ в разных костях при помощи разных методов денситометрии, и влияние препарата оценивалось при разных степенях потери костной массы. Общий эффект подсчитывался при помощи средневзвешенной разницы (СВР). Значения >0 (включая 95% ДИ) указывали на то, что ОГК более эффективен, а негативные значения — свидетельствовали в пользу КК. Значение ноль значило, что оба лечения эквивалентны между собой в отношении эффективности. Мы также выполнили вторичный анализ, используя модель фиксированных эффектов.
Два исследования [15, 16] показывали средние величины, но не стандартное отклонение (СО) процентного изменения МПКТ, и не указывали данные, позволяющие нам самим высчитать СО. Для этих исследований мы подсчитывали среднее и СО с использованием СВР, а их доверительные интервалы (ДИ) получали путем комбинирования данных из исследований, которые эти показатели давали [17, 18, 20, 25]. Максимальное значение, которое является более консервативной оценкой подсчитанных средних и СО, использовалось для данных, которых недоставало.
Для выверения достоверности результатов основного анализа проводился анализ чувствительности, в котором исключались исследования без полных данных [15, 16]. Мы также проводили анализ чувствительности для выявления факта, влияет ли применение витамина D на результаты.
Результаты
Описание исследований
Из найденных 649 публикаций 18 контролируемых клинических исследований были выбраны для дальнейшего обзора (рис. 1). Для 3 из них была получена дополнительная информация, не содержавшаяся в оригинальных публикациях [15, 17, 20]. После оценки полного текста выбранных исследований, 6 контролируемых РКИ были включены в метаанализ. Все они сравнивали ОГК с КК (табл. 1). Поскольку в одной из статей [21] результаты приводились из двух разных групп участников (с/без перелома бедра), данные из нее включались как две отдельные группы. Были исключены 12 исследований [19, 26–36] по причинам, описанным в табл. 2.
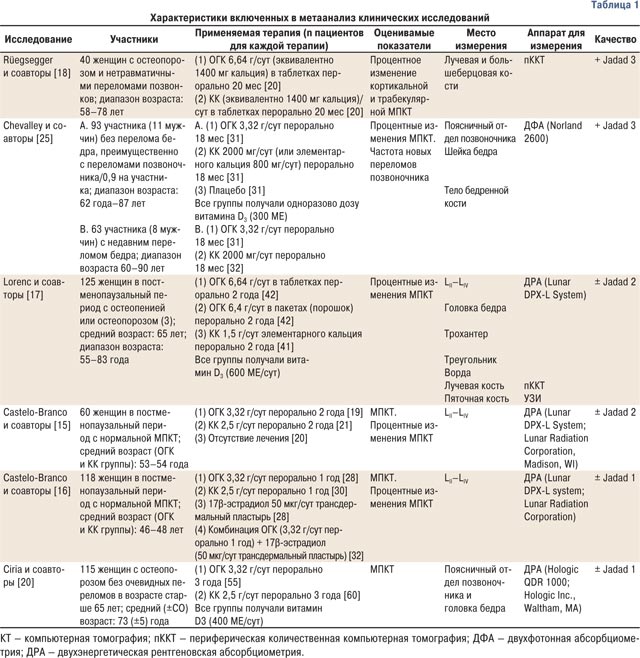

Качество исследований было приемлемым в 2 испытаниях [18, 25], и немного хуже — в 4 оставшихся [15–17, 20]. Все испытания были рандомизированными и контролируемыми. Другие метаболические нарушения в костях, патология щитовидной железы и лечение кортикостероидами в анамнезе были основными критериями исключения для всех исследований, в то время как скрининг на наличие почечной недостаточности был представлен во всех, кроме одного [18]. В 3 испытаниях сообщалось об оценке уровня потребления кальция в начале исследования [15, 17, 25], а в 2 — описывалось наличие или отсутствие курения у пациентов [15, 18]. Первичные уровни витамина D не изучались ни в одном из исследований, хотя он принимался пациентами в 3 из них [17, 20, 25]. В 1 исследовании описан процесс рандомизации и заслепления лечения. Некоторые исследования описывали детали выходов пациентов из них [15, 17, 25].
Рис. 1. Схема процесса отбора исследований для метаанализа
Всего 614 участников были включены в выбранные исследования. Средний возраст составлял от 46 [16] до 78 лет [25]. Результаты метаанализа основывались на данных 461 участника (14 мужчин), у 363 из которых было значительное снижение МПКТ в начале исследований. Остальные [98] имели нормальную МПКТ.
Два исследования фокусировались на первичной профилактике и включали участниц без остеопении или остеопороза, но с риском потери костной массы, поскольку все участницы были женщинами в постменопаузальный период [15, 16]. Остальные 4 исследования включали участников с остеопенией и остеопорозом [17, 25] или только остеопорозом [18, 20] (см. табл. 1). В 5 исследованиях МПКТ измеряли по остистым отросткам поясничного отдела позвоночника (LII–LIV) при помощи костной абсорбциометрии. В исследовании Р. Rüegsegger и соавторов [18] периферическая количественная компьютерная томография использовалась в области дистальной части лучевой кости (табл. 3).
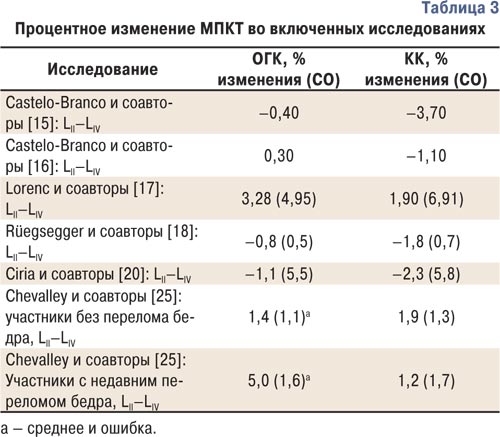
Дозы варьировали от 3320 до 6640 мг/сут для ОГК и от 2000 до 3500 мг/сут — для КК. В 3 включенных исследованиях участники получали эквивалентные дозы кальция в двух группах (ОГК и КК) [17, 18, 25]. В оставшихся 3 исследованиях [15, 16, 20] дозировки кальция были приблизительно на 30% ниже в группе, получающей ОГК (в диапазоне 712–1424 мг/сут в группах ОГК и 1000–1500 мг — в группах КК). В 3 исследованиях все участники получали одновременно перорально витамин D3 (600 [17] МЕ и 400 [20] МЕ ежедневно или 300 МЕ одноразово [25]) в обеих подгруппах.
Активное лечение во включенных в обзор исследованиях длилось от 1 [16] года до 3 [20] лет, медиана составляла 2 года (см. табл. 1).
Оценка основных результатов
Для определения общего эффекта в отношении процентного изменения МПКТ в трабекулярной кости были объединены данные из 6 РКИ [15–18, 20, 25] общее количество участников составило 360 человек (179 — в группе ОГК и 181 — в группе КК). Гетерогенность отсутствовала (I=0%; p=0,84), а результаты свидетельствовали в пользу группы, получающей лечение ОГК (рис. 2).
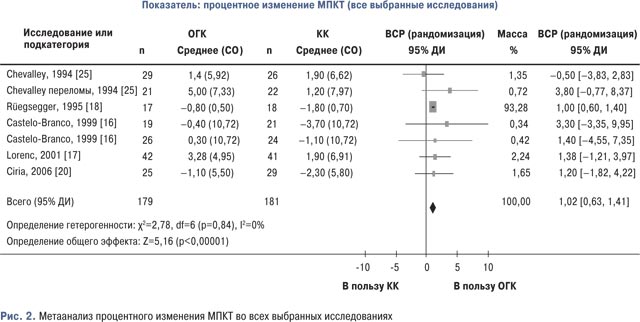
Средневзвешенная разница показывала, что МПКТ повысилась на 1,02% (95% ДИ 0,63–0,41) больше в группе ОГК, по сравнению с группой КК. Эта разница была статистически достоверной (р<0,00001).
Анализ чувствительности
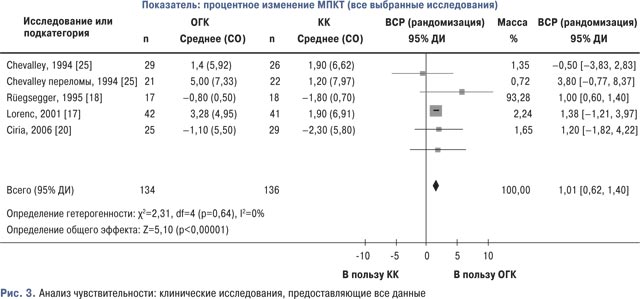
При отдельном анализе результатов 4 исследований, предоставляющих полный набор данных [17, 18, 20, 25], количество участников составляло 270 человек (134 — в группе ОГК и 136 — в группе КК), результат был очень близок к полученному при основном анализе. Гетерогенность отсутствовала (I=0%; p=0,68), и результаты свидетельствовали в пользу группы ОГК; в этом случае СВР показывала, что МПКТ повысилась на 1,01% (95% ДИ 0,62–1,40) больше в группе ОГК, по сравнению с группой КК. Результат был статистически достоверным p<0,00001 (рис. 3).
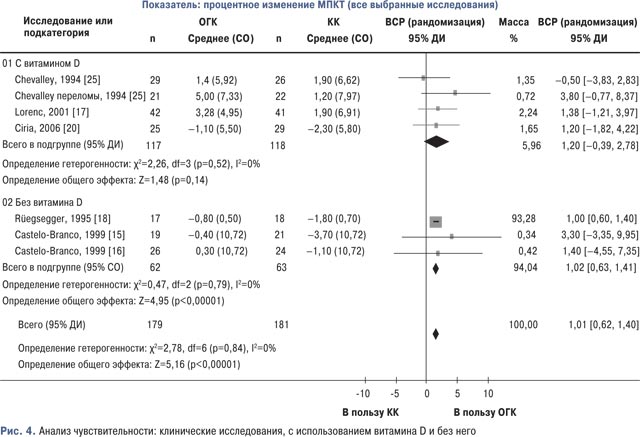
При анализе исследований в отношении приема витамина D тенденция была такая же, как и при основном анализе. Исследования, в которых витамин D применяли в обоих подгруппах, заметно не влияли на общий результат (рис. 4).
Обсуждение
Это первый метаанализ, сравнивающий эффективность ОГК и КК в профилактике или лечении потери костной массы у женщин в постменопаузальный период. Результаты основываются на данных рандомизированных сравнительных клинических исследований в параллельных группах.
В разных статьях сообщалось об эффективности кальция в профилактике или лечении потери костной массы [7, 8, 37, 38] по сравнению с плацебо. Тем не менее, имелось недостаточно информации, указывающей на достаточную эффективность препаратов кальция в отношении снижения риска переломов, хотя по последнему метаанализу [38], включающем 63 897 участников, сделано заключение, что лечение кальцием или комбинацией кальция с витамином D было связано со статистически значимым снижением риска переломов на 12% по сравнению с плацебо. Это снижение было еще больше (24%) при учете высокого уровня комплаенса. В отношении МПКТ позвоночника лечение было связано со снижением на 1,19% уровня потери костной массы, по сравнению с плацебо. Добавление витамина D к кальцию значительно влияло на результаты. Также другой метаанализ РКИ, сравнивающий с плацебо или с отсутствием лечения у женщин в постменопаузальный период и/или мужчин пожилого возраста [39] дал заключение, что пероральный прием витамина D может снижать риск переломов бедра только при применении препаратов кальция.
Эти результаты наблюдались на фоне приема 1200 мг кальция, что является рекомендуемой дозой для взрослых, что отражено в вышеуказанных публикациях, и Национальным фондом остеопороза [38, 40]. Другие обзоры рекомендуют ежедневный прием 1500 мг биодоступного кальция после менопаузы, в отсутствие заместительной терапии эстрогенами [41, 42], хотя известно, что ни то, ни другое количество кальция часто не получается принимать при обычном диетическом режиме. В отношении риска развития переломов также эффективны антирезорбтивные препараты, при назначении в комбинации с как минимум 500 мг кальция в сутки [43–46]. Недавнее клиническое исследование [47] показало, что женщины в возрасте старше 70 лет, принимавшие 600 мг кальция 2 раза в сутки в виде КК, имели значительно более низкий риск остеопоротического перелома, чем применявшие плацебо (10,2% по сравнению с 15,4% соответственно, при анализе согласно протоколу, который включал пациентов, имеющих ≥80% комплаенса). Эти результаты подтверждают гипотезу, что кальций помогает снижать риск развития остеопоротических переломов.
Исследование, проведенное Инициативной группой по изучению женского здоровья [48], направленное на обследование женщин в постменопаузальный период, живущих в обществе, и сравнивающее кальций с витамином D, по сравнению с плацебо, сообщало о степени ответа 29% в отношении переломов бедра (коэффициент риска 0,71; 95% ДИ 0,52–0,97) в основной группе. Важно отметить, что этот результат получен только среди тех пациентов, которые приняли хотя бы 80% исследуемого препарата, что подчеркивает важность комплаенса. В данном исследовании также регистрировалось повышение на 1,06% МПКТ бедра, по сравнению с плацебо на 9-м визите через 1 год (р=0,01), давая достоверное различие между группами начиная с 3-го года. В данном метаанализе повышение МПКТ составляло 1,02% у участников, получающих ОГК, по сравнению с теми, кто принимал КК.
Результаты этого первого систематического обзора и метаанализа, сравнивающего ОГК с КК, указывают, что первый дает статистически значимое преимущество в отношении процентного повышения МПКТ. Для 2 из первично включенных 6 анализов [15, 16] было необходимо подсчитывать СО с использованием данных из других исследований, поскольку эта информация не была обеспечена авторами. Тем не менее, мы это приняли во внимание и исключили эти 2 испытания из анализа чувствительности. Результаты этого дополнительного анализа подтвердили результаты основного исследования.
Хотя полностью не изучено, но наблюдаемое преимущество может быть объяснено остеогенными эффектами, связанными органическим компонентом ОГК, что предполагается авторами экспериментальных исследований, в которых образование новых костей было выше у животных, принимающих ОГК, чем у тех, которые получали такое же количество минерального компонента только в виде гидроксиапатита [11, 12]. Такая же гипотеза рассматривается в похожем исследовании, сравнивающем ОГК и только гидроксиапатит у людей [49].
Ограничения метаанализа были в том, что несколько исследований не были заслеплены. Два исследования [18, 25] маскировали терапевтическое воздействие: в одном из них была значительная степень точности, что значительно влияло на результаты метаанализа. Кроме того, исследования, которые полностью соответствовали критериям включения, имели маленькие размеры выборок, что, в свою очередь, ограничивало окончательный размер выборки в метаанализе. Хотя это, конечно, является ограничением, все же метаанализы дают самый высокий уровень научной достоверности, в частности в случаях, когда отдельные исследования дают ограниченные данные. Другой аспект метаанализа — это риск публикационных неточностей, хотя необходимо подчеркнуть, что в данный метаанализ были включены результаты 2 неопубликованных исследований [17, 20]. Поскольку в метаанализ были включены только 6 исследований, мы не использовали карту воронки, так как по данным Пособия Кокрановской библиотеки [50] не рекомендуется использовать эту технику, если включается <10 исследований.
Среди выбранных для включения исследований — 3, в которых МПКТ исследовалось при помощи радиографических методов [19, 29, 30], были исключены, поскольку эти методы менее достоверные и точные, чем двухэнергетическая рентгеновская абсорбциометрия или количественные методики компьютерной томографии. Результаты этих исследований также показали, что МПКТ не изменялась или повышалась в группе ОГК, по сравнению с КК. В 2 исследованиях [29, 35] также наблюдалось симптоматическое уменьшение выраженности боли в спине в группе, получающей ОГК.
Положительный эффект ОГК на МПКТ и качество костей [11, 12, 20] по сравнению с КК дает возможность предполагать, что лечение может привести к снижению риска развития переломов. Однако, чтобы подтвердить эту гипотезу, необходимо провести методологически адекватное сравнительное клиническое исследование с соответствующим размером выборки, в котором первичным критерием оценки будет риск развития переломов.
И, наконец, хотя это и не было целью настоящего анализа, но несколько исследований также продемонстрировали, что ОГК имеет очень хорошую переносимость при длительном применении, с частотой побочных эффектов <4% (3,2% — запор) [26, 29]. Хотя прямым образом не сравнивалось, но частота побочных эффектов, связанных с КК (в частности запор) была на уровне от 13,4% [47] до 18% [51] в рандомизированных клинических исследованиях.
Заключение
В заключение можно сказать, что этот метаанализ показал, что ОГК более эффективен, чем КК для сохранения или повышения МПКТ у пациентов с нормальной или сниженной МПКТ.
Список использованной литературы
1. Marshall D., Johnell O., Wedel H. (1996) Meta-analysis of how well measures of bone mineral density predict occurrence of osteoporotic fractures. BMJ, 312: 1254–1259.
2. Schott A.M., Cormier C., Hans D. et al. (1998) How hip and whole body bone mineral density predict hip fracture in elderly women. The EPIDOS prospective study. Osteoporos Int., 8: 247–254.
3. Faulkner K.G. (2000) Bone matters: are density increases necessary to reduce fracture risk? J. Bone Miner. Res., 15: 183–187.
4. Hochberg M.C., Greenspan S., Wasnich R.D. et al. (2002) Changes in bone density and turnover explain the reductions in incidence of nonvertebral fractures that occur during treatment with antiresorptive agents. J. Clin. Endocrinol. Metab., 87: 1586–1592.
5. Delmas P.D., Seeman E. (2004) Changes in bone mineral density explain little of the reduction in vertebral or nonvertebral fracture risk with antiresorptive therapy. Bone, 34: 599–604.
6. Cumming R., Cumming S., Nevitt M. (1997) Calcium intake and fracture risk: results from the study of osteoporotic fractures. Am. J. Epidemiol., 145: 927–935.
7. Shea B., Wells G., Cranney A. et al. (2002) Osteoporosis Methodology Group and The Osteoporosis Research Advisory Group. Meta-analyses of therapies for postmenopausal osteoporosis. VII. Meta-analysis of calcium supplementation for the prevention of postmenopausal osteoporosis. Endocr. Rev., 23: 552–559.
8. Grant A.M., Avenell A., Campbell M.K. et al. (2005) RECORD Trial Group. Oral vitamin D3 and calcium for secondary prevention of low-trauma fractures in elderly people (Randomised Evaluation of Calcium or Vitamin D, RECORD): a randomised placebo-controlled trial. Lancet, 365: 1621–1628.
9. Zárate A., Hernández M., Morán C. et al. (2003) El enfoque moderno de la osteoporosis. Rev. Fac. Med. UNAM, 46: 49–51.
10. NIH Consensus Development Panel on Osteoporosis Prevention, Diagnosis, and Therapy (2001) JAMA, 285: 785–795.
11. Annefeld M., Caviezel R., Schacht E. et al. (1986) The influence of ossein-hydroxyapatite compound on the healing of a bone defect. Curr. Med. Res. Opin, 10: 241–250.
12. Schmidt K.H., WoЁrner V.M., Buck H.J. (1988) Examination of new bone growth on aluminium oxide implant contact surfaces after oral administration of ossein-hydroxyapatite compound to rats. Curr. Med. Res. Opin., 11: 107–115.
13. Chavassieux P., Pastoureau P., Boivin G. et al. (1991) Effects of ossein-hydroxyapatite compound on ewe bone remodeling: biochemical and histomorphometric study. Clin. Rheumatol., 10: 269–273.
14. Castelo-Branco C., Vicente J.J., Haya J. (2004) Menopausia y osteoporosis: utilidad del complejo de oseÍna-hidroxiapatita. In: C. Castelo-Branco, J. Haya Palazuelos (Еds) Osteoporosis y Menopausia. Madrid, Spain: Editorial Médica Panamericana, р. 357–364.
15. Castelo-Branco C., Pons F., Vicente J.J. et al. (1999) Preventing postmenopausal bone loss with ossein-hydroxyapatite compounds. Results of a two-year, prospective trial. J. Reprod. Med., 44: 601–605.
16. Castelo-Branco C., Martinez de Osaba M.J., Pons F. et al. (1999) Osseinhydroxyapatite compounds for preventing postmenopausal bone loss. Coadjuvant use with hormone replacement therapy. J. Reprod. Med., 44: 241–246.
17. Lorenc R.S., Tlustochowicz W., Hoszowski H. et al. (2001) The importance of past history of calcium supplementation on therapeutic effect of ossein-hydroxyapatite compound in osteoporotic females (abstract). Paper presented at: the 4th International Symposium on Nutritional Aspects in Osteoporosis, May 17–20, Lausanne, Switzerland.
18. Rűegsegger P., Keller A., Dambacher M.A. (1995) Comparison of the treatment effects of ossein-hydroxyapatite compound and calcium carbonate in osteoporotic females. Osteoporos Int., 5: 30–34.
19. Epstein O., Kato Y., Dick R. et al. (1982) Hydroxyapatite and calcium gluconate in treatment of cortical bone thinning in postmenopausal women with primary biliar cirrhosis. Am. J. Clin. Nutr., 26: 426–430.
20. Ciria M., Perez-Edo L., Blanch J. et al. (2005) Ossein-hydroxyapatite versus calcium carbonate effects in bone metabolism in primary senile osteoporosis (abstract). Bone, 36: S402.
21. SIGN 50: A Guidelines Developers’ Handbook. Edinburgh, 2004. Methodology checklist 2: Randomised controlled trials (http://www.sign.ac.uk/guidelines/fulltext/50/checklist 2.html). Accessed February 1, 2007.
22. Jadad A.R., Moore R.A., Carroll D. et al. (1996) Assessing the quality of reports of randomized clinical trials: is blinding necessary? Control Clin. Trials,117: 1–12.
23. RevMan Analyses [computer program]. Version 1.0 for Windows. In: Review Manager (RevMan) 4.2. Copenhagen: The Nordic Cochrane Centre, The Cochrane Collaboration, 2003.
24. DerSimonian R., Laird N. (1986) Meta-analysis in clinical trials. Control Clin. Trials. 7: 177–188.
25. Chevalley T., Rizzoli R., Nydegger V. et al. (1994) Effects of calcium supplements on femoral bone mineral density and vertebral fracture rate in vitamin-DYreplete elderly patients. Osteoporos Int., 4: 245–252.
26. Fernández-Pareja A., Hernández-Blanco E., Pérez-Maceda J.M. et al. (2007) Prevention of osteoporosis. Fouryear follow-up of a cohort of postmenopausal women treated with an ossein-hydroxyapatite compound. Clin. Drug. Invest., 27: 227–232.
27. Tovey F.I., Hall M.L., Ell P.J. et al. (1991) Postgastrectomy osteoporosis. Br. J. Surg., 78: 1335–1337.
28. Khadzhiev A., Rachev E., Katsarova M. et al. (1990) The results of a clinical trial of the preparation Ossopan. Akush Ginekol (Sofiia), 29: 85–87.
29. Pines A., Raafat H., Lynn A.H. et al. (1984) Clinical trial of microcrystalline hydroxyapatite compound («Ossopan») in the prevention of osteoporosis due to corticosteroid therapy. Curr. Med. Res. Opin., 8: 734–742.
30. Stěpán J.J., Pospíchal J., Presl J. et al. (1989) Prospective trial of osseinhydroxyapatite compound in surgically induced postmenopausal women. Bone, 10: 179–185.
31. Stellon A., Davies A., Webb A. et al. (1985) Microcrystalline hydroxyapatite compound in prevention of bone loss in corticosteroid-treated patients with chronic active hepatitis. Postgrad. Med. J., 61: 791–796.
32. Albertazzi P., Steel S.A., Howarth E.M. et al. (2004) Comparison of the effects of two different types of calcium supplementation on markers of bone metabolism in a postmenopausal osteopenic population with low calcium intake: a double-blind placebo-controlled trial. Climacteric, 7: 33–40.
33. Lugli R., Brunetti G., Salvioli G. (1990) Effect of ossein hydroxyapatite compound (OssopanA) on back pain in the elderly. Results of a placebo-controlled trial. Clin. Trials J., 27: 141–148.
34. Hegg R., Halbe W.H., Fernandes C.E. et al. (2003) Comparative study of the bone effects of ossein-hydroxyapatite complex versus calcium carbonate in osteopenic postmenopausal women. Rev. Bras. Med., 60: 622–625.
35. Ringe J.D., Keller A. (1992) Risk of osteoporosis in long-term heparin therapy of thromboembolic diseases in pregnancy: attempted prevention with ossein-hydroxyapatite. Geburtsh Frauenheilkd, 52: 426–429.
36. Pelayo I., Haya J., De la Cruz J.J. et al. (2008) Raloxifene plus osseinhydroxyapatite compound versus raloxifene plus calcium carbonate to control bone loss in postmenopausal women: a randomized trial. Menopause, 15: 1132–1138.
37. Mackerras D., Lumley T. (1997) First and second year effects in trials of calcium supplementation of the loss of bone density in postmenopausal women. Bone, 21: 527–533.
38. Tang B.M., Eslick G.D., Nowson C. et al. (2007) Use of calcium or calcium in combination with vitamin D supplementation to prevent fractures and bone loss in people aged 50 years and older: a meta-analysis. Lancet, 370: 657–666.
39. Boonen S., Lips P., Bouillon R. et al. (2007) Need for additional calcium to reduce the risk of hip fracture with vitamin D supplementation: evidence from a comparative meta-analysis of randomised controlled trials. J. Clin. Endocrinol. Metab., 92: 1415–1423.
40. National Osteoporosis Foundation (2003) Physician’s Guide to Prevention and Treatment of Osteoporosis. Washington, DC: National Osteoporosis Foundation.
41. Recker R.R. (1993) Clinical review 41: current therapy for osteoporosis. J. Clin. Endocrinol. Metab., 76: 14–16.
42. NIH Consensus conference (1994) Optimal calcium intake. NIH Consensus Development Panel on Optimal Calcium Intake. JAMA, 272: 1942–1948.
43. Chesnut C.H., Ettinger M.P., Miller P.D. et al. (2005) Ibandronate produces significant, similar antifracture efficacy in North American and European women: new clinical findings from BONE. Curr. Med. Res. Opin., 21: 391–401.
44. Delmas P.D., Adami S., Strugala C. et al. (2006) Intravenous ibandronate injections in postmenopausal women with osteoporosis: one-year results from the dosing intravenous administration study. Arthritis Rheum., 54: 1838–1846.
45. Eisman J.A., Civitelli R., Adami S. et al. (2008) Efficacy and tolerability of intravenous ibandronate injections in postmenopausal osteoporosis: 2-year results from the DIVA study. J. Rheumatol., 35: 488–497.
46. Grupo de trabajo de la SEIOMM (2002) Osteoporosis posmenopáusica. Guía de práctica clínica. Reemo, 11: 67–78.
47. Prince R.L., Devine A., Dhaliwal S.S. et al. (2006) Effects of calcium supplementation on clinical fracture and bone structure: results of a 5-year, double-blind, placebo-controlled trial in elderly women. Arch. Intern. Med., 166: 869–875.
48. Jackson R.D., LaCroix A.Z., Gass M. et al. (2006) Calcium plus vitamin D supplementation and the risk of fractures. N. Engl. J. Med., 354: 669–683.
49. Durance R.A., Parsons V., Atkins C.J. et al. (1973) A trial of calcium supplements (Ossopan) and ashed bone. Clin. Trials. J., 10: 67–74.
50. Higgins J.P.T., Green S. (Еds) (2008) Cochrane Handbook for Systematic Reviews of Interventions, Version 5.0.0 [updated February 2008]. The Atrium, Southern Gate, Chichester, West Sussex, England; John Wiley & Sons Ltd, 2008. The Cochrane Collaboration, 2008 (http://www.cochrane-handbook.org). Accessed October 1, 2008.
51. Reid I.R., Mason B., Horne A. et al. (2006) Randomized controlled trial of calcium in healthy older women. Am. J. Med., 119: 777–785.
Публикация предоставлена компанией «Евромедэкс».

Leave a comment