Огляд матеріалів ІХ Національного конгресу ревматологів України «Нові можливості в ревматології: від теорії до практики»
Редакція «Українського ревматологічного журналу»
Резюме. У статті подано огляд матеріалів ІХ Національного конгресу ревматологів України з міжнародною участю «Нові можливості в ревматології: від теорії до практики» (Київ, 12–14 листопада 2025 р.), що висвітлив сучасні досягнення та тенденції у веденні ревматичних та аутоімунних захворювань. Конгрес продемонстрував інтеграцію фундаментальних наукових знань, таргетної і біологічної терапії, концепції Treat-to-Target, інноваційних підходів у лікуванні ревматоїдного артриту, спондилоартритів, системного червоного вовчака, люпус-нефриту, остеоартриту, остеопорозу та подагри, а також застосування інгібіторів янус-кінази (JAK), аналогів глюкагоноподібного пептиду-1 (GLP-1), цифрових платформ Європейського альянсу ревматологічних асоціацій (European Alliance of Associations for Rheumatology — EULAR) і перспектив CAR-T-клітинної терапії. Матеріали Конгресу підкреслюють роль міжнародної співпраці та освітніх програм у розвитку української ревматології та спрямовані на впровадження передових клінічних практик для підвищення якості медичної допомоги пацієнтам.
12–14 листопада 2025 р. у Києві відбувся ІХ Національний конгрес ревматологів України з міжнародною участю «Нові можливості в ревматології: від теорії до практики», який пройшов у змішаному форматі — очно на базі готелю «Русь» та дистанційно на платформі Rheumahub. Конгрес був організований за участю Всеукраїнської асоціації ревматологів України та провідних наукових установ і став важливою подією для професійної спільноти.
Програма ІХ Національного конгресу ревматологів України включала пленарні засідання, симпозіуми, секційні засідання, круглі столи, клінічні розбори, конкурс молодих учених, стендові доповіді та симуляційні тренінги з інструментальної діагностики. У заході взяли участь провідні українські фахівці та міжнародні експерти з Канади, Франції та Італії, що забезпечило високий рівень міждисциплінарного та міжнародного наукового обміну. Тематика доповідей охоплювала патогенез, діагностику та лікування ревматоїдного артриту, остеоартриту, спондилоартритів, системного червоного вовчака, васкулітів, автозапальних захворювань, подагри, гіперурикемії та коморбідної патології, включно з особливостями ведення пацієнтів дитячого віку. Значну увагу приділено сучасним терапевтичним стратегіям, таргетній та біологічній терапії, персоніфікованому лікуванню, міжнародним рекомендаціям Європейського альянсу ревматологічних асоціацій (European Alliance of Associations for Rheumatology — EULAR) і Американського коледжу ревматології (American College of Rheumatology — ACR), а також новітнім інструментальним і регенеративним технологіям у клінічній практиці. Стаття узагальнює основні наукові напрями Конгресу й відображає сучасний стан та перспективи розвитку ревматології в Україні.
Вступне слово. Пам’яті Володимира Коваленка
Урочисте відкриття ІХ Національного конгресу ревматологів України з міжнародною участю розпочалося вступним словом Володимира Коваленка — академіка НАМН України, доктора медичних наук, професора, директора ДУ «ННЦ «Інститут кардіології, клінічної та регенеративної медицини імені академіка М.Д. Стражеска» Національної академії медичних наук (НАМН) України, президента Всеукраїнської асоціації ревматологів України. Для професійної спільноти цей виступ набув особливого значення, оскільки, на превеликий жаль, Конгрес став останнім заходом під його головуванням.
Постать Володимира Коваленка є знаковою не лише для вітчизняної ревматології, а й для всієї системи клінічної медицини України. Його багаторічна наукова, клінічна та організаційна діяльність суттєво вплинула на формування стратегічних напрямів розвитку ревматології, кардіології та впровадження міждисциплінарного підходу до ведення пацієнтів із хронічними неінфекційними захворюваннями.
Обіймаючи посаду керівника ДУ «ННЦ «Інститут кардіології, клінічної та регенеративної медицини імені академіка М.Д. Стражеска», Володимир Миколайович одночасно очолював Всеукраїнську асоціацію кардіологів і Всеукраїнську асоціацію ревматологів України, був членом Європейського товариства кардіологів, правління EULAR та Координаційної ради Всесвітньої антиревматичної ліги. Така багатовекторна діяльність сприяла інтеграції української ревматології у міжнародний науковий простір та гармонізації національних підходів із глобальними стандартами.
У своєму вступному слові Володимир Коваленко акцентував увагу на ключовій ролі ревматології в сучасній медицині та її тісному взаємозв’язку з кардіологією, дерматологією, нефрологією, ендокринологією та іншими галузями, для яких ревматичні й аутоімунні захворювання становлять значний клінічний виклик. Особливу увагу було приділено необхідності професійного міждисциплінарного комплаєнсу, впровадженню сучасних стандартів і протоколів лікування хронічних захворювань, а також ролі національних клінічних настанов як практичного орієнтиру для лікаря.
Урочисту частину відкриття Конгресу доповнили вітальні слова членів президії — академіка НАМН України, члена-кореспондента Національної академії наук (НАН) України, професора, доктора медичних наук, заслуженого лікаря України, президента НАМН України Василя Лазоришинця та академіка НАН і НАМН України, професора, доктора біологічних наук, директора Інституту біохімії ім. О.В. Палладіна НАН України Сергія Комісаренка, які відзначили визначальний внесок В.М. Коваленка у розвиток української науки, медицини та міждисциплінарних наукових підходів.
Світла пам’ять про Володимира Миколайовича Коваленка назавжди збережеться серед його учнів, колег і всієї медичної спільноти як приклад беззастережного служіння науці, пацієнтам і Україні.
Перша програмна доповідь: еволюція уявлень про аутоімунне запалення
Логічним продовженням урочистого відкриття Конгресу стала програмна проблемна доповідь «Модифікація аутоімунного запального процесу в ревматології упродовж століття», представлена професором, доктором медичних наук, ректором Івано-Франківського національного медичного університету Романом Яцишиним. Саме вона визначила концептуальний і науково-методологічний вектор подальшої роботи Конгресу.
У доповіді було здійснено системний аналіз ключових етапів формування сучасних уявлень про природу аутоімунного запалення — від перших клінічних описів ревматичних захворювань на початку ХХ ст. до сучасного етапу розвитку таргетної, клітинної та персоналізованої терапії. Доповідач наголосив, що еволюція ревматології є невід’ємною складовою прогресу імунології, зокрема відкриття ролі аутоантитіл, цитокінових мереж, клітин вродженого та адаптивного імунітету, а також складних механізмів імунної регуляції [1–3].
Окрему увагу було приділено трансформації терапевтичних парадигм — від емпіричного застосування нестероїдних протизапальних препаратів (НПЗП), солей золота та глюкокортикоїдів до впровадження базисних протиревматичних препаратів, біологічної терапії та малих молекул, зокрема інгібіторів янус-кінази (JAK) [4]. Підкреслено, що кожен етап розвитку лікувальних стратегій базувався на поглибленні розуміння патогенетичних механізмів захворювань і супроводжувався зменшенням інвалідизації та покращенням якості життя пацієнтів [5–9].
Важливим компонентом доповіді став огляд сучасних і перспективних напрямів модифікації аутоімунного запального процесу, зокрема можливостей клітинної терапії, впливу на епігенетичні механізми, ролі мікробіому в ініціації та підтриманні хронічного запалення, а також потенціалу штучного інтелекту в персоніфікації лікування та прогнозуванні перебігу ревматичних захворювань [10, 11]. Наголошено, що подальший розвиток ревматології полягає не лише у створенні нових лікарських засобів, а й у чіткому визначенні терапевтичної мети з урахуванням індивідуальних характеристик пацієнта.
Таким чином, перша програмна доповідь окреслила історичну спадкоємність, сучасний стан і майбутні виклики ревматології, підкресливши необхідність інтеграції фундаментальних наукових знань, клінічного мислення та інноваційних технологій у веденні пацієнтів з аутоімунними ревматичними захворюваннями.
Міжнародні експертні доповіді та глобальні професійні зв’язки: інтеграція української ревматології у світовий простір
Міжнародна сесія науково-практичного конгресу Всеукраїнської асоціації ревматологів України засвідчила якісно новий рівень інтеграції української ревматології у глобальний науковий і професійний світ. Участь провідних експертів — президента EULAR Ксенофона Бараліакоса (Xenofon Baraliacos), Бохум, Німеччина, професорів Марії Луїзи Бранді (Maria Luisa Brandi), Флоренція, Італія, Френсіса Беренбаума (Francis Berenbaum), Париж, Франція, та Володимира Максимовича (Walter P. Maksymowych), Альберта, Канада, — надала сесії не лише високої наукової, а й стратегічної та гуманітарної значущості.
Міжнародний діалог у межах Конгресу вийшов за рамки обміну науковими даними, трансформувавшись у платформу солідарності, спільних цінностей і довгострокового бачення розвитку ревматології в умовах глобальних викликів.
EULAR і Україна: інституційна підтримка та фокус на молодих фахівцях
У програмній доповіді президент EULAR Ксенофон Бараліакос наголосив, що співпраця з українською ревматологічною спільнотою має більш ніж 20-річну історію, однак в умовах повномасштабної війни вона набула особливого змісту. Підтримка України визначена як один із пріоритетів EULAR — як на інституційному, так і на особистісному рівнях.
Окремий акцент було зроблено на розвитку молодої наукової еліти. За словами спікера, саме молоді лікарі й дослідники найближчим часом формуватимуть обличчя української ревматології в європейському контексті. Практичним проявом цієї позиції стала, зокрема, безкоштовна реєстрація українських лікарів і науковців на конгреси EULAR, що дозволяє зберігати безперервність професійного розвитку навіть у надзвичайно складних умовах.
Академік В.М. Коваленко підкреслив, що така підтримка має не лише професійне, а й потужне моральне значення, адже «солідарність проявляється не в деклараціях, а в конкретних рішеннях, які відкривають доступ до знань і міжнародної взаємодії».
Цифрова трансформація EULAR: екосистема MyEULAR
Центральним елементом стратегічного розвитку EULAR стала цифрова екосистема MyEULAR, представлена як універсальна платформа для інтеграції науки, освіти та професійної комунікації. MyEULAR забезпечує єдину точку доступу до наукового контенту, освітніх програм, конгресів і професійних спільнот з можливістю глибокої персоналізації залежно від ролі користувача — клініциста, науковця, фахівця суміжних спеціальностей або представника пацієнтських організацій [12].
Ключовою концепцією залишається тристороння модель EULAR, що ґрунтується на рівноправній взаємодії наукової спільноти, професійних асоціацій і пацієнтських організацій (PARE) [13]. Саме така модель, за словами К. Бараліакоса, створює умови для реального зменшення тягаря ревматичних і м’язово-скелетних захворювань.
EMEUNET: стартовий майданчик для нового покоління ревматологів
Доповідь Богдани Доскалюк, провідної фахівчині з інноваційної діяльності, докторки філософії та асистентки кафедри патофізіології Івано-Франківського національного медичного університету, була присвячена можливостям, які відкриває EMEUNET (Emerging EULAR Network) для молодих ревматологів і науковців. На сьогодні спільнота EMEUNET об’єднує понад 3400 учасників і функціонує як повноцінна екосистема професійного розвитку, що охоплює освітні програми, менторство, участь у науково-дослідних проєктах та формування міжнародних професійних контактів [14].
Членство в EMEUNET значно підвищує доступ до грантів EULAR, програм менторства, освітніх курсів і участі в розробці клінічних рекомендацій. Особливу практичну цінність має залучення молодих фахівців до робочих груп EULAR, що формують стандарти лікування, які згодом імплементуються у клінічну практику в різних країнах.
Також згадали про відеоконкурс EULAR, присвячений актуальним проблемам ревматології. Кожна країна-учасниця відбирає одну відеороботу, після чого їх оцінює міжнародне журі. Фіналісти отримують стипендії для участі в конгресі EULAR, включно з реєстрацією, фінансовою підтримкою та проживанням. Особливо приємно відзначити, що минулого року Україна вперше взяла участь у конкурсі та здобула 3-тє місце [15]. Це підтверджує високий потенціал молодих українських фахівців і актуальність їх активнішої інтеграції в європейські ініціативи.
Еволюція терапії остеопорозу: від антирезорбції до персоналізованих стратегій
У доповіді професорки Марії Луїзи Бранді було представлено цілісну картину розвитку лікування остеопорозу — від перших фармакологічних підходів до сучасних персоналізованих алгоритмів. Доповідачка наголосила, що ефективна терапія повинна впливати не лише на мінеральну щільність, а й на якість кісткової тканини, забезпечуючи оптимальний баланс між резорбцією та кісткоутворенням [16–20].
Особливу увагу приділено концепції послідовної терапії: застосування анаболічних препаратів на початковому етапі з подальшим переходом на антирезорбтивні засоби для закріплення досягнутого ефекту (рис. 1) [21]. Такий підхід, за даними клінічних досліджень, забезпечує максимальне зниження ризику переломів, особливо у пацієнтів із тяжким остеопорозом.
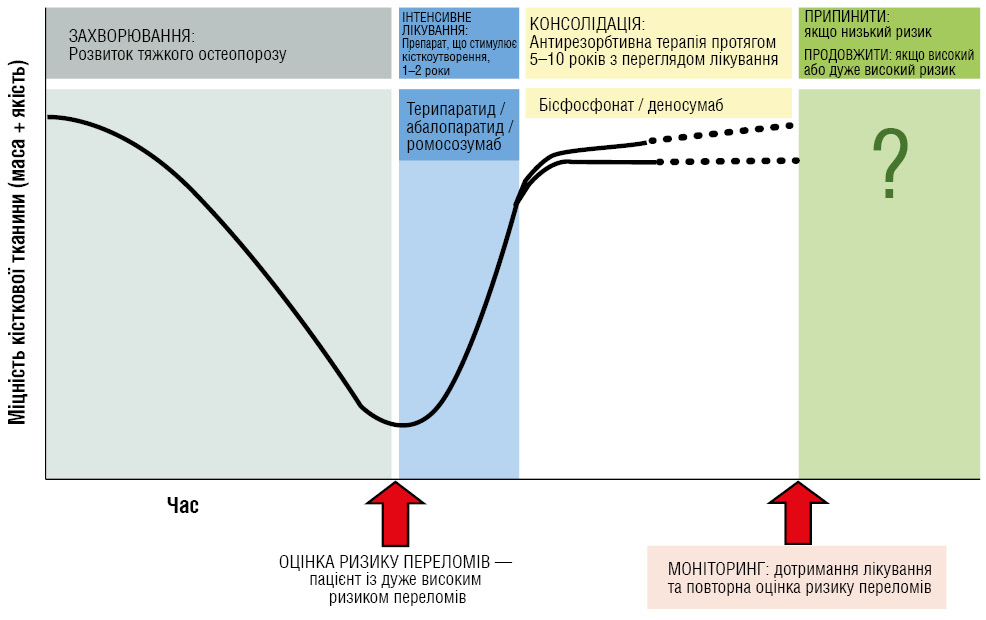
GLP-1 як новий напрям у лікуванні остеоартриту
Інноваційна доповідь професора Френсіса Беренбаума була присвячена перепрофілюванню аналогів глюкагоноподібного пептиду-1 (GLP-1) для лікування остеоартриту. Дані доклінічних та ранніх клінічних досліджень свідчать, що ці препарати можуть виявляти не лише анальгезивний, а й хондропротекторний ефект [22]. Імуногістохімічний аналіз показав експресію GLP-1R у хондроцитах колінного хряща та синовіальній мембрані пацієнтів з остеоартритом, зокрема в інтимі та ендотелії судин (рис. 2). Аналогічні результати отримані у мишачих моделях — у хрящі, меніску, кістковому мозку та синовіальних клітинах. Сукупно ці дані підкреслюють потенційно ключову та плейотропну роль GLP-1R у фізіології та патології колінного суглоба.
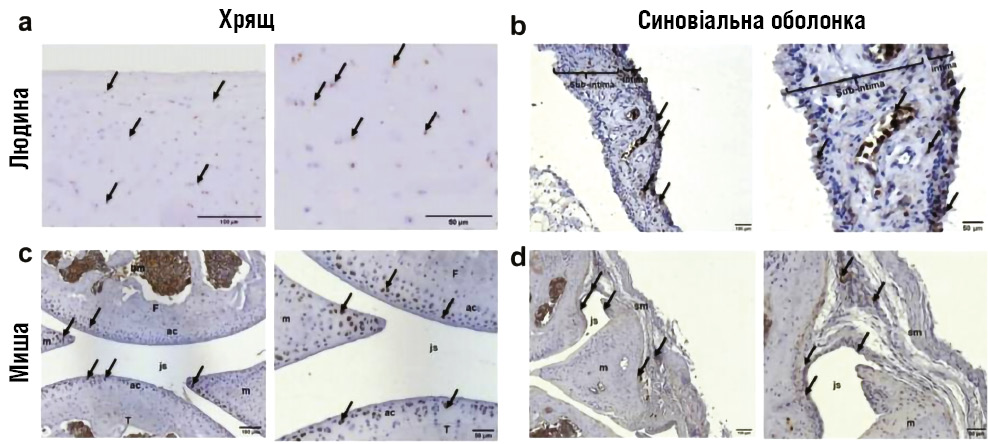
Примітки: ac — суглобовий хрящ, js — суглобова щілина, m — меніск, sm — синовіальна мембрана, F — стегнова кістка, T — великогомілкова кістка, Sub-intima — підінтимальний шар. Стрілки вказують на позитивне імуногістохімічне забарвлення / клітини-мішені. 50 μm, 100 μm — 50 мкм, 100 мкм (масштаб).
Виявлення GLP-1-рецепторів у хондроцитах і синовіальних клітинах, а також позитивні результати доклінічних моделей стали підґрунтям для клінічних досліджень внутрішньосуглобового введення аналогів GLP-1 [23, 24]. Поточні дослідження фази 2 спрямовані на оцінку впливу на біль, функцію та структурні зміни суглоба, що відкриває перспективу появи першої хворобомодифікуючої терапії остеоартриту. Дослідження має багатонаціональний дизайн із залученням клінічних центрів у Канаді (3 центри), Європі (16 центрів в Іспанії, Франції, Польщі та Данії) та США (2 центри, відкриття яких очікувалося до кінця 2025 р.) і спрямоване на оцінку ефективності втручання щодо зменшення вираженості болю та впливу на синовіальне запалення при середньо-тяжкому та тяжкому остеоартриті колінного суглоба. Очікується, що результати будуть отримані у 2026 р. У разі успіху планується розпочати ключове дослідження фази 2b у 2027 р. з перспективою прискореного регуляторного схвалення. «Нашою стратегічною метою є максимально швидке впровадження цього підходу в клінічну практику та надання пацієнтам доступу до нової терапії до 2030 р.», — зауважив спікер.
Сучасне бачення осьового спондилоартриту: роль МРТ і нові критерії
Виступ професора Володимира Максимовича був зосереджений на перегляді підходів до класифікації осьового спондилоартриту (рис. 3). Наголошено, що нові критерії, розроблені міжнародною експертною групою, забезпечують значно вищу специфічність без втрати чутливості, що має принципове значення для клінічної практики [25].

Примітки: * — МРТ-ознаки аксіального спондилоартриту в крижово-клубових суглобах за результатами загальної оцінки всіх МРТ-послідовностей, що відображають активні та структурні ураження; ** — згідно з модифікованими Нью-Йоркськими критеріями; + — визначається за загальною клінічною оцінкою лікаря.
Центральний перегляд зображень магнітно-резонансної томографії (МРТ) став золотим стандартом оцінки. У клінічній практиці застосовуються різні протоколи МРТ крижово-клубового суглоба (ККС), але не всі вони розроблені спеціально для діагностики сакроілеїту. Через це інтерпретація МРТ-зображень у різних центрах може значно відрізнятися, що створює ризик хибнопозитивних або негативних діагнозів. На глобальному рівні не існувало єдиного стандарту отримання і оцінки МРТ ККС, який би забезпечував відтворюваність результатів і точність діагностики. Щоб розв’язати цю проблему, ASAS та SPARTAN ініціювали розробку стандартизованого протоколу отримання та оцінки МРТ-зображень (International Acquisition Protocol — IAP) для діагностики сакроілеїту. Це мало забезпечити уніфіковану методику, яка дозволяє порівнювати дані між центрами та використовувати їх у клінічних дослідженнях і практиці [26]. Нові критерії продемонстрували значно кращу специфічність при збереженні достатньої чутливості. Це особливо важливо для відбору пацієнтів у клінічні дослідження та для уникнення гіпердіагностики у клінічній практиці. «Окремо хочу наголосити на ролі МРТ. Вона має виконуватися за стандартизованим протоколом і оцінюватися експертами, оскільки різні методики можуть призводити до хибної інтерпретації. Важливо враховувати не лише активні запальні зміни, а й структурні ураження», — зазначив спікер. У межах презентації також продемонстровано мобільний застосунок CARE Arthritis, призначений для поширення освітнього контенту з інтерпретації МРТ-зображень у спондилоартриті. Додаток включає тематичні випадки, навчальні матеріали та коментарі експертів, підтримує декілька мов, включно з українською, і розроблений для ревматологів та інших медичних спеціалістів, що займаються пацієнтами із спондилоартритом. CARE Arthritis сприяє підвищенню навичок оцінки МРТ згідно зі стандартизованими протоколами та може бути корисним інструментом у навчанні й клінічній практиці [27].
Доповідач підкреслив, що негативний HLA-B27 не виключає діагнозу аксіального спондилоартриту, а клінічне мислення залишається ключовим елементом діагностики. Наприкінці доповіді прозвучало запитання: «Чи можемо ми сьогодні сказати «прощавай» терміну «анкілозивний спондиліт» і перейти до ширшого поняття «аксіального спондилоартриту»?» На що спікер відповів: «Це складне і частково дискусійне питання. Історично анкілозивний спондиліт базувався на рентгенологічних змінах. Сьогодні ми розуміємо, що аксіальний спондилоартрит охоплює ширший спектр пацієнтів, зокрема на ранніх стадіях. Проте термін «анкілозивний спондиліт» усе ще має клінічне та історичне значення».
Міжнародна сесія Конгресу стала яскравим прикладом того, як наукова співпраця, цифрові інновації та людська солідарність формують нову модель розвитку ревматології.
Українська ревматологічна спільнота вже сьогодні є активною частиною європейського професійного середовища, а участь у програмах EULAR і EMEUNET відкриває реальні можливості для професійного зростання, впровадження інновацій і підвищення якості допомоги пацієнтам.
У складних умовах сьогодення міжнародна підтримка набуває не лише наукового, а й глибокого символічного значення, зміцнюючи впевненість у спільному європейському майбутньому української медицини.
CAR-T-клітинна терапія у ревматології: на шляху від онкології до аутоімунних захворювань
Однією з найбільш інноваційних та концептуально значущих подій Конгресу стала доповідь професора, доктора медичних наук, ректора Івано-Франківського національного медичного університету Романа Яцишина, присвячена можливостям впровадження CAR-T-клітинної терапії (Chimeric Antigen Receptor T-cells) у ревматологічну практику. У доповіді підкреслено, що сучасна ревматологія перебуває на етапі переходу від стратегії тривалої імуносупресії до принципово нової концепції глибокої імунної реконституції.
Доповідач розпочав виступ з історичного огляду розвитку CAR-T-технології, зазначивши, що первинно вона була створена для лікування В-клітинних лімфопроліферативних захворювань. Водночас спільність ключових патогенетичних механізмів — насамперед абератної активності В-лімфоцитів і продукції аутоантитіл — стала науковим підґрунтям для екстраполяції цього підходу на аутоімунні ревматичні захворювання [28].
Професор підкреслив, що традиційні біологічні препарати, зокрема анти-CD20-терапія, забезпечують лише тимчасове виснаження В-клітинної популяції. Натомість CAR-T-клітини здатні елімінувати патологічні В-клітинні клони у тканинах і лімфоїдних органах, що відкриває можливість для досягнення тривалої безмедикаментозної ремісії.
У доповіді детально розглянуто основні етапи створення CAR-T-препарату:
- аферез із забором аутологічних Т-лімфоцитів пацієнта;
- генетична модифікація клітин із використанням вірусних векторів для експресії химерного антигенного рецептора, найчастіше спрямованого проти CD19;
- експансія та повторна інфузія модифікованих клітин.
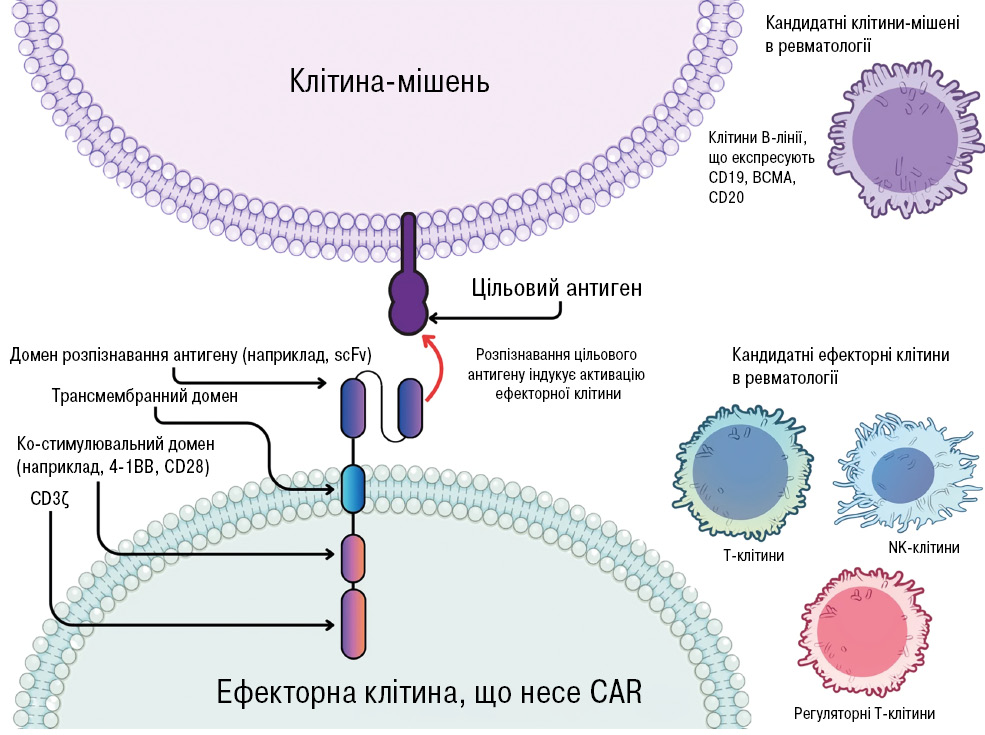
Підкреслено, що CAR-T-клітини розпізнають CD19-позитивні В-лімфоцити незалежно від головного комплексу гістосумісності, що забезпечує високу селективність і потужний цитотоксичний ефект (рис. 4) [29].
При розробці CAR-T-клітин для лікування аутоімунних захворювань критично важливо враховувати низку факторів, що визначають ефективність і безпеку терапії (рис. 5). Зокрема, необхідний ретельний вибір цільового антигену, який був би максимально специфічним для патологічних клітин, щоб уникнути ушкодження здорових тканин, а також забезпечення оптимальної специфічності та афінності CAR для балансу між високою чутливістю та мінімізацією неспецифічної активації. Додатково застосовуються стратегії зниження позацільових ефектів, включаючи точкові модифікації та подвійне розпізнавання, а також інженерні підходи, що підтримують регуляторні Т-клітини і сприяють імунній толерантності. Для підвищення контролю над терапією можуть використовуватися індуковані CAR або «суїцидальні» гени, які дозволяють модулювати активність або елімінацію CAR-T-клітин у разі виникнення побічних реакцій, що суттєво підвищує безпеку лікування. Такий комплексний підхід до дизайну CAR-T-клітин забезпечує одночасно високу ефективність, специфічність та контроль імунної відповіді, що є ключовим для застосування цих видів терапії при аутоімунних станах [30].
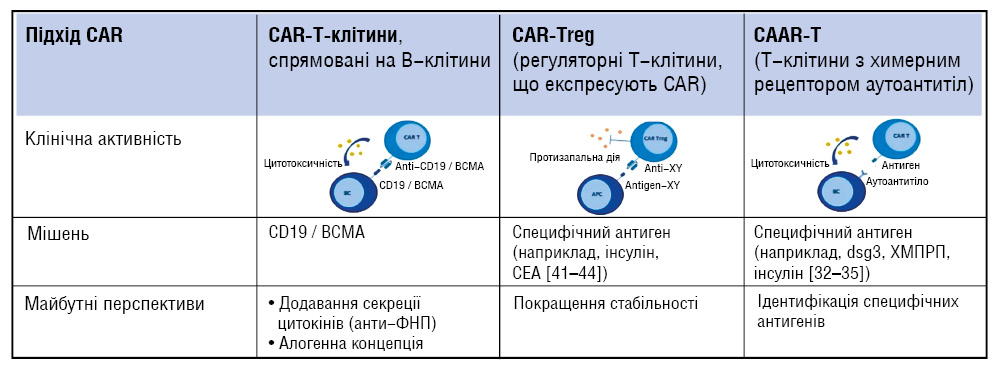
Примітки: CD19 / BCMA — кластер диференціювання 19 / антиген дозрівання B-клітин; CEA — карциноембріональний антиген; Anti-XY — антитіла до Х- та Y-хромосом; dsg3 — десмоглеїн-3; NMDAR — N-метил-D-аспартатний рецептор; CAR — химерний антигенний рецептор.
Особливу увагу було приділено аналізу результатів сучасних клінічних досліджень, зокрема робіт провідних європейських наукових груп. Наведено дані щодо застосування CAR-T-терапії у пацієнтів із тяжкими, рефрактерними формами:
- системного червоного вовчака, включаючи люпус-нефрит;
- системної склеродермії;
- ідіопатичних запальних міопатій.
У цих когортах відзначено досягнення тривалої клінічної та імунологічної ремісії без подальшої потреби в імуносупресивній терапії. Окремо наголошено на феномені «імунологічного перезавантаження», що проявляється формуванням нової популяції наївних В-клітин без ознак аутоагресії.
Разом із тим Р. Яцишин акцентував увагу на необхідності ретельного відбору пацієнтів та мультидисциплінарного супроводу через потенційні ризики, зокрема:
- синдром вивільнення цитокінів;
- нейротоксичні прояви;
- підвищений ризик інфекційних ускладнень унаслідок тривалої В-клітинної аплазії [31].
У підсумку доповідач зазначив, що CAR-T-клітинна терапія на сучасному етапі залишається високовартісною та технологічно складною опцією, яка розглядається для пацієнтів із рефрактерним перебігом захворювання. Водночас цей підхід відкриває реальну перспективу досягнення стану «cure» при окремих аутоімунних ревматичних хворобах. Для України важливим завданням є формування науково-клінічних центрів, здатних забезпечити повний цикл реалізації цієї інноваційної технології.
Сучасні можливості досягнення цілей лікування спондилоартриту
Сучасні підходи до лікування спондилоартритів були представлені в доповіді професора, доктора медичних наук, завідувача кафедри внутрішньої медицини № 3 Національного медичного університету імені О.О. Богомольця Олега Яременка, яка ґрунтувалася на багаторівневому аналізі еволюції терапевтичних стратегій та рекомендацій останнього десятиліття. Спондилоартрити являють собою гетерогенну групу хронічних запальних захворювань, які часто супроводжуються позасуглобовими проявами, зокрема псоріазом, увеїтом або запальними захворюваннями кишечнику. Цей широкий спектр клінічних проявів підкреслює необхідність персоналізованого підходу до ведення пацієнтів. Протягом останніх 10 років були опубліковані ключові міжнародні рекомендації — ACR у 2015 р., різними робочими групами у 2016 р. та 2019 р., і найактуальніші — Міжнародного товариства з оцінки спондилоартритів (Assessment in SpondyloArthritis international Society — ASAS) — EULAR у 2022 р. [32, 33]. Аналіз цих документів показує поступовий перехід від традиційного застосування НПЗП до інтегрованих стратегій, що включають біологічні та таргетні препарати, а також фокус на досягненні клінічної мети лікування.
Початкові рекомендації ACR 2015 р. визначали НПЗП як стартову терапію для більшості пацієнтів і пропонували переходити до інгібіторів фактора некрозу пухлин-α (ФНП-α) у разі відсутності клінічного ефекту протягом 3 міс, з подальшою підтримувальною монотерапією біологічним препаратом при стабільному контролі [32]. Уже у 2016 р. рекомендації чітко підкреслювали роль біологічної терапії як наступного кроку після НПЗП і відзначали розширення доступних класів препаратів, зокрема інгібіторів інтерлейкіну (IL)-17 [34]. Центральною ідеєю всіх сучасних стратегій стало впровадження концепції Treat-to-Target, де метою терапії є досягнення низької активності захворювання або ремісії. У клінічних дослідженнях та практиці найчастіше застосовувалися показники ASDAS <1,3 для ремісії та ASDAS <2,1 для низької активності, а також ASAS40 як валідований інструмент оцінки ефективності [33].
Хоча НПЗП залишаються базисом терапії, лише 60–70% пацієнтів досягають ASAS40, а ремісію відмічають у 10–20% випадків, що зумовлює потребу у нових підходах [35]. Інгібітори JAK, зокрема упадацитиніб, блокують ключові запальні сигнальні шляхи, забезпечують швидкий клінічний ефект і зручний пероральний прийом. Клінічні дослідження показали, що через 14 тиж ASAS40 досягали близько 60% пацієнтів, ремісії — 20%, а через 2 роки 56–62% підтримували низьку активність захворювання, а 26–28% — стан неактивного захворювання, включно з біонаївними та резистентними до біологічної терапії пацієнтами. Порівняльні дослідження III фази засвідчили вищу ефективність упадацитинібу порівняно з інгібіторами ФНП-α та IL-17, з Number Needed to Treat = 4. Сучасні рекомендації ASAS–EULAR 2022 визнають інгібітори ФНП-α, IL-17 і JAK рівнозначними, дозволяючи персоналізований вибір терапії з урахуванням супутніх захворювань, безпеки та попередньої відповіді. Дані безпеки демонструють, що серйозні побічні ефекти упадацитинібу не перевищують ризику при ФНП-α, іноді навіть нижчі. Таким чином, сучасне лікування спондилоартритів базується на концепції Treat-to-Target та персоналізованому підході, що дозволяє стабільно контролювати захворювання навіть у складних клінічних випадках.
Ревматоїдний артрит: декларовані та інноваційні методи лікування
Ведення ревматоїдного артриту (РА) у сучасній доказовій медицині було представлено в доповіді професорки, докторки медичних наук, завідувачки відділення ревматології Клінічної лікарні «Феофанія» Ірини Головач, яка ґрунтувалася на міжнародних рекомендаціях EULAR 2018 р., їх подальших оновленнях (2021–2022) та останніх даних EULAR, представлених на конгресі 2023–2024 рр. Основою сучасного менеджменту РА є ступенева терапія та стратегія Treat-to-Target, орієнтована на досягнення ремісії або низької активності захворювання з раннім початком активної терапії, регулярним моніторингом і корекцією лікування за потреби [36, 37].
Першим етапом залишається застосування метотрексату у поєднанні з короткотривалими глюкокортикоїдами з мінімальними дозами та швидкою відміною. У разі неефективності переходять до біологічних хворобомодифікуючих протиревматичних препаратів (ХМПРП) або інгібіторів JAK, а за відсутності відповіді протягом 6 міс — змінюють терапію на препарат із іншим механізмом дії або підбирають індивідуально ефективну комбінацію. Складність РА визначається гетерогенністю фенотипів, включно з раннім і пізнім дебютом, серопозитивністю та серонегативністю, імунологічними та структурними фенотипами, даними візуалізації та генетичними особливостями.
Особливої уваги заслуговує категорія difficult-to-treat РA, що відмічається у 5–20% пацієнтів і характеризується стійкою високою активністю, неефективністю ≥2 таргетних ХМПРП, неможливістю знизити дозу глюкокортикоїдів, коморбідністю та інвалідизацією [38]. Як зазначено у доповіді: «Мета лікування РА має бути амбітною, але реалістичною, і враховувати непропорційне зростання зусиль, необхідних для її досягнення». Це і є підхід «від розумного до мети», який сьогодні визначає сучасний менеджмент ревматоїдного артриту.
Міждисциплінарний погляд на гіперурикемію та подагру у пацієнтів із серцево-судинними захворюваннями продемонстрував професор, доктор медичних наук, завідувач відділу серцевої недостатності, поєднаної з патологією внутрішніх органів, ДУ «ННЦ «Інститут кардіології, клінічної та регенеративної медицини імені акад. М.Д. Стражеска» НАМН України» Леонід Воронков.
Сечова кислота, кінцевий продукт пуринового метаболізму, утворюється під дією ксантиноксидази, яка перебуває у динамічній рівновазі із ксантиндегідрогеназою. В умовах оксидативного стресу та ішемії переважає ксантиноксидаза, що стимулює утворення активних форм кисню та спричиняє пошкодження клітинних мембран, підтримуючи запалення при серцево-судинних захворюваннях. Підвищений рівень сечової кислоти (>400 мкмоль/л) прямо корелює з ризиком серцево-судинної смерті, особливо при артеріальній гіпертензії, цукровому діабеті 2-го типу та серцевій недостатності [39, 40]. Незважаючи на логічність застосування інгібіторів ксантиноксидази (алопуринолу, оксипуринолу, фебуксостату) для зниження рівня сечової кислоти, клінічні дослідження показали відсутність покращення гемодинаміки та прогнозу, а в окремих випадках — підвищення ризику серцево-судинної та загальної смертності [41].
Механізм пояснюється подвійною роллю ксантиноксидази: крім утворення вільних радикалів та сечової кислоти, вона бере участь у синтезі оксиду азоту незалежно від ендотеліальної NO-синтази, забезпечуючи судинний захист (рис. 6) [42, 43].
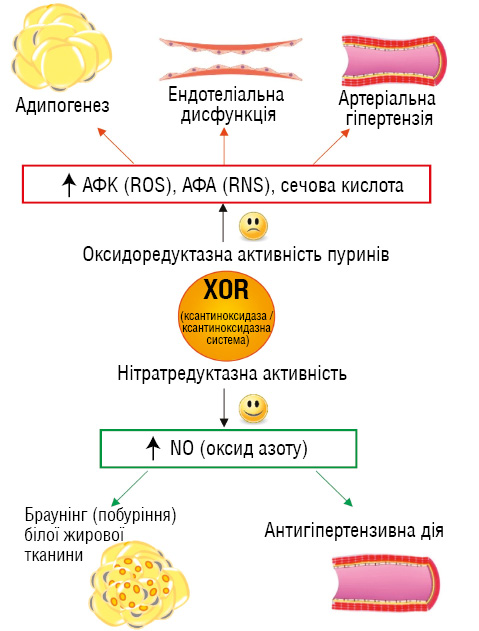
Приміки: АФК — активні (реактивні) форми кисню; АФА — активні (реактивні) форми азоту.
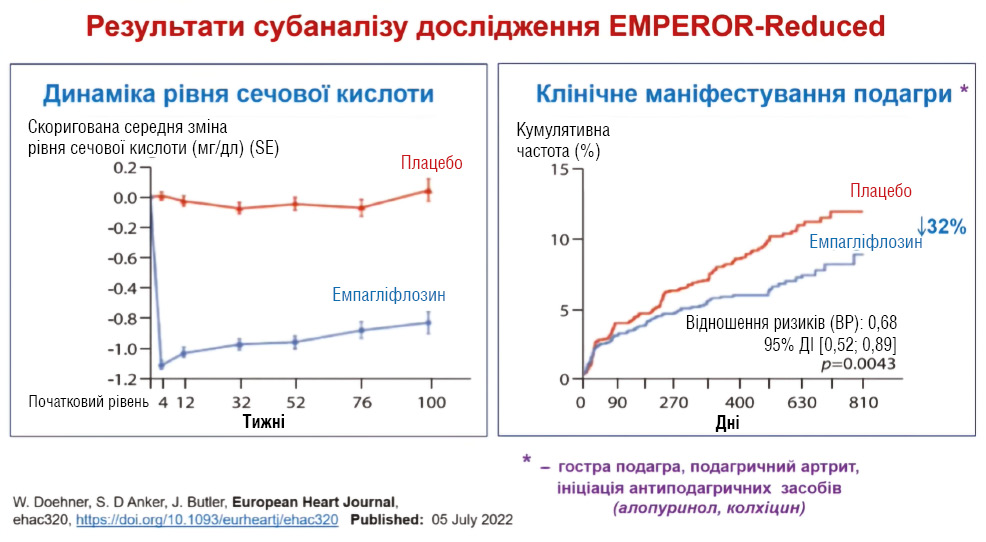
Таким чином, терапія у пацієнтів із подагрою та серцево-судинною патологією потребує обережного та індивідуалізованого підходу. Інгібітори ксантиноксидази не повинні застосовуватися рутинно, НПЗП та глюкокортикостероїди погіршують серцево-судинний прогноз, тоді як колхіцин має доведену користь у пацієнтів з ішемічною хворобою серця. Інгібітори натрійзалежного котранспортера глюкози 2-го типу (SGLT2), зокрема емпагліфлозин та дапагліфлозин, знижують рівень сечової кислоти, ризик подагричних атак та достовірно покращують серцево-судинний прогноз, поєднуючи антиоксидантний та протизапальний ефект (рис. 7) [44, 45].
Зміна парадигми менеджменту системного червоного вовчака та люпус-нефриту
Сучасний менеджмент системного червоного вовчака (СЧВ) та люпус-нефриту представлений у доповіді професора, доктора медичних наук, завідувача кафедри внутрішньої медицини № 1 Вінницького національного медичного університету імені М.І. Пирогова Миколи Станіславчука, яка відображала трансформацію підходів, зумовлену необхідністю покращення прогнозу пацієнтів, зниження токсичності терапії та оптимізації контролю активності захворювання [46–48]. Наприкінці вересня 2025 р. опубліковані оновлені рекомендації щодо лікування ураження нирок при СЧВ, які відзначаються тектонічними змінами парадигми [49]. Традиційна модель, орієнтована на послідовність «індукційна → підтримувальна терапія», мала низку обмежень: високу частоту тяжких ускладнень, незворотні структурні зміни нирок навіть на фоні лікування, значну токсичність глюкокортикоїдів, часті побічні ефекти імуносупресивних препаратів та недостатньо задовільний довгостроковий прогноз. Ці фактори визначили потребу у переосмисленні підходів до терапії та інтеграції нових лікарських засобів і патофізіологічних концепцій.
Для пацієнтів із СЧВ без ураження нирок базові принципи лікування залишаються незмінними: гідроксихлорохін рекомендований усім пацієнтам за відсутності протипоказань, глюкокортикоїди застосовуються у пульс-терапії за необхідності зі швидким зниженням дози до цільових <5 мг/добу. У разі недостатньої відповіді або неможливості знизити дозу глюкокортикоїдів показана біологічна терапія із закріпленими в протоколах опціями: циклофосфамід (включно з низькодозовим європейським режимом Euro-Lupus), ритуксимаб для резистентних випадків та інгібітори кальциневрину, зокрема такролімус, доступні в Україні [48].
Люпус-нефрит потребує чітко визначених цілей лікування: зниження протеїнурії на ≥25% за перші 3 міс, на ≥50% за 6–12 міс та досягнення протеїнурії ≤0,5–0,7 г/добу протягом 12–24 міс, зі стабілізацією або покращенням швидкості клубочкової фільтрації (ШКФ).
Ключова зміна парадигми полягає у відході від класичної схеми індукційної та підтримувальної терапії, з акцентом на ранній початок комбінованої імуносупресії, при цьому термін «індукційна та підтримувальна терапія» зберігається переважно для монотерапії циклофосфамідом [48, 50, 51]. Сучасні підходи до стартової терапії люпус-нефриту включають застосування низькодозового циклофосфаміду Euro-Lupus (500 мг кожні 2 тиж, 6 інфузій), мікофенолату мофетилу як монотерапії або в комбінаціях, а також комбіновану терапію для пацієнтів із несприятливим прогнозом, включно з комбінаціями мікофенолату мофетил + кальциневринові інгібітори (такролімус або воклоспорин), циклофосфамід + белімумаб, мікофенолату мофетил + белімумаб або потрійними комбінаціями [52]. Глюкокортикоїди застосовуються у формі пульс-терапії метилпреднізолоном (500–2500 мг сумарно) та перорально у дозі 0,3–0,7 мг/кг маси тіла із поступовим зниженням до <5 мг/добу протягом 4–6 міс, високі дози застосовують лише при тяжких гістологічних ураженнях, швидкому зниженні ШКФ або відсутності відповіді на попередню терапію [47, 48].
На 76-му тижні фази III RCT REGENCY повна ниркова відповідь була досягнута у 46,4% пацієнтів, які отримували обінутузумаб у комбінації з мікофенолату мофетилом, порівняно з 33,1% у групі плацебо, а частка пацієнтів із дозою преднізолону <7,5 мг/добу становила 42,7 проти 30,9%. Введення обінутузумабу здійснювалося внутрішньовенно по 1000 мг протягом 90 хв із премедикацією глюкокортикоїдами, антигістамінними засобами та парацетамолом, повторно через 6 міс, що супроводжувалося підвищенням рівня комплементу C3 та зниженням титру анти-dsDNA-антитіл. Управління з контролю за харчовими продуктами і лікарськими засобами США (Food and Drug Administration — FDA) 20 жовтня 2025 р. затвердило обінутузумаб у комбінації з мікофенолату мофетилом для лікування люпус-нефриту. Препарат також очікує схвалення на європейському рівні, що підтверджує глобальне визнання цього підходу як нового стандарту терапії.
Перспективним напрямом є також застосування CD19 CAR-T-клітинної терапії для аутоімунних захворювань, включно з СЧВ, що демонструє безпеку і потенційну ефективність у пацієнтів із рефрактерними формами захворювання [53]. Питання відміни імуносупресивної терапії після 3–5 років ремісії залишається дискусійним, оскільки ризик загострення люпус-нефриту зберігається, а рівень доказовості низький [47, 48]. Супутня терапія передбачає обов’язкове призначення інгібіторів ангіотензинперетворювального ферменту (АПФ) або блокаторів рецепторів ангіотензину II, застосування статинів за показаннями, антиостеопоротичну профілактику, антикоагулянтну терапію при антифосфоліпідному синдромі та контроль серцево-судинного ризику [48, 52]. Особлива увага приділяється веденню вагітних: необхідні обережність із імуносупресантами, особливо у І триместр, та мінімізація застосування високих доз глюкокортикоїдів, із суворим індивідуальним підходом [47, 48].
Таким чином, сучасний менеджмент СЧВ та люпус-нефриту характеризується раннім застосуванням комбінованої імуносупресивної терапії, мінімізацією прийому глюкокортикоїдів, інтеграцією біологічних препаратів у ранні етапи лікування та персоналізованим підходом із урахуванням ризику, морфології ураження нирок та коморбідності. Цей підхід дозволяє значно підвищити частоту ниркової відповіді, знизити токсичність терапії та покращити довгостроковий прогноз пацієнтів із СЧВ.
Нові можливості в лікуванні псоріатичного артриту
Псоріатичний артрит (ПсА) розглянуто у доповіді професорки, докторки медичних наук, головної наукової співробітниці відділу некоронарних хвороб серця, ревматології та терапії ДУ «ННЦ «Інститут кардіології, клінічної та регенеративної медицини імені академіка М.Д. Стражеска НАМН України» Галини Проценко. Гетерогенність клінічних фенотипів ПсА визначається складною патогенетичною картиною, в основі якої лежить активація Th17-клітин під впливом прозапальних цитокінів, зокрема IL-23 і ФНП-α. Th17-клітини стимулюють синовіальні фібробласти, остеокласти та кератиноцити, формуючи самопідтримувальну запальну петлю, в якій IL-23 забезпечує виживання та активацію Th17; IL-17 індукує деструкцію хряща та кістки, а IL-22 стимулює патологічний остеогенез. Баланс між IL-17 та IL-22 визначає переважання ерозивних змін або формування нової кістки, що пояснює різноманітність структурних уражень та анкілозів [54]. Ентезит як первинна пускова точка запалення відіграє ключову роль у формуванні клінічних проявів ПсА, зокрема дактилітів та асиметричного ураження суглобів, а також у швидкому розвитку структурних змін. Генетична схильність, а також тригери, як-от інфекції, ожиріння, мікротравми та хронічний стрес, визначають ранній або пізній початок артритичних проявів, які у частини пацієнтів можуть передувати шкірним ознакам на 5–10 років, ускладнюючи ранню діагностику. Клінічні фенотипи ПсА включають периферичний артрит (асиметричний оліго- або поліартрит), аксіальне ураження, ентезитасоційований фенотип та дактиліт як ключову діагностичну ознаку [55]. Діагностика ПсА ґрунтується на лабораторних маркерах запалення (швидкість осідання еритроцитів, С-реактивний білок) та виключенні РА (ревматоїдний фактор і anti-CCP зазвичай негативні). Візуалізаційні методи включають рентгенографію як скринінг, МРТ як золотий стандарт та ультразвукове дослідження з допплером. Обов’язковим є виключення остеопорозу [56].
Сучасні терапевтичні можливості розширюються завдяки застосуванню селективних інгібіторів JAK-1, таких як упадацитиніб, який блокує внутрішньоклітинну передачу сигналів від численних прозапальних цитокінів. Клінічні дослідження програми SELECT-PsA показали високу ефективність препарату у пацієнтів із недостатньою відповіддю на традиційні ХМПРП та біологічну терапію. Уже через 2–4 тиж відмічається швидкий клінічний ефект, а на 12-му тижні досягають показника тяжкості за критеріями ACR на 20% у близько 80% пацієнтів при дозі 15 мг. Результати залишаються стабільними до 52 тиж, з покращенням показників індексу площі та тяжкості псоріатичних уражень (Psoriasis Area and Severity Index 75 — PASI 75). Безпека упадацитинібу порівнянна з біологічними препаратами, при цьому пацієнтам віком ≥60 років рекомендовані нижча доза та ретельний моніторинг інфекцій та лабораторних показників [57].
Таким чином, упадацитиніб є ефективною пероральною альтернативою біологічним препаратам, а вибір терапії має залишатися персоналізованим відповідно до клінічного фенотипу ПсА.
Колхіцин 3 в 1: сучасні можливості в ревматології, кардіології та дерматології
Колхіцин, один із найстаріших протизапальних засобів, був розглянутий у доповіді професорки, докторки медичних наук, керівниці освітнього центру Інституту ревматології Єлизавети Єгудіної, яка демонструвала його універсальність у трьох галузях медицини. Механізм дії пов’язаний із інгібуванням мікротрубочок, блокадою міграції нейтрофілів та зниженням продукції IL-1β. У ревматології колхіцин застосовується для лікування гострого подагричного артриту та профілактики загострень при старті уратзнижувальної терапії, а також при сімейній середземноморській лихоманці [58]. У кардіології препарат ефективний при гострому та рецидивуючому перикардиті та для зниження ризику серцево-судинних подій, у дерматології — як ад’ювантна терапія при нейтрофільних дерматозах і запальних шкірних синдромах [59–63].
Дослідження AGREE підтвердили ефективність низьких доз колхіцину, їх кращу переносимість та безпечний профіль, зумовлюючи його роль як універсального протизапального препарату при правильному режимі дозування [64]. У ретроспективному когортному дослідженні, опублікованому в The Lancet Rheumatology, проаналізовано 99 800 пацієнтів із подагрою, які розпочали уратзнижувальну терапію (74% чоловіків, середній вік — 63 роки), з яких 16% отримували профілактику колхіцином для запобігання загостренням. Протягом 180 днів спостереження частота серцево-судинних подій (ССП) була нижчою в групі колхіцину — 29 на 1000 людино-років порівняно з 35 на 1000 людино-років у пацієнтів без профілактики, що відповідало зниженню ризику на 18% (відносний ризик (ВР) 0,82; 95% довірчий інтервал (ДІ) [0,69–0,94]). Кумулятивна частота ССП також була нижчою у групі колхіцину, що свідчить про те, що профілактичне застосування колхіцину не лише знижує частоту подагричних загострень, але й асоціюється із додатковим короткостроковим кардіопротекторним ефектом у перші 6 міс після початку уратзнижувальної терапії [65].
Остеопороз у молодих: виклики в діагностиці та рішення в лікуванні
Остеопороз у молодих пацієнтів став темою доповіді професорки, докторки медичних наук, керівниці відділу клінічної фізіології та патології опорно-рухового апарату ДУ «Інститут геронтології імені Д.Ф. Чеботарьова НАМН України», президентки Української асоціації остеопорозу, віцепрезидентки Товариства геронтологів та геріатрів України, національної амбасадорки Міжнародної асоціації остеоартриту (OARSI) в Україні Наталії Григор’євої, яка підкреслила особливості клінічної проблеми через обмежену доказову базу, різноманітність етіології та високу варіабельність мінеральної щільності кісткової тканини (МЩКТ). Вторинний остеопороз є провідним механізмом втрати кісткової маси та включає системне запалення, прийом лікарських засобів, синдром мальабсорбції, низьку фізичну активність, затримку статевого дозрівання та ендокринні порушення. Генетичні фактори, зокрема моногенні мутації при недосконалому остеогенезі або полігенні варіанти, а також дефіцит естрогенів у молодих жінок, значно підвищують ризик ранньої втрати кісткової маси. Ятрогенні фактори включають тривале застосування глюкокортикоїдів, деяких протиепілептичних препаратів та інгібіторів протонної помпи [66].
Діагностика остеопорозу у молодих базується на даних двохенергетичної рентгенівської абсорбціометрії (Dual-energy X-ray Absorptiometry — DXA) із застосуванням Z-score, а оцінка ризику переломів має бути індивідуалізованою з урахуванням клінічної картини та вторинних причин [67].
Лікування передбачає контроль основного захворювання, оптимізацію кальцію та вітаміну D, модифікацію способу життя та ризикорієнтовану фармакотерапію. Бісфосфонати, зокрема золедронова та ібандронова кислота, залишаються препаратами 1-ї лінії завдяки високій ефективності та зручності застосування (рис. 8) [68].
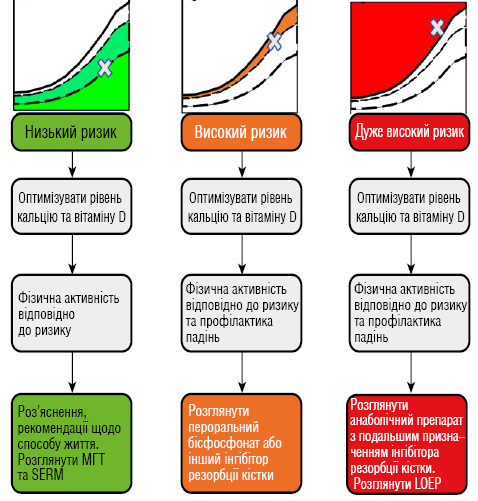
Примітки: MГT — менопаузальна гормональна терапія; SERM — селективний модулятор естрогенових рецепторів; LOEP — локальна процедура посилення кістки.
Закінчила доповідь спікерка словами Антонія Кемпінського: «У медицині головними ліками є сам лікар».
Персоналізація лікування, контроль ризиків і міждисциплінарна співпраця залишаються ключовими принципами для досягнення оптимальних клінічних результатів.
Артралгічний синдром: важче, ніж здається?
Артралгічний синдром розглянуто у доповіді професора, доктора медичних наук, провідного наукового співробітника ДУ «ННЦ «Інститут кардіології імені академіка М.Д. Стражеска» НАМН України» Дмитра Рекалова, який описав його як гетерогенний клінічний прояв, що супроводжує широкий спектр захворювань — від остеоартриту (ОА) та РА до ПсА та різноманітних коморбідних станів. Сучасне уявлення про ОА зміщується від концепції «дегенерації хряща» до розуміння його як запального захворювання із активною участю синовії та субхондральної кістки.У більшості пацієнтів біль поєднується з мультиморбідністю, включно з кардіоваскулярними, гастроінтестинальними, метаболічними та психоемоційними розладами. Перехрест ОА та запального артриту ускладнює верифікацію діагнозу, а тип болю та його механізм можуть змінюватися у одного пацієнта протягом часу [69].
Сучасна ревматологія виділяє різні ендотипи ОА, що визначають клінічну картину та швидкість прогресування [70].
Синовітасоційований ендотип
Характеризується вираженим запаленням синовіальної оболонки. На клітинному рівні виявляють «перехресний зв’язок» між синовіоцитами, хондроцитами та остеобластами. Ключовими ознаками є підвищена активація остеокластів та прогресуюче ураження хряща під впливом медіаторів запалення.
Кістковоасоційований ендотип
Фокусується на змінах у субхондральній кістці. Гістологічні дослідження (на прикладі проксимальної фаланги) демонструють:
- ремоделювання та резорбтивну остеокластичну активність;
- формацію великих дегенеративних псевдокіст;
- локальну кісткову проліферацію.
Візуалізаційні методи, такі як МРТ та ультразвукове дослідження синовії з допплером, дозволяють оцінити активність запалення та ураження кісткової тканини, що має критичне значення для клінічної тактики.
Сучасна стратегія лікування ОА (колінного, кульшового суглобів та суглобів кисті) спирається на консолідовані дані провідних світових організацій:
- Міжнародне товариство дослідження остеоартриту (OARSI) (2019): настанова щодо нехірургічного менеджменту [71];
- EULAR (2018/2019): оновлені рекомендації з лікування ОА кисті [72];
- Європейського товариства з клінічних та економічних аспектів остеопорозу (The European Society for Clinical and Economic Aspects of Osteoporosis, Osteoarthritis and Musculoskeletal Diseases — ESCEO) (2019): алгоритм ведення пацієнтів з ОА колінного суглоба [73];
- ACR / Артритична спільнота (Arthritis Foundation) (2020): комплексні настанови для різних локалізацій [74];
- національні клінічні настанови України (2020): адаптовані протоколи (Коваленко В.М. та співавт., 2020) [75].
Також враховуються регіональні стандарти: Королівський австралійський коледж лікарів загальної практики (Royal Australian College of General Practitioners — RACGP, Австралія), Французьке товариство ревматології (Société Française de Rhumatologie — SFR, Франція) та настанови китайських фахівців, що підкреслює глобальний консенсус у методах діагностики та контролю болю [76–78].
Сучасне лікування болю базується на балансі ефективності та безпеки. НПЗП залишаються основою симптоматичної терапії, проте їх вибір має бути індивідуалізованим з урахуванням тривалості застосування та профілю гастроінтестинальних і кардіоваскулярних ризиків. Декскетопрофен як S(+)-ізомер ібупрофену демонструє швидкий анальгезивний ефект та покращений профіль безпеки при коротко- і середньостроковому застосуванні, що робить його доцільним у пацієнтів з коморбідністю [70, 79].
На завершення конференції була представлена збірка рекомендацій «Ревматичні хвороби. Класифікація, стандарти діагностики та лікування», затверджена академіком В.М. Коваленком та Всеукраїнською асоціацією ревматологів України, що є фундаментальною базою для клінічної практики (рис. 9).

Частина положень має класичний характер і залишається актуальною протягом десятиліть, забезпечуючи основу для лікування більшості ревматичних захворювань.
Разом із тим сучасна медицина динамічно розвивається: з’являються нові препарати, технології та терапевтичні підходи, що потребують постійного оновлення рекомендацій. Документ має офіційний статус та рекомендований для широкого кола фахівців, включно з ревматологами, ортопедами, травматологами, дерматологами та іншими спеціалістами у суміжних галузях.
Класичні паперові рекомендації мають обмежену актуальність, часто втрачаючи її вже через 1–2 роки. Тому стратегічним напрямом є електронний формат документів із можливістю оперативного оновлення та створення цифрових додатків, що дозволить лікарям завжди залишатися в курсі найактуальніших змін. Робота над рекомендаціями — це складний командний проєкт, особливо в умовах воєнного стану, який потребує значних фінансових ресурсів, залучення експертів та підтримки партнерів. У підсумку рекомендації не є статичним документом, а живим інструментом, який поєднує перевірену наукову базу та сучасні можливості медицини для покращення діагностики та лікування ревматичних хвороб.
Висновки
ІХ Національний конгрес ревматологів України підкреслив важливість міждисциплінарного підходу в сучасній медицині, відзначивши тісний зв’язок ревматології з кардіологією, нефрологією, ендокринологією, дерматологією та імунологією, а сучасні уявлення про патогенез ревматичних захворювань зумовлюють перехід від емпіричної протизапальної терапії до таргетних, патогенетично обґрунтованих та персоналізованих стратегій лікування. Концепція Treat-to-Target залишається основою ведення пацієнтів із запальними артритами, забезпечуючи контроль активності захворювання, зниження інвалідизації та покращення якості життя, а сучасні інгібітори JAK, біологічні препарати, нові підходи до лікування остеопорозу та перспективи перепрофілювання лікарських засобів, зокрема аналогів GLP-1, суттєво розширюють терапевтичні можливості. Впровадження CAR-T-клітинної терапії відкриває принципово нові перспективи для лікування тяжких рефрактерних аутоімунних хвороб і потенційно може змінити парадигму ведення окремих ревматичних станів, а міжнародна співпраця з EULAR, цифрові платформи та підтримка молодих фахівців сприяють інтеграції української ревматології у світовий науковий простір і гармонізації клінічної практики з міжнародними стандартами, демонструючи динамічний розвиток галузі в Україні та формуючи науково-практичне підґрунтя для впровадження інноваційних підходів у щоденну клінічну роботу.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
- 1. Bloch H. (1979) Guillaume de Baillou, M.D. (1538–1616): portrait of a sixteenth-century Renaissance pathfinder. N. Y. State J. Med., Mar; 79(3): 406–407.
- 2. Garrod A.B. (1848) Observations on certain pathological conditions of the blood and urine, in gout, rheumatism, and Bright’s disease. Med. Chir. Trans., 31: 83–97. doi:10.1177/095952874803100109.
- 3. Smith C.D., Cyr M. (1988) The history of lupus erythematosus: from Hippocrates to Osler. Rheum. Dis. Clin. North Am., Apr; 14(1): 1–14.
- 4. Hench P.S., Kendall E.C., Slocumb C.H. et al. (1949) The effect of a hormone of the adrenal cortex in arthritis. Ann. Rheum. Dis., Jun; 8(2): 97–104. doi:10.1136/ard.8.2.97.
- 5. Smolen J.S., Aletaha D., Bijlsma J.W. et al. (2010) Treating rheumatoid arthritis to target: recommendations of an international task force. Ann. Rheum. Dis., Apr; 69(4): 631–637. doi:10.1136/ard.2009.123919.
- 6. Smolen J.S., Breedveld F.C., Burmester G.R. et al. (2016) Treating rheumatoid arthritis to target: 2014 update. Ann. Rheum. Dis., Jan; 75(1): 3–15. doi:10.1136/annrheumdis-2015-207524.
- 7. Smolen J.S., Landewé R., Bijlsma J. et al. (2017) EULAR recommendations for the management of rheumatoid arthritis: 2016 update. Ann. Rheum. Dis., Jun; 76(6): 960–977. doi:10.1136/annrheumdis-2016-210715.
- 8. Singh J.A., Saag K.G., Bridges S.L.Jr. et al. (2016) 2015 American College of Rheumatology guideline for the treatment of rheumatoid arthritis. Arthritis Care Res., Jan; 68(1): 1–25. doi:10.1002/acr.22783.
- 9. Upchurch K.S., Kay J. (2012) Evolution of treatment for rheumatoid arthritis. Rheumatology, Dec; 51(Suppl. 6): vi28–vi36. doi:10.1093/rheumatology/kes278.
- 10. Labinsky H., Ukalovic D., Hartmann F. et al. (2023) An AI-powered clinical decision support system to predict flares in rheumatoid arthritis. Diagnostics, Jan; 13(1): 148. doi:10.3390/diagnostics13010148.
- 11. Barturen G., Beretta L., Cervera R. et al. (2018) Moving towards a molecular taxonomy of autoimmune rheumatic diseases. Nat. Rev. Rheumatol., Feb; 14(2): 75–93. doi:10.1038/nrrheum.2017.220.
- 12. European Alliance of Associations for Rheumatology (2026) myEULAR digital platform.
- 13. European Alliance of Associations for Rheumatology (n.d.) EULAR PARE Community.
- 14. European Alliance of Associations for Rheumatology (n.d.) EMEUNET — The Emerging EULAR Network.
- 15. Emeunews (2025) RheumaVision 2 is here: your chance to shine in London at EULAR 2026.
- 16. Miller P.D., Hattersley G., Riis B.J. et al. (2016) Effect of abaloparatide vs placebo on new vertebral fractures. JAMA, Aug; 316(7): 722–733. doi:10.1001/jama.2016.11136.
- 17. McClung M.R., Brown J.P., Diez-Perez A. et al. (2018) Romosozumab followed by denosumab or placebo. J. Bone Miner. Res., Aug; 33(8): 1397–1406. doi:10.1002/jbmr.3452.
- 18. Miller P.D., Lewiecki E.M., Krohn K., Schwartz E. (2021) Teriparatide: label changes and long-term use. Cleve Clin. J. Med., Sep; 88(9): 489–493. doi:10.3949/ccjm.88a.21011.
- 19. Kendler D.L., Bone H.G., Massari F. et al. (2019) Bone mineral density gains with second romosozumab course. Osteoporos Int., Dec; 30(12): 2437–2448. doi:10.1007/s00198-019-05146-9.
- 20. Cosman F., Nieves J.W., Zion M. et al. (2009) Retreatment with teriparatide. J. Bone Miner. Res., Jun; 24(6): 1110–1115. doi:10.1359/jbmr.081250.
- 21. Curtis E.M., Reginster J.Y., Al-Daghri N. et al. (2022) Sequential treatments in very high fracture risk. Aging Clin. Exp. Res., Apr; 34(4): 695–714. doi:10.1007/s40520-022-02100-4.
- 22. Meurot C., Martin C., Sudre L. et al. (2022) Liraglutide in osteoarthritis. Sci. Rep., Jan; 12(1): 1567. doi:10.1038/s41598-022-05323-7.
- 23. Cheng J., Solomon T., Estee M. et al. (2025) GLP-1 receptor agonists in osteoarthritis. Osteoarthr Cartil. Open., Jan; 7(1): 100567. doi:10.1016/j.ocarto.2025.100567.
- 24. 4Moving Biotech (2025) Phase 2a trial of 4P004 in knee osteoarthritis.
- 25. Maksymowych W.P., van der Heijde D., Caplan L. et al. (2025) ASAS/SPARTAN revised classification criteria for axial spondyloarthritis. ACR Convergence Abstracts.
- 26. Lambert R.G.W., Baraliakos X., Bernard S.A. et al. (2024) MRI protocol for sacroiliac joints. Ann Rheum Dis., Dec;83(12):1628–1635. doi:10.1136/ard-2024-225882.
- 27. Care Arthritis Ltd. (2024) CARE Arthritis mobile app.
- 28. Mitra A., Barua A., Huang L. et al. (2023) CAR T cell therapy: history and progress. Front Immunol., May; 14: 1188049. doi:10.3389/fimmu.2023.1188049.
- 29. Niño-Torres D. Quintana-López G. Salguero G. et al. (2025) CAR applications in rheumatology. Clin. Exp. Med., Jun; 25(1): 189. doi:10.1007/s10238-025-01717-9.
- 30. Pecher A.C., Hensen L., Lengerke C., Henes J. (2024) CAR T therapeutics in autoimmune disorders. Mol. Diagn. Ther., Sep; 28(5): 593–600. doi:10.1007/s40291-024-00730-0.
- 31. Hagen M., Müller F., Wirsching A. et al. (2025) Immune effector cell toxicity in autoimmune disease. Lancet Rheumatol., Jun; 7(6): e424–e433. doi:10.1016/S2665-9913(25)00091-8.
- 32. Ward M.M., Deodhar A., Akl E.A. et al. (2016) ACR recommendations for axial spondyloarthritis. Arthritis Care Res., Feb;68(2):151–166. doi:10.1002/acr.22708.
- 33. Ramiro S., Nikiphorou E., Sepriano A. et al. (2023) ASAS-EULAR axial spondyloarthritis recommendations. Ann. Rheum. Dis., Jan; 82(1): 19–34. doi:10.1136/ard-2022-223296.
- 34. van der Heijde D., Ramiro S., Landewé R. et al. (2017) ASAS-EULAR management update. Ann. Rheum. Dis., Jun; 76(6): 978–991. doi:10.1136/annrheumdis-2016-210770.
- 35. Ali A.H.G., Elganady A., Hindawi M.D. et al. (2025) Upadacitinib for axial spondyloarthritis. Curr. Rheumatol. Rev., 21(4): 455–467. doi:10.2174/0115733971296457240805064237.
- 36. Smolen J.S., Landewé R.B.M., Bergstra S.A. et al. (2023) EULAR rheumatoid arthritis recommendations: 2022 update. Ann. Rheum. Dis., Jan; 82(1): 3–18. doi:10.1136/ard-2022-223356.
- 37. Nagy G. Roodenrijs N.M.T. Welsing P.M. et al. (2021) Difficult-to-treat rheumatoid arthritis. Ann. Rheum. Dis., Jan; 80(1): 31–35. doi:10.1136/annrheumdis-2020-217344.
- 38. Zonne L., Hofman N.M.T.R., Nikiphorou E. et al. (2025) Difficult-to-treat rheumatoid arthritis. Rheumatology, Jan; 64(1): 65–73. doi:10.1093/rheumatology/keae544.
- 39. Kim J.Y., Seo C., Pak H. et al. (2023) Uric acid and cardiovascular risk. J. Korean Med. Sci., Sep; 38(38): e302. doi:10.3346/jkms.2023.38.e302.
- 40. Du L., Zong Y., Li H. et al. (2024) Hyperuricemia and related diseases. Signal Transduct Target Ther., 9: 212. doi:10.1038/s41392-024-01916-y.
- 41. White W.B., Saag K.G., Becker M.A. et al. (2018) Cardiovascular safety of febuxostat vs allopurinol. N. Engl. J. Med., Mar; 378(13): 1200–1210. doi:10.1056/NEJMoa1710895.
- 42. Polito L., Bortolotti M., Battelli M.G. et al. (2021) Xanthine oxidoreductase in cardiovascular disease. Redox. Biol., Dec; 48: 102195. doi:10.1016/j.redox.2021.102195.
- 43. Battelli M.G., Bortolotti M., Polito L. et al. (2018) Xanthine oxidoreductase in metabolic syndrome. Biochim. Biophys. Acta Mol. Basis Dis., Aug; 1864(8): 2557–2565. doi:10.1016/j.bbadis.2018.05.003.
- 44. Doehner W., Anker S.D., Butler J. et al. (2022) Uric acid and empagliflozin in heart failure. Eur. Heart J., Sep; 43(36): 3435–3446. doi:10.1093/eurheartj/ehac320.
- 45. Jhund P.S., Claggett B.L., Talebi A. et al. (2023) Dapagliflozin in HFpEF. JAMA Cardiol., Jun; 8(6): 554–563. doi:10.1001/jamacardio.2023.0711.
- 46. KDIGO Lupus Nephritis Work Group (2024) KDIGO guideline for lupus nephritis. Kidney Int., Jan; 105(1S): S1–S69. doi:10.1016/j.kint.2023.09.002.
- 47. Sammaritano L.R., Askanase A., Bermas B.L. et al. (2025) ACR guideline for lupus nephritis. Arthritis Care Res., Sep; 77(9): 1045–1065. doi:10.1002/acr.25528.
- 48. Fanouriakis A., Kostopoulou M., Andersen J. et al. (2024) EULAR systemic lupus erythematosus recommendations. Ann. Rheum. Dis., Jan; 83(1): 15–29. doi:10.1136/ard-2023-224762.
- 49. Fanouriakis A., Kostopoulou M., Anders H.J. et al. (2026) EULAR lupus nephritis recommendations. Ann. Rheum. Dis., Jan; 85(1): 75–90. doi:10.1016/j.ard.2025.09.007.
- 50. Vajgel G. Miranda Filho C. Oliveira C. et al. (2024) Dapagliflozin in inactive lupus nephritis. Nephrol Dial Transplant., Suppl;39:gfae069.
- 51. Yaman R. et al. (2025) Lupus nephritis: current advances. Med. Res. Arch., Jan; 13(1). doi:10.18103/mra.v13i1.6217.
- 52. Rossi G.M., Vaglio A. (2025) New treatment regimens for lupus nephritis. J. Clin. Med., 14(2): 584. doi:10.3390/jcm14020584.
- 53. Müller F., Taubmann J., Bucci L. et al. (2024) CD19 CAR T cell therapy in autoimmune disease. N. Engl. J. Med., Feb; 390(8): 687–700. doi:10.1056/NEJMoa2308917.
- 54. Coates L.C., Soriano E.R., Corp N. et al. (2022) GRAPPA treatment recommendations for psoriatic arthritis. Nat. Rev. Rheumatol., 18: 465–479. doi:10.1038/s41584-022-00798-0.
- 55. Scher J.U., Ogdie A., Merola J.F., Ritchlin C. (2021) Combination therapies in psoriatic arthritis. Arthritis Rheumatol., Sep; 73(9): 1574–1578. doi:10.1002/art.41765.
- 56. Anandarajah A.P., Ritchlin C.T. (2009) Early psoriatic arthritis. Nat. Rev. Rheumatol., Nov; 5(11): 634–641. doi:10.1038/nrrheum.2009.210.
- 57. Akpabio A., Adebajo A. (2022) Upadacitinib in psoriatic arthritis. Expert Opin. Pharmacother., Feb; 23(2): 169–173. doi:10.1080/14656566.2021.2006183.
- 58. D’Amario D., Cappetta D., Cappannoli L. et al. (2021) Colchicine in ischemic heart disease. Clin. Res. Cardiol., Oct; 110(10): 1531–1542. doi:10.1007/s00392-021-01828-9.
- 59. Adler Y., Charron P., Imazio M. et al. (2021) ESC pericardial disease guidelines update. Eur. Heart J., 42(47): 459–468. doi:10.1093/eurheartj/ehab371.
- 60. Imazio M., Andreis A., De Ferrari G.M., Adler Y. (2023) Colchicine for pericarditis. J. Am. Coll. Cardiol., Aug; 82(9): 907–919. doi:10.1016/j.jacc.2023.06.017.
- 61. Robinson K.P., Chan J.J. (2018) Colchicine in dermatology. Australas J. Dermatol., Nov; 59(4): 278–285. doi:10.1111/ajd.12795.
- 62. Sardana K., Sinha S., Sachdeva S. (2020) Colchicine in dermatology. Indian Dermatol. Online J., Sep; 11(5): 693–700. doi:10.4103/idoj.IDOJ_475_20.
- 63. Otón T., Sağ E., Carmona L., Ozen S. (2025) Colchicine safety in pregnancy and lactation. Ann. Rheum. Dis., Jun; 84(6): 1045–1051. doi:10.1016/j.ard.2025.02.005.
- 64. Terkeltaub R.A., Furst D.E., Bennett K. et al. (2010) High vs low dose colchicine in acute gout. Arthritis Rheum., Apr; 62(4): 1060–1068. doi:10.1002/art.27327.
- 65. Cipolletta E., Nakafero G., McCormick N. et al. (2025) Colchicine and cardiovascular events in gout. Lancet Rheumatol., Mar; 7(3): e197–e207. doi:10.1016/S2665-9913(24)00248-0.
- 66. Ganesan K., Jandu J.S., Anastasopoulou C. et al. (2023) Secondary osteoporosis. StatPearls.
- 67. Shepherd J.A. (2023) ISCD positions and etiology. J. Clin. Densitom., Jul–Sep; 26(3): 101369. doi:10.1016/j.jocd.2023.101369.
- 68. Kanis J.A., Harvey N.C., McCloskey E. et al. (2020) Algorithm for osteoporotic fracture risk. Osteoporos Int., Jan; 31(1): 1–12. doi:10.1007/s00198-019-05176-3.
- 69. Swain S., Sarmanova A., Coupland C. et al. (2020) Comorbidities in osteoarthritis. Arthritis Care Res., Jul; 72(7): 991–1000. doi:10.1002/acr.24008.
- 70. Schäfer N., Grässel S. (2022) Targeted therapy for osteoarthritis. Nat. Med., Dec; 28(12): 2473–2475. doi:10.1038/s41591-022-02057-x.
- 71. Bannuru R.R., Osani M.C., Vaysbrot E.E. et al. (2019) OARSI osteoarthritis guidelines. Osteoarthritis Cartilage. doi:10.1016/j.joca.2019.05.013.
- 72. Kloppenburg M. et al. (2019) EULAR hand osteoarthritis recommendations. Ann. Rheum. Dis., 78: 16–24. doi:10.1136/annrheumdis-2018-213826.
- 73. Bruyere O., Honvo G., Veronese N. et al. (2019) ESCEO knee osteoarthritis algorithm. Semin. Arthritis Rheum., 49(3): 337–350. doi:10.1016/j.semarthrit.2019.03.008.
- 74. Kolasinski S.L., Neogi T., Hochberg M.C. et al. (2020) ACR/AF osteoarthritis guideline. Arthritis Rheumatol., Feb; 72(2): 220–233. doi:10.1002/art.41142.
- 75. Kovalenko V.M., Bortkevych O.P., Holovach I.Yu. et al. (2020) National clinical guidelines: osteoarthritis.
- 76. Royal Australian College of General Practitioners (2018) Guideline for knee and hip osteoarthritis.
- 77. Sellam J., Courties A., Eymard F. et al. (2020) French recommendations for knee osteoarthritis. Joint Bone Spine, Dec; 87(6): 548–555. doi:10.1016/j.jbspin.2020.09.004.
- 78. Zhang Z., Huang C., Jiang Q. et al. (2020) Osteoarthritis guidelines in China. Ann. Transl. Med., Oct; 8(19): 1213. doi:10.21037/atm-20-4665.
- 79. Kuczyńska J., Pawlak A., Nieradko-Iwanicka B. (2022) Dexketoprofen compared with other analgesics. Biomed. Pharmacother., 149: 112819. doi:10.1016/j.biopha.2022.112819.

Leave a comment