Еволюція глюкокортикоїдної терапії: від історичних спостережень до персоналізованої ревматології
Редакція «Українського ревматологічного журналу»
Резюме. Глюкокортикоїди (ГК) вже понад 7 десятиліть залишаються одним із найважливіших класів лікарських засобів у клінічній медицині. Останніми десятиріччями їх застосування не лише не скоротилось, а й продовжує зростати, незважаючи на активне використання біологічної та таргетної терапії [1]. Згідно із сучасними епідеміологічними даними, у різні періоди життя системні ГК отримує 1–3% населення [2]. Такий масштаб застосування зумовлений унікальними фармакологічними властивостями ГК: поєднанням потужної імуносупресивної та протизапальної дії, що дозволяє застосовувати їх у різноманітних клінічних ситуаціях. Завдяки цим ефектам ГК незамінні у лікуванні численних неендокринних захворювань, зокрема ревматологічних, аутоімунних, алергічних, дерматологічних, гастроентерологічних, пульмонологічних та кардіологічних патологій, а також деяких ендокринопатій (недостатність надниркових залоз, вроджена гіперплазія надниркових залоз) [2]. Попри широту сучасного застосування ГК, шлях до їх впровадження у клінічну практику був досить непростим.
DOI: 10.32471/rheumatology.2707-6970.20290
Початок ери ГК: відкриття, експерименти, революція
Історія становлення цього класу препаратів є однією з найбільш вражаючих у медицині. Вона почалась у далекому 1948 р., коли Philip S. Hench та його команда у Mayo Clinic (США) опублікували перше повідомлення про приголомшливе покращення стану молодої жінки із ревматоїдним артритом (РА) після застосування кортизону (рис. 1). Для ревматології це був момент тріумфу та справжнього прориву: невиліковне прогресуюче захворювання перетворилося на легко кероване.
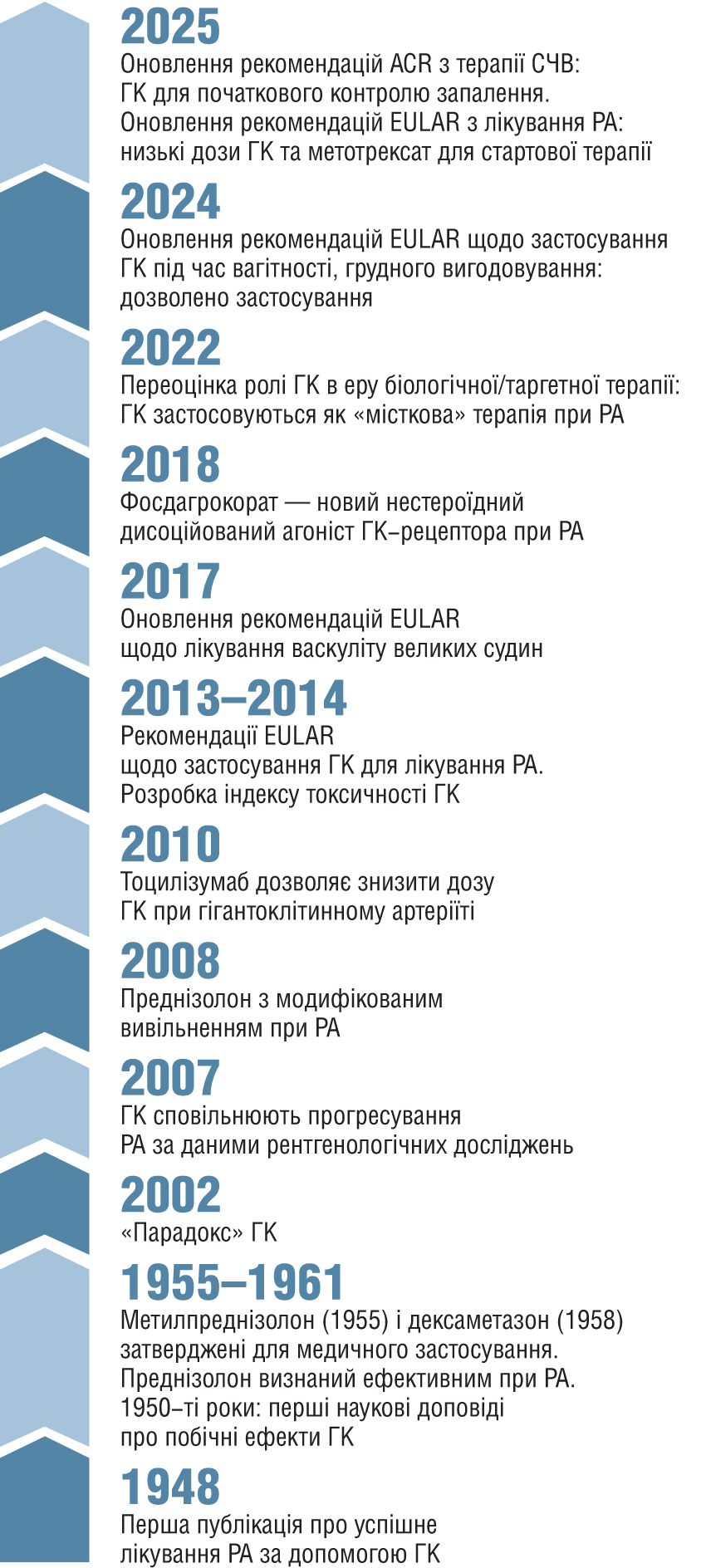
Примітки. EULAR — Європейський альянс ревматологічних асоціацій (European Alliance of Associations for Rheumatology); ACR — Американський коледж ревматологів (American College of Rheumatology); СЧВ — системний червоний вовчак; РА — ревматоїдний артрит; ГК — глюкокортикоїди.
Незабаром цей прорив отримав визнання світової спільноти: лише через 2 роки від цього моменту три провідних спеціалісти отримали Нобелівську премію: хімік Edward C. Kendall та його швейцарський колега Tadeus Reichstein — за ізоляцію й структурну характеристику гормонів кори надниркових залоз, а ревматолог Philip S. Hench — за блискуче доведення клінічної ефективності глюкокортикоїдів (ГК), завдяки якому суто «лабораторна» знахідка стала діючим способом лікування багатьох хворих.
Перші десятиліття застосування ГК стали часом справжньої ейфорії. Раніше не існувало жодного іншого засобу, який міг би так швидко приборкувати запалення, повертати рухливість, допомагаючи пацієнтам «оживати» буквально за лічені дні. Здавалося, нарешті знайдено універсальний ключ до лікування усіх ревматичних захворювань [3]. Та невдовзі ейфорія змінилася тривогою. Уже в 1950-х роках з’явилися перші описи серйозних побічних ефектів, що супроводжували терапію ГК. Лікарі неочікувано стикнулися з двоїстою природою ГК. Страх перед їх застосуванням був настільки сильним, що інколи затьмарював усі сприятливі ефекти та змушував відмовлятися від призначення. Згодом саме цей період F. Buttgereit назве початком «ери розчарування» — часу, коли постала гостра потреба переосмислити дози, тривалість та раціональність застосування ГК [3].
Проте одночасно розгорталася інша революція — молекулярна. Наступні десятиліття досліджень відкрили особливості механізму дії ГК та докорінно змінили уявлення про їх вплив. Численні роботи довели, що ГК не просто «пригнічують запалення», а діють через складну систему геномних ефектів: зв’язуються зі спеціальним глюкокортикоїдним рецептором, змінюють його конформацію, модулюють транскрипцію тисяч генів, впливають на NF-κB, білковий транскрипційний фактор AP-1, інтерлейкіни та хемокіни [4, 5]. Ці відкриття стали черговим вибухом в історії ГК, черговою поворотною точкою, коли стало ясно: «Ми маємо справу з набагато сильнішим та точнішим інструментом, ніж уявляли раніше» [3].
Паралельно з молекулярною наукою розвивалися й технології. Розробка преднізолону з модифікованим вивільненням відкрила можливість узгодити терапію з природними циркадними ритмами пацієнтів, що докорінно змінило підхід до контролю ранкової скутості при РА. Накопичення клінічного досвіду дозволило розробити один із дієвих інструментів об’єктивізації ризиків застосування цих ліків: індекс токсичності ГК. Експерти Європейського альянсу ревматологічних асоціацій (European Alliance of Associations for Rheumatology — EULAR) запропонували застосовувати його як інструмент для уніфікованої та об’єктивної оцінки кумулятивних небажаних ефектів. Так розпочалася «ера конвергенції»: період, коли наука, клінічний досвід та нові терапевтичні засоби нарешті почали узгоджуватися між собою [3]. Біологічні та таргетні препарати змінили стратегії лікування, проте не витіснили ГК; за їх допомогою знайдений «баланс» між ефективністю та безпекою. Поважні міжнародні організації почали поступово змінювати застарілі погляди та формувати нову філософію: ГК — це не «зайвий пережиток минулого», а контрольований раціональний стратегічний засіб сучасної терапії багатьох ревматологічних захворювань.
І сьогодні багаторічна еволюція ГК отримує нове продовження. Те, що починалося як клінічний прорив, перетворилося на сферу глибоких молекулярних досліджень. Саме за останні два десятиліття стали очевидними фундаментальні механізми дії ГК — геномні та негеномні — від яких залежить як терапевтичний ефект, так і профіль безпеки. Розуміння цих механізмів стало основою сучасних підходів до вибору препарату, режиму дозування та тривалості лікування.
Сучасне розуміння протизапального ефекту ГК: геномні та негеномні механізми
Протягом перших десятиліть після відкриття ГК їх протизапальну дію пояснювали переважно простими та загальними механізмами, зокрема:
- «зменшенням набряку» завдяки стабілізації судинної стінки;
- «пригніченням імунітету» без детального розуміння конкретних клітинних мішеней;
- «заспокоєнням» надмірної імунної відповіді;
- блокуванням синтезу прозапальних медіаторів.
Такі пояснення, з одного боку, частково відображали реальність, з іншого — були значно спрощеними й не дозволяли зрозуміти, чому пульс-терапія ГК дає швидкий ефект, а низькі дози працюють інакше, чому токсичність ГК проявляється різними механізмами.
Протягом останніх десятиліть ситуація змінилася радикально. Завдяки низці фундаментальних досліджень стало зрозуміло, що протизапальні властивості ГК формуються двома паралельними шляхами: геномними (повільними, стабільними, дозонезалежними) та негеномними (дуже швидкими, дозозалежними). Більш того, попри довгу історію застосування ГК, дослідники й сьогодні продовжують відкривати нові, раніше невідомі компоненти їх протизапальної дії — особливо ті, що стосуються швидких негеномних реакцій і клітинноспецифічних механізмів [3].
Геномні механізми дії ГК
Попри те що термін «геномна дія» може звучати тривожно, він не означає, що ГК спричиняють мутації чи будь-яке пошкодження ДНК. Геномні механізми не змінюють структури генетичного матеріалу та не впливають на його послідовність. Їх суть зовсім інша: потрапляючи до клітини, ГК зв’язуються зі своїм цитозольним рецептором, і комплекс «ГК — рецептор» переміщується в ядро [6]. Там він взаємодіє з певними ділянками ДНК та транскрипційними факторами, фактично «вмикаючи» або «вимикаючи» окремі гени, тобто регулюючи експресію білків, необхідних для протизапальної відповіді. Цей процес є зворотним, контрольованим та не супроводжується жодними генетичними мутаціями. ГК не здатні пошкоджувати ДНК, вони лише змінюють активність генів, які клітина тимчасово використовує для синтезу потрібних білків. Масштаб геномної регуляції, яку запускають ГК, є надзвичайно значним. За даними сучасних транскриптомних досліджень, терапія ГК здатна змінювати експресію понад 9457 генів, тобто впливати на близько 17% людського транскриптома [7]. Важливо й те, що цей вплив є клітинноспецифічним: різні типи клітин залучають різний набір генів, що пояснює як широкий спектр клінічних ефектів ГК, так і варіабельність побічних реакцій у різних пацієнтів.
Геномні ефекти ГК розпочинаються з моменту, коли гормон зв’язується з цитозольним рецептором і «вмикає» його. Утворений комплекс «ГК — рецептор» переміщується до ядра й починає впливати на активність генів, які клітина залучає в роботу. Цей вплив може мати два напрямки: трансрепресія (вимикання генів) та трансактивація (вмикання генів) (рис. 2А). У режимі трансрепресії рецептор працює як мономер і не зв’язується напряму з ДНК [8]. Натомість він «підчіплюється» до прозапальних транскрипційних факторів (ядерний фактор каппа-В (NF-κB), активатор білка AP-1), що зазвичай активують гени, відповідальні за синтез прозапальних цитокінів, хемокінів, металопротеїназ та молекул адгезії. Блокуючи їхню активність, комплекс «ГК–рецептор» фактично «вимикає» ці гени, і запалення починає стихати [4, 5]. Саме трансрепресія пояснює більшу частину бажаного протизапального ефекту ГК у ревматології.
Другий шлях — трансактивація — працює інакше. Коли два рецептори об’єднуються у димер, вони вже можуть напряму зв’язуватися з ДНК у спеціальних ділянках, що називаються GRE (glucocorticoid response element — ГК-елемент відповіді). Це зумовлює «вмикання» певних генів, найчастіше пов’язаних із метаболізмом глюкози, ліпогенезом і гормональною відповіддю [4, 5, 8]. Саме цей механізм частково пояснює розвиток метаболічних побічних ефектів ГК, як-от гіперглікемія чи стероїд-індукований цукровий діабет. Тож трансактивація — це «увімкнення» генів, які не завжди працюють на користь пацієнта.

Примітки. GSE — ГК-чутливий елемент, NF-κB — ядерний фактор каппа-В, RL — рецептор-ліганд.
На клінічному рівні саме геномні ефекти забезпечують «класичну» дію ГК, яку так цінують у ревматології: відносно повільний (4–6 год, мінімум ≈30 хв), але стійкий протизапальний та імуносупресивний ефекти, котрі реалізуються при застосуванні терапевтичних доз [8]. Зменшення вираженості болю та припухлості суглобів, зниження швидкості осідання еритроцитів (ШОЕ) та С-реактивного білка, покращення функції суглобів, поліпшення якості життя пацієнтів із ревматичними захворюваннями досягається завдяки геномним ефектам ГК.
Хронічні геномні ефекти ГК виявляють «структурнозахисний» ефект, тобто хворобомодифікуючий вимір. Доведено, що застосування низьких доз системних ГК (5–7,5 мг/добу у перерахунку на преднізолон; або 4–6 мг/добу метилпреднізолону у таблетках) у комбінації з традиційними синтетичними хворобомодифікуючими антиревматичними препаратами (conventional synthetic disease-modifying antirheumatic drugs — csDMARD) при РА асоціюється зі сповільненням рентгенологічної прогресії ураження суглобів [9].
Водночас ті самі геномні механізми, що залучають гени вуглеводного й ліпідного обміну, ремоделювання кісткової тканини та регуляції судинного тонусу, лежать в основі виникнення віддалених побічних ефектів ГК. Тривале лікування, особливо в дозах, що перевищують «низькі», асоціюється зі збільшенням маси тіла, розвитком стероїд-індукованого цукрового діабету, інсулінорезистентності, дисліпідемії, артеріальної гіпертензії, остеопорозу, переломів, катаракти, атрофії шкіри, м’язової слабкості й підвищеної схильності до інфекцій [9].
Негеномні механізми
Негеномні ефекти доповнюють дію геномного механізму, являючи собою «швидкий шар» дії ГК. Негеномні ефекти не пов’язані з впливом на ДНК та реалізуються через мембранні рецептори завдяки прямій фізико-хімічній взаємодії з ліпідним бішаром та модулюванню іонних каналів, внутрішньоклітинних сигнальних шляхів (рис. 2В). Завдяки негеномним механізмам швидко знижується судинна проникність і зменшуються набряки, пригнічуються дегрануляція гладких клітин та активація нейтрофілів, відбувається модуляція нейрогенних та гуморальних ланок запалення [4, 5, 8]. Клінічно ці ефекти проявляються вже через 15 хв після введення та виникають при застосуванні високих доз ГК (≥100 мг у перерахунку на преднізолон, що відповідає близько ≥80 мг метилпреднізолону).
Пошук оптимального ГК крізь призму геномних та негеномних ефектів
Сучасні клінічні настанови допускають застосування різних системних ГК, часто наводячи добові дози у перерахунку на преднізолон. Такий преднізолоновий еквівалент використовується як універсальна шкала порівняння різних ГК та не є рекомендацією призначати саме преднізолон. У рутинній практиці це інколи призводить до помилкового трактування слова «преднізолон» як препарату вибору, хоча насправді ключовою є не назва молекули, а досягнення потрібного протизапального ефекту при мінімально достатній еквівалентній дозі.
Додаткових труднощів додає широкий вибір ГК на фармакологічному ринку та відмінності між ними за інтенсивністю геномних і негеномних ефектів, мінералокортикоїдною активністю та фармакокінетикою. У ревматології оптимальною є така молекула ГК, яка поєднує виражені негеномні ефекти для швидкого контролю загострення з достатньою геномною активністю для стійкого протизапального впливу, а також має сприятливі фармакокінетичні характеристики (зокрема меншу залежність від транскортину). Такий баланс дозволяє одночасно контролювати гостре запалення та забезпечить стійку протизапальну дію при тривалому лікуванні. Цим вимогам, які висуваються до «оптимального» ГК, найбільш повно відповідає метилпреднізолон, який зручно застосовувати як для пульс-терапії, так і для плавного переходу від високодозових режимів до перорального етапу лікування з використанням таблетованої форми для контрольованого зниження дози (табл. 1).
| ГК | Геномна потужність | Негеномна потужність | Мінералокортикоїдна активність | Зв’язування з транскортином | Зв’язування з альбуміном | Період напіврозпаду, год |
|---|---|---|---|---|---|---|
| Преднізолон | 4 | 4 | 0,3 | +++ | + | 12–36 |
| Гідрокортизон | 1 | <1 | 1 | – | +++ | 8–12 |
| Метилпреднізолон | 5 | 10–15 | 0,5 | – | +++ | 18–36 |
| Дексаметазон | 20–30 | 20 | 0 | – | +++ | 36–54 |
| Бетаметазон | 20–30 | <4 | 0 | – | +++ | 36–54 |
| Флудрокортизон | 10–15 | – | 250 | – | +++ | 18–36 |
Тому в повсякденній роботі доцільно одразу перекладати дозування, еквівалентне преднізолону, у відповідні дози метилпреднізолону: 5 мг преднізолону еквівалентно ≈4 мг метилпреднізолону; 7,5 мг преднізолону відповідає ≈6 мг метилпреднізолону; 100 мг преднізолону еквівалентно ≈80 мг метилпреднізолону.
Щоб обґрунтувати такий вибір, доцільно розглянути, який клінічний ефект забезпечують геномні та негеномні механізми дії системних ГК, та порівняти препарати за потужністю цих ефектів.
Сучасний фармакологічний ринок пропонує великий вибір ГК, які суттєво відрізняються між собою за інтенсивністю геномних та негеномних ефектів. Обираючи конкретний ГК, доцільно врахувати, які властивості та пов’язані з ними клінічні наслідки будуть найбільш значущими у ревматологічній практиці. Геномні механізми формують хворобомодифікуючий вплив, тоді як негеномні забезпечують швидке зменшення набряку й зниження судинної проникності, що критично важливо при загостренні системних захворювань. Особливо цінним буде той ГК, який поєднує достатню геномну активність та виявляє виражені негеномні ефекти. Такий баланс дозволить одночасно контролювати гостре запалення та забезпечить стійку протизапальну дію при тривалому лікуванні. Саме тому оптимальним ГК в ревматології за всіма зваженими показниками є саме метилпреднізолон (табл. 1).
Серед існуючих системних ГК метилпреднізолон демонструє найбільш збалансований профіль геномної та негеномної активності. Його геномна потужність перевищує відповідний показник преднізолону та гідрокортизону. Негеномна активність метилпреднізолону, яка коливається в межах 10–15, є однією з найвищих серед системних ГК. Завдяки цим особливостям метилпреднізолон забезпечує як виражену швидку дію при гострих станах, так і стабільний контроль запалення при тривалому лікуванні [8].
Не менш важливим є співвідношення ГК- та мінералокортикоїдної активності. Мінералокортикоїдна дія метилпреднізолону значно нижча за таку гідрокортизону та принципово відрізняється від такої флудрокортизону. Ця особливість має важливе клінічне значення для хворих ревматологічного профілю, оскільки мінімізує ризик затримки натрію, набряків та підвищення артеріального тиску, які можуть ускладнювати перебіг коморбідної серцево-судинної патології [4, 8].
Особливу увагу привертає властивість зв’язуватися з білками плазми крові. Метилпреднізолон практично не зв’язується з транскортином, тоді як преднізолон демонструє високий ступінь зв’язування. Враховуючи той факт, що рівень транскортину знижується при системному запаленні, препарати з низькою залежністю від цього білка будуть мати більш стабільну сироваткову концентрацію. Така особливість додає метилпреднізолону додаткові фармакокінетичні переваги при тяжкому системному запаленні. Висока спорідненість з альбуміном додатково стабілізує його вміст у сироватці крові та забезпечує появу більш передбачуваного клінічного ефекту [8, 10].
Період напіввиведення метилпреднізолону становить 18–36 год, що, з одного боку, зіставно з преднізолоном, а з іншого — він значно коротший, ніж у дексаметазону та бетаметазону. Це дозволяє досягати потужного протизапального ефекту при короткому курсі терапії та забезпечує стійке пригнічення активності імунних клітин. Уже через 24 год після інфузії близько 99% препарату виводиться з організму, що знижує ризик накопичувальної токсичності, особливо у пацієнтів, які потребують повторних курсів лікування [10]. Застосування метілпреднізолону дозволяє уникати накопичення й надмірної тривалості геномних ефектів, які можуть підвищувати ризик метаболічних ускладнень, але при цьому зберігає стабільний добовий протизапальний вплив [8].
У сукупності перелічені особливості визначають не лише ефективність метилпреднізолону при гострих станах, але й його зручність для подальшого застосування як терапевтичного «містка» — переходу від високих доз до підтримувальних, коли критично важливими стають передбачуваність ефекту та можливість поступового зниження дози. Саме на цьому етапі доцільно робити акцент на застосуванні метилпреднізолону у таблетках: поєднання збалансованих геномних і виражених негеномних ефектів (табл. 1) забезпечує керований протизапальний вплив у перехідний період, тоді як нижча мінералокортикоїдна активність знижує ймовірність затримки рідини та набряків у пацієнтів із кардіометаболічними ризиками. Додатковою практичною перевагою є можливість поступового зниження дози: 5 мг/добу у перерахунку на преднізолон відповідає ≈4 мг/добу метилпреднізолону, що спрощує титрування та уніфікує підходи до поетапного зниження дози в амбулаторних умовах. Такий підхід узгоджується із загальною логікою сучасних настанов: мінімізувати кумулятивну експозицію ГК, але не втрачати керованості симптомів до моменту повної відміни ГК.
Побічні дії ГК: і знову геномні та негеномні особливості
Сучасні уявлення про побічні дії ГК сформувалися багато років тому, але залишаються актуальними й сьогодні. Вже немає сумнівів, що ГК впливають практично на всі органи та системи, водночас забезпечуючи потужний терапевтичний ефект (зменшення вираженості болю, набряку, скутості, шкірних та алергічних проявів) і спричиняючи широкий спектр небажаних реакцій (остеопороз, інфекції, міопатія, катаракта, метаболічні порушення, психічні зміни, підвищення артеріального тиску та шлунково-кишкові ускладнення) (рис. 3) [11, 12].
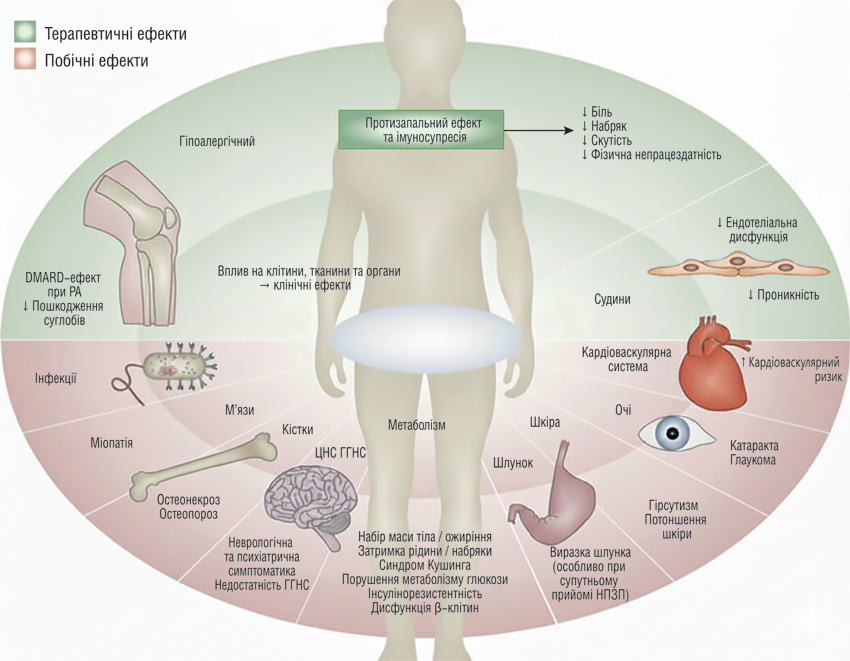
Примітки. ГГНС — гіпоталамо-гіпофізарно-наднирникова система; ЦНС — центральна нервова система; НПЗП – нестероїдні протизапальні препарати.
Зараз підходи до пояснення небажаних ефектів ГК виходять за межі традиційного переліку ускладнень та ґрунтуються на розумінні геномного та негеномного механізмів дії ГК. Геномний ефект, зокрема процеси трансактивації, пояснюють розвиток гіперглікемії, інсулінорезистентності, порушення ліпідного обміну, розвитку остеопорозу та атрофії шкіри, катаболізму м’язів та багатьох інших реакцій [13]. Імуносупресивні небажані ефекти (підвищена схильність до інфекцій, порушення клітинної відповіді) також виникають переважно через геномне пригнічення цитокінів і зміну функції лейкоцитів [14].
Негеномні побічні ефекти ГК реалізуються швидше та переважно пов’язані з модулюванням клітинних мембран, судинної проникності та іонних каналів. Саме вони пояснюють гострі реакції на високі дози ГК: швидке зменшення набряку чи вазодилатаційні зміни. Поєднання геномних і негеномних механізмів формує індивідуальний профіль ризиків у кожного пацієнта, що підтверджується й клінічними опитуваннями пацієнтів із ревматичними захворюваннями [15].
Сучасні уявлення про побічні ефекти ГК еволюціонували від простого переліку ускладнень до розуміння складної взаємодії геномних та негеномних механізмів, що лежать в основі їх розвитку. Такий підхід дозволяє оцінювати не лише потенційну ефективність ГК, а й характер та ймовірність небажаних реакцій, що дає змогу визначити препарати з оптимальним балансом терапевтичної активності та профілем безпеки.
Саме метилпреднізолон доцільно позиціонувати як препарат 1-ї лінії серед системних ГК у ревматологічній практиці, адже за однакової протизапальної ефективності в еквівалентних дозах він порівняно з преднізолоном частіше забезпечує кращу переносимість: меншу затримку рідини та набряки (через нижчу мінералокортикоїдну активність), більш передбачувану фармакокінетику в умовах системного запалення (мінімальна залежність від транскортину) та керованіший профіль небажаних реакцій при переході на пероральний етап лікування. Порівняно з тривалодіючими та високопотужними ГК (дексаметазон / бетаметазон) метилпреднізолон характеризується менш вираженими метаболічними ускладненнями й нижчою частотою шкірних і м’язових небажаних ефектів. Саме тому сучасна стратегія мінімізації ГК через побічні реакції є більш логічною, коли «стандартною» молекулою для високих доз і подальшого поетапного зниження виступає метилпреднізолон, а не преднізолон. Дані сучасних оглядів також свідчать про нижчу частоту шкірних і м’язових ускладнень при застосуванні метилпреднізолону [13]. Пацієнти, своєю чергою, частіше відзначають кращу переносимість цього препарату та нижчу частоту виникнення таких суб’єктивно значущих побічних ефектів, як безсоння, зміни настрою та набряки, порівняно з іншими системними ГК [15].
Сьогодення ГК у ревматології: погляд з позицій EULAR та ACR
Нещодавно провідні міжнародні організації — EULAR та Американський коледж ревматологів (American College of Rheumatology — ACR) — опублікували одразу кілька практичних настанов щодо лікування РА та системного червоного вовчака (СЧВ), в яких розглядали умови призначення ГК.
ГК при РА: європейський компроміс та американська категоричність
Європейські та американські експерти, обговорюючи ведення хворих на РА, продемонстрували однакове ставлення щодо застосування ГК: вони одностайно рекомендують мінімізувати дозу й тривалість лікування, підкреслюючи при цьому доцільність ранньої та адекватної DMARD-терапії. Положення EULAR та ACR відрізняються тільки за ступенем «стероїдної обережності». У настановах EULAR (2023) ГК представлені як допоміжний інструмент, застосування якого може бути доцільним при ініціації лікування або при загостренні РА (табл. 2); ГК виконують роль короткочасної «bridging» (місткової або зв’язувальної) терапії, яку слід продовжувати лише до настання ефекту від базисних чи біологічних препаратів [16]. Водночас європейські експерти наголошують на необхідності призначення найнижчих ефективних доз та розроблення чіткого плану з поступового зниження дозування ГК відразу після досягнення клінічного контролю над перебігом захворювання. Тривала підтримувальна ГК-терапія допускається лише у виняткових ситуаціях і потребує регулярної переоцінки ризиків [16].
| ACR (2021) | EULAR (2023) | |
|---|---|---|
| Призначення ГК | Уникати рутинного застосування; не рекомендується застосовувати ГК при старті терапії разом із csDMARD (навіть короткостроково). Лише у виняткових випадках для контролю сильного загострення | Можна використовувати короткочасно як «bridging»-терапію на старті лікування або при загостренні до настання ефекту DMARD |
| Ключовий акцент | «Zero or minimal steroids» — максимально стероїдообмежувальна стратегія | «Temporary assistance» — дозволене короткочасне застосування як місткової терапії |
| Мета | Повна мінімізація / уникнення застосування ГК | Тимчасове «посилення» контролю над симптомами; обов’язкове подальше зниження дози після стабілізації стану |
| Короткий курс ГК / «місткова» терапія | Проти ініціації csDMARD із одночасним коротким курсом ГК;
застосування можливе лише за життєвої необхідності |
Дозволяється та підтримується як засіб контролю симптомів на старті терапії |
| Пульс-терапія | Не розглядається як стандартний підхід для лікування РА (на відміну від СЧВ) | Рутинно не рекомендується; використовується виключно у тяжких станах |
| Підтримувальна доза | Немає рекомендованої «допустимої» підтримувальної дози; хронічна терапія вважається небажаною навіть у низьких дозах | Немає чіткої допустимої цифри, але бажано ≤7,5 мг/добу еквівалентно преднізолону або мінімальна доза, яка дозволяє контролювати симптоми; лише тимчасово |
| Хронічний прийом ГК | Сильна рекомендація проти тривалого застосування (≥3 міс); у разі розвитку ГК-залежності — корекція базисної терапії | Небажаний, але можливий у поодиноких випадках при низькій активності та неможливості повної відміни; рішення індивідуальне |
Американські експерти займають більш категоричну позицію. Представники ACR зазначають, що ініціювати базисну терапію слід без супутнього призначення ГК, а їх застосування (навіть короткострокове, до 3 міс) вважають небажаним та розглядають лише як тимчасове «виняткове» рішення для швидкого полегшення симптомів при ініціації лікування [17]. Довготривале застосування ГК (понад 3 міс) асоційовано з несприятливим профілем безпеки, тому ACR наполегливо не рекомендує використовувати цю стратегію лікування. Якщо пацієнт залишається ГК-залежним та схильний приймати ГК для контролю симптомів, експерти радять відкоригувати дозування DMARD-препаратів, а не підтримувати тривале застосування ГК.
Обидві організації сходяться в ключовому принципі: ГК є препаратами для тимчасового контролю запалення, але не засобом тривалої підтримки. Таким чином, стратегія EULAR допускає короткий курс ГК у разі потреби досягнення швидкого протизапального ефекту, тоді як ACR закликає максимально інтенсифікувати DMARD-терапію.
ГК-стратегія при СЧВ: глобальний тренд на мінімізацію
Незважаючи на спільну мету (контроль запалення та мінімізація токсичності), можна знайти важливі відмінності в американських та європейських підходах щодо застосування ГК при СЧВ. ACR знову дотримується максимально стероїдообмежувальної стратегії (табл. 3). Передбачається застосування ГК лише для швидкого контролю загострень, після чого дозу стероїдів слід агресивно знижувати до ≤5 мг еквівалентно преднізолону на добу протягом близько 6 міс, а потім намагатися досягти повної відміни ГК [18]. Хронічна підтримка із застосуванням доз >5 мг/добу (еквівалентно преднізолону) вважається небажаною та розглядається як сигнал до інтенсифікації імуносупресивної терапії, а не підтримання хронічного прийому середніх доз ГК. ACR детально регламентує пульс-терапію у тяжких органозагрозливих випадках та прямо вказує, який саме ГК слід призначати. Американські експерти рекомендують застосовувати метилпреднізолон у дозі 250–1000 мг внутрішньовенно (в/в) протягом 1–3 днів, вважаючи його оптимальним препаратом для індукційної терапії. Наступним кроком повинен бути перехід на пероральний прийом ГК з подальшим початком поступового зниження дози. Застосування на цьому етапі метилпреднізолону у таблетках спрощує ведення пацієнта та сприяє уніфікації призначень на амбулаторному етапі.
| ACR (2025) | EULAR (025) | |
|---|---|---|
| Призначення ГК | Лише для швидкого контролю активних проявів або загострень; уникати рутинного застосування | При активному перебігу СЧВ або загостреннях; допускається як тимчасовий захід під час індукції терапії |
| Ключовий акцент |
«Maximal steroid-sparing» — агресивна стратегія мінімізації глюкокортикоїдів | «Minimal cumulative steroids» — контроль активності СЧВ із максимально можливим зниженням сумарної дози ГК |
| Мета | Мінімізувати / уникнути тривалої терапії ГК; швидко знизити до мінімуму | Забезпечити контроль активності захворювання з подальшим зниженням дози ГК до мінімальної підтримувальної дози |
| Пульс-терапія | Строго рекомендована при органо- / життєзагрозливих станах; метилпреднізолон у дозі 250–1000 мг/добу в/в 1–3 дні | Рекомендована при тяжких загостреннях, особливо при люпус-нефриті; метилпреднізолон (дози варіюють) |
| Підтримувальна доза | ≤5 мг/добу у перерахунку на преднізолон (≈4 мг/добу метилпреднізолону) протягом ~6 міс, у подальшому — відміна | ≤5 мг/добу у перерахунку на преднізолон (≈4 мг/добу метилпреднізолону) як прийнятна низька підтримувальна доза, якщо повна відміна неможлива |
| Хронічний прийом |
>5 мг/добу еквівалентно преднізолону вважається неприпустимим; слід інтенсифікувати DMARD- /імуносупресивну терапію | Небажаний, але може зберігатися у низьких дозах у разі неможливості повної відміни |
Положення EULAR більш гнучкі. Європейські експерти розглядають ГК як частину індукційної терапії при активному перебігу / загостренні СЧВ та люпус-нефриті та передбачають застосування ГК як короткочасну допоміжну терапію до початку дії імуносупресантів [19]. Після досягнення контролю над активністю СЧВ експерти EULAR також наполягають на зниженні дози ГК до ≤5 мг/добу (≈≤4 мг/добу перорального метилпреднізолону), але допускають більш тривалу низькодозову ГК-терапію, якщо повна відміна цих препаратів неможлива. Як і в американських рекомендаціях, стандартом для проведення пульс-терапії визнаний метилпреднізолон. На відміну від рекомендацій ACR, європейські настанови менше деталізують дозові режими метилпреднізолону та надають більше самостійності лікарям з цього питання.
Таким чином, ACR займає більш жорстку позицію щодо мінімізації глюкокортикоїдів, тоді як EULAR дозволяє ширше застосувати ГК на ранніх етапах лікування, водночас також підкреслюючи необхідність зниження дози. Обидва товариства дотримуються схожої тактики при веденні пацієнтів із тяжким перебігом СЧВ: короткий курс пульс-терапії метилпреднізолоном із подальшим переходом на пероральні ГК та поступовим зниженням їхньої дози. На цьому етапі лікування метилпреднізолон також забезпечує досить сприятливий профіль безпеки порівняно з іншими ГК.
Хронічне застосування ГК: альтернативний погляд
Попри тенденцію міжнародних рекомендацій до максимального обмеження застосування ГК, у ревматологічній спільноті існує й альтернативна думка, яку поділяє частина досвідчених фахівців. Вони підкреслюють, що для окремих пацієнтів довготривале застосування дуже низьких доз ГК може бути не лише прийнятним, а й клінічно доцільним. Як зазначає один із провідних ревматологів: «Деякі ревматологи — включно зі мною — вважають довготривале застосування дуже низьких доз ГК (у межах 2–4 мг/добу) реалістичним терапевтичним варіантом для пацієнтів із РА» [20].
Прихильники цього підходу аргументують, що мікродози стероїдів здатні забезпечувати стабільний контроль запалення, знижувати частоту загострень і допомагати уникати більш токсичної імуносупресії, особливо у пацієнтів із тривалим перебігом хвороби або непереносимістю DMARD [21]. Вони також застерігають, що надмірно жорсткий підхід до повної відмови від ГК може у деяких випадках призвести до втрати контролю над хворобою, посилення болю та скутості, а також необхідності переходу до агресивнішої або менш безпечної терапії [20]. Особливо гостро це звучить для пацієнтів похилого віку, які вже протягом тривалого часу отримують ГК: «Клінічний досвід показує, що люди літнього віку з ревматологічною патологією, яка важко піддається лікуванню, отримують користь від довгострокового застосування ГК у низьких дозах з хорошим профілем безпеки. Припинення лікування ГК у пацієнтів, які приймали їх протягом тривалого часу, часто є складним через ефект відміни або загострення захворювання» [22].
З цієї перспективи дуже низькі підтримувальні дози (2–4 мг/добу) можуть розглядатися як компромісний, проте безпечний інструмент довгострокового менеджменту за умови регулярного моніторингу та оптимізації супутньої терапії [20–22]. Такий підхід розширює рамки традиційної концепції зниження дози ГК і підкреслює важливість персоналізації, тобто адаптації терапевтичної стратегії до конкретного пацієнта, його фенотипу захворювання та переносимості лікування.
Висновки
Упродовж понад 75-річної історії клінічного застосування ГК пройшли шлях від «чарівної палички» до строго контрольованого раціонального засобу таргетованого впливу на запалення. За цей час кардинально змінилися уявлення про їх механізм дії, еволюціонували й підходи до режиму дозування, тривалості терапії та моніторингу безпеки.
Оновлені рекомендації EULAR та ACR демонструють глобальний тренд на максимальну мінімізацію кумулятивної дози ГК, розглядаючи ці ліки переважно як інструмент короткочасного контролю активного запалення з пріоритетом раннього призначення DMARD- та імуносупресивної терапії. Сучасні підходи до застосування ГК зосереджені на мінімізації їх прийому, поступовому зниженні дози або припиненні лікування, коли це можливо, та підвищенні безпеки при тривалому застосуванні. Тривале застосування ГК у низьких дозах має DMARD-подібний ефект. У цьому контексті особливого значення набуває персоналізація терапії ГК з індивідуальним підбором препарату, його дози та тривалості з урахуванням ризиків, фенотипу хвороби та відповіді на терапію. Метилпреднізолон, препарат, який рекомендований EULAR та ACR для пульс-терапії СЧВ, має збалансований геномний і негеномний механізм дії, сприятливий профіль безпеки. Його можна вважати пріоритетним системним ГК у ревматологічній практиці: стандарт для пульс-терапії, оптимальний препарат для подальшого перорального прийому на етапі керованого поступового зниження дози.
Список використаної літератури
- 1. Crowson L.P., Davis J.M. 3rd, Hanson A.C. et al. (2023) Time Trends in Glucocorticoid Use in Rheumatoid Arthritis During the Biologics Era: 1999-2018. Semin. Arthritis Rheum., 61: 152219. doi: 10.1016/j.semarthrit.2023.152219.
- 2. Pofi R., Othonos N., Marjot T. et al. (2025) Dose-dependent and tissue-specific adverse effects of exogenous glucocorticoids: insights for optimizing clinical practice. J. Endocrinol. Invest., 48(9): 2067–2076. doi: 10.1007/s40618-025-02637-x.
- 3. Buttgereit F. (2021) Glucocorticoids: surprising new findings on their mechanisms of actions. Ann. Rheum. Dis., 80(2): 137–139. doi: 10.1136/annrheumdis-2020-218798.
- 4. Liew S.Y., Akker S.A., Guasti L. et al. (2019) Glucocorticoid replacement therapies: past, present and future. Curr Opin. Endocr. Metab. Res., 8: 152–159. doi: 10.1016/j.coemr.2019.08.011.
- 5. Eiers A.K., Vettorazzi S., Tuckermann J.P. (2024) Journey through discovery of 75 years glucocorticoids: evolution of our knowledge of glucocorticoid receptor mechanisms in rheumatic diseases. Ann. Rheum. Dis., 83(12): 1603–1613. doi: 10.1136/ard-2023-225371.
- 6. Lockett J., Inder W.J., Clifton V.L. (2024) The Glucocorticoid Receptor: Isoforms, Functions, and Contribution to Glucocorticoid Sensitivity. Endocr. Rev., 45(4): 593–624. doi: 10.1210/endrev/bnae008.
- 7. Franco L.M., Gadkari M., Howe K.N. et al. (2019) Immune regulation by glucocorticoids can be linked to cell type-dependent transcriptional responses. J. Exp. Med., 216(2): 384–406. doi: 10.1084/jem.20180595.
- 8. Peinado-Acevedo J., Rivera-Bustamante T., Rivera J. et al. (2024) Balancing inflammation and adverse effects of glucocorticoids in clinical practice. Rev. Colomb. Reumatol. (Engl. Ed), 31(4): 498–510. doi: 10.1016/j.rcreue.2023.08.004.
- 9. Doumen M., Pazmino S., Bertrand D. et al. (2023) Glucocorticoids in rheumatoid arthritis: Balancing benefits and harm by leveraging the therapeutic window of opportunity. Joint Bone Spine, 90(3): 105491. doi: 10.1016/j.jbspin.2022.105491.
- 10. Drugs and Lactation Database (LactMed®) (2025) Methylprednisolone. National Institute of Child Health and Human Development. Available from: http://www.ncbi.nlm.nih.gov/books/NBK501028.
- 11. Hoes J.N., Jacobs J.W., Buttgereit F. et al. (2010) Current view of glucocorticoid co-therapy with DMARDs in rheumatoid arthritis. Nat. Rev. Rheumatol., 6(12): 693–702. doi: 10.1038/nrrheum.2010.179.
- 12. van der Goes M.C., Jacobs J.W., Bijlsma J.W. (2014) The value of glucocorticoid co-therapy in different rheumatic diseases—positive and adverse effects. Arthritis Res. Ther., 16(Suppl. 2): S2. doi: 10.1186/ar4686.
- 13. Tavares L.C.P., Caetano L.V.N., Ianhez M. (2024) Side effects of chronic systemic glucocorticoid therapy: what dermatologists should know. An. Bras. Dermatol., 99(2): 259–268. doi: 10.1016/j.abd.2023.05.005.
- 14. Jia W.Y., Zhang J.J. (2022) Effects of glucocorticoids on leukocytes: Genomic and non-genomic mechanisms. World J. Clin. Cases, 10(21): 7187–7194. doi: 10.12998/wjcc.v10.i21.7187.
- 15. Alnaimat F., Alduraidi H., Yaghi A.R.A. et al. (2025) Glucocorticoid use and perceptions of side effects among patients with rheumatic medical diseases: Insights from a developing country. PLoS One, 20(7): e0327436. doi: 10.1371/journal.pone.0327436.
- 16. Smolen J.S., Landewé R.B.M., Bergstra S.A. et al. (2023) EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological DMARDs: 2022 update. Ann. Rheum. Dis., 82(1): 3–18. doi: 10.1136/ard-2022-223356.
- 17. Fraenkel L., Bathon J.M., England B.R. et al. (2021) 2021 American College of Rheumatology Guideline for the Treatment of Rheumatoid Arthritis. Arthritis Care Res., 73(7): 924–939. doi: 10.1002/acr.24596.
- 18. Sammaritano L.R., Askanase A., Bermas B.L. et al. (2025) 2025 American College of Rheumatology Guideline for the Treatment of Systemic Lupus Erythematosus. Arthritis Care Res. doi: 10.1002/acr.25690.
- 19. Fanouriakis A., Kostopoulou M., Anders H.J. et al. (2025) EULAR recommendations for the management of systemic lupus erythematosus with kidney involvement: 2025 update. Ann. Rheum. Dis. S0003-4967(25)04412-7. doi: 10.1016/j.ard.2025.09.007.
- 20. Buttgereit F. (2020) Views on glucocorticoid therapy in rheumatology: the age of convergence. Nat. Rev. Rheumatol., 16(4): 239–246. doi: 10.1038/s41584-020-0370-z.
- 21. Sugihara T., Tanaka E., Matsui T. (2024) Low-Dose Glucocorticoids in Older Patients with Rheumatoid Arthritis: What Does the Evidence Say? Drugs Aging. 41(8):641-652. doi: 10.1007/s40266-024-01133-w.
- 22. Hysa E., Vojinovic T., Gotelli E. et al. (2023) The dichotomy of glucocorticosteroid treatment in immune-inflammatory rheumatic diseases: an evidence-based perspective and insights from clinical practice. Reumatologia. 61(4):283-293. doi: 10.5114/reum/170845.
Надійшла до редакції/Received: 1.12.2025
Прийнято до друку/Accepted: 30.12.2025

Leave a comment