Подагра: які акценти менеджменту здатні покращити прогноз?
Рекалов Д.Г.1, Борткевич О.П.1, Данюк І.О.2, Чорна І.В.2
- 1Національний науковий центр «Інститут кардіології, клінічної та регенеративної медицини імені академіка М.Д. Стражеска НАМН України»
- 2Запорізький державний медичний та фармацевтичний університет
Резюме. Подагра є однією з найпоширеніших запальних артропатій у чоловіків, але відмічається й у жінок, особливо у постменопаузальний період. Сечова кислота вважається кінцевим продуктом метаболізму пуринів у людини. Докази свідчать про те, що підвищення рівня сечової кислоти в сироватці крові пов’язане з розвитком артеріальної гіпертензії, ішемічної хвороби серця, інсультів, гострого інфаркту міокарда і серцево-судинних захворювань. Гіперурикемія — це лабораторний феномен, стійке підвищення концентрації сечової кислоти в сироватці крові. За оцінками, до 21% загальної популяції та 25% госпіталізованих пацієнтів мають безсимптомну гіперурикемію, а рівень сечової кислоти може бути підвищений за 10–15 років до клінічних проявів подагри. Розчинність сечової кислоти визначається межею — точкою насичення моноурату натрію в плазмі крові і становить 6,8 мг/дл (408 мкмоль/л) для чоловіків і 7,0 мг/дл (420 мкмоль/л) для жінок. In vitro кристали моноурату натрію формуються при вмісті сечової кислоти >6,0 мг/дл (>360 мкмоль/л) при температурі 35 °С (кристалічні урати — це біологічно активні молекули, які можуть викликати несприятливі судинні, метаболічні та запальні явища. Згідно з багатьма популяційними дослідженнями, зв’язок між гіперурикемією та нирковими, серцево-судинними та метаболічними захворюваннями також очевидний і переконливий. Враховуючи високий рівень виявлення безсимптомної гіперурикемії, зростаючу поширеність судинних, метаболічних і ниркових захворювань і ефективність і доступність уратзнижувальної терапії, які можуть знизити вплив триваючої метаболічної епідемії, роль уратів залишається актуальним і важливим дискусійним питанням і дослідницьким викликом. Ефективність інгібіторів ксантиноксидази поширюється не лише на полегшення гострих симптомів подагри, але й на хронічну природу гіперурикемії.
DOI: 10.32471/rheumatology.2707-6970.19872
Актуальність
Подагра — загальне захворювання організму, в основі якого лежить порушення пуринового обміну з надмірним відкладенням кристалів моноурату натрію (МУН) в тканинах, що призводить до характерного ураження суглобів, нирок та інших внутрішніх органів [39]. Формування кристалів пов’язане з гіперурикемією, станом з підвищеним рівнем сечової кислоти (СК) >360 ммоль/л [33]. Однак важливо підкреслити, що у переважної кількості пацієнтів з гіперурикемією немає клінічних ознак подагри [32].
У 2020 р. у всьому світі відмічали 55,8 млн людей із подагрою, що є значним підвищенням цього показника (150,6%) порівняно з оцінками 1990 р. Глобальна стандартизована за віком поширеність подагри у 2020 р. становила 659,3 випадка на 100 тис. населення, що підвищилася на 22,5% у період 1990–2020 рр. Глобальна поширеність подагри виявилася в 3,26 раза вищою серед чоловіків, ніж жінок [11], із загальновіковим стандартизованим показником поширеності 1030,8 на 100 тис. для чоловіків і 316,4 на 100 тис. для жінок (рис. 1).
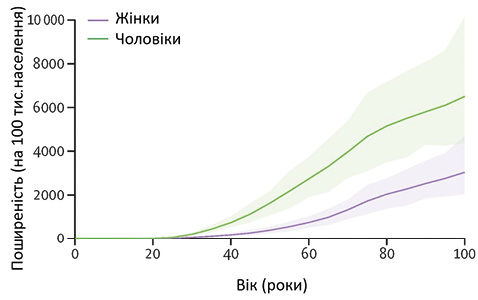
На жаль, на сьогодні відзначається тенденція до зростання захворюваності на подагру в індустріально розвинених країнах, при цьому цей показник в різних регіонах може коливатися від 1 до 10% дорослого населення. Так, у США у 1 із 25 чоловіків відмічено подагру [21].
В Україні така тенденція також зберігається, отже, кількість хворих поступово збільшується. За даними Міністерства охорони здоров’я України, у 2013 р. поширеність подагри становила 167,6 на 100 тис. населення, у 2017 р. — вже 190,4 на 100 тис. населення [1].
Подагра є тяжким захворюванням, оскільки значно погіршує якість життя, підвищує кардіоваскулярний ризик, призводить до інвалідизації та тяжкої нефропатії [3]. Депозиція кристалів МУН, відомих як тофуси, може відзначатися як параартикулярно, так і в будь-яких локалізаціях. Ідентифікація кристалів МУН у синовіальній рідині під час загострення [25] або аспірація з тофусу дозволяють нескладно, але переконливо верифікувати діагноз. Ультразвукове дослідження (УЗД) продемонструвало відкладення кристалів МУН у пацієнтів із асимптоматичною гіперурикемією [30]. Захворювання маніфестує курабельними епізодами запалення суглобів. Можливо також запобігти як суглобовому запаленню, так і формуванню тофусів, подальшому нефролітіазу. Важливо, що кристали МУН розчиняються повільно та повністю зникають при досягненні порогових значень СК [29]. Слід зазначити, що у великої частини пацієнтів із гіперурикемією виявляють метаболічний синдром. Наявність подагри, пов’язаної з коморбідністю, яка потребує змін у харчуванні, звичках, способі життя, — має насторожувати лікаря. Доведено, що подагра відіграє самостійну роль у якості фактора ризику для атеросклеротичної кардіоваскулярної хвороби [19]. Тофусна подагра пов’язана з підвищеним ризиком смертності, гострого інфаркту міокарда (ІМ) та термінальної хронічної хвороби нирок (ХХН) порівняно з нетофусною подагрою. Це може бути пов’язано зі збільшенням загального вмісту уратів, запаленням, кумулятивними кардіоренальними побічними ефектами застосування нестероїдних протизапальних препаратів (НПЗП) та/або глюкокортикоїдів (ГК), а також функціональним погіршенням стану [8].
Патогенез подагри. СК — це фінальний метаболіт пуринового метаболізму у людини. Пурини є гетероциклічними ароматичними органічними сполуками, що складаються з піримідинового кільця, вплавленого в імідазольне кільце. СК є слабкою кислотою з рКа 5,75. При фізіологічному рН 7,4 на екстрацелюлярному компартменті, 98% СК — це іонізовані форми уратів. У зв’язку з високою концентрацією натрію на екстрацелюлярному компартменті урати широко представлені як МУН з низькою розчинністю, близько 380 ммоль/л. [5]. Таким чином, якщо концентрація уратів перевищує цей показник, ризик формації кристалів МУН значно зростає. Рівень СК залежить від балансу між споживанням, синтезом та деградацією пуринів. Споживання пуринів та/або уратів — обмежене та становить близько 10% від усього того, що є в організмі. Печінка є головною локалізацією синтезу пуринів. Під час деградації пуринів вмикається процес реутилізації, оскільки синтез є доволі складним. Реутилізація пуринів вважається одним з головних джерел нуклеотидів для синтезу ДНК, РНК та кофакторів ферментів. Ферменти, які залучені у зазначені процеси, це аденозинфосфорибозилтрансфераза (АФРТ) та гіпоксантин-гуанінфосфорибозилтрансфераза (ГГФТ). На кінцевому етапі пуринового обміну залучається фермент ксантиноксидаза, який каталізує оксидацію гіпоксантину у ксантин та ксантин у СК [2].
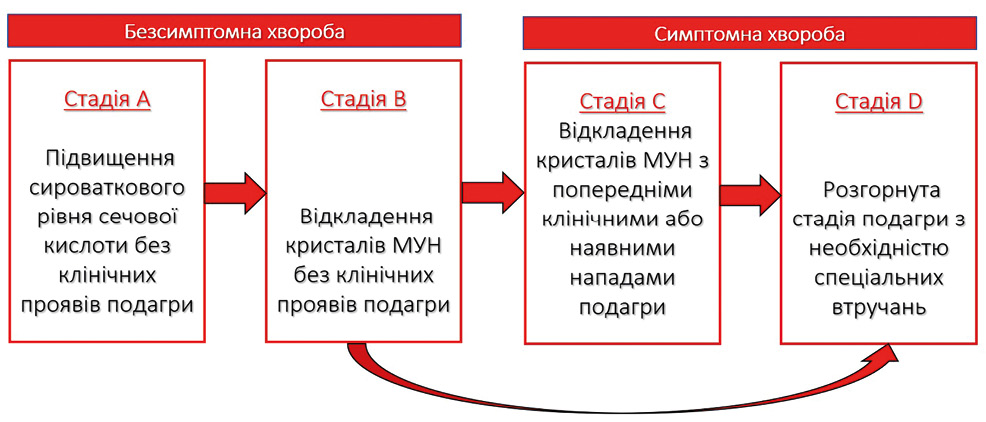
Патогенез подагри пов’язаний із ключовими точками: гіперурикемія, формування кристалів МУН та наявна вроджена імунна відповідь [23]. Прогресування через ці контрольні точки керується варіантами генотипу, факторами навколишнього середовища та їх взаємодією. Трансформація гіперурикемії у подагру проходить у 4 етапи: асимптомна гіперурикемія без наявних депозитів МУН, асимптомна гіперурикемія з підтвердженими депозитами МУН, кристали МУН з попередніми або наявними симптомами гострого подагричного артриту та хронічна подагра з тофусами (рис. 2) [22].
Урати погано розчиняються, отже, потребують трансмембранного транспортування. На сьогодні ідентифіковано такі: URAT (урат-транспортер), GLUT (глюкоза-транспортер), 2 представники органічних аніон-транспортерів (OAT1, OAT3), пов’язаних із тубулярною секрецією уратів та головним протеїном, відповідальним за тубулярну реабсорбцію уратів [12].
Вважається, що шлях екскреції СК кишечником становить до третини на добу, зниження інтестинальної екскреції СК може викликати розвиток гіперурикемії [14]. Але зниження екскреції СК не завжди призводить до гіперурикемії. Так, у хворих на подагру чоловіків Маорі (Полінезія) екскреція СК нижча, ніж в осіб європеоїдної раси при нормоурикемії. А от у жінок Маорі з нормальним рівнем СК екскреція вища, ніж у чоловіків [12].
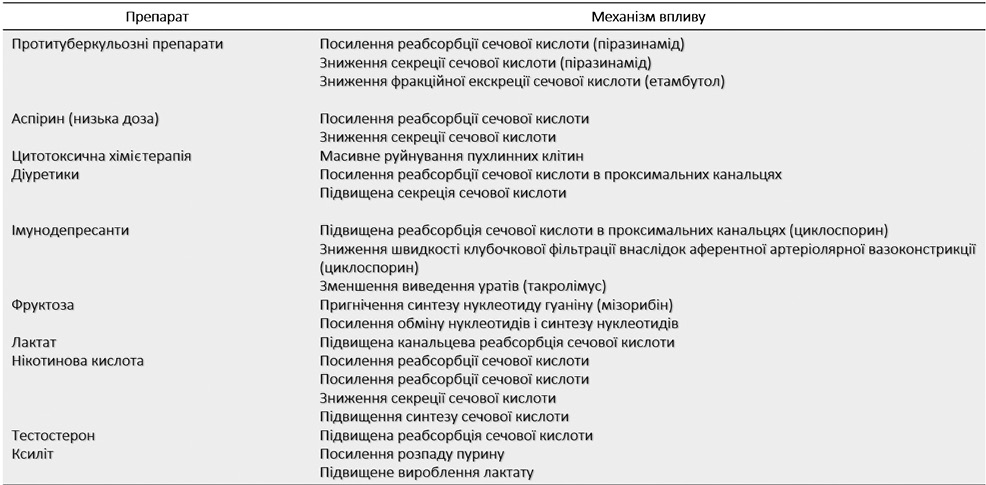
Зниження екскреції уратів спричиняє підвищення рівня СК, асоційованого з метаболічним синдромом, есенціальною артеріальною гіпертензією, декомпенсованою серцевою недостатністю (СН) [7, 29]. Деякі лікарські засоби, наприклад, циклоспорин, низькодозова ацетилсаліцилова кислота, діуретики, за рахунок зниження екскреції уратів можуть зумовлювати розвиток гіперурикемії (рис. 3).
Генетика
Нові відкриття щодо генетичної основи гіперурикемії та подагри, взаємодії ген — середовище та фармакогенетики уратзнижувальної терапії (УЗТ) розширили можливості використання підходів персоналізованої медицини у клінічній практиці. У сучасній терапії генетичне тестування є відносно дорогим і проводиться лише там, де існує гостра клінічна потреба в діагностиці або фармакогеноміці. Однак нині вартість створення всієї послідовності геному для окремої особи становить менше 1000 дол. США і знижується. Тому майбутні підходи до охорони здоров’я можуть включати наявність електронної послідовності всього геному задля того, щоб генетичний результат був доступний миттєво [9].
На рівень МУН у сироватці крові та ризик подагри впливає поєднання спадкових генетичних варіантів та середовища. Спадковість визначається як частка відхилення у фенотипі, що пояснюється спадковими генетичними варіантами, які можна оцінити, вивчивши фенотипічні кореляції між спорідненими особами, як правило, близнюками. Такі дослідження оцінювали спадковість у межах 45–73% [16]. Для того щоб охарактеризувати генетичну основу подагри, використано дослідження повногеномних асоціацій (ДПА). Найбільше ДПА у Європі залучило 110 тис. осіб і виявило 28 асоційованих з уратами локусів [18]. У цих локусах переважають гени, що кодують транспортери нирок та кишкової кислоти (SLC2A9/GLUT9, ABCG2, SLC22A11/OAT4, SLC22A12/URAT1, SLC17A1/NPT1 та допоміжна молекула PDZK1). Ефекти 28 поліморфізмів з єдиними нуклеотидами (SNP) були подібними для багатьох груп предків (європейського, афроамериканського, індійського, японського походження) [18].
За даними ДПА з населенням європейського та азіатського походження, включаючи мешканців Японії, існують генетичні відмінності між європейськими та азіатськими популяціями, у них є багато спільних асоційованих генів, таких як ABCG2, SLC2A9 та SLC22A12, що є визнаними та відомими репрезентативними транспортерами уратів [26].
Так, у недавньому дослідженні на Тайвані з використанням записів медичного страхування продемонстровано, що спадковий компонент для зазначеної популяції подагри становив 35% для чоловіків та 17% для жінок [21]. У дослідженні в США серед 512 пар близнюків не визначено значущої спадковості подагри, на противагу гіперурикемії [20]. Таким чином, існує чіткий спадковий компонент рівня сироваткового урату, навіть якщо оцінки спадковості при подагрі дуже невизначені, особливо при розгляді можливого генетичного контролю формування кристалів МУН та вродженої імунної відповіді.
Швидко прогресуючі технології та генетичні відкриття, специфічні для хвороби, мають потенціал для того, щоб персоналізована медицина стала реальністю у багатьох аспектах лікування подагри, включаючи оцінку ризику її прогресування, індивідуальні поради щодо способу життя, вибір і режим дозування УЗТ та запобігання серйозним побічним ефектам лікарських засобів [38].
Діагностика
Багато пацієнтів з кристалічними артропатіями діагностують, базуючись лише на клінічних проявах (рівень СК), тому клінічний діагноз не є достовірним при нетипових проявах. Важливо пам’ятати, що діагноз, що ґрунтується на рівні урикемії, може бути хибним. Рівень СК слід визначати за відсутності нападу, оскільки асимптоматична гіперурикемія є поширеною у пацієнтів старшого віку [15]. Останніми роками переглянуто рекомендації з діагностики подагри. У 2015 р. презентовано спільні рекомендації Європейського альянсу асоціацій ревматологів (European Alliance of Associations for Rheumatology — EULAR) та Американського коледжу ревматології (American College of Rheumatology — ACR) (рис. 4) [27].
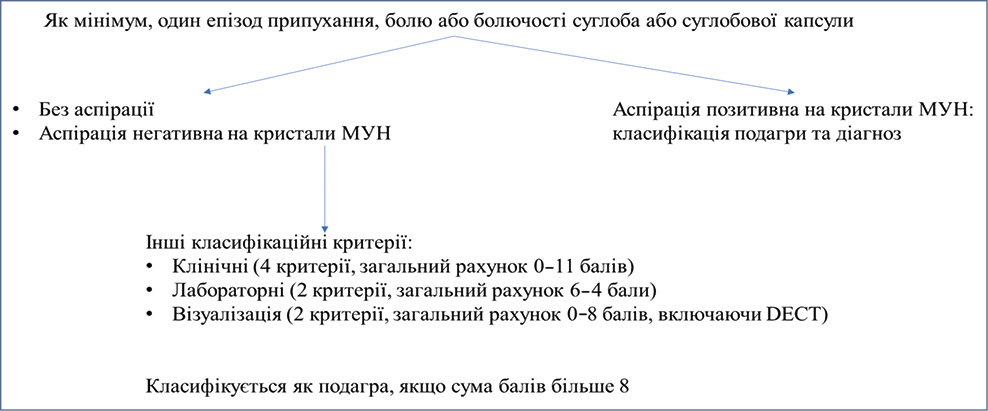
Аналіз синовіальної рідини (СР) залишається золотим стандартом діагностики подагри, оскільки наявність кристалів є достатнім класифікаційним критерієм. Інвазивна аспірація СР може бути проведена і при тофусній, і при асимптомній подагрі, однак для верифікації діагнозу необхідна поляризаційна мікроскопія, якість якої, своєю чергою, залежить від кваліфікації фахівця [2]. УЗД суглобів є важливим діагностичним методом у ранній період, оскільки у частини пацієнтів з гіперурикемією відмічають типові ультразвукові ознаки подагри («подвійний контур», симптом «хуртовини» у СР, гіперехогенні гетерогенні пошкодження, оточені анехогенними краями (тофуси)), які можуть виявлятися раніше, ніж хвороба маніфестує гострим нападом артриту (рис. 5).
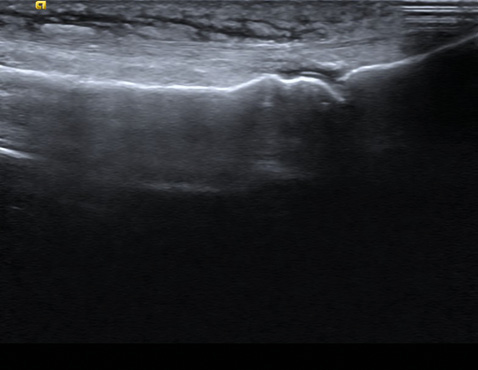
Для подагри характерні такі ультразвукові симптоми:
- СР: зміна СР від абсолютно неехогенної до сукупності агрегатів змінної ехогенності; агрегати мікрокристалів МУН можуть бути виявлені як гіперехогенні плями або ехопозитивні точкові фокуси;
- синовіальна проліферація і гіперваскуляризація: допплерівській режим дозволяє диференціювати наявність чи відсутність активного запалення синовіальної тканини шляхом оцінки її васкуляризації;
- ерозії кісток: визначаються при подагрі як інтра- та/або екстраартикулярна перерваність поверхні кістки у двох перпендикулярних площинах;
- симптом «подвійного контуру» або «уратна глазур», або «уратне обмерзання» («urate icing») над суглобовим хрящем є вельми специфічним симптомом для подагри;
- депозити МУН можна виявити у вигляді тофусів чи агрегатів. Тофус — це обмежена неоднорідна гіперехогенна та/або гіпоехогенна депозиція, яка генерує акустичну тінь і може бути оточена анехогенним обідком [28].
Терапевтичний менеджмент — немедикаментозна стратегія
Окрім призначення ліків, рекомендації щодо дієти та модифікації способу життя стали невід’ємною частиною поточних рекомендацій з лікування подагри. Незважаючи на дискусії, що тривають протягом багатьох років, безсимптомна гіперурикемія все ще не є показанням до терапії зниження СК з ревматологічної точки зору, оскільки на сьогодні немає доказів того, що користь від зниження рівня СК у цієї групи пацієнтів переважає потенційні ризики, пов’язані з певною фармакологічною терапією. Це підкреслює потенціал і важливість включення конкретних рекомендацій щодо дієти та способу життя для стимулювання та підтримки немедикаментозних стратегій зниження СК у постійно зростаючої популяції пацієнтів з гіперурикемією (через вік, ожиріння, достаток тощо). Додатковим, не менш важливим аспектом є можливий позитивний вплив корекції харчування на коморбідність [29]. У 2022 р. презентовані рекомендації щодо харчування та способу життя для пацієнтів із подагрою та гіперурикемією, включаючи найновішу відповідну літературу, яка служить навчальним матеріалом для пацієнтів та оновленою інформацією для лікарів [35].
Оновлені рекомендації Австрійського товариства ревматології та реабілітації щодо харчування та способу життя для пацієнтів із подагрою та гіперурикемією за 2022 р. передбачають, зокрема, наступне [35]:
- збільшення маси тіла та ожиріння можуть призвести до підвищення рівня СК та розвитку подагри. У разі ожиріння поступове зменшення маси тіла може допомогти знизити рівень СК і таким чином захистити від подагри;
- як подагра, так і гіперурикемія пов’язані з кардіометаболічними та нирковими супутніми захворюваннями. Таким чином, на додаток до контролю маси тіла та дієтичних заходів рекомендуються регулярні фізичні вправи / серцево-судинні тренування;
- здорова дієта, наприклад дієта підходів до зупинки гіпертензії (DASH), у поєднанні зі зменшенням маси тіла, якщо пацієнт має надмірну масу тіла, може позитивно вплинути на зниження захворюваності на подагру, підвищеного рівня СК та кардіометаболічного ризику;
- червоне м’ясо, субпродукти та ковбасні вироби можуть підвищувати рівень СК і тим самим зумовлювати зростання ризику подагри. З цієї причини червоне м’ясо та пов’язані з ним продукти слід їсти рідше і лише в невеликій кількості. Рекомендується споживання багатих на пурини овочів;
- морепродукти можуть підвищити рівень СК, а отже, ризик подагри, тому їх слід споживати помірно. Рибу рекомендується вживати регулярно як частину здорової дієти, а також для запобігання серцево-судинним захворюванням;
- вживання алкоголю підвищує ризик подагри залежно від дози. Особливо слід уникати пива та алкогольних напоїв, тоді як червоне вино має найменший потенціал для підвищення ризику подагри;
- солодкі безалкогольні напої, фруктові соки та продукти з високим вмістом фруктози можуть підвищити рівень СК, тому їх слід уникати. Свіжі фрукти та «легкі напої» без фруктози не підвищують ризику подагри;
- регулярне вживання молока / молочних продуктів може знизити рівень СК, тому рекомендується всім пацієнтам з подагрою;
- регулярне вживання кави може допомогти знизити рівень СК у поєднанні з правильною дієтою та ліками, тому його слід підтримувати;
- вишня (особливо сорт Монморансі) може знизити рівень СК, сприяючи виведенню сечі. Однак досі незрозуміло, в якій дозі різні продукти (сік, концентрат, екстракт) зумовлюють найбільш бажаний ефект.
Терапевтичний менеджмент — медикаментозна стратегія
Принцип цільового лікування «treat-to-target» передбачає наступне:
- рівень СК в сироватці крові повинен бути <360 мкмоль/л або навіть 300 мколь/л у пацієнтів із тяжкою подагрою з тофусами та/або частими нападами;
- тофуси повинні зменшуватися за кількістю та/або розміром;
- зменшення вираженості болю;
- відсутність загострень (нападів гострого артриту).
У рутинній клінічній практиці ревматологи керуються двома основними рекомендаціями ACR 2020 [10] та EULAR 2016 [34], які мають деякі відмінності за умов збереження основних принципів лікування подагри.
Однотипний підхід до ведення гострого нападу в усіх країнах світу включає ранній початок лікування до 12 год або «ліки в кишені» (колхіцин, НПЗП, ГК). Вважається, що чим раніше використовується цей етап, тим кращий результат отримають в подальшому [2]. Ризик повторного нападу подагри після першого нападу становить 62% через 1 рік, 78% через 2 роки і 93% через 10 років. У рекомендаціях ACR зазначено, що для усунення гострих та хронічних симптомів подагри УЗТ слід продовжувати нескінченно довго, якщо вона добре переноситься і не обтяжує. Вважається, що як тільки буде досягнуто розчинення наявних кристалів СК, може бути достатньо менш жорсткого контролю, щоб запобігти утворенню нових кристалів [10].
Не існує єдиної думки щодо термінів початку УЗТ. З одного боку, першому нападу подагри передують роки мовчазного осадження кристалів СК, а отже, доцільний старт УЗТ після першого гострого артриту. Також запропонована рання УЗТ у пацієнтів із супутніми захворюваннями, але необхідні подальші дослідження для надання підтверджувальних доказів. З іншого боку, деякі дослідники вважають, що для того, щоб у пацієнта з’явилися тофус та тяжка симптоматична подагра, потрібні роки рецидивуючих нападів [2].
Алопуринол рекомендований в якості терапії 1-ї лінії для зниження рівня СК з початковою дозою ≤100 мг/добу (≤50 мг/добу для пацієнтів із ХХН) з подальшим титруванням дози протягом тижнів / місяців до досягнення рівня сечової кислоти <360 мкмоль/л.
Як показала практика, найпоширеніша доза алопуринолу становить 300 мг/добу, але у 30–50% пацієнтів з нормальною функцією нирок вона не дозволяє досягти цільового рівня СК, що зумовлює необхідність подальшого підвищення дози з метою досягнення мети. Лікування алопуринолом в дозі 600–800 мг/добу дозволяє досягти цільової концентрації СК у 75–80% випадків [36].
Фебуксостат, непуриновий селективний інгібітор ксантиноксидази, є потенційною альтернативою алопуринолу у пацієнтів із подагрою. Фебуксостат вводиться перорально і метаболізується переважно в печінці. У терапевтичних концентраціях фебуксостат (добова доза 80 та 120 мг) не пригнічує інших ферментів, що беруть участь у метаболізмі пуринів або піримідинів. Застосування фебуксостату (80 або 120 мг) зумовлює більш ефективне зниження концентрації СК і підтримку її рівня в сироватці крові порівняно з алопуринолом в стандартній добовій дозі 300 мг [21].
Препарат метаболізується в печінці, при цьому нирки не є основним шляхом виведення, що дозволяє використовувати його для лікування пацієнтів з легкою або помірною ХХН. Настійно рекомендується починати лікування низькими дозами фебуксостату (≤40 мг/добу у пацієнтів з ХХН ≥3) з подальшим титруванням дози. Поетапне введення фебуксостату — 10 мг/добу протягом 4 тиж, потім 20 мг/добу протягом 4 тиж, потім 40 мг/добу — виявило зменшення нападів подагри у рандомізованому відкритому порівняльному дослідженні [37]. Хоча загострення все ще виникали, їх частота була нижчою навіть за відсутності отримання колхіцину, тому такий підхід також може бути корисним для осіб зі значними протипоказаннями до застосування колхіцину або НПЗП.
Останнє дослідження FAST щодо порівняння ефективності і безпеки алопуринолу та фебуксостату мало на меті оцінити серцево-судинну безпеку у понад 6000 осіб європеоїдної раси з подагрою. Пацієнти отримували 6-річну терапію алопуринолом, причому за наявності ≥1 фактора ризику серцево-судинних захворювань (ССЗ) та/або тяжкої СН пацієнти не залучалися у дослідження. Первинним результатом була комбінована госпіталізація з приводу нелетального ІМ або біомаркерпозитивного гострого коронарного синдрому, нефатального інсульту або смерті від ССЗ. Лише у 33% пацієнтів встановлено ССЗ. Більшість пацієнтів, які приймали фебуксостат, отримували колхіцин. Встановлено, що фебуксостат не поступався алопуринолу щодо первинного результату (тобто мети лікування), і його тривале застосування не асоціювалося з підвищеним ризиком смерті. Випробування FAST може забезпечити більш високий рівень комфорту для ревматологів, які застосовують фебуксостат. Однак лише третина пацієнтів у дослідженні FAST мали ССЗ, тоді як усі пацієнти, включені у дослідження CARES, мали серцево-судинну хворобу. Встановлено, що фебуксостат у дозах 80–120 мг/добу не поступався алопуринолу у дозі 100–900 мг/добу щодо його впливу на несприятливі серцево-судинні події. Автори цього дослідження дійшли висновку, що нормативні рекомендації щодо уникнення застосування фебуксостату у пацієнтів із ССЗ повинні бути переглянуті та змінені! [24].
У систематичному огляді економічних оцінок алопуринолу і фебуксостату (Cochrane CENTRAL, Web of Science, PubMed, Embase та реєстр аналізу економічної ефективності, всього 94 дослідження) констатується, що за всіх послідовностей лікування, які використовували рівень СК як маркер, фебуксостат є більш економічним, ніж алопуринол. Крім того, у дослідженнях, які мають якість життя як показник ефективності, фебуксостат виявився економічно ефективним як лікування 2-ї лінії [31].
Відомо, що основною перешкодою для ефективної терапії подагри, що спричиняє повторний подагричний артрит й утворення тофусу, є погана прихильність [17]. У багатьох дослідженнях продемонстровано, що дотримання УЗТ при подагрі є надзвичайно низьким (рис. 6).
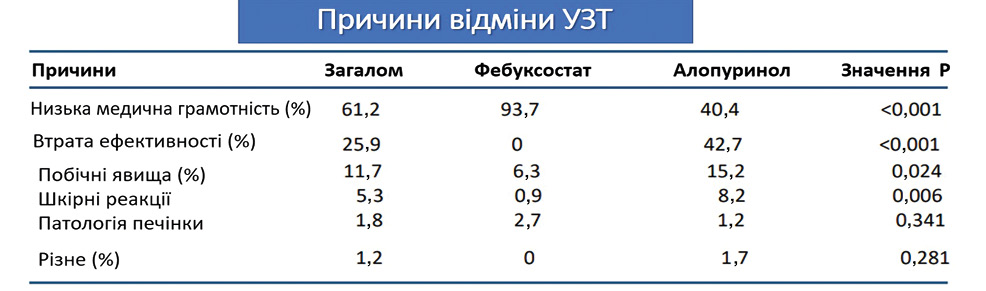
Прихильність до призначеної терапії є важливою для лікування хронічних захворювань, включаючи подагру, оскільки очевидно, що довгострокова ефективність терапії суттєво скомпрометована недотриманням її пацієнтами [6]. Для подагри досягнення оптимальної терапевтичної цілі потребує узгоджених зусиль для підвищення прихильності до УЗТ. Проте більшість досліджень з цього приводу повідомляють про дуже низькі показники прихильності. Забезпечення ефективної терапії додатково обмежується тим, що лише ~50% пацієнтів із подагрою або отримують консультацію з приводу подагри, або проходять лікування [21].
Отже, існує значний інтерес до оптимізації лікування подагри на рівні пацієнта, закладів охорони здоров’я та національному рівні. Одним із ключових заходів є активна пропаганда кращого дотримання УЗТ.
Висновки
Високий рівень СК — поширений в загальній популяції і є ключовим у розвитку подагри.
Подагра — це генетичне захворювання, на яке впливають зовнішні фактори (наприклад ожиріння).
Підвищення рівня СК асоційоване з оксидативним стресом, ендотеліальною дисфункцією та проліферацією гладком’язових клітин судин in vitro та моделях на тваринах.
Мета лікування подагри: полегшити біль, скоротити тривалість запалення під час гострого нападу, запобігти наступним нападам і пошкодженню суглобів.
УЗТ зменшує вираженість запалення, викликане кристалами СК в уражених суглобах, тим самим зменшуючи вираженість болю, набряку і запалення.
Для ефективного менеджменту подагри необхідно моніторувати рівень СК та прихильність до лікування, і якщо мети не досягнуто — переглянути терапію. Фебуксостат і алопуринол чинять подібний кардіоваскулярний вплив. Фебуксостат — більш ефективний, ніж алопуринол для контролю рівня урикемії.
При узгодженні плану лікування дуже важлива відповідальність пацієнтів, оскільки хворі повинні знати свій показник СК і приймати УЗТ пожиттєво.
Список використаної літератури
- 1. Коваленко В.М., Корнацький В.М. (2019) Стан здоров’я народу України та медичної допомоги третинного рівня. Аналітично-статистичний посібник. 221 с.
- 2. Подагра (2022) Монографія. Коваленко В.М., Головач І.Ю., Кушніренко С.В., Рекалов Д. Г., Сміян С.І. 72 с.
- 3. Asghari K.M., Zahmatyar M., Seyedi F. et al. (2024) Gout: global epidemiology, risk factors, comorbidities and complications: a narrative review. BMC Musculoskelet Disord. Dec 19; 25(1): 1047. doi: 10.1186/s12891-024-08180-9. PMID: 39702222; PMCID: PMC11660718.
- 4. Salem C.B., Slim R., Fathallah N. (2017) Drug-induced hyperuricaemia and gout. Rheumatology, Volume 56, Issue 5: 679–688. doi.org/10.1093/rheumatology/kew293.
- 5. Bardin T., Nguyen Q.D., Tran K.M. (2021) A cross-sectional study of 502 patients found a diffuse hyperechoic kidney medulla pattern in patients with severe gout. Kidney Int. Jan; 99(1): 218–226. doi: 10.1016/j.kint.2020.08.024. Epub 2020 Sep 6. PMID: 32898570.
- 6. Briesacher B.A., Andrade S.E., Fouayzi H., Chan K.A. (2008) Comparison of drug adherence rates among patients with seven different medical conditions. Pharmacotherapy; 28(4): 437–443. doi: 10.1592/phco.28.4.437.
- 7. Brook R., Forsythe A., Smeeding J., Edwards N. (2010). Chronic gout: Epidemiology, disease progression, treatment and disease burden. Current medical research and opinion. 26: 2813–21. 10.1185/03007995.2010.533647.
- 8. Challener G., Sheng-kaima k., McCormick N.(2024) Risk of Mortality and Major Cardiovascular-Kidney Outcomes in Patients with Tophaceous versus Non-Tophaceous Gout [abstract]. Arthritis Rheumatol.; 76 (Suppl. 9).
- 9. Dalbeth N., Stamp L.K., Merriman T.R. (2017) The genetics of gout: towards personalised medicine? BMC Med., 15: 108. doi.org/10.1186/s12916-017-0878-5.
- 10. FitzGerald J.D. et al. (2020) American College of Rheumatology guideline for the management of gout. Arthritis Care Res. (Hoboken). Jun; 72 (6): 744–760.
- 11. GBD 2021 Gout Collaborators (2024) Global, regional, and national burden of gout, 1990-2020, and projections to 2050: a systematic analysis of the Global Burden of Disease Study 2021. Lancet Rheumatol. Aug; 6(8): e507–e517. doi: 10.1016/S2665-9913(24)00117-6.
- 12. Gibson T., Waterworth R., Hatfield P.R. (1984) Hyperuricaemia, gout and kidney function in New Zealand Maori men. Br. J. Rheumatol. Nov; 23(4): 276–82. doi: 10.1093/rheumatology/23.4.276. PMID: 6487933.
- 13. Gibson T. (2012) Hyperuricemia, gout and the kidney. Curr. Opin. Rheumatol. Mar; 24(2): 127–31. doi: 10.1097/BOR.0b013e32834f049f. PMID: 22157498.
- 14. Ichida K., Matsuo H., Takada T. et al. (2012) Decreased extra-renal urate excretion is a common cause of hyperuricemia. Nat. Commun. Apr 3; 3: 764. doi: 10.1038/ncomms1756. PMID: 22473008; PMCID: PMC3337984.
- 15. Janssens H.J., Fransen J., van de Lisdonk E.H. et al. (2010) Diagnostic rule for acute gouty arthritis in primary care without joint fluid analysis. Arch. Intern. Med. Jul 12; 170(13): 1120–6. doi: 10.1001/archinternmed.2010.196. PMID: 20625017.
- 16. Kalousdian S., Fabsitz R., Havlik R. et al. (1987) Heritability of clinical chemistries in an older twin cohort: the NHLBI Twin Study. Genet. Epidemiol.; 4(1): 1–11.
- 17. Kim A., Kim Y., Kim G.T. et al. (2020) Comparison of persistence rates between allopurinol and febuxostat as first-line urate-lowering therapy in patients with gout: an 8-year retrospective cohort study. Clin Rheumatol. Dec; 39(12): 3769–3776. doi: 10.1007/s10067-020-05161-w. Epub 2020 May 26. PMID: 32458236.
- 18. Kottgen A., Albrecht E., Teumer A. et al. (2013) Genome-wide association analyses identify 18 new loci associated with serum urate concentrations. Nat. Genet.; 45(2): 145–54.
- 19. Krishnan E., Baker J.F., Furst D.E., Schumacher H.R. (2006) Gout and the risk of acute myocardial infarction. Arthritis Rheum. Aug; 54(8): 2688–96. doi: 10.1002/art.22014. PMID: 16871533.
- 20. Krishnan E., Lingala B., Bhalla V. (2012) Low-level lead exposure and the prevalence of gout: an observational study. Ann. Intern. Med. Aug 21; 157(4): 233–41.
- 21. Kuo C.F., Grainge M.J., Zhang W., Doherty M. (2015) Global epidemiology of gout: prevalence, incidence and risk factors. Nat. Rev. Rheumatol. Nov; 11(11): 649–62.
- 22. Lautour H., Dalbeth N., Taylor W. (2015). Outcome Measures for Gout Clinical Trials: a Summary of Progress. Current Treatment Options in Rheumatology, 1: 10. 1007/s40674-015-0014-7.
- 23. Major T.J., Dalbeth N., Stahl E.A. (2018) An update on the genetics of hyperuricaemia and gout. Nat. Rev. Rheumatol. Jun; 14(6): 341–353. doi: 10.1038/s41584-018-0004-x. PMID: 29740155.
- 24. Mackenzie I.S., Ford I., Nuki G. et al. (2020) FAST Study Group. Long-term cardiovascular safety of febuxostat compared with allopurinol in patients with gout (FAST): a multicentre, prospective, randomised, open-label, non-inferiority trial. Lancet. Nov 28; 396(10264): 1745–1757. doi: 10.1016/S0140-6736(20)32234-0. Epub 2020 Nov 9. PMID: 33181081.
- 25. Marson P., Pasero G. (2012) Some historical remarks on microcrystalline arthritis (gout and chondrocalcinosis). Reumatismo. Jan 19; 63(4): 199–206. doi: 10.4081/reumatismo.2011.199. PMID: 22303526.
- 26. Matsuo H., Chiba T., Nagamori S. et al. (2008) Mutations in glucose transporter 9 gene SLC2A9 cause renal hypouricemia. Am. J. Hum. Genet.; 83: 744–51.
- 27. Neogi T., Jansen T.L., Dalbeth N. et al. (2015) 2015 Gout classification criteria: an American College of Rheumatology/European League Against Rheumatism collaborative initiative. Ann. Rheum. Dis.; 74(10): 1789–98. doi: 10.1136/annrheumdis-2015-208237.
- 28. Ottaviani S., Bardin T., Richette P. (2012) Usefulness of ultrasonography for gout. Joint Bone Spine; 79(5): 441–5. doi: 10.1016/j.jbspin.2012.01.012.
- 29. Pascual E., Sivera F. (2007) Why is gout so poorly managed? Ann. Rheum. Dis. Oct; 66(10): 1269–70. doi: 10.1136/ard.2007.078469. PMID: 17881662; PMCID: PMC1994299.
- 30. Pineda C., Amezcua-Guerra L.M., Solano C. et al. (2011) Joint and tendon subclinical involvement suggestive of gouty arthritis in asymptomatic hyperuricemia: an ultrasound controlled study. Arthritis Res. Ther. Jan 17; 13(1): R4. doi: 10.1186/ar3223. PMID: 21241475. PMCID: PMC3241349.
- 31. Rezapour A., Alidoost S., Asgharzadeh A. et al. (2020) Cost-effectiveness of allopurinol versus febuxostat in the treatment of gout patients: A systematic review. Med. J. Islam. Repub. Iran; 34: 41. Published 2020 Apr 30. doi:10.34171/mjiri.34.41
- 32. Richette P., Bardin T. (2010) Gout. Lancet. Jan 23; 375(9711): 318–28. doi: 10.1016/S0140-6736(09)60883-7. Epub 2009 Aug 17. PMID: 19692116.
- 33. Richette P., Perez-Ruiz F., Doherty M. et al. (2014) Improving cardiovascular and renal outcomes in gout: what should we target? Nat. Rev. Rheumatol. Nov; 10(11): 654–61.
- 34. Richette P., Doherty M., Pascual E. et al. (2017) 2016 updated EULAR evidence-based recommendations for the management of gout. Ann. Rheum. Dis.; 76(1): 29–42. doi: 10.1136/annrheumdis-2016-209707.
- 35. Sautner J., Eichbauer-Sturm G., Gruber J. et al. (2022) 2022 update of the Austrian Society of Rheumatology and Rehabilitation nutrition and lifestyle recommendations for patients with gout and hyperuricemia. Wien Klin. Wochenschr. Jul; 134(13–14): 546–554. doi: 10.1007/s00508-022-02054-7.
- 36. Seth R., Kydd A.S., Buchbinder R. et al. (2014) Allopurinol for chronic gout. Cochrane Database Syst. Rev. Oct 14; 2014(10): CD006077. doi: 10.1002/14651858.CD006077.pub3. PMID: 25314636; PMCID: PMC8915170.
- 37. Yamanaka et al. (2018) Stepwise dose increase of febuxostat is comparable with colchicine prophylaxis for the prevention of gout flares during the initial phase of urate-lowering therapy: results from FORTUNE-1, a prospective, multicentre randomised study. Ann. Rheum. Dis.; 77(2): 270–276 (ISSN: 1468-2060).
- 38. Yang Q., Kottgen A., Dehghan A. et al. (2010) Multiple genetic loci influence serum urate levels and their relationship with gout and cardiovascular disease risk factors. Circ. Cardiovasc. Genet.; 3(6): 523–30.
- 39. Watts R.A. et al. (eds), Oxford Textbook of Rheumatology, 4 edn, Oxford Textbook (Oxford, 2013; online edn, Oxford Academic, 1 Oct. 2013), doi.org/10.1093/med/9780199642489.001.0001.
Відомості про авторів
Рекалов Дмитро Геннадійович — доктор медичних наук, професор, провідний науковий співробітник Державної установи «Національний науковий центр «Інститут кардіології імені академіка М.Д. Стражеска» Національної академії медичних наук України, Київ.
E-mail: dmitryrekalov@gmail.com
ORCID: 0000-0002-5793-2322
Борткевич Олег Петрович — доктор медичних наук, професор, головний науковий співробітник Державної установи «Національний науковий центр «Інститут кардіології імені академіка М.Д. Стражеска» Національної академії медичних наук України, Київ.
ORCID: 0009-0000-0620-626X
Данюк Інна Олександрівна — кандидат медичних наук, асистент кафедри внутрішніх хвороб № 3, Запорізький державний медико-фармацевтичний університет, Запоріжжя.
E-mail: daniuk.inna.alex@gmail.com
ORCID: 0000-0002-4596-5709
Чорна Інна Володимирівна — кандидатка медичних наук, доцентка кафедри внутрішніх хвороб № 3, Запорізький державний медико-фармацевтичний університет, Запоріжжя.
E-mail: lada.zsmu@gmail.com
ORCID: 0000-0002-6205-7032
Надійшла до редакції/Received: 8.05.2025
Прийнято до друку/Accepted: 17.06.2025

Leave a comment