КЛІНІКО-ПАТОГЕНЕТИЧНЕ ЗНАЧЕННЯ ЗМІН ВЕНТИЛЯЦІЙНОЇ, ВОЛОГОВИДІЛЬНОЇ, СУРФАКТАНТНОЇ ТА ДИФУЗІЙНОЇ ЗДАТНОСТІ ЛЕГЕНЬ У ХВОРИХ НА СИСТЕМНУ СКЛЕРОДЕРМІЮ
Синяченко О.В., Юр’єва А.В., Мільнер І.А. , Совпель І.В.
Резюме. На підставі клініко-інструментального обстеження (спірографія, ехокардіографія, бодипневмографія, міжфазна тензіореографія експіратів) 57 жінок віком від 18 до 67 років із системною склеродермією, оцінки стану вентиляційної (дихальні об’єми, параметри бронхопрохідності, внутрішньолегеневої гемодинаміки), кондиціонуючої (швидкість і об’єм респіраторного вологовиділення), сурфактантсинтетичної (поверхневий натяг, в’язкоеластичність, релаксація експіратів) та дифузійної здатності легень підвищено якість діагностики склеродермічної пневмопатії, розроблено критерії, що дозволяють прогнозувати перебіг патологічного процесу.
Вступ
Одним із найчастіших вісцеральних проявів системної склеродермії (ССД) вважається пневмопатія, яка нерідко є першою маніфестною ознакою патологічного процесу (van der Kamp R. et al., 2007) і значно погіршує якість життя пацієнтів (Baron M. et al., 2008; Chow S. et al., 2008). За даними клінічних досліджень, бронхолегенева система вражається у 70–90% кількості хворих на ССД (Gohari Moghadam К. et al., 2011), а зміни з боку легень на розтині виявляють у всіх випадках (Chung L. et al., 2007; Nagai В. et al, 2007). 5-річна виживаність при ССД становить 95%, а 8-річна — 77%, причому в 60% випадків смерть розвивається внаслідок прогресуючої дихальної недостатності, зумовленою саме склеродермічною пневмопатією (Vettori S. et al., 2010).
Основними проявами ураження легень при ССД вважаються базальний пневмофіброз (Marasini B. et al., 2007; Ostojic P. et al., 2007; De Lauretis А. et al., 2011), інтерстиціальний пневмоніт (Khanna D. et al., 2010; Mouthon L. et al., 2010; Swartz J.S. et al., 2010), фіброзуючий альвеоліт (Renzoni E.A. et al., 2007; Goh N.S. et al., 2008) та ізольована легенева гіпертензія (Agard C. et al., 2009; Condliffe R. et al., 2009; Ciurzyzski M. et al., 2011). За останні роки у хворих на ССД виявляються зміни сурфактантутворюючої здатності легень (Hant F.N. et al., 2009; Parra E.R. et al., 2009; Shirahama R. et al., 2010), щільно пов’язаної з альвеолярно-капілярною (дифузійною) здатністю легень (ДЗЛ) (Wanchu А. et al., 2009; Celebi Z. et al., 2010; Gohari Moghadam К. et al., 2011).
Патогенез склеродермічної пневмопатії залишається недостатньо вивченим (Homer R.J., Herzog E.L., 2010). Можна припустити, що уточнення характеру порушень функції легень при різних варіантах перебігу захворювання сприятиме визначенню нових ланок патогенезу ССД, розробці методів ранньої діагностиці склеродермічної пневмопатії. Мета проведеної роботи — оцінка клініко-патогенетичної значущості порушень вентиляційної, вологовидільної, сурфактантної та ДЗЛ у хворих на ССД.
Об’єкт і методи дослідження
Під спостереженням перебували 57 жінок віком від 18 до 67 років (в середньому — 41±1,7 року) із ССД. Тривалість захворювання становила 10±0,9 року. I ступінь активності патологічного процесу встановлено у 39% обстежених, II — у 31%, III — у 30%. Синдром Рейно діагностовано у 86% випадків, ураження суглобів (артрит, артралгія, контрактура, фіброзний анкілоз) — у 90%, шкіри (набряк, індурація, атрофія, диспігментація) — у 81%, скелетних м’язів (міозит, міалгія, атрофія, цибулиноподібні пальці) — у 44%, серця (міокардіодистрофія, міокардіосклероз, міокардит, ураження клапанного апарату) — у 83%, стравоходу (дилатація, гіпомобільність, рефлюкс-езофагіт) — у 61%, печінки (гепатит, гепатодистрофія) — у 25%, нирок (хронічний гломерулонефрит, інтерстиціальний нефрит) — у 35%, центральної нервової системи (дисциркуляторна енцефалопатія, кортиконуклеарний, псевдобульбарний, пірамідний синдроми) — у 23%, периферичної нервової системи (моно- й полінейропатія, радикулопатія) — у 37%, легень — у 61%, серед яких інтерстиціальний пневмоніт — у 25%, фіброзуючий альвеоліт — у 5%, базальний пневмофіброз — у 26%, ізольована легенева гіпертензія — у 9%. Хворі з пневмопатією становили основну групу, а решта — контрольну.
Рентгенологічне дослідження виконували на апараті «Multix-Compact-Siеmens» (Німеччина), ультразвукове — на «Envisor-Philips» (Нідерланди), електрокардіографічне — на «МІДАК-ЕК1Т (Україна) і «Fukuda Denshi» Cardimax-FX326 (Японія), трансторакальну та черезстравохідну ехокардіографію — на «Acuson-Aspen-Siemens» (Німеччина) і «SSA-270A-Toshiba» (Японія), спірографічне — на «Master-Scope-Jaeger» (Німеччина), бодипульмонологічне — на «Master-Screen-Body-Jaeger» (Німеччина). У частини обстежених хворих проведено комп’ютерну («Somazom-Emotion-6 Siemens», Німеччина) і магнітно-резонансну («Gygoscan-Intera-Philips», Нідерланди) томографію легень.
Конденсат вологи повітря, що видихується (КВП), збирали вранці за допомогою скляних приймачів, занурених у танучий лід. Після полоскання рота дистильованою водою хворі в положенні сидячи спокійно дихали через рот протягом 20 хв. Визначали швидкість вологовиділення (ШВВ) за годину і з перерахунком на хвилинний обсяг дихання — об’єм вологовиділення (ОВВ) у літрі повітря. Задля оцінки фізико-хімічних параметрів адсорбційно-реологічних властивостей експіратів, що відображають сурфактантсинтетичну здатність легень, визначали їх рН, статичний (рівноважний) поверхневий натяг (ПН), модуль в’язкоеластичності (ВЕ) і час релаксації (ЧР). Використовували метод аналізу форми вісесиметричних крапель (комп’ютерний тензіореометр «ADSA-Toronto», Німеччина — Канада). Застосовували швидку стресову деформацію розширення поверхні (при t=12 000 ˚С) з визначенням ВЕ. Після розширення краплі ПН поволі релаксував, тобто повертався до свого початкового значення, а ЧР характеризував здатність моношару відновлювати вихідний стан. Як контроль обстежено 20 практично здорових жінок віком від 17 до 62 років.
Статистичну обробку отриманих результатів досліджень здійснено на комп’ютері за допомогою варіаційного, кореляційного, регресійного, одно- (ANOVA) і багатофакторного (ANOVA/MANOVA) дисперсійного аналізу (пакети ліцензійних програм «Microsoft Excel» і «Statistica-Stat-Soft», США). Оцінювали середні значення (M), їхні похибки, середньоквадратичні відхилення (s), коефіцієнти кореляції, критерії регресії, дисперсії, Стьюдента (t), Вілкоксона — Рао, хі-квадрат Макнемара — Фішера та вірогідність статистичних показників (р).
Результати дослідження
Результати вентиляційної, вологовидільної, сурфактантної та ДЗЛ у хворих на ССД наведено в таблиці. Зміни спірограм встановлено у 44% хворих, причому за рестриктивним типом у всіх випадках, а за змішаним — у 24%. Характер пневмопатії достовірно впливає на інтегральні параметри гемодинаміки в малому колі кровообігу і не діє на стан функції зовнішнього дихання. Ізольована легенева гіпертензія чинить вплив на показники бронхопрохідності, а саме на форсовану життєву ємність легень (ФЖЄЛ), фіброзуючий альвеоліт — на тиск у легеневій артерії (Тла).
Рівень Тла >25 мм рт. ст. виявлено у 26% загальної кількості хворих і у 43% — від кількості осіб з пневмопатією. При цьому встановлено високодостовірний прямий кореляційний зв’язок між параметрами Тла і легеневого судинного опору (ЛСО). У всіх хворих із фіброзуючим альвеолітом виявлено рестриктивні зміни спірограм, а у разі ізольованої легеневої артеріальної гіпертензії параметри функції зовнішнього дихання не змінюються. Обструктивний характер порушень вентиляційної функції легень констатовано у 7% хворих із інтерстиціальним пневмонітом і у 27% — з базальним пневмофіброзом. Достовірно відрізняються між собою групи з базальним пневмофіброзом і без такого за параметрами ФЖЄЛ, об’ємом форсованого видиху (ОФВ) за першу секунду, Тла, ЛСО.
| Показник | Група хворих | Відмінності | ||
|---|---|---|---|---|
| основна (n=35) | контрольна (n=22) | t | p | |
| Резерв вдиху, л
Резерв видиху, л ФЖЄЛ, л ОФВ, л ОФВ/ЖЄЛ,% Тла, мм рт. ст. ЛСО, дин · с · см Правий шлуночок серця, см ШВВ, мл/год ОВВ, мл/л рН ПН, мН/м ВЕ, мН/м ЧР, с ДЗЛ, ммоль/хв/ммHg |
1,5±0,10
0,6±0,05 2,4±0,11 2,2±0,10 85,3±1,76 27,5±2,20 259,5±27,87 2,6±0,04 15,1±1,00 2,6±0,20 7,21±0,026 52,8±1,96 17,3±1,40 307,3±46,69 7,5±0,22 |
2,0±0,12
0,8±0,08 3,1±0,10 2,8±0,08 88,5±1,61 15,4±0,24 147,9±2,18 2,2±0,06 19,6±0,76 2,9±0,14 7,37±0,018 50,3±1,86 21,3±1,55 319,8±55,28 9,4±0,45 |
3,19
1,74 4,59 4,36 1,26 4,33 3,16 6,28 3,19 1,23 4,35 0,87 1,85 0,17 4,18 |
0,002
0,088 <0,001 <0,001 0,213 <0,001 0,003 <0,001 0,002 0,223 <0,001 0,390 0,069 0,866 <0,001 |
Розвиток склеродермічної пневмопатії супроводжується достовірним зменшенням ШВВ і збільшенням ОВВ (M±s здорових) у 49 і 31% числа обстежених пацієнток. У хворих на ССД основної групи істотно зменшується рН експіратів, при цьому закиснення КВП на фоні склеродермічної пневмопатії не супроводжується змінами ПН, ВЕ і ЧР. Розвиток патології легень виявляється зменшенням (<M–s хворих контрольної групи) рН і ВЕ експіратів відповідно у 46 і 37% числа обстежених хворих на фоні підвищення ПН КВП у 40% спостережень. Зменшення параметрів ДЗЛ констатовано у 79% обстежених пацієнток, тобто достовірно на 18% частіше, аніж склеродермічну пневмопатію виявлено у процесі інших методів дослідження.
Обговорення результатів дослідження
На тяжкість легеневої патології при ССД достовірно впливає вік пацієнтів, але не тривалість захворювання і ступінь активності патологічного процесу. У свою чергу, за даними багатофакторного дисперсійного аналізу, активність ССД впливає на характер склеродермічної пневмопатії, зокрема, про що свідчить однофакторний аналіз, на розвиток інтерстиціального пневмоніту і фіброзуючого альвеоліту. На характер легеневої патології у хворих на ССД достовірно впливає ураження серця, печінки й нирок. Однофакторний дисперсійний і регресійний аналіз указують на прямий зв’язок тяжкості пневмопатії зі змінами центральної нервової системи. Має місце також вплив вираженості кардіопатії та нефропатії. Серед ознак ураження серця зазначене стосується порушень електричної провідності, розмірів його камер і діастолічної функції лівого шлуночка. З урахуванням наведених даних можна вважати, що склеродермічне ураження серця і центральної нервової системи належать до несприятливих ознак перебігу легеневої патології.
Вираженість змін з боку серця та нирок обернено корелює з показниками ФЖЄЛ та ОФВ, ураження стравоходу прямо співвідноситься із Тла, кардіопатії та енцефалопатії — з розмірами правого шлуночка. Розвиток фіброзуючого альвеоліту та ізольованої легеневої гіпертензії мало залежать від тяжкості екстрапульмональних проявів ССД. У свою чергу, на формування інтерстиціального пневмоніту здійснюють достовірний вплив вираженість уражень шкіри, серця і нирок, а на появу фіброзуючого альвеоліту — тяжкість змін скелетних м’язів, стравоходу і центральної нервової системи. Наявність у хворих інтерстиціального пневмоніту погіршує перебіг склеродермічної кардіопатії, гепатопатії та нефропатії, про що свідчить ANOVA, а тяжкість печінкової патології залежить від появи фіброзуючого альвеоліту.
За даними ANOVA/MANOVA на інтегральний стан функції зовнішнього дихання і гемодинаміки в малому колі кровообігу впливають інтерстиціальний пневмоніт і фіброзуючий альвеоліт, але не базальний пневмофіброз та ізольована (первинна) легенева артеріальна гіпертензія. Однофакторний дисперсійний аналіз демонструє вплив розвитку фіброзуючого альвеоліту на параметри ОФВ, Тла, ЛСО та співвідношення ЛСО і периферичного судинного опору. Артеріальний легеневий тиск також тісно пов’язаний із наявністю базального пневмофіброзу.
За даними регресійного аналізу показники кондиціонуючої функції легень достовірно різноспрямовано залежать від ступеня активності патологічного процесу. Характер пневмопатії не надає впливу на інтегральні параметри респіраторного вологовиділення, але вони залежать від тяжкості ураження легень: як його швидкість, так і об’єм. Показники ШВВ <10 мл/год і ОВВ <2 мл/л у хворих на ССД є прогнознегативними щодо перебігу легеневої патології. Однофакторний дисперсійний аналіз свідчить про вплив на ШВВ у хворих тяжкості ураження скелетних м’язів і серця. Не встановлено зв’язків ОВВ з вираженістю екстрапульмональних проявів захворювання.
Розвиток інтерстиціального пневмоніту, фіброзуючого альвеоліту й ізольованої легеневої гіпертензії не зумовлює достовірного впливу на параметри ШВВ і ОВВ, тоді як формування базального пневмосклерозу за даними однофакторного дисперсійного аналізу визначає об’єм експіратів. Середні значення ШВВ і ОВВ у хворих з наявністю або відсутністю різних проявів пульмональної патології мало відрізняються між собою.
За даними регресійного аналізу ШВВ і ОВВ у хворих на ССД залежать від тяжкості легеневої патології. Вплив вираженості пневмопатії на ШВВ демонструє і дисперсійний аналіз. На ШВВ та ОВВ високодостовірно впливають рестриктивні та обструктивні порушення вентиляційної функції легень. Розвиток таких змін функції зовнішнього дихання у хворих на ССД відповідно супроводжується зменшенням ШВВ на 30 і 37%, а також пригніченням ОВВ на 20 і 32% (результати достовірні). ШВВ при ССД прямо корелює з параметрами резерву видиху, а обернено співвідноситься з Тла, ЛСО і розмірами правого шлуночка серця. Із Тла і ЛСО мають місце негативні кореляційні зв’язки і ОВВ. Саме підвищення тиску в малому колі кровообігу визначає зменшення респіраторного вологовиділення у цієї категорії хворих. За наслідками дисперсійного аналізу на ШВВ і ОВВ при ССД впливають ФЖЄЛ, ОФВ, Тла, ЛСО.
Релаксаційні властивості експіратів при ССД обернено залежать від тривалості захворювання, а прямо пов’язані зі ступенем активності патологічного процесу. За даними регресійного аналізу відповідно до зростання активності ССД зменшуються в’язкоеластичні характеристики КВП. Виявлено достовірну дію на інтегральний фізико-хімічний стан експіратів вираженості змін з боку серця, які багато в чому визначають параметри ПН, ВЕ і ЧР. Необхідно відзначити, що кислотність КВП тісно пов’язана з наявністю у хворих печінкової патології. На інтегральний фізико-хімічний стан експіратів впливають загальна тяжкість склеродермічної пневмопатії та розвиток фіброзуючого альвеоліту, але не інтерстиціального пневмоніту, базального пневмофіброзу й ізольованої легеневої гіпертензії. Відзначимо, що перебіг фіброзуючого альвеоліту відбувається з найнижчими значеннями рН КВП. З вираженістю легеневої патології у хворих на ССД достовірно пов’язані всі адсорбційно-реологічні показники експіратів: рН, ПН, ВЕ, ЧР. Базальний пневмофіброз достовірно діє на ступінь кислотності експіратів. Показники рН <7,25 свідчать про наявність при ССД базального пневмофіброзу.
Інтегральний фізико-хімічний стан КВП, що відображає синтез легеневого сурфактанту, за даними багатофакторного дисперсійного аналізу залежить від наявності у хворих рестриктивних та обструктивних порушень вентиляційної функції легенів. Однофакторний дисперсійний аналіз демонструє вплив як рестриктивних, так і обструктивних змін на всі параметри міжфазної тензіореометрії, зокрема на ПН, ВЕ, ЧР.
При ССД показники функції зовнішнього дихання і гемодинаміки в малому колі кровообігу мало впливають на кислотність й релаксаційні властивості експіратів, тоді як міжфазна активність щільно пов’язана з легеневими об’ємами, а візкознопружні — зі станом бронхопрохідності. На ПН впливають показники резервів вдиху й видиху, на ВЕ — ФЖЄЛ і ОФВ. рН КВП прямо корелює зі значеннями ФЖЄЛ і ОФВ, а обернено співвідносяться зі Тла і ЛСО, ПН експіратів негативно корелює з резервом вдиху, ФЖЄЛ і ОФВ, а ВЕ має позитивні кореляційні зв’язки з ФЖЄЛ і ОФВ.
ШВВ і ОВВ достовірно прямо корелюють із рН експіратів, а ОВВ, окрім того, із релаксійною здатністю КВП. Тяжкість склеродермічної пневмопатії зумовлює дію на інтегральний фізико-хімічний стан експіратів, впливаючи на ПН, ВЕ і ЧР. Прогнознегативними показниками стосовно патології легень у хворих на ССД можуть бути значення ПН >60 мН/м, ВЕ <10 мН/м і ЧР <150 с. Регресійний аналіз демонструє пряму залежність ШВВ від кислотності експіратів. Як свідчить дисперсійний аналіз, на ШВВ впливають рН, ВЕ та ЧР КВП.
За даними однофакторного дисперсійного аналізу на стан ДЗЛ впливають ступінь активності захворювання і тяжкість ураження скелетних м’язів. Регресійний аналіз демонструє обернену залежність параметрів альвеолярно-капілярної дифузії від активності патологічного процесу. Значення стану альвеолярної дифузії щільно пов’язані з вираженістю склеродермічної пневмопатії, про що свідчать дисперсійний і регресійний аналіз. У цілому без легеневої патології параметри ДЗЛ не відрізняються від аналогічних у здорових людей, тоді як при ураженні легень вони достовірно на 20% менші. Не виявляється істотного впливу на ДЗЛ окремих проявів склеродермічної пневмопатії. Відповідно до змін ШВВ і ОВВ альвеолярно-капілярна дифузія у хворих на ССД достовірно зменшується. За даними дисперсійного і регресійного аналізу не виявляється залежності показників ДЗЛ від рН експіратів, їх міжфазної активності, в’язкоеластичних і релаксаційних властивостей.
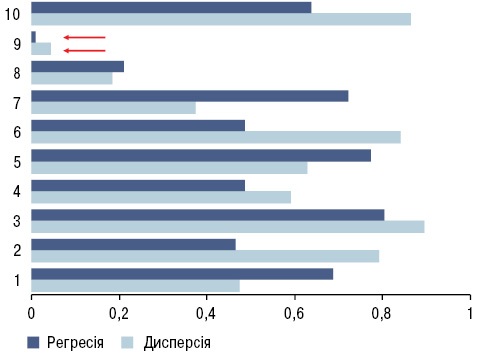
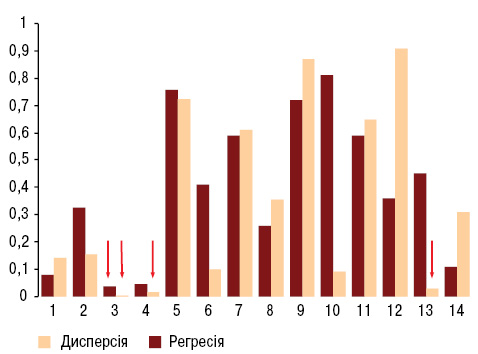
Як свідчить ANOVA/MANOVA, стан ДЗЛ мало впливає на інтегральну тяжкість екстрапульмональних ознак ССД. Разом із тим однофакторний дисперсійний і регресійний аналізи вказують на залежність від параметрів ДЗЛ тяжкості ураження центральної нервової системи (рис. 1). Слід зазначити, що зміни ДЗЛ негативно впливають на діастолічну функцію лівого шлуночка серця. Порушення альвеолярно-капілярної дифузії посилюють функціональну тяжкість легеневої патології у хворих на ССД, оцінену за іншими методами дослідження (спірографія, ехокардіографія). При цьому не виявляється впливу ДЗЛ на інтегральний стан функції зовнішнього дихання та гемодинаміки в малому колі кровообігу, що відображає проведений ANOVA/MANOVA. Параметри ДЗЛ за результатами ANOVA та регресійного аналізу достовірно прямо пов’язані з бронхопрохідністю, визначаючи значення ФЖЄЛ і ОФВ. ДЗЛ зумовлює слабку дію на загальне респіраторне вологовиділення та інтегральний фізико-хімічний стан КВП, але при цьому визначає в’язкоеластичні властивості експіратів (рис. 2).
Висновки
1. Зміни з боку легень виявляються у 61% хворих на ССД, які у 43% випадків проявляються базальним пневмофіброзом, у 40% — інтерстиціальним пневмонітом, у 14% — ізольованою легеневою артеріальною гіпертензією і в 9% — фіброзуючим альвеолітом, що визначається ступенем активності захворювання, розвиваються рестриктивні пульмональні зміни у 71% спостережень, а у 24% обстежених із порушеннями вентиляційної функції легень — змішані, причому характер склеродермічної пневмопатії впливає на стан гемодинаміки в малому колі кровообігу та функцію зовнішнього дихання.
2. Характер склеродермічної пневмопатії, ступінь тяжкості легеневої патології та особливості порушень вентиляційної здатності легень впливають на респіраторні ШВВ і ОВВ, які відповідно зменшуються у 49% і збільшуються у 31% обстежених хворих, залежать від стану бронхопрохідності й Тла, що дозволяє прогнозувати перебіг патологічного процесу.
3. У 46% хворих на ССД змінюється кислотність експіратів, у 40% — їх міжфазна активність, у 37% — їх в’язкоеластичні властивості, що зумовлено змінами синтезу легеневого сурфактанту, пов’язано з тяжкістю ураження легенів, серця і печінки, визначається характером склеродермічної пневмопатії (фіброзуючий альвеоліт, базальний пневмосклероз), наявністю гіпертензії в малому колі кровообігу, формуванням рестриктивних та обструктивних порушень пульмональної вентиляції, впливаючи на стан кондиціонуючої функції легень.
4. Порушення ДЗЛ відзначаються у 79% хворих на ССД, що дозволяє виявляти приховану пневмопатію на 18% частіше, аніж при інших дослідженнях, а бодипульмонологічні показники залежать від ступеня активності захворювання, тяжкості ураження скелетних м’язів і легень, пов’язані з резервом видиху, розмірами правого шлуночка серця і станом респіраторного вологовиділення, у свою чергу, вираженість змін ДЗЛ визначає тяжкість енцефалопатії, діастолічної дисфункції лівого шлуночка серця, бронхообструкції й в’язкоеластичних властивостей експіратів.
Література
Agard C., Haloun A., Hamidou M.A. (2009) Pulmonary arterial hypertension related to systemic sclerosis in 2008. J. Mal. Vasc., 34(1): 7–15.
Baron M., Sutton E., Hudson M. et al. (2008) The relationship of dyspnoea to function and quality of life in systemic sclerosis. Ann. Rheum. Dis., 67(5): 644–650.
Celebi Z., Karabykohlu G., Daјzgaјn N. (2010) Evaluation of the functional parameters in scleroderma cases with pulmonary involvement. Tuberk. Toraks., 58(3): 235–241.
Chow S., Pope J.E., Mehta S. (2008) Lack of correlation of the health assessment questionnaire disability index with lung parameters in systemic sclerosis associated pulmonary arterial hypertension. Clin. Exp. Rheumatol., 26(6): 1012–1017.
Chung L., Krishnan E., Chakravarty E.F. (2007) Hospitalizations and mortality in systemic sclerosis: results from the Nationwide Inpatient Sample. Rheumatology, 46(12): 1808–1813.
Ciurzyzski M., Bienias P., Irzyk K. et al. (2011) Usefulness of echocardiography in the identification of an excessive increase in pulmonary arterial pressure in patients with systemic sclerosis. Kardiol. Pol., 69(1): 9–15.
Condliffe R., Kiely D.G., Peacock A.J. et al. (2009) Connective tissue disease-associated pulmonary arterial hypertension in the modern treatment era. Am. J. Respir. Crit. Care. Med., 179(2): 151–157.
De Lauretis A., Veeraraghavan S., Renzoni E. (2011) Aspects of interstitial lung disease: Connective tissue disease-associated interstitial lung disease: How does it differ from IPF? How should the clinical approach differ? Chron. Respir. Dis., 8(1): 53–82.
Goh N.S., Desai S.R., Veeraraghavan S. et al. (2008) Interstitial lung disease in systemic sclerosis: a simple staging system. Am. J. Respir. Crit. Care. Med., 177(11): 1248–1254.
Gohari Moghadam K., Gharibdoost F., Parastandechehr G. et al. (2011) Assessments of pulmonary involvement in patients with systemic sclerosis. Arch. Iran Med., 14(1): 22–26.
Hant F.N., Ludwicka-Bradley A., Wang H.J. et al.(2009) Surfactant protein D and KL-6 as serum biomarkers of interstitial lung disease in patients with scleroderma. J. Rheumatol., 36(4): 773–780.
Homer R.J., Herzog E.L. (2010) Recent advances in pulmonary fibrosis: implications for scleroderma. Curr. Opin. Rheumatol., 22(6): 683–689.
Khanna D., Brown K.K., Clements P.J. et al. (2010) Systemic sclerosis-associated interstitial lung disease-proposed recommendations for future randomized clinical trials. Clin. Exp. Rheumatol., 28(2): 55–62.
Marasini B., Belloli L., Massarotti M. (2007) Interstitial lung disease in systemic sclerosis. Int. J. Immunopathol. Pharmacol., 20(2): 223–228.
Mouthon L., Guillevin L., Valeyre D. (2010) Therapeutic options for systemic sclerosis related interstitial lung diseases. Respir. Med., 104 (1): 59–69.
Nagai Y., Yamanaka M., Hashimoto C. et al. (2007) Autopsy case of systemic sclerosis with severe pulmonary hypertension. J. Dermatol., 34(11): 769–772.
Ostojic P., Cerinic M.M., Silver R. et al. (2007) Interstitial lung disease in systemic sclerosis. Lung, 185(4): 211–220.
Parra E.R., Otani L.H., de Carvalho E.F. et al. (2009) Systemic sclerosis and idiopathic interstitial pneumonia: histomorphometric differences in lung biopsies. J. Bras. Pneumol., 35(6): 529–540.
Renzoni E.A. (2007) Interstitial lung disease in systemic sclerosis. Monaldi Arch. Chest. Dis., 67(4): 217–228.
Shirahama R., Miyazaki Y., Okamoto T. et al. (2010) Proteome analysis of bronchoalveolar lavage fluid in lung fibrosis associated with systemic sclerosis. Allergol. Int., 59(4): 409–415.
Swartz J.S., Chatterjee S., Parambil J.G. (2010) Desquamative interstitial pneumonia as the initial manifestation of systemic sclerosis. J. Clin. Rheumatol., 16(6): 284–286.
van der Kamp R., Tak P.P., Jansen H.M. et al. (2007) Interstitial lung disease as the first manifestation of systemic sclerosis. Neth. J. Med., 65(10): 390–394.
Vettori S., Cuomo G., Abignano G. et al. (2010) Survival and death causes in 251 systemic sclerosis patients from a single Italian center. Reumatismo, 62(3): 202–209.
Wanchu A., Suryanaryana B.S., Sharma S. et al. (2009) High-dose rednisolone and bolus cyclophosphamide in interstitial lung disease associated ith systemic sclerosis: a prospective open study. Int. J. Rheum. Dis., 12(3): 239–242.
КЛИНИКО-ПАТОГЕНЕТИЧЕСКОЕ ЗНАЧЕНИЕ ИЗМЕНЕНИЙ ВЕНТИЛЯЦИОННОЙ, ВЛАГОВЫДЕЛИТЕЛЬНОЙ, СУРФАКТАНТНОЙ И ДИФФУЗИОННОЙ СПОСОБНОСТИ ЛЕГКИХ У БОЛЬНЫХ СИСТЕМНОЙ СКЛЕРОДЕРМИЕЙ
Резюме. На основании клинико-инструментального обследования (спирография, эхокардиография, бодипневмография, межфазная тензиореография экспиратов) 57 женщин в возрасте от 18 до 67 лет с системной склеродермией, оценки состояния вентиляционной (дыхательные объемы, параметры бронхопроходимости, внутрилегочной гемодинамики), кондиционирующей (скорость и объем респираторного влаговыделения), сурфактантсинтетической (поверхностное натяжение, вязкоэластичность, релаксация экспиратов) и диффузионной способности легких повышено качество диагностики склеродермической пневмопатии, разработаны критерии, позволяющие прогнозировать течение патологического процесса.
системная склеродермия, легкие, функция.
Адреса для листування:
Синяченко Олег Володимирович
83003, Донецьк-3, просп. Ілліча, 16
Донецький національний медичний
університет ім. Максима Горького
E-mail: synyachenko@ukr.net

Leave a comment