Інгібітори янус-кіназ у ревматології
Тарасенко Т.М.1, Рекалов Д.Г.2, Тарасенко О.М.1, Доценко С.Я.3, Шевченко М.В.3, Свистун С.І.3
- 1Херсонський державний університет
- 2Національний науковий центр «Інститут кардіології, клінічної та регенеративної медицини імені академіка М.Д. Стражеска НАМН України»
- 3Запорізький державний медичний та фармацевтичний університет
Резюме. Інгібітори янус-кіназ належать до одного з найновіших класів таргетних синтетичних протиревматичних засобів, що модифікують захворювання, і продемонстрували високу ефективність у пацієнтів із ревматоїдним артритом, псоріатичним артритом, анкілозивним спондилітом та іншими імуноопосередкованими запальними хворобами. Механізм дії інгібіторів янус-кіназ полягає у внутрішньоклітинному перериванні сигнального шляху signal transducers and activators of transcription (JAK/STAT), який має вирішальне значення в імунній відповіді. Зручність пероральних інгібіторів янус-кіназ, на відміну від біологічних препаратів, які потребують парентеральних ін’єкцій, є інноваційною з точки зору пацієнта. У цьому огляді обговорюються ефективність і безпека інгібіторів янус-кіназ при ревматичних захворюваннях.
DOI: 10.32471/rheumatology.2707-6970.95.18641
Вступ
Останніми десятиліттями переглянута парадигма лікування ревматичних захворювань, вона включає стратегії лікування до цілі, ранній початок лікування та розробку і впровадження в клінічну практику цільової таргетної терапії, що ґрунтується на принципах патогенезу захворювань. Незважаючи на революцію в лікуванні ревматичних захворювань, 20–30% пацієнтів взагалі не реагують або знижується ефективність одного або більше біологічних хворобомодифікуючих антиревматичних препаратів (бХМАРП). Пероральні інгібітори янус-кіназ (іJAK) — це новий клас таргетних ХМАРП (тХМАРП), які порушують каскад цитокінів і чинять протизапальну дію, перешкоджаючи передачі сигналів через внутрішньоклітинні шляхи signal transducers and activators of transcription (JAK/STAT). Поточні рекомендації щодо лікування рекомендують застосовувати іJAK поряд із бХМАРП у пацієнтів з ревматоїдним артритом (РА), псоріатичним артритом (ПсА), аксіальним спондилоартритом (АС) та іншими ревматичними хворобами, які погано реагують на традиційні синтетичні ХМАРП (сХМАРП). Завдяки низькомолекулярній будові іJAK не притаманна імуногенність, а пероральний прийом істотно підвищує комплаєнтність [1].
Шлях JAK/STAT. Система JAK/STAT використовується для передачі внутрішньоклітинних сигналів цитокінам. JAK — це внутрішньоклітинні тирозинкінази, пов’язані з внутрішньоклітинними доменами багатьох цитокінових рецепторів. Сімейство JAK складається з кількох різних підтипів, зокрема JAK1, JAK2, JAK3 і TYK2 на додаток до безлічі білків STAT, STAT1, STAT2, STAT3, STAT4, STAT5a, STAT5b і STAT6. Шлях JAK/STAT ініціюється лігандом/цитокіном, який діє як позаклітинний сигнал і зв’язується з рецептором на клітинній мембрані, що, своєю чергою, спричиняє структурну або конформаційну зміну і, таким чином, наступну активацію залучених ізоформ JAK. JAKs сприяють транспортуванню або транслокації білків STAT у ядро клітини, за допомогою чого ініціюється експресія гена з подальшим синтезом білка [2].
Різні сімейства рецепторів цитокінів використовують специфічні ізоформи JAK для передачі сигналу. Більше 50 розчинних факторів, включаючи інтерлейкін (IL)-2, IL-3, IL-4, IL-5, IL-6 та IL-12, а також інтерферони, ендокринні фактори (включаючи гормон росту, пролактин і лептин) і колонієстимулюючі фактори, включаючи еритропоетин, тромбопоетин і гранулоцитарно-макрофагальний колонієстимулюючий фактор, чинять свою дію через специфічні комбінації JAK (рисунок) [3].
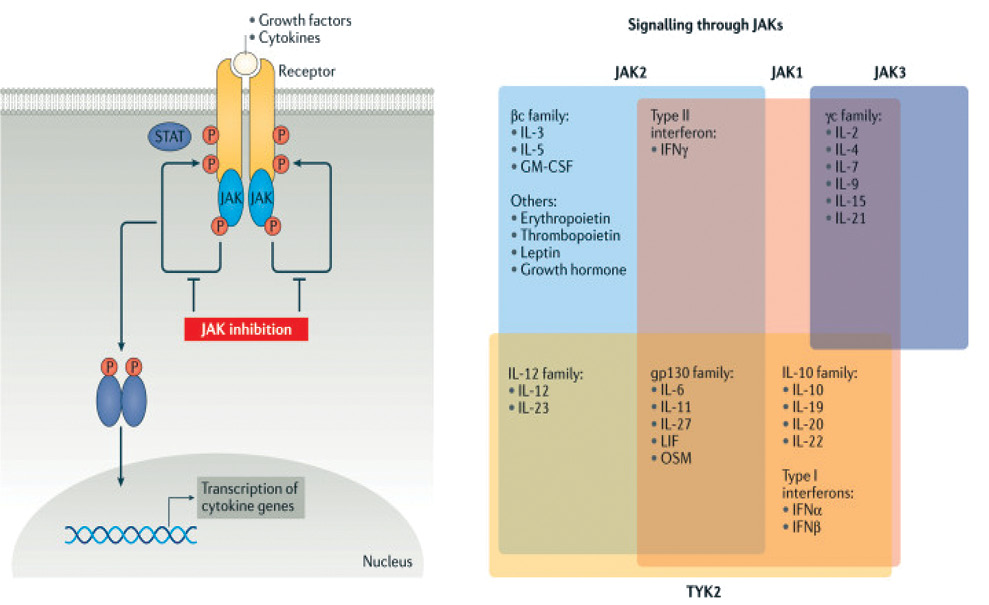
іJAK чинять вибіркову дію на певні внутрішньоклітинні мішені, що зближує їх з генно-інженерними біологічними препаратами, але, на відміну від останніх, іJAK є не білками (моноклональними антитілами або циркулюючими рецепторами), а низькомолекулярними синтетичними речовинами.
Спектр застосування іJAK. Застосування окремих іJAK залежить від їх селективної взаємодії з конкретними цитокіновими рецепторами. Клас іJAK був розроблений протягом останнього десятиліття, і зараз налічує понад 20 представників. іJAK можуть блокувати сигнальну активність різноманітних прозапальних цитокінів і, отже, мають потенціал опосередковувати терапевтичні переваги в широкому діапазоні імуноопосередкованих станів. Шляхи JAK/STAT важливі для клітинної взаємодії під час патологічних процесів РА, викликаючи синовіальне запалення, продукцію аутоантитіл, синовіальну проліферацію та руйнування суглобів, які є потенційними мішенями для інгібування JAK. Крім РА, інгібування JAK має потенціал у лікуванні аутоімунних захворювань, включаючи ПсА, АС, системний червоний вовчак (СЧВ), запальні захворювання кишечнику (ЗЗК) та гніздову алопецію, при яких стимуляція вродженого імунітету активує адаптивний імунітет, що призводить до генерації аутореактивних Т-клітин, активації та диференціювання В-клітин. іJAK також ефективні в лікуванні алергічних розладів, таких як атопічний дерматит, і навіть можуть використовуватися при «цитокіновому штормі», пов’язаному з COVID-19. Лікування на основі механізму, спрямованого на шляхи JAK/STAT, має потенціал для забезпечення позитивних результатів шляхом мінімізації застосування глюкокортикоїдів та/або неспецифічних імунодепресантів у лікуванні системних імуноопосередкованих запальних захворювань [4–7].
іJAK при РА. З кінця 1990-х років метотрексат (МТХ) є основним антиревматичним препаратом, що модифікує захворювання при РА, але близько 30% пацієнтів припиняють лікування протягом першого року через відсутність ефективності або розвиток побічних ефектів. МТХ ефективний лише у 19,8–25,4% хворих на РА [8]. Незважаючи на появу за останні 2 десятиліття бХМАРП, залишається значна група пацієнтів з РА з субоптимальним контролем, втратою відповіді або непереносимістю існуючих бХМАРП. Відкриття ролі JAK і компонентів STAT у передачі сигналів цитокінів у патогенезі РА зумовило появу нової таргетної терапії. 5 іJAK (тофацитиніб, баріцитиніб, пефіцитиніб, упадацитиніб і філготиніб) наразі схвалені різними агенціями для лікування РА та класифікуються як тХМАРП [9].
Тофацитиніб був першим іJAK для лікування РА. Його розробка розпочалася в середині 1990-х років, він був схвалений Управлінням з контролю за харчовими продуктами й лікарськими засобами США (Food and Drug Administration — FDA) у 2012 р., Європейським агентством з лікарських засобів (European Medicines Agency — EMA) у 2017 р. [10]. Пізніше отримали схвалення FDA баріцитиніб та упадацитиніб в 2018 та 2019 р. відповідно. Існує кілька ключових відмінностей у терапевтичних цілях кожного з іJAK. Тофацитиніб є пан-інгібітором JAK з вищою селективністю щодо JAK1/JAK3 і з незначною активністю щодо JAK2 і TYK2. Баріцитиніб є інгібітором JAK1/JAK2 з помірною активністю проти TYK2 і мінімальною активністю проти JAK3 [11, 12]. Упадацитиніб спрямований виключно на шлях JAK1.
У процесі схвалення FDA всі 7 рандомізованих контрольованих досліджень (РКД) III фази тофацитинібу показали ефективність інгібування JAK1/JAK3 при РА. ORAL-START продемонстрував значно вищі показники відповіді ACR20, ACR50 і ACR70 при режимі дозування тофацитинібу 5 мг і 10 мг один раз на добу, ніж монотерапія МТХ як через 6, так і через 24 міс. Дослідження ORAL-SCAN підкреслило ефективність тофацитинібу порівняно з плацебо незалежно від фонової дози МТХ [19]. У ORAL-STRATEGY тофацитиніб + МТХ не поступався адалімумабу + МТХ. Однак монотерапія тофацитинібом не була такою сприятливою, як комбінація адалімумаб + МТХ. Це свідчить про те, що синергічний ефект тофацитинібу + МТХ є кращим, ніж монотерапія тофацитинібом при помірному та тяжкому РА з точки зору контролю захворювання, якщо комбінація є переносимою для пацієнта. У дослідженні ORAL-START було показано, що монотерапія тофацитинібом перевершує монотерапію МТХ щодо обмеження прогресування структурного ураження суглобів [13].
Баріцитиніб успішно пройшов 4 глобальні РКД III фази під час процесу затвердження. У дослідженні RA-BEGIN монотерапію баріцитинібом і баріцитинібом + МТХ порівнювали з монотерапією МТХ у пацієнтів з РА, які майже не застосовували ХМАРП. Статистично значуще покращення відзначали через 24 тиж при монотерапії баріцитинібом і баріцитинібом + МТХ порівняно з монотерапією МТХ для показників відповіді ACR20, ACR50 і ACR70 p<0,01) [15].
У дослідженні RA-BEAM баріцитиніб як у монотерапії, так і в комбінації з МТХ порівнювали з адалімумабом і плацебо у пацієнтів з РА зі слабкою відповіддю на попереднє лікування МТХ. Добова доза баріцитинібу 4 мг порівняно з інгібітором фактора некрозу пухлин (іTNF) адалімумабом досягла переваги за основним результатом, частотою відповіді ACR20 (покращення на 20% кількості болісних та набряклих суглобів, а також з 20% покращенням за трьома критеріями, а саме загальної оцінки пацієнта, загальної оцінки лікаря, вимірювання функціональної здатності, візуальної аналогової шкали болю та швидкості осідання еритроцитів або С-реактивного білка) через 12 тиж [21]. Баріцитиніб перевершував адалімумаб щодо середньої зміни оцінки DAS28-CRP на 12-му тижні (–2,24 для баріцитинібу та –1,95 для адалімумабу, p<0,001). Час досягнення ефекту баріцитинібу був зі значною перевагою над плацебо через 1 тиж і над адалімумабом через 2–4 тиж. Зменшення рентгенологічної прогресії виявлено на 24-му тижні як для баріцитинібу, так і для адалімумабу порівняно з плацебо [16]. Баріцитиніб + МТХ також продемонстрував статистично краще зниження рентгенографічної прогресії порівняно з монотерапією МТХ [17].
Селективний іJAK1 упадацитиніб у РКД SELECT-EARLY та SELECT-MONOTHERAPY продемонстрував значно вищу клінічну відповідь у дозах 15 мг і 30 мг порівняно з МТХ у відповіді ACR50 (52,1; 56,4 і 28,3%; p<0,001) і DAS28-CRP <2,6 (35,6; 40,8 і 13,7%) на 12-му тижні [18, 19].
У дослідженні SELECT-COMPARE упадацитиніб + МТХ порівнювали з адалімумабом + МТХ у пацієнтів з РА з попередньою неадекватною відповіддю на МТХ. На 12-му тижні було досягнуто переваги для упадацитинібу + MTX порівняно з адалімумабом + MTX з ACR 20 (70,5% проти 63%; p<0,05), ACR50 (45,2% проти 29,1%; p<0,01) і DAS28-CRP ≤3,2 (45,0% проти 28,7%). При проведенні оцінки рентгенологічної прогресії упадацитиніб і адалімумаб показали однакові результати. У більшості пацієнтів, рандомізованих для упадацитинібу (86%) або адалімумабу (88%), не відмічено рентгенологічного прогресування порівняно з плацебо (74%) (p≤0,001) [20].
У рекомендаціях Європейського альянсу ревматологічних асоціацій (European Alliance of Associations for Rheumatology — EULAR) щодо лікування РА від 2019 р. рівень щодо іJAK було підвищено до того самого, що й для бХМАРП, тобто для застосування як препаратів 2-го та 3-го ряду [21]. На основі принципу «treat-to-target» інгібітори JAK слід застосовувати в комбінації із сХМАРП у пацієнтів з РА.
Інгібітори JAK упадацитиніб і філготиніб є терапевтично ефективними у пацієнтів з РА, який важко піддається лікуванню (difficult-to-treat RA), і чинять свою дію навіть у пацієнтів, які раніше отримували принаймні 2 бХМАРП [22, 23]. Режим дозування філготинібу 200 мг один раз на добу не поступається адалімумабу [24].
Хоча прямих порівняльних досліджень між іJAK при РА загалом не проводилося, результати дослідження, що базуються на оцінці шкали схильності, показують, що баріцитиніб є більш ефективним, ніж тофацитиніб [25]. В іншому метааналізі пефіцитиніб мав порівнянну ефективність з тофацитинібом і баріцитинібом щодо зниження активності захворювання, виміряного SDAI, і зменшення рентгенографічного прогресування ураження суглобів [26].
Рекомендації EULAR 2022 р. щодо лікування РА сХМАРП та бХМАРП, передбачають застосування тХМАРП, а саме іJAK (тофацитиніб, баріцитиніб, філготиніб, упадацитиніб). При поганих прогностичних факторах (наявність аутоантитіл, висока активність захворювання, ранні ерозії або неефективність 2 сХМАРП, має бути доданий бХМАРП до ХМАРП. Після ретельного розгляду ризик серйозних несприятливих серцево-судинних подій (MACEs — major adverse cardiovascular events), злоякісних новоутворень та/або тромбоемболії тХМАРП також можуть бути розглянуті на цьому етапі. Якщо перший бХМАРП (або тХМАРП) неефективний, застосовують будь-який інший бХМАРП (іншого або того самого класу) або тХМАРП (з огляду на ризики) [27].
Інгібітори JAK при спондилоартриті. Схвалення іJAK за межами РА поширюється на різні ревматичні та аутоімунні захворювання, включаючи АС. Різні цитокіни, включаючи IFNγ, IL-6, IL-12, IL-17, IL-23 і TNF, відіграють важливу роль у патогенезі АС із залученням кількох сигнальних шляхів, включаючи JAK/STAT. Спрямування іJAK на ці ефекторні цитокіни може допомогти у розв’язанні питання лікування артриту, пошкодження хряща і хребта при спондилоартриті.
Таблиця 1. Прогрес у застосуванні інгібіторів янус-кінази при аутоімунних, алергічних та запальних захворюваннях
(адаптовано за Tanaka Y. et al.) [3]
| Нозологія | Схвалені | У III або IV фазі випробувань | У II фазі випробувань |
|---|---|---|---|
| Ревматоїдний артрит | Тофацитиніб; баріцитиніб; пефіцитиніб; упадацитиніб; філготиніб | – | Ритлецитиніб |
| Поліартикулярний ювенільний ідіопатичний артрит | Тофацитиніб | Баріцитиніб | – |
| Системний ювенільний ідіопатичний артрит | – | Тофацитиніб; баріцитиніб | – |
| Атопічний дерматит | Баріцитиніб; аброцитиніб; місцевий делгоцитиніб | Упадацитиніб; топічний руксолітиніб | Тофацитиніб; гусацитиніб; брепоцитиніб |
| Псоріаз | – | Тофацитиніб; декравацитиніб | Баріцитиніб; пефіцитиніб; PF-6826647; брепоцитиніб; гусацитиніб; руксолітиніб |
| Псоріатичний артрит | Тофацитиніб; упадацитиніб | Філготиніб | Брепоцитиніб; декравацитиніб |
| Анкілозуючий спондилоартрит | Упадацитиніб | Тофацитиніб | Філготиніб |
| Аксіальний спондилоартрит | – | Упадацитиніб | Тофацитиніб |
| Ревматична поліміалгія | – | – | Тофацитиніб; баріцитиніб |
| Активний виразковий коліт | Тофацитиніб | Упадацитиніб | Пефіцитиніб; декравацитиніб; брепоцитиніб; ритлецитиніб |
| Хвороба Крона | – | Упадацитиніб; філготиніб; ізенцитиніб | Тофацитиніб; декравацитиніб; брепоцитиніб, ритлецитиніб |
| Первинний біліарний холангіт | – | – | Баріцитиніб |
| Неінфекційний увеїт | – | – | Тофацитиніб;
філготиніб |
| Увеїт, пов’язаний з ювенільним ідіопатичним артритом, або хронічний передній увеїт з позитивним результатом антинуклеарних антитіл | – | Баріцитиніб | Брепоцитиніб |
| Системний червоний вовчак | – | Баріцитиніб | Упадацитиніб;
декравацитиніб; брепоцитиніб |
| Шкірний червоний вовчак | – | – | Тофацитиніб; філготиніб |
| Вовчакова мембранозна нефропатія | – | – | Філготиніб |
| Вовчаковий нефрит | – | – | Декравацитиніб |
| Синдром Шегрена | – | – | Тофацитиніб; філготиніб |
| Системна склеродермія | – | – | Тофацитиніб; ітацитиніб |
| Ідіопатичний запальний міозит | – | – | Баріцитиніб |
| Артеріїт Такаясу | – | Тофацитиніб | – |
| Гігантоклітинний артеріїт | – | Упадацитиніб | Баріцитиніб |
| Синдром Айкарді — Гутьєра; синдром Накахо — Нісімура;
STING-асоційована васкулопатія з початком у дитинстві |
– | Баріцитиніб | Баріцитиніб |
| Трансплантація нирки | – | – | Тофацитиніб |
| Діабетична хвороба нирок | – | – | Баріцитиніб |
| COVID-19 | Баріцитиніб | Тофацитиніб | Руксолітиніб |
Результати випробувань III фази при АС показують, що загальна величина відповіді іJAK подібна до тієї, про яку повідомлялося для іTNF [28]. ЕМА схвалило упадацитиніб для лікування АС. Упадацитиніб у дозі 15 мг на добу оцінювали у II/III фазі плацебо-контрольованого дослідження SELECT-AXIS 1, і більше пацієнтів мали відповідь ASAS40 (покращення ≥40% і абсолютне покращення ≥10 одиниць у 3 або більше доменах: загальна оцінка пацієнта, оцінка болю, функції та запалення) на 14-му тижні в групі упадацитинібу, ніж у групі плацебо [29].
Певна кількість пацієнтів із нерентгенографічним аксіальним спондилоартритом (Нр-АСпА) не реагує на нестероїдні протизапальні препарати (НПЗП) та бХМАРП, що потребує додаткових варіантів лікування. Результати випробувань III фази (дослідження SELECT-AXIS 2) упадацитиніб продемонстрував адекватну ефективність у пацієнтів з Нр-АСпА незалежно від попереднього застосування бХМАРП. Профілі безпеки були аналогічні профілям безпеки у пацієнтів з іншими захворюваннями (наприклад РА, ПсА та АС).
Упадацитиніб став багатообіцяючим варіантом лікування Нр-АСпА. Однак необхідно усвідомлювати відсутність реальних даних про довгострокову ефективність та безпеку, прямих досліджень упадацитинібу та бХМАРП, а також результатів ефективності доказової медицини, особливо щодо пацієнтів, для яких ми повинні надавати пріоритет упадацитинібу над бХМАРП.
Оновлені рекомендації ASAS-EULAR з лікування АС 2022 р. передбачають застосування бХМАРП, iTNF, інгібіторів IL-17 та тХМАРП у пацієнтів з АС з показником активності спондиліту ASDAS ≥2,1 та неефективністю ≥2 НПЗП, а також з підвищеним рівнем С-реактивного білка, МРТ-ознаками запалення крижово-клубових суглобів або рентгенографічним сакроілеїтом. Сучасна практика передбачає початок лікування із застосуванням іTNF або інгібіторів IL-17. Неефективність лікування повинна спонукати до повторної оцінки діагнозу та розгляду наявності супутніх захворювань. Якщо активний Нр-АСпА підтверджено, рекомендується перейти на інший б/тХМАРП [30].
Серед осіб із псоріазом 30–40% мають спондилоартрит в рамках ПсА. Вплив на ефекторні цитокіни за допомогою бХМАРП та іJAK може допомогти вирішити лікування ентезиту і прогресування артриту, а також пошкодження хребта та суглобів при ПcА [31–36]. Тофацитиніб схвалений для ПсА в багатьох країнах. У дослідженні III фази OPAL Broaden тофацитиніб мав порівнянний профіль ефективності та безпеки з адалімумабом у пацієнтів із ПсА, які мали неадекватну відповідь на принаймні один звичайний сХМАРП та раніше не застосовували іTNF [37]. В іншому дослідженні III фази, OPAL Beyond, тофацитиніб був ефективним у пацієнтів із ПсА, які раніше мали неадекватну відповідь на іTNF [38]. Примітно, що дозу 10 мг тофацитинібу не було схвалено для ПсА через занепокоєння щодо його співвідношення безпеки та користі. Крім того, тофацитиніб не був схвалений для пацієнтів із псоріазом без ПсА.
Клінічна розробка баріцитинібу для ПсА була припинена, можливо, через результати дослідження ІІ фази за участю пацієнтів із псоріазом, у яких відповідь відмічали лише при більш високих дозах — 8 мг і 10 мг [39].
Упадацитиніб продемонстрував подібну або вищу ефективність при ПсА порівняно зі стандартним лікуванням, адалімумабом у пацієнтів, які раніше не отримували бХМАРП (SELECT-PsA 1 і 2). Упадацитиніб не поступався адалімумабу за частотою відповіді ACR20 на 12-му тижні. Вираженість покращення при застосуванні упадацитинібу збільшувалася з часом. Так, виявлено вищі показники відповіді ACR20/50/70 порівняно з адалімумабом на 24-му тижні (номінальні значення p<0,05) і вищі показники відповіді ACR50 і ACR70 на 56-му тижні порівняно з адалімумабом (номінальні значення p<0,05). На 24-му тижні зафіксовано значне пригнічення рентгенологічного прогресування при застосуванні упадацитинібу порівняно з плацебо, причому частка пацієнтів без рентгенологічного прогресування була подібною порівняно з адалімумабом [40, 41].
Брепоцитиніб, інгібітор TYK2 і JAK1, ефективний для лікування ПсА, при цьому терапевтична відповідь починається вже через 4 тиж після початку і зберігається до 52 тиж.
Згідно з рекомендаціями EULAR 2019 р. щодо фармакотерапії ПсА, у пацієнтів, які не реагують адекватно на бХМАРП або не переносять їх, рекомендовано розглянути можливість переходу на інший бХМАРП або тХМАРП, включаючи один перехід в межах класу [42].
Питання безпеки при застосуванні інгібіторів JAK. Поки у 2021 р. не було опубліковано попередження FDA [43], консенсус полягав у тому, що коротко- та довгострокова безпека іJAK порівнянна з безпекою бХМАРП. Як потужні імуносупресивні засоби, частота інфекцій, включаючи опортуністичні інфекції, порівнянна з такою для бХМАРП, за винятком частоти інфекцій оперізувального лишаю, яка дещо вища для іJAK [44, 45]. Аналізи РКД тофацитинібу та баріцитинібу свідчать про можливу дозозалежну модель ризику інфекції [46, 47]. Дослідження довгострокової безпеки тофацитинібу з подальшим спостереженням до 9,5 року не виявили змін із плином часу в частоті інфекцій, опортуністичних інфекцій, серйозних інфекцій, злоякісних новоутворень, тромбозів або серцево-судинних розладів [48].
У комплексному аналізі безпеки 5 досліджень III фази упадацитиніб мав порівнянну коротко- та довгострокову безпеку з МТХ й адалімумабом, за винятком вищого ризику оперізувального герпесу та підвищення рівня креатинфосфокінази упадацитинібу, ніж адалімумабу [49]. іJAK також пов’язані з потенційно серйозними ефектами, включаючи злоякісні пухлини, MACE і венозні тромбоемболічні події [50].
У дослідженні ORAL-Surveillance порівнювали безпеку тофацитинібу та іTNF. Попередні дані свідчать про зв’язок із ризиком венозної тромбоемболії та смерті у пацієнтів, які приймали тофацитиніб у дозі 10 мг двічі на добу, але не в дозі 5 мг двічі на добу, що спонукало до попередження FDA щодо високих доз тофацитинібу [51, 52]. Проте пізніші результати показують вищу частоту MACE та злоякісних новоутворень, за винятком немеланомного раку шкіри, у пацієнтів з РА, які отримували тофацитиніб у дозі 5 мг або 10 мг двічі на добу, ніж у пацієнтів, які отримували іTNF [53]. У відповідь на це дослідження FDA у вересні 2021 р. випустило оновлене попередження в рамках щодо підвищеного ризику смерті, MACE, злоякісних новоутворень і тромбозу при застосуванні інгібіторів JAK порівняно з іTNF [43]. Воно також обмежує всі схвалені випадки застосування певними пацієнтами, які не відповіли або не можуть переносити один або більше іTNF. Хоча це дослідження лише порівнювало фацитиніб з адалімумабом, FDA було стурбоване ефектом класу іJAK, і попередження було поширено на два інших іJAK, схвалені в США для лікування запальних захворювань, — баріцитиніб і упадацитиніб. Чи підвищить серцево-судинний і канцерогенний ризик застосування інгібіторів з різною селективністю субтипу JAK або використання іJAK при різних захворюваннях — відповідь однозначно потребує подальшого дослідження. Крім того, у клінічних сценаріях, коли іTNF виявилися неефективними або не були прийнятними, вибір між іншими біопрепаратами та іJAK незрозумілий.
Деякі несприятливі явища, пов’язані з іJAK, передбачаються механізмами, зумовленими блокадою цитокінів, які використовують JAK/STAT для передачі сигналів, що може пояснити ризик серйозних та/або опортуністичних інфекцій, таких як оперізувальний герпес (табл. 2) [53, 54]. Однак виникнення тромбоемболії, хоч і відносно рідкісне, є несподіваною та нез’ясованою подією [51, 54]. Чи включає ця подія активацію системи коагуляції-фібринолізу або тромбоцитів і ендотеліальних клітин, ще невідомо. Таким чином, хоча застосування іJAK є зручним через їх пероральний прийом, його слід ретельно розглянути. Необхідно провести відповідний скринінг на наявність таких факторів, як інфекції, серцево-судинні розлади, тромбози та злоякісні новоутворення. іJAK повинні призначатися лікарями, які здатні забезпечити системне лікування побічних явищ. Протипоказання до застосування іJAK пов’язані з фармакокінетичними та фармакодинамічними профілями й побічними ефектами та включають тяжку активну інфекцію (гостру або хронічну), зокрема латентний туберкульоз та опортуністичні інфекції, за винятком COVID-19; активну злоякісну пухлину; тяжке ураження органів (зокрема тяжке захворювання печінки або нирок); період вагітності і годування гудьми; венозну тромбоемболію в анамнезі. Необхідно провести довгострокові дослідження безпеки щодо розвитку побічних ефектів.
Таблиця 2. Застосування та безпека основних інгібіторів JAK (адаптовано за Chen Xue et al.) [53]
| Інгібітори JAK | Вибірковість | Затверджені показання | Показання до клінічних досліджень | Повідомлені побічні явища |
|---|---|---|---|---|
| Тофацитиніб | JAK1 і JAK3 | Ревматоїдний артрит,
виразковий коліт, ювенільний ідіопатичний артрит та псоріатичний артрит |
Псоріаз, хвороба Крона, COVID-19, гніздова алопеція, дерматоміозит, атопічний дерматит, сухий кератокон’юнктивіт, рецидивуючий поліхондрит, анкілозуючий спондиліт, запальне захворювання кишечнику та відторгнення трансплантата | Інфекції, злоякісні новоутворення, анемія, нейтропенія, підвищення рівня креатиніну та трансаміназ у сироватці крові, гіперхолестеринемія, шлунково-кишкові симптоми та тромбоемболія |
| Пефіцитиніб | JAK3, JAK1, TYK2 і JAK2 | Ревматоїдний артрит | Виразковий коліт і псоріаз | Інфекції, злоякісні пухлини, підвищений рівень креатинкінази, підвищений рівень креатиніну та гіперліпідемія |
| Руксолітиніб | JAK1 і JAK2 | Мієлофіброз і справжня поліцитемія | Псоріаз, поліцитемія, вітиліго, злоякісні пухлини, гостра реакція «трансплантат проти хазяїна», ревматоїдний артрит, есенціальна тромбоцитемія, гніздова алопеція, атопічний дерматит, COVID-19 | Анемія, тромбоцитопенія, нейтропенія, гіпокаліємія, інфекції та периферичні набряки |
| Баріцитиніб | JAK1 і JAK2 | Ревматоїдний артрит, атопічний дерматит та COVID-19 | Системний червоний вовчак, ювенільний дерматоміозит, псоріаз, діабетична нефропатія, гніздова алопеція та аутозапальні захворювання | Інфекції, злоякісні пухлини та гіперліпідемія |
| Делгоцитиніб | JAK1, JAK2, TYK2 і JAK3 | Атопічний дерматит | Екзема, дискоїдний червоний вовчак, псоріаз і гніздова алопеція | Назофарингіт, вітряна віспа Капоші, контактний дерматит і акне |
| Момелотиніб | JAK1 і JAK2 | / | Мієлофіброз і множинна мієлома | Діарея, кашель, нудота, анемія, нейтропенія, тромбоцитопенія та периферична нейропатія, викликана лікуванням |
| Філготиніб | JAK1 | Ревматоїдний артрит | Запальні захворювання кишечнику, псоріатичний артрит і анкілозуючий спондиліт | Інфекції, назофарингіт і головний біль |
| Упадацитиніб | JAK1 | Ревматоїдний артрит, анкілозуючий спондиліт, нерентгенографічний аксіальний спондилоартрит та псоріатичний артрит | Запальні захворювання кишечнику та атопічний дерматит | Інфекції, злоякісні пухлини, підвищені рівні ліпідів, креатинфосфокінази, печінкової амінотрансферази, низька кількість кров’яних тілець, інсульт та венозна тромбоемболія |
| Федратиніб | JAK2 | Мієлофіброз | Тромбоцитопенія і солідні пухлини | Летальні енцефалопатії, анемія, шлунково-кишкові симптоми, підвищення рівня трансаміназ печінки, креатиніну в сироватці крові та ферментів підшлункової залози |
| Аброцитиніб | JAK1 | Атопічний дерматит | Псоріаз, системний червоний вовчак і артрит | Назофарингіт, нудота, блювання, акне, оперізувальний лишай, підвищення рівня креатинфосфокінази в крові, запаморочення та головний біль |
| Децернотиніб | JAK3 | / | Ревматоїдний артрит | Головний біль, нудота, інфекції, підвищення рівня трансаміназ, ліпопротеїнів і креатиніну, зниження кількості лімфоцитів і нейтрофілів |
| Ітацитиніб | JAK1 | / | Хвороба «трансплантат проти хазяїна» та рак легені | Зниження рівня тромбоцитів і нейтрофілів, анемія і гіперглікемія |
| Декравацитиніб | TYK2 | Плямистий псоріаз | Псоріатичний артрит, системний червоний вовчак і запальні захворювання кишечнику | Назофарингіт та інфекції верхніх дихальних шляхів |
Висновки
1. Інгібітори JAK чинять імуномодулюючу дію на широкий спектр гетерогенних захворювань шляхом інгібування STAT-опосередкованих сигнальних шляхів багатьох цитокінів.
2. При рефрактерних системних аутоімунних захворюваннях іJAK можуть потенційно мінімізувати застосування глюкокортикоїдів і неспецифічних імунодепресантів.
3. Шляхи JAK/STAT важливі для клітинної взаємодії під час патологічних процесів РА, викликаючи синовіальне запалення, вироблення аутоантитіл, синовіальну проліферацію та руйнування суглобів, які є потенційними мішенями для інгібування JAK.
4. Запальні процеси за участю сигнальних шляхів JAK/STAT беруть участь у патології спондилоартриту (включаючи ПсА) і є мішенями для інгібування JAK.
5. Застосування іJAK потребує ретельного розгляду їх багатоцільових ефектів із відповідним попереднім скринінгом і регулярним плановим моніторингом під час лікування інфекцій, серцево-судинних розладів, тромбозу та злоякісних новоутворень.
Список використаної літератури
- 1. Savia de Souza et al. (2024) Clinician and patient views on janus kinase inhibitors in the treatment of inflammatory arthritis: a mixed methods study. BMC Rheumatol.; 8: 1.
- 2. Harrington R., Ahmad Al Nokhatha S., Conway R. (2020) JAK Inhibitors in Rheumatoid Arthritis: An Evidence-Based Review on the Emerging Clinical Data. J. Inflamm. Res.; 13: 519–531.
- 3. Tanaka Y., Luo Y., O’Shea J.J. et al. (2022) Janus kinase-targeting therapies in rheumatology: a mechanisms-based approach. Nat. Rev. Rheumatol.; 18(3): 133–145.
- 4. Tanaka Y. (2019) The JAK inhibitors: do they bring a paradigm shift for the management of rheumatic diseases? Rheumatology; 58: i1–i3.
- 5. Choy E.H. (2019) Clinical significance of Janus kinase inhibitor selectivity. Rheumatology; 58: 953–962.
- 6. Gadina M. et al. (2020) Translating JAKs to Jakinibs. J. Immunol.; 204: 2011–2020.
- 7. Benucci M. et al. (2023) JAK inhibitors and autoimmune rheumatic diseases. Autoimmunity Reviews. Vol. 22, Issue 4, April: 103276.
- 8. Favalli E.G., Biggioggero M., Meroni P.L. (2014) Methotrexate for the treatment of rheumatoid arthritis in the biologic era: still an “anchor” drug? Autoimmun. Rev.; 13(11): 1102–1108.
- 9. Smolen J.S., Aletaha D., Barton A. et al. (2018) Rheumatoid arthritis. Nat. Rev. Dis. Prim.; 4. doi: 10.1038.
- 10. Garber K. (2013) Pfizer’s first-in-class JAK inhibitor pricey for rheumatoid arthritis market. Nat. Biotechnol.; 31(1): 3–4. doi: 10.1038.
- 11. Clark J.D., Flanagan M.E., Telliez J.B. (2014) Discovery and development of Janus kinase (JAK) inhibitors for inflammatory diseases. J. Med. Chem.; 57(12): 5023–5038.
- 12. Genovese M.C., Kremer J., Zamani O. et al. (2016) Baricitinib in patients with refractory rheumatoid arthritis. N. Engl. J. Med.; 374(13): 1243–1252.
- 13. Lee E., Fleischmann R., Hall S. et al. (2014) Tofacitinib versus methotrexate in rheumatoid arthritis. N. Engl. J. Med.; 370(25): 2377–2386.
- 14. Fleischmann R., Mysler E., Hall S. et al. (2017) Efficacy and safety of tofacitinib monotherapy, tofacitinib with methotrexate, and adalimumab with methotrexate in patients with rheumatoid arthritis (ORAL Strategy): a Phase 3b/4, double-blind, head-to-head, randomised controlled trial. Lancet; 390(10093): 457–468.
- 15. Fleischmann R., Schiff M., van der Heijde D. et al. (2017) Baricitinib, methotrexate, or combination in patients with rheumatoid arthritis and no or limited prior disease-modifying antirheumatic drug treatment. Arthritis Rheumatol.; 69(3): 506–517.
- 16. Taylor P.C. et al. (2017) Baricitinib versus placebo or adalimumab in rheumatoid arthritis. N. Engl. J. Med.; 376: 652–662.
- 17. Van der Heijde D., Durez P., Schett G. et al. (2018) Structural damage progression in patients with early rheumatoid arthritis treated with methotrexate, baricitinib, or baricitinib plus methotrexate based on clinical response in the phase III RA-BEGIN study. Clin. Rheumatol.; 37(9): 2381–2390.
- 18. Van Vollenhoven R., Takeuchi T., Pangan A.L. et al. (2018) A phase 3, randomized, controlled trial comparing upadacitinib monotherapy to MTX monotherapy in MTX-naïve patients with active rheumatoid arthritis. Arthritis Rheumatol.; 70 (Suppl. 10). [Google Scholar].
- 19. Smolen J.S., Cohen S., Emery P. et al. (2018) Upadacitinib as monotherapy: a phase 3 randomized controlled double-blind study in patients with active rheumatoid arthritis and inadequate response to methotrexate. Arthritis Rheumatol.; 70(Suppl. 10).
- 20. Fleischmann R., Pangan A.L., Mysler E. et al. (2018) A phase 3, randomized, double-blind study comparing upadacitinib to placebo and to adalimumab, in patients with active rheumatoid arthritis with inadequate response to methotrexate. Arthritis Rheumatol.; 70(Suppl. 10).
- 21. Smolen J.S. et al. (2020) EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs: 2019 update. Ann. Rheum. Dis.; 79: 685–699.
- 22. Genovese M.C. et al. (2018) Safety and efficacy of upadacitinib in patients with active rheumatoid arthritis refractory to biologic disease-modifying anti-rheumatic drugs (SELECT-BEYOND): a double-blind, randomised controlled phase 3 trial. Lancet; 391: 2513–2524.
- 23. Genovese M.C. et al. (2019) Effect of filgotinib vs placebo on clinical response in patients with moderate to severe rheumatoid arthritis refractory to disease-modifying antirheumatic drug therapy: the FINCH 2 randomized clinical trial. JAMA; 322: 315–325.
- 24. Combe B. et al. (2021) Filgotinib versus placebo or adalimumab in patients with rheumatoid arthritis and inadequate response to methotrexate: a phase III randomised clinical trial. Ann. Rheum. Dis.; 80: 848–858.
- 25. Taylor P. (2019) Clinical efficacy of launched JAK inhibitors in rheumatoid arthritis. Rheumatology (Oxford); 58: 17–26.
- 26. Tanaka Y. et al. (2021) Comparative efficacy and safety of peficitinib versus tofacitinib and baricitinib for treatment of rheumatoid arthritis: a systematic review and network meta-analysis. Rheumatol. Ther.; 8: 729–750.
- 27. Smolen J.S. et al. (2023) EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs: 2022 update Ann. Rheum. Dis., Jan; 82(1): 3–18.
- 28. Deodhar A. et al. (2021) Tofacitinib for the treatment of ankylosing spondylitis: a phase III, randomised, double-blind, placebo-controlled study. Ann. Rheum. Dis.; 80: 1004–1013.
- 29. van der Heijde D. et al. (2019) Efficacy and safety of upadacitinib in patients with active ankylosing spondylitis (SELECT-AXIS 1): a multicentre, randomised, double-blind, placebo-controlled, phase 2/3 trial. Lancet; 394: 2108–2117.
- 30. ASAS-EULAR recommendations for the management of axial spondyloarthritis: 2022 update. Ann. Rheum. Dis. 2023, Jan; 82(1): 19–34.
- 31. McGonagle D.M. et al. (2019) Pathophysiology, assessment and treatment of psoriatic dactylitis. Nat. Rev. Rheumatol.; 15: 113–122.
- 32. Bravo A., Kavanaugh A. (2019) Bedside to bench: defining the immunopathogenesis of psoriatic arthritis. Nat. Rev. Rheumatol.; 15: 645–656.
- 33. Van den Bosch F., Coates L. (2018) Clinical management of psoriatic arthritis. Lancet; 391: 2285–2294.
- 34. Ritchlin C.T. et al. (2017) Psoriatic arthritis. N. Engl. J. Med.; 376: 957–970.
- 35. Schett G. et al. (2017) Enthesitis: from pathophysiology to treatment. Nat. Rev. Rheumatol.; 13: 731–741.
- 36. Sieper J. et al. (2019) The IL-23-IL-17 pathway as a therapeutic target in axial spondyloarthritis. Nat. Rev. Rheumatol.; 15: 747–757.
- 37. Mease P. et al. (2017) Tofacitinib or adalimumab versus placebo for psoriatic arthritis. N. Engl. J. Med.; 377: 1537–1550.
- 38. Gladman D. et al. (2017) Tofacitinib for psoriatic arthritis in patients with an inadequate response to TNF inhibitors. N. Engl. J. Med.; 377: 1525–1536.
- 39. Papp K.A. et al. (2016) A randomized phase 2b trial of baricitinib, an oral Janus kinase (JAK) 1/JAK2 inhibitor, in patients with moderate-to-severe psoriasis. Br. J. Dermatol.; 174: 1266–1276.
- 40. Mease P.J. et al. (2020) Upadacitinib for psoriatic arthritis refractory to biologics: SELECT-PsA 2. Ann. Rheum. Dis.; 80: 312–320.
- 41. McInnes I.B. et al. (2021) Trial of upadacitinib and adalimumab for psoriatic arthritis. N. Engl. J. Med.; 384: 1227–1239.
- 42. Gossec L. et al. (2020) EULAR recommendations for the management of psoriatic arthritis with pharmacological therapies: 2019 update Ann. Rheum. Dis.; 79: 700–712.
- 43. U.S. Food & Drug Administration (2021) FDA requires warnings about increased risk of serious heart-related events, cancer, blood clots, and death for JAK inhibitors that treat certain chronic inflammatory conditions.
- 44. Pawar A., Desai R.J., Gautam N. et al. (2020) Risk of admission to hospital for serious infection after initiating tofacitinib versus biologic DMARDs in patients with rheumatoid arthritis: a multidatabase cohort study. Lancet Rheumatol.; 2: E84–E94.
- 45. Cohen S.B. et al. (2020) Safety profile of upadacitinib in rheumatoid arthritis: integrated analysis from the SELECT phase III clinical programme. Ann. Rheum. Dis.; 80: 304–311.
- 46. Wollenhaupt J. et al. (2019) Safety and efficacy of tofacitinib for up to 9.5 years in the treatment of rheumatoid arthritis: final results of a global, open-label, long-term extension study. Arthritis Res. Ther.; 21: 89.
- 47. Wang F. et al. (2020) Efficacy and safety of tofacitinib, baricitinib, and upadacitinib for rheumatoid arthritis: a systematic review and meta-analysis. Mayo Clin. Proc.; 95: 1404–1419.
- 48. Cohen S. B. et al. (2020) Long-term safety of tofacitinib up to 9.5 years: a comprehensive integrated analysis of the rheumatoid arthritis clinical development programme. RMD Open; 6: e001395.
- 49. Conaghan P.G. et al. (2021) Upadacitinib in rheumatoid arthritis: a benefit-risk assessment across a phase III program. Drug Saf.; 44: 515–530.
- 50. Bechman K. et al. (2019) A systematic review and meta-analysis of infection risk with small molecule JAK inhibitors in rheumatoid arthritis. Rheumatology; 58: 1755–1766.
- 51. Pfizer (2021) Pfizer shares co-primary endpoint results from post-marketing required safety study of Xeljanz® (tofacitinib) in subjects with rheumatoid arthritis (RA).
- 52. U.S. Food & Drug Administration (2019) FDA approves Boxed Warning about increased risk of blood clots and death with higher dose of arthritis and ulcerative colitis medicine tofacitinib (Xeljanz, Xeljanz XR).
- 53. Chen Xue et al. (2023) Evolving cognition of the JAK-STAT signaling pathway: autoimmune disorders and cancer. Signal Transduction and Targeted Therapy; volume 8, Article number: 204.
- 54. Winthrop K.L. (2017) The emerging safety profile of JAK inhibitors in rheumatic disease. Nat. Rev. Rheumatol.; 13: 234–243.
Відомості про авторів:
Тарасенко Т.М., кандидат медичних наук, доцент кафедри медицини Херсонського державного університету.
ORCID ID: 0000-0002-9142-3492
Рекалов Д.Г., доктор медичних наук, професор, «Ревматологічна клініка професора Рекалова», м. Дніпро, Запоріжжя. ДУ «Національний науковий центр «Інститут кардіології, клінічної та відновної медицини імені академіка М.Д. Стражеска», м. Київ.
ORCID ID: 0000-0002-5793-2322
Тарасенко О.М., доктор медичних наук, професор кафедри медицини Херсонського державного університету.
ORCID ID: 0000-0001-9152-179X
Доценко С.Я., доктор медичних наук, професор, завідувач кафедри внутрішніх хвороб-3 Запорізького державного медичного та фармацевтичного університету.
ORCID ID: 0000-0003-2913-3790
Шевченко М.В., кандидат медичних наук, доцент кафедри внутрішніх хвороб-3 Запорізького державного медичного та фармацевтичного університету.
ORCID ID: 0000-0001-6748-2815
Свистун С.І., кандидат медичних наук, доцент кафедри внутрішніх хвороб-3 Запорізького державного медичного та фармацевтичного університету.
ORCID ID: 0000-0003-0398-8803

Leave a comment