ТЕРАПЕВТИЧНІ ПІДХОДИ ДО СИСТЕМНОЇ СКЛЕРОДЕРМІЇ: РЕТРОСПЕКТИВНИЙ АНАЛІЗ
Яцишин Р.І., Дрогомерецька О.І.
Резюме. Системна склеродермія (CCД) — рідкісне аутоімунне захворювання, що характеризується судинними аномаліями та фіброзом багатьох органів. Лікування ССД є складним через його гетерогенність, що потребує мультидисциплінарного підходу для вирішення різних аспектів його патогенезу. Мета. Наше дослідження спрямоване на аналіз особливостей терапії пацієнтів із ССД та порівняння національних стратегій та міжнародних регламентів лікування цього захворювання. Методи. Наше дослідження, здійснене у форматі ретроспективного аналізу, охопило медичні записи 55 пацієнтів із ССД, збережених в електронній базі даних КНП «Обласна клінічна лікарня Івано-Франківської обласної ради». Для аналізу використовувалися критерії класифікації Американського коледжу ревматології (American College of Rheumatology — ACR)/Європейського альянсу ревматологічних асоціацій (European Alliance of Associations for Rheumatology — EULAR) за 2013 р. та національні рекомендації. Учасники дослідження були повнолітніми та перебували на стаціонарному лікуванні в ревматологічному відділенні протягом 2018–2023 рр. Інформацію систематизовано за допомогою програми Microsoft Excel, а статистичний аналіз — за допомогою Statistical Package for the Social Sciences версії 26.0 (IBM Corp., Armonk, NY, USA). Результати. Під час аналізу медичних записів встановлено, що більшість пацієнтів із ССД отримували протизапальні/знеболювальні препарати протягом терапії (n=38; 69%). Застосування цитостатичних препаратів відмічено у 30,9% випадків, переважно метотрексату (n=20) та циклофосфаміду (n=9). Більше половини пацієнтів (52,7%) приймали препарати групи простагландинів, особливо алпростадил. Значна частина пацієнтів (n=22; 40%) застосовувала ніфедипін. Засоби для корекції реологічних властивостей крові призначали майже кожному третьому пацієнту із CCД (n=17; 30,9%). Висновки. Терапевтичні підходи, які впроваджуються в національних медичних закладах, відповідають світовим стандартам і рекомендаціям, зосереджені як на патогенетичному, так і на симптоматичному лікуванні ССД. Проте відсутність прогресу в таргетній терапії створює перепони на шляху досягнення оптимальних результатів лікування пацієнтів із ССД.
DOI: 10.32471/rheumatology.2707-6970.94.18279
УДК 616.5-004.1+ 616.24-004
Вступ
Системна склеродермія (ССД) є рідкісним і складним аутоімунним захворюванням, що характеризується розвитком типової тріади порушень функцій організму. Ключовими елементами патогенезу ССД є наявність судинних порушень, імунної дисрегуляції та синтезу і накопичення колагену, що призводить до фіброзу багатьох систем органів [1]. Ця виснажлива патологія створює значні проблеми як для пацієнтів, так і для медичних працівників через різноманітні клінічні симптоми та непередбачуваний перебіг хвороби.
ССД характеризується наявністю двох основних клінічних підтипів: обмежена шкірна форма ССД (оССД) і дифузна шкірна форма ССД (дССД), кожна з яких має різні клінічні прояви та тенденції до прогресування. Особливості лікування ССД зумовлені її гетерогенністю, що потребує мультидисциплінарного підходу, спрямованого на різні аспекти патогенезу захворювання [2].
Однією з особливостей лікування ССД є відсутність єдиної терапевтичної схеми для всіх хворих [3]. Ця різноманітність клінічних проявів і тяжкості захворювання потребує індивідуальних планів лікування, адаптованих до індивідуальних потреб кожного пацієнта. Терапевтичні втручання спрямовані на зменшення вираженості симптомів, контроль запалення та уповільнення прогресування фіброзу з основною метою підвищення якості життя пацієнтів. Програми лікування ССД значно змінилися протягом багатьох років, зосереджуючись на досягненні кращих результатів шляхом поєднання фармакологічних і нефармакологічних стратегій [4].
Фармакологічні методи лікування ССД насамперед спрямовані на імунну дисрегуляцію та запалення. Імуносупресивні агенти, такі як кортикостероїди, метотрексат і мікофенолату мофетил, зазвичай застосовуються для контролю аутоімунних реакцій і зменшення вираженості запалення [5]. Крім того, нещодавні досягнення свідчать про появу біологічних засобів, які спеціально спрямовані на ключові молекули в імунному каскаді, пропонуючи нові шляхи менеджменту ССД [5]. Однак ці методи лікування не позбавлені проблем, оскільки можуть викликати значні побічні ефекти та потребують ретельного моніторингу.
Окрім імуносупресії, особливості лікування ССД охоплюють ширший спектр втручань. Вазодилататори, такі як блокатори кальцієвих каналів, застосовуються для лікування феномену Рейно. Фізична терапія відіграє вирішальну роль у підтримці гнучкості суглобів і запобіганні контрактурам, які часто відзначають у пацієнтів із ССД. Ерготерапія також допомагає хворим адаптуватися до повсякденної діяльності, підвищуючи загальну якість життя.
Крім того, усунення ускладнень ССД є невід’ємною частиною лікування. Симптоми з боку шлунково-кишкового тракту, ураження легень і серцево-судинної системи потребують спеціалізованої допомоги гастроентерологів, пульмонологів і кардіологів відповідно. Мультисистемний характер CCД вимагає спільних зусиль фахівців різних профілів для комплексного вирішення різних аспектів захворювання [6].
Останніми роками дослідницькі зусилля були спрямовані на розробку та вивчення нових методів лікування, включаючи трансплантацію стовбурових клітин і генну терапію, які обіцяють змінити перебіг захворювання. Ці підходи передбачають більш ефективне спрямування на основні фіброзні процеси та є потенційним проривом у лікуванні ССД.
Метою нашого дослідження було проаналізувати характерні особливості менеджменту обраної когорти пацієнтів із ССД та провести порівняння між національними та міжнародними стратегіями терапії цього захворювання.
Методи дослідження
Наше дослідження було проведено у форматі ретроспективного аналізу, і для досягнення поставленої мети ми аналізували медичні записи пацієнтів, які зберігалися в електронній базі даних КНП «Обласна клінічна лікарня Івано-Франківської обласної ради». Беручи до уваги його ретроспективний характер, не було потреби звертатися до пацієнтів із запитом на письмову інформовану згоду. Усі аналітичні дослідження та обробка даних були проведені в суворій відповідності з принципами збереження конфіденційності інформації.
Наукове дослідження включало аналіз даних 55 пацієнтів, яким встановили діагноз ССД, послуговуючись критеріями класифікації ACR/EULAR за 2013 р. [7] та національними рекомендаціями. Усі учасники дослідження були повнолітніми (віком старше 18 років) і перебували на стаціонарному лікуванні в ревматологічному відділенні КНП «Обласна клінічна лікарня Івано-Франківської обласної ради» протягом періоду з 2018 до 2023 р.
Під час статистичного аналізу даних визначено їх розподіл за допомогою методу Шапіро — Вілка. Категоріальні змінні представлені у вигляді частоти та частки, а неперервні змінні — у вигляді середнього значення та стандартного відхилення залежно від їх розподілу. Систематизацію даних здійснено за допомогою програми Microsoft Excel, що входить до пакету прогам Microsoft Office 2016. Аналіз проведено за допомогою програми Statistical Package for the Social Sciences версії 26.0 (IBM Corp., Armonk, NY, USA).
Результати
Під час проведення дослідження вивчено групу пацієнтів із ССД, загальна кількість яких становила 55 осіб. Абсолютну більшість цієї когорти становили жінки, а вік пацієнтів коливався в межах 37,8 та 53,6 року, серединне значення було на рівні 49,5 року (табл. 1). Тривалість захворювання була розподілена в досліджуваній групі нерівномірно, проте серединне значення характеризувалося показником у 7,6 року. Дані про вік початку захворювання та тривалість ССД перед верифікацією діагнозу представлено в таблиці.
Таблиця. Клініко-демографічна характеристика пацієнтів із ССД
| Показник | Загальна когорта пацієнтів із ССД(n=55) |
|---|---|
| Стать, жінки n (%) | 52 (94,5) |
| Вік, роки (IQR) | 49,5 (37,8–60,5) |
| Вік початку захворювання, роки (IQR) | 43,4 (35,4–53,6) |
| Тривалість захворювання до встановлення діагнозу*, роки (IQR) | 2,5 (1,5–4,8) |
| Тривалість захворювання загалом, роки (IQR) | 7,6 (2,8–16,1) |
*Час від появи першого симптому (окрім синдрому Рейно) до встановлення діагнозу.
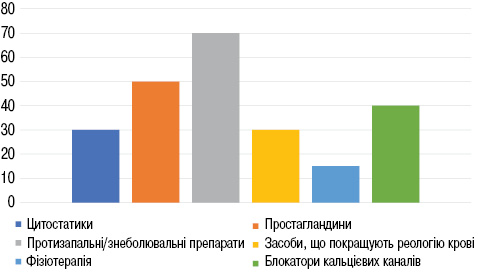
У ході аналізу медичних карт нам вдалося встановити, що переважній більшості пацієнтів із ССД в ході терапії призначали протизапальні/знеболювальні препарати (n=38; 69%). Цитостатичні засоби застосовували у 30,9% випадків. Вони були представлені здебільшого метотрексатом (n=20) та циклофосфамідом (n=9). Більше половини (52,7%) пацієнтів приймали препарати групи простагландинів, зокрема алпростадил. Велика частка пацієнтів (n=22; 40%) отримувала ніфедипін. Засоби для корекції реологічних властивостей крові застосовували у майже кожного третього пацієнта із ССД (n=17; 30,9%). 9 пацієнтів (16,4%) отримали також фізіотерапевтичне лікування.
Обговорення
Стратегії лікування пацієнтів із ССД характеризуються наявністю особливостей залежно від національного контексту. Терапевтичні підходи охоплюють засоби, що модифікують захворювання, імуносупресивні препарати та таргетну біологічну терапію. Наявність, вартість і доступність цих методів лікування можуть помітно відрізнятися в різних країнах. Наприклад, доступ до передових біопрепаратів є більш обмеженим у певних регіонах, що впливає на варіанти лікування пацієнтів. Крім того, відмінності в системах охорони здоров’я та стандартах медичної допомоги можуть вплинути на впровадження рекомендацій щодо терапії.
Імуносупресивні препарати є наріжним каменем первинного лікування пацієнтів із ССД. Ці препарати виявляють незаперечну ефективність у зниженні інтенсивності фіброзу шкіри та пошкодження легень, причому циклофосфамід є основним вибором для повторного введення, особливо у разі дифузної ССД. Незважаючи на побічні ефекти, пов’язані з циклофосфамідом, його переваги зберігаються при застосуванні в комбінації з іншими імунодепресантами, такими як метотрексат, азатіоприн або мікофенолату мофетил (MMФ) [8, 9]. Циклофосфамід також продемонстрував ефективність у лікуванні антральної кровотечі, пов’язаної з ектазією судин шлунка [8]. Однак результати щодо відновлення дифузійної здатності легень для монооксиду вуглецю (DLCO) за допомогою лікування циклофосфамідом є непереконливими [10]. Крім того, занепокоєння щодо геморагічного циститу, тератогенних ризиків і медулярної супресивної дії потребує ретельного моніторингу під час його застосування [11]. Комбінація внутрішньовенного введення циклофосфаміду з пероральним азатіоприном показала покращання стану пацієнтів у 6-місячному британському дослідженні [11].
Дослідження 2018 р. дало менш переконливі результати для іншого імуносупресанта, такролімусу, який застосовували в комбінації з преднізолоном [3]. Ритуксимаб, анти-CD20 моноклональне антитіло, демонструє ефекти, подібні до ефектів циклофосфаміду, щодо зменшення вираженості фіброзу шкіри та служить альтернативою для пом’якшення побічних ефектів циклофосфаміду. Для ефективного контролю легеневого фіброзу рекомендовано поєднання ритуксимабу з ММФ як імуносупресанта. Крім того, ритуксимаб продемонстрував переваги при підшкірній кальцифікації та васкулопатії [10].
Тоцилізумаб, моноклональне антитіло проти інтерлейкіну (IL)-6, виявляється більш ефективним на ранніх стадіях захворювання та при легеневій дисфункції з обмеженим впливом на шкірний фіброз [10, 11]. Хоча тоцилізумаб і ритуксимаб є багатообіцяючими препаратами, необхідні подальші дослідження для підтвердження їх позитивного ефекту. Слід зазначити, що застосування цих імунодепресантів протипоказано при інфікуванні виразок. C.G. Khor та співавтори представили клінічний випадок, який продемонстрував, що рецидивні виразки можуть загоюватися після лікування ритуксимабом [12]. На жаль, серед нашої когорти пацієнтів жоден не отримував таргетної імунобіологічної терапії. Висока вартість цих препаратів є головною перепоною на шляху активної імплементації імунобіологічних лікарських засобів у менеджмент пацієнтів із ССД.
Лікування мікроваскулопатії має важливе значення, особливо у випадках феномену Рейно, для запобігання розвитку дигітальних виразок й ураженню багатьох органів [10]. Вазодилататори підтвердили свою ефективність у лікуванні критичної ішемії та зниженні ризику гангрени, тим самим знижуючи частоту ампутацій [3]. Ацетилсаліцилова кислота, відома своєю антиагрегантною дією, не сприяє значному вирішенню виразок пальців і не полегшує феномену Рейно. Проте антитромбоцитарні препарати зазвичай рекомендуються при ССД. З іншого боку, антикоагулянт гепарин не є ефективним і зумовлює ризик шлунково-кишкової кровотечі [13]. Пентоксифілін, ефективний вазодилататор, може полегшити стан при акральних ураженнях, але менш ефективний у контролі феномену Рейно. Крім того, пентоксифілін діє як імуномодулятор, пригнічуючи вироблення фактора некрозу пухлин (TNF) і стимулюючи колагеназу для обмеження синтезу колагену [14].
Ніфедипін менш ефективний, ніж лозартан, у лікуванні васкулоспастичних епізодів Рейно. Лозартан, окрім зниження трансформуючого фактора росту бета-1 (TGF-β1), чинить позитивний вплив на серцевий і легеневий фіброз і покращує прогноз склеродермічного ниркового кризу [3]. Ендотеліальні клітини, пошкоджені при ССД, виробляють надлишок оксиду азоту (NO), що призводить до зниження рівня ендотеліальної синтази NO (eNOS). L-аргінін, попередник NO, покращує клінічну картину при феномені Рейно та стан кровообігу в цілому. Це спостереження підтверджує використання гелю на основі NO для покращання шкірної васкуляризації або інгаляційного введення NO та простациклінів через їх легеневі судинорозширювальні ефекти.
При легеневій артеріальній гіпертензії показані антагоністи рецепторів ендотеліну та інгібітори фосфодіестерази-5. Простаноїди, такі як ілопрост, рекомендуються при рефрактерних випадках синдрому Рейно, які не реагують на пероральні вазодилататори [10].
Лікування легеневої гіпертензії передбачає також такі лікарські засоби, як ріоцигуат і селексипаг. Ріоцигуат, який застосовують протягом 12 тиж, покращує здатність до ходьби та толерантність до фізичних навантажень, а також знижує інтенсивність задишки шляхом зниження судинного опору та посилення вивільнення N-кінцевого поліпептиду натрійуретичного гормону (NT-proBNP) [3]. Селексипаг, пероральний селективний агоніст рецепторів простацикліну, був ефективним у зменшенні вираженості ускладнень порівняно з плацебо в дослідженні GRIPHON [15]. Бозентан і ситаксентан викликають подібні результати при лікуванні артеріальної легеневої гіпертензії, пов’язаної з ССД, особливо у випадках більшої тяжкості порівняно з ідіопатичною легеневою гіпертензією [16].
Ситаксентан є альтернативою, коли бозентан неефективний і виявляє нижчу гепатотоксичність [17]. Результати дослідження AMBITION свідчать, що комбінована терапія амбризентаном і тадалафілом є більш ефективною, ніж монотерапія, що сприяє нижчому рівню госпіталізації (4% проти 12%). Проте необхідні подальші дослідження для визначення оптимальних комбінацій лікарських засобів і контексту їх застосування.
Ремоделювання легеневих капілярів при ССД обмежує використання вазодилататорів, оскільки вони можуть спровокувати набряк легень, пов’язаний із венооклюзійним захворюванням [18]. У деяких випадках ССД може бути пов’язаний з легеневою тромбоемболією, що підвищує тиск у легеневій артерії. У таких ситуаціях може бути доречним хірургічне лікування або можна розглянути стимулятори гуанілатциклази, такі як ріоцигуат.
У літературі наголошується також на фізичній та трудотерапії, спрямованій на покращання функції рук, особливо хапання. Фіорі та його дослідницька група виявили, що присутність домашніх тварин і собак під час лікування інфузією ілопросту позитивно вплинула на відчуття болю, підвищивши прихильність до лікування та знизивши тривогу [19]. У рамках вітчизняних стаціонарів практика залучення тварин-компаньйонів для терапії аутоімунних захворювань не застосовується. Проте варто зазначити, що фізіотерапевтичні процедури входять до звичного пакету послуг, які за потреби може отримати пацієнт.
У підсумку слід зазначити, що терапевтичні стратегії, які використовуються в українських стаціонарах, відповідають міжнародним стандартам та рекомендаціям та спрямовані на патогенетичну та симптоматичну терапію ССД. Проте нерозвиненою залишається ніша таргетної терапії, що спричиняє труднощі у процесі досягнення оптимальних результатів менеджменту пацієнтів із ССД.
Список використаної літератури
- 1. Doskaliuk B., Zaiats L., Yatsyshyn R. et al. (2020) Pulmonary involvement in systemic sclerosis: exploring cellular, genetic and epigenetic mechanisms. Rheumatol. Int.; 40(10): 1555–1569. doi: 10.1007/s00296-020-04658-6.
- 2. Sierra‑Sepúlveda A., Esquinca‑González A., Benavides‑Suárez S.A. et al. (2019) Systemic sclerosis pathogenesis and emerging therapies, beyond the fibroblast. Biomed. Res. Int.: 4569826.
- 3. Bobeica C., Niculet E., Tatu A.L. et al. (2022) Old and new therapeutic strategies in systemic sclerosis (Review). Experimental and Therapeutic Medicine; 23 (2): 134. doi.org/10.3892/etm.2021.11057.
- 4. Kowal-Bielecka O., Fransen J., Avouac J. et al. (2017) Update of EULAR recommendations for the treatment of systemic sclerosis. Ann. Rheum. Dis., Aug; 76(8): 1327–1339. doi: 10.1136/annrheumdis-2016-209909.
- 5. Hussain Y., Khan H. (2022) Immunosuppressive Drugs. Encyclopedia of Infection and Immunity: 726–40. doi: 10.1016/B978-0-12-818731-9.00068-9.
- 6. Asano Y. (2020) The Pathogenesis of Systemic Sclerosis: An Understanding Based on a Common Pathologic Cascade across Multiple Organs and Additional Organ-Specific Pathologies. J. Clin. Med., Aug 19; 9(9): 2687. doi: 10.3390/jcm9092687.
- 7. van den Hoogen F., Khanna D., Fransen J. et al. (2013) 2013 classification criteria for systemic sclerosis: an American college of rheumatology/European league against rheumatism collaborative initiative. Ann. Rheum. Dis., Nov; 72(11): 1747–55. doi: 10.1136/annrheumdis-2013-204424.
- 8. Matsumoto Y., Hayashi H., Tahara K. et al. (2019) Intravenous cyclophosphamide for gastric antral vascular ectasia associated with systemic sclerosis refractory to endoscopic treatment: A case report and review of the pertinent literature. Intern. Med. 58: 135–139.
- 9. Konma J., Kotani T., Shoda T. et al. (2019) Efficacy and safety of combination therapy with prednisolone and oral tacrolimus for progressive interstitial pneumonia with systemic sclerosis: A retrospective study. Mod. Rheumatol., 28: 1009–1015.
- 10. Barsotti S., Orlandi M., Codullo V. et al. (2019) One year in review 2019: Systemic sclerosis. Clin. Exp. Rheumatol., 37 (Suppl. 119): S3–S14.
- 11. Denton C.P. (2016) Advances in pathogenesis and treatment of systemic sclerosis. Clin. Med. (Lond), 16: 55–60.
- 12. Khor C.G., Chen X.L., Lin T.S. et al. (2014) Rituximab for refractory digital infarcts and ulcers in systemic sclerosis. Clin. Rheumatol., 33: 1019–1020.
- 13. Bobeică C., Tatu A.L., Crăescu M. et al. (2020) Dynamics of digital ulcers in systemic sclerosis. Exp. Ther. Med., 20: 61–67.
- 14. Thakkar V., Nikpour M., Stevens W.M. et al. (2015) Prospects for improving outcomes in systemic sclerosis‑related pulmonary hypertension. Intern. Med. J., 45: 248–254.
- 15. Simonneau G., Torbicki A., Hoeper M.M. et al. (2012) Selexipag: an oral, selective prostacyclin receptor agonist for the treatment of pulmonary arterial hypertension. Eur. Respir. J., Oct; 40(4): 874–80. doi: 10.1183/09031936.00137511.
- 16. Rubin L.J., Badesch D.B., Barst R.J. et al. (2002) Bosentan therapy for pulmonary arterial hypertension. N. Engl. J. Med., Mar 21; 346(12): 896–903. doi: 10.1056/NEJMoa012212.
- 17. Nosrati M., Shahmirzadi N.A., Afzali M. et al. (2020) Cost-utility analysis of Macitentan Vs. Bosentan in pulmonary atrial hypertension. J. Family Med. Prim. Care. Jul 30; 9(7): 3634–3638. doi: 10.4103/jfmpc.jfmpc_1166_19.
- 18. Koito H. (2012) Pulmonary arterial hypertension due to pulmonary veno-occlusive disease in systemic sclerosis: Importance of early diagnosis and cautious use of pulmonary vasodilator therapy. J. Cardiol. Cases. May 16; 5(3): e175–e178. doi: 10.1016/j.jccase.2012.03.001.
- 19. Fiori G., Marzi T., Bartoli F. et al. (2018) The challenge of pet therapy in systemic sclerosis: Evidence for an impact on pain, anxiety, neuroticism and social interaction. Clin. Exp. Rheumatol., 36 (Suppl. 113): 135–141.
Адреса для листування:
E-mail: yatsyshyn25@gmail.com

Leave a comment