УЛЬТРАСТРУКТУРНІ ОСОБЛИВОСТІ АЛЬВЕОЛОЦИТІВ І ТА ІІ ТИПІВ ПРИ ЕКСПЕРИМЕНТАЛЬНОМУ МОДЕЛЮВАННІ СИСТЕМНОЇ СКЛЕРОДЕРМІЇ ТА ПРИ ЇЇ КОРЕКЦІЇ
Резюме. Мета. Перевірити гіпотезу про можливу ефективність вітаміну D3 (віт. D) та альфа-токоферолу ацетат (віт. Е) на морфологічну структуру альвеолоцитів І (АІ) та ІІ (АІІ) типу. Матеріали та методи. У ході роботи використано лабораторних тварин лінії Wistar 220–240 г, які були розділені на 4 групи: інтактну (ІГ), контрольну (КГ), експериментальну групу 1 (ЕГ1) та експериментальну групу 2 (ЕГ2). Тваринам ЕГ1 вводили NaClO в дозі 0,5 мл 5% розчину тричі на тиждень підшкірно впродовж 6 тиж. У ЕГ2 додатково також проводилася внутрішньом’язова ін’єкція віт. D (1000 МО/100 г) та віт. Е (10 мг/100 г) внутрішньом’язово. Результати. Проведене електронно-мікроскопічне дослідження показало, що введення віт. D та віт. Е чинить позитивний вплив на структуру альвеолоцитів легень, зменшуючи патологічні зміни, такі як агрегація гранул хроматину, деструкція мітохондрій та розриви плазмолеми. Також застосування цих препаратів допомогло зменшити вираженість набрякових змін у клітинних структурах АІ та АІІ типу. У АІІ типу виявлено також покращання структурних характеристик пластинчастих тілець. Висновки. Отримані результати свідчать про потенційну користь використання вітаміну D3 та альфа-токоферолу ацетату при корекції респіраторних уражень, асоційованих із системною склеродермією.
DOI: 10.32471/rheumatology.2707-6970.92.17801
УДК: 616-092+616.24+616-018.2+616-08+616-092.9
Вступ
Системна склеродермія (ССД) — це хронічне, як правило, прогредієнтне аутоімунне захворювання, основними патологічними механізмами якого є імунні порушення, васкулопатія та розвиток фіброзу [1]. Незважаючи на добре встановлені основні принципи патологічних змін в організмі хворих на ССД, у детальній картині розуміння ініціації та прогресування захворювання все ще бракує фрагментів. Отже, на даний час не існує переломних здобутків у боротьбі з несприятливими наслідками ССД, особливо у разі ураження легень.
У серії досліджень отримано гетерогенні результати щодо поширеності інтерстиціального захворювання легень (ІЗЛ), асоційованого із ССД (ССД-ІЗЛ). Згідно з епідеміологічними даними, частота ІЗЛ коливається в межах 30–80% [2–4]. До того ж 30–35% усіх випадків смерті, пов’язаних із ССД, спровоковані саме ІЗЛ [5].
Клінічний перебіг ІЗЛ надзвичайно різноманітний і непередбачуваний. Як приклад, деякі пацієнти можуть бути стабільними або мати повільне зниження легеневої функції. В інших можуть відмічати раптове прогресування симптомів ІЗЛ або значне збільшення площі уражень впродовж короткого періоду [6, 7], що асоціюється з вищою смертністю [8].
Незважаючи на встановлений зв’язок між ССД-ІЗЛ та захворюваністю і смертністю від ССД, досі немає консенсусу ні щодо скринінгу ІЗЛ, ні щодо моніторингу прогресування захворювання. Окрім цього, відсутня чітка стратегія менеджменту пацієнтів із ССД-ІЗЛ [9]. Пацієнтам із дифузним ССД і факторами ризику швидкого прогресування ІЗЛ зазвичай призначають імуносупресанти для лікування основного захворювання. Однак оскільки запалення та фіброз можуть співіснувати на ранніх стадіях ССД-ІЗЛ, ці пацієнти також можуть отримати користь від антифіброзної терапії. Здійснення ранньої корекції для стабілізації функції легень є важливою ланкою у менеджменті ССД-ІЗЛ [10]. На даний час єдиним антифіброзним препаратом, що отримав схвалення для застосування у пацієнтів із ССД, є нінтеданіб. Цей препарат є внутрішньоклітинним інгібітором тирозинкіназ, який чинить антифіброзну та протизапальну дію, пригнічуючи патогенетичні шляхи, залучені у розвиток ССД-ІЗЛ [11]. Саме через нестачу патогенетично обґрунтованих методів терапії досі слід вважати актуальним пошук додаткових методів корекції патологічних змін, залучених у прогресування ІЗЛ у пацієнтів із ССД.
Патогенез ССД-ІЗЛ включає складну мережу клітинних взаємодій та реакцій, яка в результаті призводить до порушення архітектоніки легеневої тканини та судин [12]. Клітинне середовище легень досить широке і містить різноманітні типи клітин, кожна з яких виконує визначені функції.
Метою цього дослідження є перевірка гіпотези щодо сприятливого впливу вітаміну D3 (віт. D) та альфа-токоферолу ацетату (віт. Е) на морфологічну структуру елементів паренхіми легень, зокрема на альвеолоцити І (АІ) типу та на альвеолоцити ІІ (АІІ) типу.
Матеріали і методи дослідження
Методологічна основа цього дослідження знаходиться у повній відповідності з оновленими рекомендаціями Animal Research: Reporting of In Vivo Experiments (ARRIVE) 2 щодо звітності про дослідження на тваринах [13].
Піддослідні тварини, їх утримання, догляд та нагляд
У ході проведення експериментального дослідження використано статевозрілих щурів лінії Вістар масою тіла 220–240 г, отриманих з віварію Івано-Франківського національного медичного університету (ІФНМУ). Впродовж усього терміну експерименту піддослідні тварини перебували у задовільних умовах. Усі процедури на тваринах проводилися із суворим дотриманням біоетичних принципів медичної та біологічної експериментальної роботи, як це передбачено положеннями Європейської конвенції про захист хребетних тварин, які використовуються для досліджень та інших наукових цілей. Дослідження схвалено комісією з етики ІФНМУ за № 117/20 від 19.11.2020 р.
Дизайн дослідження
У рамках цього дослідження лабораторних тварин було розділено на 4 окремі групи: інтактну групу (ІГ) — 15 тварин, контрольну групу (КГ) — 20 тварин, експериментальну групу 1 (ЕГ1) та експериментальну групу 2 (ЕГ2) — 25 тварин кожна. Для забезпечення справедливого розподілу щурів поміж вказаних груп ми ретельно виконали рандомізацію, використовуючи метод мінімізації розбіжностей маси тіла. Забір зразків тканинних матеріалів та плазми крові проводили вранці перед щоденним годуванням, що допомогло знизити ризик можливих побічних ефектів, пов’язаних із щоденним ритмом і біологічною активністю тварин.
Методологія рандомізації
Щоб знизити ризик можливих помилок під час втручання, тварин з однієї групи було розміщено в спільних маркованих клітках. Процес втручання не можна було замаскувати, оскільки ізотонічний розчин і гіпохлорит натрію (NaClO) мають видимі відмінності, а інтактна група взагалі не потребувала втручання. Однак кожен зразок тканини лабораторних тварин був закодований окремо для забезпечення чистоти проведення електронної мікроскопії.
Моделювання CCД
Нами було проведено індукцію ССД у піддослідних тварин наступним методом: тварини отримували підшкірні ін’єкції 0,5 мл 5% NaClO тричі на тиждень впродовж 6 тиж поспіль, як повідомлялося раніше [14]. Контрольна група лабораторних щурів отримувала ізотонічний розчин за такою ж схемою введення. Лабораторні тварини інтактної групи не піддавалися ятрогенному впливу. Лабораторним тваринам з ЕГ2 крім NaClO вводили розчин віт. Е 10 мг/100 г маси тіла внутрішньом’язово та розчин віт. D 1000 МО/100 г маси тіла внутрішньом’язово протягом 3 тиж (друга половина експерименту). Дослідним контрольній та інтактній групам провели евтаназію методом декапітації через 8 тиж від початку експерименту під тіопенталовим наркозом (внутрішньом’язово в дозі 10 мг/100 г маси щура).
Електронно-мікроскопічне дослідження
Для електронної мікроскопії використані зразки тканин нижньої частки лівої легені. Забір тканинного матеріалу проведений під кетаміновою анестезією та відповідав стандартним нормам щодо швидкості та атравматичності. Для виготовлення препаратів, призначених для електронно-мікроскопічного аналізу, використано стандартну методику, описану детально в попередніх публікаціях [15]. Зразки тканин вивчали на електронному мікроскопі «ПЕМ-125К» (Selmi, Україна) та фотографували в подальшому при збільшеннях від 2000 до 20 000 разів.
Результати
У ході проведення ультраструктурного аналізу продемонстровано, що через 2 міс після початку експерименту ядра багатьох АІ типу були з матриксом низької електронно-оптичної щільності і маргінальною агрегацією гранул хроматину (рис. 1). Ядерна оболонка має хвилясті контури та утворює неглибокі інвагінації. Перинуклеарний простір розширений. Мітохондрії збільшені за розміром з поодинокими редукованими кристами. У деяких клітинах виявлена деструкція крист. Поряд з розширеними цистернами апарату Гольджі визначається фрагментація мембран гранулярної ендоплазматичної сітки. Базальна мембрана (БМ) на значному проміжку потовщена з нечіткими контурами. У периферичних відділах окремих клітин відмічаються локальні розриви апікальної плазмолеми, що призводять до викиду внутрішньоклітинного вмісту в просвіт альвеоли.
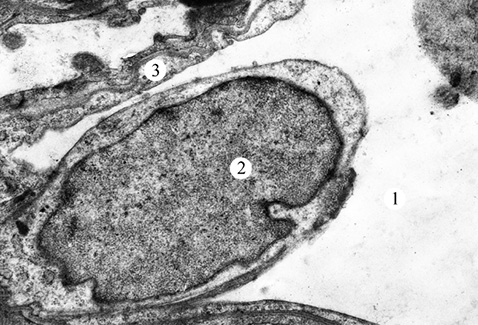
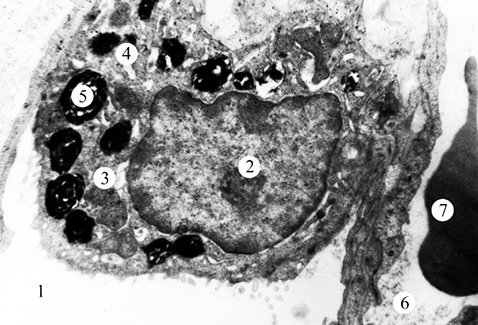
Порушення ультраструктурної організації відмічали і в АІІ типу (рис. 2). Ядра клітин — з нуклеоплазмою низької електронно-оптичної щільності. Навколоядерний простір розширений. Мітохондрії збільшені за об’ємом з поодинокими кристами. Цистерни апарату Гольджі розширені. Канальці гранулярної ендоплазматичної сітки розширені, зі зменшеною кількістю рибосом. Виявлено також фрагментацію мембрани гранулярної ендоплазматичної сітки. Деякі пластинчасті тільця частково заповнені осміофільним матеріалом. В окремих АІІ типу на місці пластинчастих тілець виявляли вакуолі із залишками мембран. На плазмолемі апікальної ділянки клітин відмічені поодинокі невисокі мікроворсинки. БМ — потовщена.
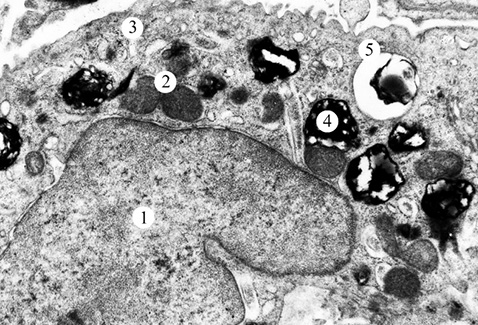
Результати електронно-мікроскопічного дослідження зразків тканин ЕГ2 засвідчили, що введення віт. D та віт. Е призводить до зменшення вираженості набрякових явищ в АІ та АІІ типів (рис. 3, 4). Ядра АІ типу — помірної електронної щільності. Перинуклеарний простір локально розширений. Деякі мітохондрії набряклі, з дезорганізованими кристами. Цистерни і канальці апарату Гольджі та гранулярної ендоплазматичної сітки дещо розширені. У периферичній частині АІ типу відмічається підвищена кількість мікропіноцитозних пухирців. БМ окремих клітин потовщена.
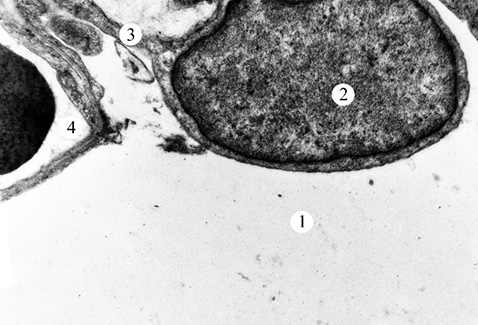
В АІІ типу на даний період дослідження ядра з дрібнозернистою нуклеоплазмою і маргінальним розміщенням гранул хроматину. Перинуклеарний простір локально розширений. Мітохондрії різної величини та форми. Окремі мітохондрії з просвітленим матриксом. Цистерни і канальці апарату Гольджі та гранулярної ендоплазматичної сітки помірно розширені. У цитоплазмі АІІ типу виявлено підвищену кількість пластинчастих тілець. На апікальній поверхні клітин виявлена велика кількість мозаїчно розміщених мікроворсинок. БМ — локально потовщена.
Обговорення
Наше дослідження наводить експериментальні дані щодо ультраструктурної організації АІ та АІІ типів при моделюванні ССД та подальшої її корекції шляхом введення віт. D та віт. Е. Ми звернули увагу саме на ці клітини, адже незважаючи на те, що альвеолоцити критично важливі для підтримки гомеостазу в легенях, вичерпних даних щодо їх субмікроскопічної будови при розглянутій патології недостатньо.
АI типу утворюють епітеліальний шар альвеол і є важливим елементом аерогематичного бар’єру. Результати нашого дослідження підтверджують порушення структури цих клітин при розвитку ремоделювання респіраторного відділу легень. Окрім цього, вони відповідають науковій гіпотезі щодо ініціації ідіопатичного легеневого фіброзу. Згідно з даною гіпотезою, першочерговим тригером процесів структурної перебудови аерогематичного бар’єру є пошкодження саме AI, що вистилають більшу частину альвеолярної поверхні [16]. Коли AI типу пошкоджені, AII типу піддаються гіперпластичній проліферації для захисту пошкоджених базальних мембран [17].
АII типу — клітини, що активно секретують. Ці клітини виробляють низку сурфактантних протеїнів, зокрема таких, як поверхнево-активний білок D (SP-D) [18]. Важливо зазначити, що попри свою першочергову функцію у підтримці поверхневого натягу в альвеолах, АІІ типу також здатні сприяти розвитку процесів ремоделювання легень шляхом продукування інтерлейкіну (IL)-6 та IL-8, молекули міжклітинної адгезії-1, фактора некрозу пухлини (TNF)-α та -β, тромбоцитарного фактора росту (PDGF) [12]. PDGF, в свою чергу, є потужним модулятором активності фібробластів і тригером синтезу колагену цими клітинами [19]. TGF-β активує фібробласти та індукує синтез протеїнів позаклітинного матриксу [20]. АІІ типу також є основним джерелом тканинного фактора, який регулює відкладення фібрину [21]. Доведено, що АІІ типу внаслідок впливу TGF-β здійснюють епітеліально-мезенхімальний перехід і з часом перетворюються на фібробласти [17], що робить їх важливою ланкою патогенезу на ранніх стадіях процесу ремоделювання респіраторного відділу легень при ССД.
Кілька досліджень відзначили SP-D як надійний діагностичний біомаркер для ССД-ІЗЛ [22, 23]. Антитіла проти топоізомерази I в комбінації з SP-D в сироватці крові забезпечують посилення значення останнього для діагностики ІЗЛ з 97% чутливістю та 69% специфічністю. З іншого боку, лише SP-D недостатньо для прогнозування перебігу і тяжкості захворювання [22]. Проте Yamakawa та співавтори [23] повідомили, що підвищений SP-D є надійним предиктором зниження форсованої життєвої ємності легень при ССД-ІЗЛ, що підтверджено багатофакторним логістичним регресійним аналізом.
Крім того, його концентрація в плазмі крові може свідчити про ефективність антифіброзної терапії [24]. Інше дослідження показало, що ступінь зниження рівня SP-D під час терапії циклофосфамідом може передбачити відповідь на лікування [25]. Таким чином, різниця в рівнях SP-D між EГ1 і EГ2 може підтвердити гіпотезу про те, що віт. D і віт. E позитивно впливають на ремоделювання легень.
У попередній роботі нами проаналізовано ефективність використання віт. D та віт. Е у фокусі стабілізації функціонування АІІ типу [26]. Контрольна група тварин характеризувалася значно нижчими показниками SP-D, ніж особини з ЕГ1 (78,10 [40,80–100,40] та 123,75 [108,80–145,03] відповідно, p<0,05). При порівнянні результатів проведеного імуноферментного аналізу серед тварин ЕГ1 та ЕГ2 виявлено статистично достовірні відмінності (490,20 [156,20–605,70] та 123,75 [108,80–145,03] відповідно, p<0,05). Ці експериментальні дані доводять покращання функціональної здатності АІІ типу при використанні комбінації віт. D та віт. Е.
Одним із обмежень цього дослідження є те, що воно проводилося на тваринній моделі, а отже, результати не можуть бути безпосередньо застосованими у клінічній практиці і потребують подальшої апробації в клінічних умовах. Окрім цього, ефект віт. D та віт. Е вивчався у короткостроковій перспективі, що не дає можливості стверджувати стосовно збереження позитивного впливу впродовж тривалого часу. Незважаючи на ці недоліки, наше дослідження є одним з небагатьох, яке надає вичерпні дані щодо морфологічної перебудови АІ та АІІ при експериментальному індукуванні ССД. А підтвердження позитивного впливу віт. D та віт. Е при спробі корекції описаних змін дає змогу розглядати цю комбінацію як можливий елемент комплексного менеджменту ССД.
Висновки
Беручи до уваги позитивні результати дослідження, можна стверджувати, що використана модель корекції може бути ефективною у спробах забезпечення цілісності та функціональної ефективності АІ та АІІ типу.
Список використаної літератури
- 1. Cottin V., Brown K.K. (2019) Interstitial lung disease associated with systemic sclerosis (SSc–ILD) Respir. Res.; 20(1): 13. doi: 10.1186/s12931-019-0980-7.
- 2. Hax V., Bredemeier M., Didonet Moro A.L. et al. (2017) Clinical algorithms for the diagnosis and prognosis of interstitial lung disease in systemic sclerosis. Semin. Arthritis Rheum.; 47(2): 228–234. doi: 10.1016/j.semarthrit.2017.03.019.
- 3. Steen V.D., Medsger T.A. (2007) Changes in causes of death in systemic sclerosis, 1972–2002. Rheum. Dis.; 66: 940– 4.
- 4. Schoenfeld S.R., Castelino F.V. (2015) Interstitial lung disease in scleroderma. Rheum. Dis. Clin. N. Am.;41(2): 237–248. doi: 10.1016/j.rdc.2014.12.005.
- 5. Strollo D., Goldin J. (2010) Imaging lung disease in systemic sclerosis. Curr. Rheumatol. Rep.; 12(2): 156–161. doi: 10.1007/s11926-010-0095-0.
- 6. Wijsenbeek M., Suzuki A., Maher T.M. (2022) Interstitial Lung Diseases. Lancet; 400: 769–786. doi: 10.1016/S0140-6736(22)01052-2.
- 7. Landini N., Orlandi M., Bruni C. et al. (2022) Computed Tomography Predictors of Mortality or Disease Progression in Systemic Sclerosis–Interstitial Lung Disease: A Systematic Review. Front. Med.; 8: 807982. doi: 10.3389/fmed.2021.807982.
- 8. Distler O. et al. (2020) Predictors of progression in systemic sclerosis patients with interstitial lung disease. Eur. Respir. J.; 55(5): 1–12. doi: 10.1183/13993003.02026-2019.
- 9. Kennedy B., Branagan P., Moloney F. et al. (2015) Biomarkers to identify ILD and predict lung function decline in scleroderma lung disease or idiopathic pulmonary fibrosis. Sarcoidosis. Vasc. Diffuse Lung. Dis.; 32: 228–236.
- 10. Hoffmann-Vold A.-M., Maher T.M., Philpot E.E. et al. (2020) The identification and management of interstitial lung disease in systemic sclerosis: evidence-based European consensus statements. Lancet Rheumatol.; 2: e71–83. doi:10.1016/S2665-9913(19)30144-4.
- 11. Wollin L., Distler J.H.W., Redente E.F. et al. (2019) Potential of nintedanib in treatment of progressive fibrosing interstitial lung diseases. Eur. Respir. J.; 54: 1900161. doi:10.1183/13993003.00161-2019.
- 12. Doskaliuk B., Zaiats L., Yatsyshyn R. et al. (2020) Pulmonary involvement in systemic sclerosis: exploring cellular, genetic and epigenetic mechanisms. Rheumatol. Int. Oct; 40(10): 1555–1569. doi: 10.1007/s00296-020-04658-6.
- 13. Percie du Sert N., Hurst V., Ahluwalia A. et al. (2020) The ARRIVE guidelines 2.0: Updated guidelines for reporting animal research. PLoS Biol.; 14; 18(7): e3000410. doi: 10.1371/journal.pbio.3000410.
- 14. Doskaliuk B., Zaiats L. Yatsyshyn RAB0090 (2021) The biochemical basis of animal model of systemic sclerosis. Annals of the Rheumatic Diseases; 80: 1074.
- 15. Doskaliuk B., Zaiats L. (2023) Structural and functional characteristics of the pulmonary hemomicrocirculatory bed in induced systemic sclerosis: an experimental study. Rheumatol. Int. Jul; 43(7): 1341–1347. doi: 10.1007/s00296-023-05328-z.
- 16. Günther A., Korfei M., Mahavadi P. et al. (2012) Unravelling the progressive pathophysiology of idiopathic pulmonary fibrosis. Eur. Respir. Rev.; 21: 152–160.
- 17. Bagnato G., Harari S. (2015) Cellular interactions in the pathogenesis of interstitial lung diseases. Eur. Respir. Rev. Mar; 24(135): 102–14. doi: 10.1183/09059180.00003214.
- 18. Bonhomme O., André B., Gester F. et al. (2019) Biomarkers in systemic sclerosis-associated interstitial lung disease: review of the literature. Rheumatology; 58(9): 1534–46. dx.doi.org/10.1093/rheumatology/kez230.
- 19. Makino K., Makino T., Stawski L. et al. (2017) Blockade of PDGF receptors by crenolanib has therapeutic effect in patient fibroblasts and in preclinical models of systemic sclerosis. J. Invest. Dermatol.; 137(8): 1671–81. doi.org/10.1016/j.jid.2017.03.032.
- 20. Goldmann T., Zissel G., Watz H. et al. (2018) Human alveolar epithelial cells type II are capable of TGFβ-dependent epithelial-mesenchymal-transition and collagen-synthesis. Respir. Res.; 19(1): 138. doi.org/10.1186/s12931-018-0841-9.
- 21. Novelli F., Neri T., Tavanti L. et al. (2014) Procoagulant, tissue factor-bearing microparticles in bronchoalveolar lavage of interstitial lung disease patients: an observational study. PloS one; 28; 9(4): e95013. doi.org/10.1371/journal.pone.0095013.
- 22. Elhai M., Hoffmann-Vold A.M., Avouac J. et al. (2019) Performance of candidate serum biomarkers for systemic sclerosisinterstitial lung disease. Arthritis Rheumatol.; 71: 972–82. doi.org/10.1002/art.40815.
- 23. Yamakawa H., Hagiwara E., Kitamura H. et al. (2017) Serum KL-6 and surfactant protein-D as monitoring and predictive markers of interstitial lung disease in patients with systemic sclerosis and mixed connective tissue disease. J. Thorac. Dis.; 9(2): 362–71. doi.org/10.21037/jtd.2017.02.48.
- 24. Ikeda K., Shiratori M., Chiba H. et al. (2017) Serum surfactant protein D predicts the outcome of patients with idiopathic pulmonary fibrosis treated with pirfenidone. Respir. Med.; 131: 184–191.
- 25. Sumida H., Asano Y., Tamaki Z. et al. (2018) Prediction of therapeutic response before and during i.v. cyclophosphamide pulse therapy for interstitial lung disease in systemic sclerosis: a longitudinal observational study. J. Dermatol.; 45: 1425–1433.
- 26. Doskaliuk B., Zaiats L. Yatsyshyn RPOS0483 (2022) The effect of vitamin D3 and α-tocopherol acetate in the preclinical model of systemic sclerosis. Annals of the Rheumatic Diseases; 81: 496. dx.doi.org/10.1136/annrheumdis-2022-eular.3061.
Адреса для листування:
E-mail: doskaliuk_bo@ifnmu.edu.ua

Leave a comment