ПРОГНОЗУВАННЯ РИЗИКУ КОМОРБІДНОСТІ У ПАЦІЄНТІВ З ПОДАГРОЮ
Сміян С.І., Маховська О.Ю., Сверстюк А.С., Мігенько Л.М., Кулешко І.І.
Резюме. Подагра — це гіперурикемічний метаболічний стан, що має причинно-наслідкову парадигму з частими коморбідними захворюваннями. Саме тому перспективним завданням є визначення факторів ризику розвитку коморбідності (РРК) при подагрі з метою їх модифікації. Мета роботи: розробити алгоритм та математичну модель прогнозування коефіцієнту РРК у хворих з подагрою. Матеріали та методи. Обстежено 136 пацієнтів з подагрою з різним модифікованим для подагри індексом коморбідності ревматичного захворювання (mRDCI): 20 — з mRDCI 0, 28 — з mRDCI 1–2, 62 — з mRDCI 3–4, 26 — з mRDCI ≥5, а також 31 практично здорову особу, щоб запропонувати підхід до прогнозування РРК за допомогою багатофакторного регресійного аналізу. Для перевірки якості прогностичної моделі використовували коефіцієнт детермінації (R2), а для оцінки прийнятності моделі — аналіз ANOVA. Результати. Виявлено найбільш значущі фактори РРК у пацієнтів з подагрою (p<0,05) за даними багатофакторного регресійного аналізу, а саме: затримка встановлення діагнозу подагра, тривалість подагри, шкала активності хвороби, частота контролю рівня сечової кислоти у крові за останній рік, Health Assessment Questionnaire Disability Index, психологічний компонент здоров’я за 36-Item Short Form Health Survey Questionnaire, індекс маси тіла, розрахункова швидкість клубочкової фільтрації, сироватковий рівень холестеролу ліпопротеїнів низької густини, С-реактивного білка, інтерлейкіну (ІЛ)-6, ІЛ-8, та співвідношення адипонектин/лептин. Створена прогностична модель для визначення коефіцієнта РРК (КРРК), використовуючи дані коефіцієнтів регресії «В» вищезазначених предикторів. Для стратифікації РРК у хворих з подагрою запропоновано наступні критерії: відсутність ризику при КРРК ≤3; низький ризик — 3<КРРК≤9, середній ризик — 9<КРРК<18, високий ризик — 18≤КРРК<30, критичний РРК — КРРК ≥30. Значимий рівень прийнятності прогностичної моделі РРК підтверджується результатами аналізу ANOVA (p<0,001), а висока якість моделі — отриманим коефіцієнтом детермінації (R2=0,98). Висновки. Вперше запропоновані алгоритм та математична модель прогнозування РРК при подагрі мають високу прийнятність та якість. Розроблена прогностична модель дасть змогу своєчасно визначати та проводити моніторинг пацієнтів із критичним ступенем РРК, а також сприятиме створенню адаптованих програм профілактики коморбідної патології у пацієнтів з подагрою.
DOI: 10.32471/rheumatology.2707-6970.92.17764
УДК 616-002.79-037-06
ВСТУП
Поширеність та захворюваність на подагру зростає в усьому світі за рахунок складної взаємодії екологічних, соціально-демографічних і географічних факторів [1]. Подагра розглядається як гіперурикемічний метаболічний стан, що асоціюється з причинно-наслідковими кардіометаболічними та нирковими захворюваннями. Коморбідні стани зумовлюють підвищення загальної передчасної смертності, медичні витрати, втрату працездатності, ускладнення перебігу та терапії подагри, посилюючи глобальний тягар подагри [2, 3]. Крім того, подагра пов’язана із вищою вірогідністю встановлення діагнозу, госпіталізацією та смертю при COVID-19, що є наслідком гіперурикемії та широкого спектра коморбідностей у цій когорті [4, 5].
Вважається, що подагра — це хронічне системне запальне захворювання, зумовлене активацією уратами прозапальних цитокінів (інтерлейкіну (ІЛ)-1α, ІЛ-1β, ІЛ-6, ІЛ-8, ІЛ-18 та фактора некрозу пухлини альфа (TNF-α) [6, 7]. Констатовано, що вищі циркулюючі рівні ІЛ-6 пов’язані з обтяженим клінічним перебігом подагри [8], а сироваткові рівні ІЛ-8 підвищуються як під час гострої фази, так і при інтермітуючій подагрі [9].
Останнім часом обговорюється роль дисадипокінемії (підвищення лептину (Л), зниження адипонектину (А) та співвідношення А/Л) у контексті вищої активності, індексу тяжкості перебігу ревматологічного захворювання, а також прогностичного біомаркера метаболічного та серцево-судинного ризику [10, 11]. Проте для визначення, як сироватковий профіль ІЛ та адипокінів асоціюється з коморбідним статусом при подагрі, необхідні подальші дослідження.
Саме тому перспективним завданням є своєчасне визначення факторів ризику розвитку коморбідності (РРК) у пацієнтів з подагрою з метою їх модифікації у реальній клінічній практиці.
Мета роботи — розробити алгоритм та математичну модель прогнозування коефіцієнту РРК у пацієнтів з подагрою.
МАТЕРІАЛИ ТА МЕТОДИ ДОСЛІДЖЕННЯ
Обстежено 136 хворих на подагру чоловічої статі, які перебували на лікуванні в ревматологічному відділенні Комунального некомерційного підприємства «Тернопільська обласна клінічна лікарня» Тернопільської обласної ради (ТОР) у період 2019–2022 рр. Середній вік пацієнтів (M±SD) становив 50,49±6,39 року з тривалістю недуги (M±SD) 9,9±6,01 року. Детальні клініко-лабораторні параметри перебігу подагри та характеристика патернів коморбідності включених пацієнтів з подагрою описана у нашій попередній публікації [12]. Контрольна група — 31 практично здорова особа чоловічої статі (середній вік 50,33±5,74 року), відбір яких проводився з урахуванням відсутності хронічних захворювань.
Це дослідження проведено після схвалення комітетом з етики людини Тернопільського національного медичного університету імені І.Я. Горбачевського МОЗ України (протокол № 54 від 27 серпня 2019 р.). Усі пацієнти підписали інформовану згоду на участь у дослідженні.
Діагноз подагри встановлювали згідно з класифікаційними критеріями Американського коледжу ревматології та Європейської антиревматичної ліги (нині — Європейський альянс асоціацій ревматологів) (ACR/EULAR) 2015 р. [13]. Для визначення функціонального статусу користувалися опитувальником стану здоров’я — Health Assessment Questionnaire Disability Index (HAQ-DI) [14]. Для оцінки якості життя проводили анкетування за опитувальником 36-Item Short Form Health Survey Questionnaire (SF-36), що складається з фізичного (SF-36 ФКЗ) та психологічного компонентів здоров’я (SF-36 ПКЗ) [15]. Для аналізу активності подагри використовували шкалу активності подагри Gout Activity Score (GAS 3-step-c) [16].
Коморбідні захворювання встановлювали згідно з даними медичного катанамнезу. За настановами Всесвітньої організації охорони здоров’я, ожиріння верифікували за показником індексу маси тіла (ІМТ) [17]. Функцію нирок оцінювали згідно з розрахунковою швидкістю клубочкової фільтрації (рШКФ), яку обчислювали за допомогою рівняння Chronic Kidney Disease Epidemiology Collaboration (CKD-EPI) із врахуванням рівня креатиніну у крові [18].
Сироваткові рівні цитокінів (ІЛ-6 та ІЛ-8) визначали методом імуноферментного аналізу із застосуванням тест-систем виробництва Joint Stock Company «Vector-Best». Імуноферментне визначення циркулюючого вмісту адипокінів проводили за допомогою стандартних наборів фірми «Diagnostics Biochem Canada Inc.». Для комплексної оцінки дисадипокінемії розраховували співвідношення між вмістом адипонектину у мкг/мл та лептину у нг/мл. Визначення концентрації цитокінів та адипокінів у сироватці крові проводили на імуноферментному аналізаторі «Multiskan FС 357» у Міжкафедральній навчально-дослідній лабораторії Тернопільського національного медичного університету ім. І.Я. Горбачевського МОЗ України. Референтними значеннями сироваткових рівнів ІЛ-6 вважали до 10 пг/мл; для ІЛ-8 — до 10 пг/мл; лептину — до 5,6 нг/мл у пацієнтів з нормальним ІМТ, адипонектину — залежно від ІМТ (для ІМТ<25 кг/м2 — 3,4–19,5 мкг/мл, при ІМТ 25–30 кг/м2 — у межах 2,6–13,7 мкг/мл, для ІМТ ≥30 кг/м2 — 1,8–9,4 мкг/мл).
Рівні сечової кислоти (СК), креатиніну, загального холестеролу (ЗХ), холестеролу ліпопротеїнів високої щільності (ХС ЛПВЩ), тригліцеридів (ТГ) у сироватці крові визначали ферментативно-колориметричним методом на аналізаторі Соbas Integra 800 тест-системою Roche Diagnostics (Німеччина). ХС ліпопротеїнів низької щільності (ЛПНЩ) розраховували за формулою Friedwald. Визначення рівня С-реактивного білка у плазмі венозної крові проводили імунотурбідиметричним методом із латексним підсиленням з використанням наборів фірми Roche Diagnostics (Німеччина) на аналізаторі Соbas Integra 800. Вищезазначені дослідження проводили у клініко-діагностичній лабораторії КНП «Тернопільська обласна клінічна лікарня» ТОР.
Коморбідний статус оцінювали за допомогою модифікованого для подагри індексу коморбідності ревматичного захворювання (англ. the gout-specifically modified Rheumatic Diseases Comorbidity Index — mRDCI) для кожного пацієнта з подагрою [19]. Після цього провели аналіз та індексацію 19 потенційних факторів РРК (табл. 1).
O. Chukur та співавтори (2022) розглянули підхід до прогнозування ризику розвитку клімактеричного синдрому [20] з використанням універсальних статистичних програм «Microsoft Excel 2016» та «Statistica 10.0» (StatSoft. Inc.). Аналогічний підхід використано для побудови регресійної моделі РРК. Проаналізовано 19 ймовірних предикторів виникнення коморбідності у пацієнтів з подагрою (див. табл. 1).
Таблиця 1. Потенційні фактори РРК та їх індексація у пацієнтів з подагрою
| Індексація | Назви факторів та їх можливих діапазонів | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Вік, роки | Затримка встановлення діагнозу подагри, роки | Тривалість подагри, роки | GAS | Частота контролю рівня СК у крові за останній рік | УЗТ, добова доза | HAQ-DI | SF-36ФКЗ | SF-36ПКЗ | ІМТ,кг/м2 | |
| 0 | <40 | 0 | 0 | <4 | ≥2 | Адекватна | 0 | ≥50 | ≥50 | <25 |
| 1 | 40–49 | 1–3 | 1–5 | 4–4,9 | 1 | Недостатня | ≤1,0 | 50–30 | 50–30 | 25–29 |
| 2 | 50–59 | 4–6 | 6–10 | 5–5,9 | 0 | Без УЗТ | 1–2 | <30 | <30 | 30–34 |
| 3 | ≥60 | 7–9 | 11–15 | 6–6,9 | >2 | 35–39 | ||||
| 4 | ≥10 | 16–20 | 7–7,9 | ≥40 | ||||||
| 5 | >20 | ≥8 | ||||||||
Таблиця 1 (продовження)
| Індексація | Назви факторів та їх можливих діапазонів | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| рШКФ,мл/хв/1,73 м2 | ЗХ,ммоль/л | ХС ЛПВЩ,ммоль/л | ХС ЛПНЩ,ммоль/л | ТГ,ммоль/л | СРБ,мг/л | ІЛ-6,пг/мл | ІЛ-8,пг/мл | СпіввідношенняA/Л | |
| 0 | ≥90 | <5,2 | ≥1,03 | <3,4 | <1,7 | <5 | ≤10 | ≤10 | ≥1 |
| 1 | 60–90 | 5,2–6,2 | <1,03 | 3,4–4 | 1,7–2,24 | 5–9 | 10–15 | 10–15 | 0,8–1,0 |
| 2 | 45–59 | ≥6,2 | 4,1–4,8 | 2,25–5,64 | 10–19 | 16–20 | 16–20 | 0,6–0,7 | |
| 3 | 30–44 | ≥4,9 | ≥5,65 | 20–29 | 21–25 | 21–25 | 0,4–0,5 | ||
| 4 | 15–29 | ≥30 | 26–30 | 26–30 | 0,2–0,3 | ||||
| 5 | <15 | >30 | >30 | <0,2 | |||||
Примітка. GAS — шкала активності подагри (англ. Gout Activity Score 3 step-c); СК — сечова кислота; УЗТ — уратзнижувальна терапія; HAQ–DI — Health Assessment Questionnaire Disability Index; SF-36 ФКЗ — фізичний компонент здоров’я за 36-Item Short Form Health Survey Questionnaire; ПКЗ — психологічний компонент здоров’я; ІМТ — індекс маси тіла; рШКФ — розрахункова швидкість клубочкової фільтрації; ЗХ — загальний холестерол; ХС ЛПВЩ — холестерол ліпопротеїнів високої щільності; ХС ЛПНЩ — холестерол ліпопротеїнів низької щільності; ТГ — тригліцериди; СРБ — C-реактивний білок; ІЛ-6 — інтерлейкін-6; ІЛ-8 — інтерлейкін-8; співвідношення A/Л: співвідношення адипонектин/лептин.
Для оцінки значущості впливу цих факторів виконано покроковий багатофакторний регресійний аналіз. Початковий етап включав побудову кореляційної матриці, а також підтверджено відсутність мультиколінеарних зв’язків між факторами РРК (r>0,7). Після цього обчислено коефіцієнти регресії «В», які показують для кожного окремого предиктора відношення щодо впливу на РРК в обстежених пацієнтів. Фактори, у яких рівень значущості р>0,05, поетапно виключені з багатофакторного регресійного аналізу в такому порядку: вік, ХС ЛПВЩ, уратзнижувальна терапія (УЗТ), ЗХ, тригліцериди та SF-36 ФКЗ. На наступному етапі дослідження за повторним аналізом кореляційної матриці з врахуванням 13 предикторів встановлено відсутність мультиколінеарних факторів. Потім побудовано багатофакторну регресійну модель з врахуванням 13 достовірних факторів для прогнозування РРК. У підсумку, серед 19 проаналізованих предикторів відібрано 13 достовірних факторів, що найвагоміше впливають на РРК. Для перевірки якості прогностичної моделі використовували критерій детермінації Нейджелкерка (R2), а для оцінки прийнятності моделі — аналіз ANOVA.
РЕЗУЛЬТАТИ
Включені в дослідження пацієнти з подагрою були розподілені на 4 клінічні групи: I група (n=20) — хворі з mRDCI 0; II група (n=28) — пацієнти з mRDCI 1–2; III група (n=62) — пацієнти з mRDCI 3–4; IV група (n=26) — пацієнти з mRDCI≥5.
За математичну модель узято результати багатофакторного регресійного аналізу, який дає змогу за даними коефіцієнтів регресії «В» та значень предикторів, що чинять значний вплив на РРК, спрогнозувати критичний ступінь РРК у пацієнтів з подагрою. Побудовано багатофакторну регресійну модель із врахуванням лише 13 достовірних факторів для прогнозування РРК (табл. 2). Враховуючи значення коефіцієнтів багатофакторного регресійного аналізу, звертаємо увагу, що значущими предикторами були саме модифікуючі фактори РРК. На основі отриманих результатів, які наведені у табл. 2, створено математичну модель для визначення КРРК:
Таблиця 2. Коефіцієнти моделі за багатофакторним регресійним аналізом для визначення РРК у пацієнтів з подагрою із врахуванням 13 достовірних предикторів коморбідності
| Умовні позначення факторів у математичній моделі прогнозування | Назва предикторів | Коефіцієнт регресії (В) | Стандартна похибка, SE (В) | Значення,р |
|---|---|---|---|---|
| Х1 | Затримка встановлення діагнозу подагри, роки | 0,473 | 0,079 | 0,0000 |
| Х2 | Тривалість подагри, роки | 0,128 | 0,035 | 0,0003 |
| Х3 | GAS | 0,931 | 0,117 | 0,0000 |
| Х4 | Частота контролю рівня СК у крові за останній рік | –0,835 | 0,195 | 0,0000 |
| Х5 | HAQ-DI | 2,181 | 0,504 | 0,0000 |
| Х6 | SF-36 ПКЗ | –0,099 | 0,026 | 0,0002 |
| Х7 | ІМТ, кг/м2 | 0,276 | 0,042 | 0,0000 |
| Х8 | рШКФ, мл/хв/1,73 м2 | –0,032 | 0,008 | 0,0001 |
| Х9 | ХС ЛПНГ, ммоль/л | 0,746 | 0,168 | 0,0000 |
| Х10 | СРБ, мг/л | 0,108 | 0,023 | 0,0000 |
| Х11 | ІЛ-6, пг/мл | 0,267 | 0,024 | 0,0000 |
| Х12 | ІЛ-8, пг/мл | 0,192 | 0,022 | 0,0000 |
| Х13 | Співвідношення A/Л | –0,508 | 0,254 | 0,04 |
ККРК = (Х1·0,473) + (Х2·0,128) + (Х3·0,931) — (Х4·0,835) + (Х5·2,181) — (Х6·0,099) + (Х7·0,276) — (Х8·0,032) + (Х9·0,746) + (Х10·0,108) + (Х11·0,267) + (Х12·0,192) — (Х13·0,508),
де КРРК — коефіцієнт ризику розвитку коморбідності; X1–X13 — значимі предиктори РРК з коефіцієнтами регресії «В».
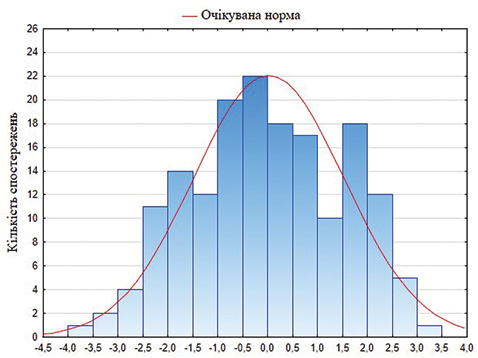
Для аналізу якості багатофакторної регресійної моделі оцінено залишкові відхилення (рис. 1). Як показано на гістограмі, залишкові відхилення розподілені симетрично, наближаючись до кривої нормального розподілу залишків, тому статистична гіпотеза про їх розподіл на відповідність нормальному закону розподілу не відхиляється.
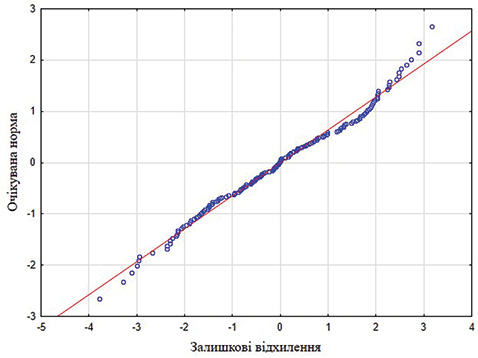
Також побудовано нормально-ймовірнісний графік для підтвердження нормального закону розподілу залишкових відхилень (рис. 2). Дані графіка свідчать про відсутність систематичних відхилень від нормально-ймовірнісної прямої. Це вказує на те, що залишкові відхилення розподілені за нормальним законом розподілу.
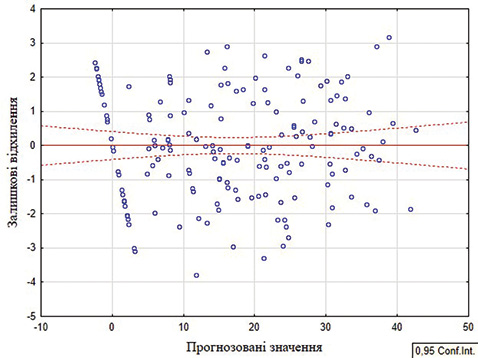
Для перевірки залежності залишкових відхилень від прогнозованих значень збудовано діаграму розсіювання (рис. 3). На основі отриманих результатів можна зробити висновок про те, що залишки відносно прогнозованих значень розсіяні хаотично. Це вказує на відсутність залежності залишків від прогнозованих величин РРК. Гістограма та нормально-ймовірнісний графік підтверджують відповідніcть нормальному закону розподілу залишкових відхилень. Саме тому отримана модель прогнозування коморбідності вважається якісною та адекватною.
Для оцінки прийнятності моделі в цілому проведено аналіз ANOVA (табл. 3) та розраховано фактичне значення залежної змінної КРРК у пацієнтів з подагрою. Отримані дані свідчать про високий рівень прийнятності моделі прогнозування РРК в цілому, оскільки рівень значущості p<0,0001, а сама модель працюватиме краще, ніж простий прогноз, використовуючи середні значення.
Таблиця 3. Результат оцінки прийнятності моделі для прогнозування РРК у пацієнтів з подагрою з використанням аналізу ANOVA
| Суми квадратів відхилень (Sums of squares of deviations) | Кількість незалежних значень (Degrees of freedom) | Середньоквадратичне відхилення (Mean square value) | Критерій Фішера | р-значення | |
|---|---|---|---|---|---|
| Між групами | 23717,17 | 13 | 1824,4 | 715,57 | p<0,0001 |
| Всередині груп | 390,08 | 153 | 2,55 | ||
| У підсумку | 24107,26 |
Для додаткового оцінювання якості математичної моделі РРК проаналізовано коефіцієнт детермінації Нейджелкерка (R2), який показує, яка частина факторів врахована при прогнозуванні. Його розглядають як універсальну міру зв’язку однієї випадкової величини з іншими. Коефіцієнт детермінації змінюється від 0 до 1. Чим більше його значення наближається до «1», тим більш якісна багатофакторна регресійна модель. У запропонованій математичній моделі прогнозування РРК коефіцієнт детермінації дорівнює R2=0,98. Таким чином, 98% факторів враховано в моделі прогнозування РРК. Коефіцієнт детермінації підкреслює, наскільки отримані спостереження підтверджують математичну модель РРК.
З метою класифікації РРК обчислено значення фактичного КРРК у хворих з подагрою. Запропоновано 4 ступені РРК:
0 ступінь — відсутність РРК (числове значення КРРК ≤3);
I ступінь — низький РРК (3<КРРК≤9);
II ступінь — середній РРК (9<КРРК<18);
III ступінь — високий РРК (18≤КРРК<30);
IV ступінь — критичний РРК (КРРК ≥30).
Значення КРРК було в межах від 0 до 43 та вказувало на ризик виникнення коморбідності. Чим вище значення КРРК, тим вищий РРК у пацієнтів з подагрою.
Результати дослідження виявили, що прогноз фактичної залежної змінної КРРК очікувався таким: із відсутністю РРК — у 31 (18,56%) практично здорового чоловіка, із низьким ступенем РРК — у 20 (11,98%) пацієнтів з подагрою, із середнім ступенем РРК — у 35 (20,96%) пацієнтів з подагрою, з високим ступенем РРК — у 51 (30,54%) пацієнта з подагрою, а з критичним ступенем РРК — у 30 (17,96%) обстежених з подагрою.
У групі з теоретично очікуваним низьким КРРК, за вищеописаною математичною моделлю, прогнозоване значення низького КРРК констатовано у 17 (10,18%) хворих на подагру, що вказує на високу чутливість прогностичної моделі. Підтверджена також висока точність розробленої моделі у 28 (16,77%) пацієнтів з подагрою, у яких прогнозували РРК із середнім ступенем імовірності, у 45 (26,95%) — РРК із високим ступенем ймовірності та у 29 (17,37%) — із критичним ступенем РРК. У 29 (17,37%) практично здорових осіб прогнозовано відсутність РРК.
У подальших наукових дослідженнях необхідно провести ROС-аналіз запропонованої моделі РРК при подагрі для визначення її чутливості, специфічності та прогностичної точності.
ОБГОВОРЕННЯ
На основі отриманих результатів багатофакторного регресійного аналізу акцентуємо увагу, що значущими предикторами РРК були тривалість та активність подагри. Висновки попередніх досліджень свідчать, що неконтрольована гіперурикемія та подагра є прогностичними факторами розвитку артеріальної гіпертензії (АГ), метаболічного синдрому, цукрового діабету (ЦД) 2-го типу, ішемічної хвороби серця (ІХС), гіпертрофії лівого шлуночка, фібриляції передсердь, інфаркту міокарда, інсульту, серцевої недостатності та хронічної хвороби нирок (ХХН) [21, 22]. Існує також двоспрямований зв’язок між гіперурикемією та атерогенною дисліпідемією [23], яка в подальшому є фактором ризику розвитку супутніх серцево-судинних захворювань (ССЗ) [24].
Відомо, що погано контрольована подагра пов’язана з підвищеною частотою загострення цієї патології [25]. Крім того, напади подагри асоціюються з підвищенням частоти гострого інфаркту міокарда або інсульту після нападу [26].
Як було показано, цільове лікування хронічної подагри, а саме регулярний прийом та титрування дози УЗТ для досягнення сироваткового рівня СК <360 мкмоль/л, може запобігти не лише частим загостренням [27], а й поширеності та тяжкості коморбідних захворювань у пацієнтів з подагрою [28, 29, 30], а також покращити ліпідний профіль [31].
Окремі дослідження свідчать про те, що погіршення фізичного функціонування та якості життя може бути зумовлено не лише клінічною артритичною симптоматикою подагри, а й частою коморбідною патологією у пацієнтів з подагрою [14, 19]. Ці дані підкреслюють важливість таргетного ведення коморбідного хворого з подагрою для підвищення якості життя.
Відомо, що ниркова дисфункція зменшує екскрецію СК нирками. На сьогодні експериментальні дані підтверджують те, що гіперурикемія ініціює оксидативний стрес й ендотеліальну дисфункцію, що є причиною клубочкової гіпертензії з підвищенням судинного опору та зниженням ниркового кровообігу. Більше того, підвищений сироватковий рівень СК спричиняє фіброз нирки на клітинному рівні, як при ХХН. Повідомляється про зменшення вираженості тубулоінтерстиціальної травми, спричиненої гіперурикемією при зниженні рівня СК. Враховуючи ці дані, гіперурикемія може бути пов’язана із субклінічним ураженням нирок тривалий час, зумовлювати маніфестацію та прогресування ХХН [32]. Існує також кілька інших механізмів розвитку ХХН при подагрі. Ураження нирок може бути наслідком коморбідної АГ та ЦД, а також застосування нестероїдних протизапальних препаратів. Все частіше наголошується, що запалення при подагрі зберігається і в період між гострими нападами подагри, як це описано і для інших аутоімунних запальних артропатій, що викликає вищий судинний ризик [33].
Основними генетичними висновками Framingham Heart Study and the Hypertension Genetic Epidemiology Network study були наступні: креатинін генетично корелював лише з уратами, а індекс маси тіла (ІМТ) — з уратами, систолічним артеріальним тиском та глюкозою [34].
Наступним вагомим предиктором ризику коморбідності при подагрі є хронічне системне запалення, зумовлене підвищенням сироваткових рівнів прозапальних ІЛ-6 та ІЛ-8. P.M. Ridker і співавтори (2022) повідомили, що підвищення циркулюючого рівня ІЛ-6 пов’язане із підвищенням на 42% частоти несприятливих серцево-судинних подій у хворих із подагрою [35]. Останніми роками зроблено значний внесок у вивчення прозапальної дії ІЛ-8, TNF-α у патофізіології ЦД 2-го типу [36], ІЛ-1β, ІЛ-6 — при ЦД, ХХН та ССЗ [37]. Отже, інгібування прозапальних цитокінів має фармакологічний потенціал при кардіометаболічних розладах у пацієнтів з подагрою.
Достовірним фактором РРК при подагрі було знижене співвідношення А/Л у нашому дослідженні. Окремі науковці підтверджують обтяжливий взаємозв’язок між зниженням співвідношення А/Л та ЦД 2-го типу, АГ, атеросклерозом, серцево-судинною дисфункцією, метаболічним синдромом [11, 38]. Саме тому спрямованість на збільшення А та зниження Л розглядається як перспектива серцево-судинної безпеки.
Вищеописані літературні тенденції підтверджують результати проведеного нами багатофакторного регресійного аналізу з виділенням найбільш значущих факторів РРК у пацієнтів з подагрою.
Ми визнаємо деякі обмеження нашого дослідження. По-перше, ми включили малу кількість хворих на подагру (n=136). Більша вибірка може забезпечити кращу статистичну оцінку. По-друге, результати нашого дослідження необхідно перевірити на амбулаторній когорті пацієнтів з подагрою, оскільки хворих набирали лише в стаціонарних умовах і, можливо, наша вибірка представляє тяжку форму захворювання. По-третє, ми не враховували вплив гетерогенного патогенетичного або симптоматичного лікування подагри. По-четверте, у цьому дослідженні ми не визначали прихильність до УЗТ, яка є низькою у клінічній практиці (у межах 17–83,5%) [39].
ВИСНОВКИ
Вперше запропонований алгоритм та математична модель прогнозування РРК при подагрі мають високу прийнятність та якість. Розроблена прогностична модель дасть змогу своєчасно визначати та проводити моніторинг пацієнтів із критичним ступенем РРК, а також сприятиме створенню адаптованих програм профілактики коморбідної патології у пацієнтів з подагрою.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
- 1. Jeong Y.J., Park S., Yon D.K. et al. (2023) Global burden of gout in 1990-2019: A systematic analysis of the Global Burden of Disease study 2019. Eur. J. Clin. Invest., 53(4): e13937. DOI:10.1111/eci.13937.
- 2. Afinogenova Y., Danve A., Neogi T. (2022) Update on gout management: what is old and what is new. Curr. Opin. Rheumatol., 34(2): 118–124. DOI: 10.1097/BOR.0000000000000861.
- 3. Choi H.K., McCormick N., Yokose C. (2022) Excess comorbidities in gout: the causal paradigm and pleiotropic approaches to care. Nat. Rev. Rheumatol., 18(2): 97–111. DOI: 10.1038/s41584-021-00725-9.
- 4. Conway R., Nikiphorou E., Demetriou C.A. et al. (2023) Outcomes of COVID-19 in people with rheumatic and musculoskeletal disease in Ireland over the first 2 years of the pandemic [published online ahead of print, 2023 Jan 9]. Ir. J. Med. Sci., 1–6. DOI:10.1007/s11845-022-03265-7.
- 5. Topless R.K., Gaffo A., Stamp L.K. et al. (2022) Gout and the risk of COVID-19 diagnosis and death in the UK Biobank: a population-based study. Lancet Rheumatol., 4(4): e274–e281. DOI:10.1016/S2665-9913(21)00401-X.
- 6. Joosten L.A.B., Crişan T.O., Bjornstad P. et al. (2020) Asymptomatic hyperuricaemia: a silent activator of the innate immune system. Nat. Rev. Rheumatol., 16(2): 75–86. DOI: 10.1038/s41584-019-0334-3.
- 7. Scanu A., Oliviero F., Luisetto R. et al. (2021) Effect of pathogenic crystals on the production of pro- and anti-inflammatory cytokines by different leukocyte populations. Immunobiology, 226(1): 152042. DOI: 10.1016/j.imbio.2020.152042.
- 8. Cavalcanti N.G., Marques C.D., Lins E. et al. (2016) Cytokine Profile in Gout: Inflammation Driven by IL-6 and IL-18? Immunol. Invest., 45(5): 383–95. DOI: 10.3109/08820139.2016.1153651.
- 9. Kienhorst L.B., van Lochem E., Kievit W. et al. (2015) Gout Is a Chronic Inflammatory Disease in Which High Levels of Interleukin-8 (CXCL8), Myeloid-Related Protein 8/Myeloid-Related Protein 14 Complex, and an Altered Proteome Are Associated With Diabetes Mellitus and Cardiovascular Disease. Arthritis Rheumatol., 67(12): 3303–3313. DOI: 10.1002/art.39318.
- 10. Targońska-Stępniak B., Grzechnik K. (2022) Adiponectin and Leptin as Biomarkers of Disease Activity and Metabolic Disorders in Rheumatoid Arthritis Patients. J. Inflamm. Res., 15: 5845–5855. DOI:10.2147/JIR.S380642.
- 11. Zhao S., Kusminski C.M., Scherer P.E. (2021) Adiponectin, Leptin and Cardiovascular Disorders. Circ. Res., 128(1): 136–149. DOI: 10.1161/CIRCRESAHA.120.314458.
- 12. Smiyan S., Makhovska O. (2022) Сomorbidity and its impact on the course of gout and COVID-19. Proceeding of the Shevchenko Scientific Society. Medical Sciences, 66(1): 148–158. DOI: 10.25040/ntsh2022.01.14.
- 13. Neogi T., Jansen T.L., Dalbeth N. et al. (2016) 2015 Gout classification criteria: an American College of Rheumatology/European League Against Rheumatism collaborative initiative. Ann. Rheum. Dis., 74(10): 1789–1798. DOI:10.1136/annrheumdis-2015-208237.
- 14. Chandratre P., Mallen C., Richardson J. et al. (2018) Health-related quality of life in gout in primary care: Baseline findings from a cohort study. Semin. Arthritis Rheum., 48(1): 61–69. DOI: 10.1016/j.semarthrit.2017.12.005.
- 15. Lins L., Carvalho F.M. (2016) SF-36 total score as a single measure of health-related quality of life: Scoping review. SAGE Open. Med., 4: 2050312116671725. DOI:10.1177/2050312116671725.
- 16. Scirè C.A., Carrara G., Viroli C. et al. (2016) Development and First Validation of a Disease Activity Score for Gout. Arthritis Care Res. (Hoboken), 68(10): 1530–1537. DOI: 10.1002/acr.22844.
- 17. Bağcı A., Aksoy F., Baş H.A. et al. (2021) The effect of systolic and diastolic blood pressure on Tp-e interval in patients divided according to World Health Organization classification for body mass index. Clin. Exp. Hypertens., 43(7): 642–646. DOI:10.1080/10641963.2021.1925684.
- 18. Stevens P.E., Levin A., Kidney Disease: Improving Global Outcomes Chronic Kidney Disease Guideline Development Work Group Members (2013) Evaluation and management of chronic kidney disease: Synopsis of the Kidney Disease: Improving Global Outcomes 2012 Clinical practice Guideline. Ann. Intern. Med., 158(11): 825–830. DOI:10.7326/0003-4819-158-11-201306040-00007.
- 19. Spaetgens B., Wijnands J.M., van Durme C. et al. (2015) Content and construct validity of the Rheumatic Diseases Comorbidity Index in patients with gout. Rheumatology (Oxford), 54(9): 1659–1663. DOI:10.1093/rheumatology/kev030.
- 20. Chukur O., Pasyechko N., Bob A. et al. (2022) Prediction of climacteric syndrome development in perimenopausal women with hypothyroidism. Menopause Review/Przegląd Menopauzalny, 21(4): 236–241. DOI:10.5114/pm.2022.123522.
- 21. Borghi C., Agabiti-Rosei E., Johnson R.J. et al. (2020) Hyperuricaemia and gout in cardiovascular, metabolic and kidney disease. Eur. J. Intern. Med., 80: 1–11. DOI: 10.1016/j.ejim.2020.07.006.
- 22. Francis-Sedlak M., LaMoreaux B., Padnick-Silver L. et al. (2021) Characteristics, Comorbidities, and Potential Consequences of Uncontrolled Gout: An Insurance-Claims Database Study. Rheumatol Ther., 8(1): 183–197. DOI: 10.1007/s40744-020-00260-1.
- 23. Choi H.G., Kwon B.C., Kwon M.J. et al. (2022) Association between Gout and Dyslipidemia: A Nested Case-Control Study Using a National Health Screening Cohort. J. Pers. Med., 12(4): 605. DOI:10.3390/jpm12040605.
- 24. Mach F., Baigent C., Catapano A.L. et al. (2020) 2019 ESC/EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk. Eur. Heart. J., 41(1): 111–188. DOI:10.1093/eurheartj/ehz455.
- 25. Liang J., Jiang Y., Huang Y. et al. (2021) Comorbidities and factors influencing frequent gout attacks in patients with gout: a cross-sectional study. Clin. Rheumatol., 40(7): 2873–2880. DOI: 10.1007/s10067-021-05595-w.
- 26. Cipolletta E., Tata L.J., Nakafero G. et al. (2022) Association Between Gout Flare and Subsequent Cardiovascular Events Among Patients With Gout. JAMA, 328(5): 440–450. DOI: 10.1001/jama.2022.11390.
- 27. Doherty M., Jenkins W., Richardson H. et al. (2018) Efficacy and cost-effectiveness of nurse-led care involving education and engagement of patients and a treat-to-target urate-lowering strategy versus usual care for gout: a randomised controlled trial. Lancet, 392(10156): 1403–1412. DOI:10.1016/S0140-6736(18)32158-5.
- 28. Yoshida K., Liu J., Solomon D. et al. (2021) Comparative Safety of Gout «Treat-to-target» and «Usual Care» Treatment Strategies on Cardiovascular Outcomes Using Observational Data: Causal Inference Approach [abstract]. Arthritis Rheumatol., 73 (9). Available from: acrabstracts.org/abstract/comparative-safety-of-gout-treat-to-target-and-usual-care-treatment-strategies-on-cardiovascular-outcomes-using-observational-data-causal-inference-approach/. Accessed December 15, 2022.
- 29. Levy G.D., Rashid N., Niu F. et al. (2014) Effect of urate-lowering therapies on renal disease progression in patients with hyperuricemia. J. Rheumatol., 41(5): 955–962. DOI: 10.3899/jrheum.131159.
- 30. Gupta M.K., Singh J.A. (2019) Cardiovascular Disease in Gout and the Protective Effect of Treatments Including Urate-Lowering Therapy. Drugs. 79(5): 531-541. DOI:10.1007/s40265-019-01081-5.
- 31. Fang Y.J., Wu T.Y., Lin C.L. et al. (2020) Effects of Urate-Lowering Therapy on Risk of Hyperlipidemia in Gout by a Population-Based Cohort Study and on In Vitro Hepatic Lipogenesis-Related Gene Expression. Mediators Inflamm., 2020: 8890300. DOI: 10.1155/2020/8890300.
- 32. Khanna P., Johnson R.J., Marder B. et al. (2020) Systemic Urate Deposition: An Unrecognized Complication of Gout? J. Clin. Med., 9(10): 3204. DOI: 10.3390/jcm9103204.
- 33. Roughley M.J., Belcher J., Mallen C.D. et al. (2015) Gout and risk of chronic kidney disease and nephrolithiasis: meta-analysis of observational studies. Arthritis Res Ther., 17(1): 90. DOI: 10.1186/s13075-015-0610-9.
- 34. Reynolds R.J., Irvin M.R., Bridges S.L. et al. (2021) Genetic correlations between traits associated with hyperuricemia, gout, and comorbidities. Eur. J. Hum. Genet., 29(9): 1438–1445. DOI: 10.1038/s41431-021-00830-z.
- 35. Ridker P.M., MacFadyen J.G., Thuren T. et al. (2020). Residual inflammatory risk associated with interleukin-18 and interleukin-6 after successful interleukin-1β inhibition with canakinumab: further rationale for the development of targeted anti-cytokine therapies for the treatment of atherothrombosis. Eur. Heart J., 41(23): 2153–2163. DOI: 10.1093/eurheartj/ehz542.
- 36. Maravilla Domínguez M.A., Zermeño González M.L., Zavaleta Muñiz E.R. et al. (2022) Inflammation and atherogenic markers in patients with type 2 diabetes mellitus. Clin. Investig. Arterioscler., 34(3): 105–112. DOI: 10.1016/j.arteri.2021.03.006.
- 37. Kreiner F.F., Kraaijenhof J.M., von Herrath M. et al. (2022) Interleukin 6 in diabetes, chronic kidney disease, and cardiovascular disease: mechanisms and therapeutic perspectives. Expert. Rev. Clin. Immunol., 18(4): 377–389. DOI: 10.1080/1744666X.2022.2045952.
- 38. Frühbeck G., Catalán V., Rodríguez A. et al. (2019) Adiponectin-leptin Ratio is a Functional Biomarker of Adipose Tissue Inflammation. Nutrients., 11(2): 454. DOI:10.3390/nu11020454.
- 39. Yin R., Li L., Zhang G. et al. (2018) Rate of adherence to urate-lowering therapy among patients with gout: A systematic review and meta-analysis. BMJ Open, 8(4): e017542. DOI:10.1136/bmjopen-2017-017542.
Адреса для листування:
Маховська Ольга Юріївна
46002, Тернопіль, вул. Клінічна, 1
КНП «Тернопільська обласна клінічна лікарня» ТОР, ревматологічне відділення
E-mail: makhovska@tdmu.edu.ua

Leave a comment