РЕЗОЛЮЦІЯ РАДИ ЕКСПЕРТІВ, ПРИСВЯЧЕНОЇ ТЕМІ «ІНТЕРСТИЦІАЛЬНІ ЗАХВОРЮВАННЯ ЛЕГЕНЬ ПРИ СИСТЕМНІЙ СКЛЕРОДЕРМІЇ» (16 грудня 2020 р.)
Резюме. 16 грудня 2020 р. в онлайн-форматі відбулося засідання групи провідних українських експертів-ревматологів «Інтерстиціальні захворювання легень при системній склеродермії» під головуванням доктора медичних наук, професора, академіка Національної академії медичних наук (НАМН) України Володимира Миколайовича Коваленка. У висновках Ради експертів представлені результати обговорення питань діагностики та терапії інтерстиціальних захворювань легень (ІЗЛ) при системній склеродермії (СС). Причиною даного обговорення стала поява нових даних про застосування препарату нінтеданіб у цієї категорії пацієнтів. Так, у дослідженні SENSCIS оцінювали ефективність та безпеку нінтеданібу у 576 пацієнтів з ІЗЛ при СС, які отримали принаймні одну дозу нінтеданібу або плацебо. При вихідній оцінці у 51,9% пацієнтів виявлена дифузна шкірна форма СС, 48,4% пацієнтів отримували мікофенолату мофетил. При аналізі первинної кінцевої точки швидкість зміни функції життєвої ємності легень становила 52,4 мл за рік у групі лікування нінтеданібом і 93,3 мл за рік у групі плацебо (відмінність — 41,0 мл за рік; 95% довірчий інтервал 2,9–79,0; p=0,04). Учасники Ради експертів вважають за доцільне актуалізувати проблему діагностики і терапії ІЗЛ при СС як на національному, так і регіональному рівні; керуватися мультидисциплінарним підходом до діагностики та лікування ІЗЛ при СС з обов’язковим залученням фахівців — ревматолога і рентгенолога (спеціаліста з КТ-діагностики), за необхідності диференційної діагностики в складних клінічних ситуаціях — пульмонолога; рекомендувати включення препарату нінтеданіб в національні та регіональні клінічні рекомендації з лікування ІЗЛ при СС.
DOI: 10.32471/rheumatology.2707-6970.84.16190
 Системна склеродермія (СС) — рідкісне аутоімунне захворювання, що характеризується дисрегуляцією імунної системи, мікросудинними ушкодженнями і фіброзом шкіри та внутрішніх органів [1]. Інтерстиціальні захворювання легень (ІЗЛ) часто відмічають при СС [2, 3]. Вони істотно погіршують якість життя і прогноз захворювання і при прогресуванні стають додатковим тягарем як для пацієнтів, так і для системи охорони здоров’я в цілому [4, 5]. На даний час ІЗЛ є однією з провідних причин смерті, пов’язаних із СС [6].
Системна склеродермія (СС) — рідкісне аутоімунне захворювання, що характеризується дисрегуляцією імунної системи, мікросудинними ушкодженнями і фіброзом шкіри та внутрішніх органів [1]. Інтерстиціальні захворювання легень (ІЗЛ) часто відмічають при СС [2, 3]. Вони істотно погіршують якість життя і прогноз захворювання і при прогресуванні стають додатковим тягарем як для пацієнтів, так і для системи охорони здоров’я в цілому [4, 5]. На даний час ІЗЛ є однією з провідних причин смерті, пов’язаних із СС [6].
Виявлення ураження легень при СС потребує ретельного обстеження, що включає оцінку клінічних проявів, виконання функціональних легеневих тестів (ФЛТ), в тому числі визначення форсованої життєвої ємності легень (ФЖЄЛ), дифузійної здатності легень (ДЗЛ), а також комп’ютерної томографії органів грудної клітини з високою роздільною здатністю (КТВРЗ). Вкрай рідко, особливо в останні роки, проводять біопсію легень з морфологічним дослідженням біоптатів. Як правило, при СС має місце ІЗЛ у вигляді неспецифічної інтерстиціальної пневмонії за морфологічною класифікацією з відповідним рентгенологічним патерном. Ретикулярні зміни у більшості пацієнтів зумовлені потовщенням легеневого інтерстицію з розвитком фіброзних змін.
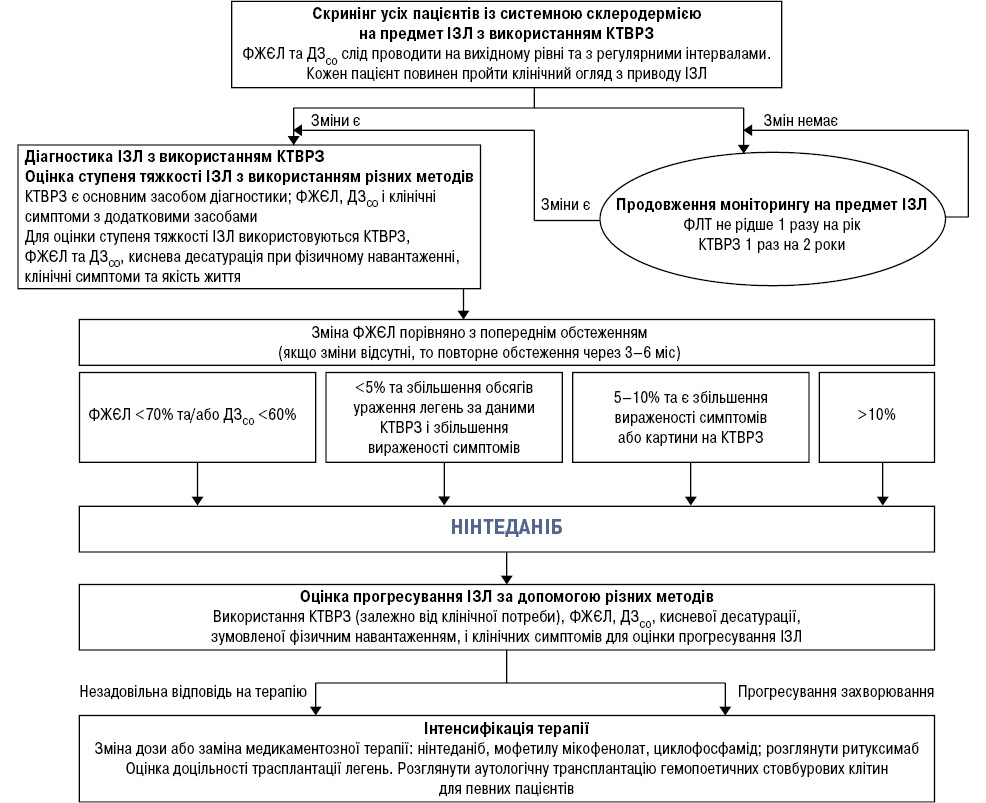
Пацієнтам із СС показано виконання ФЛТ (мінімально це визначення ФЖЄЛ і ДЗЛ) і КТВРЗ як на момент встановлення діагнозу, так і при динамічному спостереженні. Рекомендована кратність проведення для ФЛТ — не рідше 1 разу на рік, КТВРЗ — 1 раз на 2 роки за умови, що пацієнт знаходиться в клінічно стабільному стані. У разі появи клінічних ознак прогресування СС, наявності факторів несприятливого прогнозу або при проведенні активної терапії повторні ФЛТ показано здійснювати кожні 3–6 міс. Повторення КТВРЗ рекомендується при явному клінічному погіршенні та/або клінічно значущому зниженні показників ФЛТ.
Перебіг ІЗЛ при ССД значно варіює за ступенем тяжкості і темпами прогресування. Варіанти перебігу, що відображають темпи прогресування, мають основне значення у виборі тактики ведення хворого. Так, у певної частини пацієнтів ураження легень може мати перебіг без явного прогресування, тому не у всіх випадках необхідно проводити активну терапію.
На підставі даних, отриманих у двох рандомізованих подвійних сліпих дослідженнях (Дослідження склеродермії легень I і II — LS-I і SLS-II) [7, 8], для лікування ІЗЛ при СС часто застосовуються імуносупресанти — мікофенолату мофетил і циклофосфамід. Контроль за ефективністю терапії здійснюють за рівнем ФЖЄЛ. Про ефективність терапії свідчить стабілізація або підвищення рівня ФЖЄЛ. У разі неефективності або непереносимості терапії циклофосфамідом або мікофенолату мофетилом можливе застосування азатіоприну або циклоспорину А. При неефективності імуносупресивної терапії і прогресуванні легеневого фіброзу показана трансплантація легень.
Нині відмічається новий етап вивчення патогенезу СС. Поглиблення уявлень про механізми ушкоджень сприяє вивченню таргетних препаратів. Одним із найбільш вивчених на поточний момент є нінтеданіб — внутрішньоклітинний інгібітор тирозинкіназ [9]. У дослідженні SENSCIS оцінювалися ефективність та безпека нінтеданібу у пацієнтів з ІЗЛ при СС [16]. Це дослідження включало 576 пацієнтів, які отримали принаймні одну дозу нінтеданібу або плацебо. При вихідній оцінці у 51,9% пацієнтів виявлена дифузна шкірна форма СС, 48,4% пацієнтів отримували мікофенолату мофетил. При аналізі первинної кінцевої точки швидкість зміни ФЖЄЛ становила 52,4 мл за рік в групі лікування нінтеданібом і 93,3 мл за рік в групі плацебо (відмінність — 41,0 мл за рік; 95% довірчий інтервал 2,9–79, 0; p=0,04). Між групами відсутні значущі відмінності в динаміці оцінки за модифікованою шкалою шкірних змін Роднана і загальною оцінкою за опитувальником SGRQ. Діарея — найчастіше небажане явище — зареєстрована у 75,7% пацієнтів у групі лікування нінтеданібом і у 31,6% пацієнтів у групі плацебо. Ґрунтуючись на результатах цього дослідження, Управління з контролю за харчовими продуктами і лікарськими засобами США (Food and Drug Administration — FDA) схвалило застосування у пацієнтів з ІЗЛ при СС нінтеданібу як єдиного препарату з доведеним антифібротичним ефектом.
Володимир Миколайович Коваленко, голова Експертної ради, доктор медичних наук, професор, академік НАМН України, президент Асоціації ревматологів України, у своїй вступній промові звернув увагу на необхідність підвищення доступності терапії для пацієнтів ревматологічного профілю в якості одного з основних стратегічних медико-соціальних напрямків в Україні та світі. Також окремо зупинився на поширеності та медико-соціальній актуальності СС з ІЗЛ.
О.Б. Яременко, доктор медичних наук, професор, завідувач кафедри внутрішньої медицини № 3 Національного медичного університету імені О.О. Богомольця, звернув увагу на необхідність діагностики та критерії прогресування ІЗЛ при СС.
Золотим стандартом для діагностики ІЗЛ, в тому числі при СС, вважається КТВРЗ, яка дозволяє не тільки виявити сам факт ураження, а й кількісно його оцінити. Найпоширенішим проявом ІЗЛ у пацієнтів із СС, яке може бути виявлено за допомогою КТВРЗ, є так звана неспецифічна інтерстиціальна пневмонія. Це якраз той самий посилений ретикулярний малюнок і затемнення легеневої тканини за типом матового скла.
Р.І. Яцишин, декан медичного факультету Івано-Франківського національного медичного університету, професор, доктор медичних наук, віцепрезидент Асоціації ревматологів України, зазначив, що ми маємо в арсеналі зовсім небагато засобів, які дозволяють допомогти цим пацієнтам.
Сама проблема лікування, напевно, ще менше вивчена, ніж проблема діагностики та ведення таких пацієнтів. У 2016 р. з’явилася перша публікація рекомендацій Європейської протиревматичної ліги (European Alliance of Associations for Rheumatology — EULAR) з лікування таких пацієнтів, і в 2017 р. їх було доповнено, що дало змогу використовувати ті чи інші засоби з певним рівнем доказовості для різних варіантів СС. Хоча, за великим рахунком, і немає великого арсеналу в лікуванні таких пацієнтів. Зокрема, є метотрексат, який може розглядатися при поєднанні шкірної форми склеродермії з легеневими ураженнями, хоча особливого позитивного впливу у великих дослідженнях не виявлено. За результатами двох якісних контрольованих досліджень можна призначати циклофосфамід.
Але зараз з’явився шанс для наших пацієнтів, тому що ми розуміємо патогенез та патогенетичні схеми, що відіграють головну роль при даному захворюванні, адже при СС профілюючими є судинний фактор росту, фактор росту фібробластів, фактор росту іншого типу. Треба знайти інший препарат, який би зупиняв ці чинники зростання, причому бажано не один з них, а відразу декілька. І ось таким триєдиним напрямком призупинення розвитку факторів росту є новий препарат, який з’явився недавно, — нінтеданіб.
М.М. Островський, завідувач кафедри фтизіатрії і пульмонології з курсом професійних хвороб, лікар-пульмонолог, Національний медичний університет, Центр легеневих захворювань м. Івано-Франківськ, заслужений діяч науки і техніки України, д.м.н., професор, зазначив, що Національний інститут фтизіатрії і пульмонології ім. Ф.Г. Яновського під егідою Юрія Івановича Фещенка має великий досвід лікування пацієнтів з ІЛФ, підтримує інноваційні підходи в лікуванні пацієнтів та надає допомогу хворим на всіх етапах перебігу захворювання легень. На даний час ми не можемо впоратися без антифібротичної терапії. Дані препарати значно уповільнюють річний показник зниження функції легень — приблизно на 50%. Тобто якщо ми говоримо про середню медіану виживаності 2–5 років, то від застосування нінтеданібу, який зможе уповільнити зниження функції легень в 2 рази, повинні були б продовжити до 5, 10 або навіть 12 років. Зниження ФЖЄЛ на 5–10% в нашій пульмонологічній практиці реально підвищує ризик смерті пацієнта більш ніж у 2 рази. Якщо ми можемо відвоювати 3; 4; 5% ФЖЄЛ від застосування препарату ОФЕВ®, ми автоматично знижуємо в 2 рази цей ризик смерті пацієнта. Даний препарат не тільки зменшує ФЖЄЛ, але й знижує ризики. Пацієнти, які застосовують препарат, значно знижують, крім цього, не тільки рівень загострення, але і ризик смертності під час лікування, що теж є дуже великим досягненням.
Т.О. Меффорд, к.м.н., завідувач ревматологічного відділення № 2 Олександрівської клінічної лікарні, вважає дуже важливим те, що препарат не є імуносупресивним, що важливо при лікуванні і тривалому застосуванні нашими пацієнтами. Дослідження, проведені раніше, демонстрували виражений протизапальний ефект безпосередньо в легенях. Дослідження SENSCIS — одне з найбільших досліджень у пацієнтів із СС включало більше 500 пацієнтів з цією патологією, спостереження тривало не менше 100 тиж. Групи рандомізовані за абсолютно однаковими показниками, які були відображені і щодо ураження легень, і вікових показників, і початку захворювання, поділу на дифузний і лімітований підтипи. ОФЕВ® модифікує прогресування захворювання при ІЗЛ-СС, затримуючи зменшення ФЖЄЛ приблизно на ~44% протягом 52 тиж.
За словами доповідача, у нас з’являється шанс підвищити якість життя пацієнтів і, найголовніше, подовжити його тривалість.
О.О. Гарміш, експерт МОЗ України за напрямами «Кардіологія. Ревматологія. Дитяча кардіоревматологія. Функціональна діагностика», старший науковий співробітник відділу некоронарних хвороб серця, ревматології і терапії Державної установи «Національний науковий центр «Інститут кардіології імені академіка М.Д. Стражеска Національної академії медичних наук України», відмітила, що ІЗЛ при СС — дуже гетерогенне захворювання. Тому необхідно ретельно контролювати індивідуальний перебіг хвороби у кожного пацієнта для того, щоб потім з’єднати всі ці дані і зрозуміти, який перебіг захворювання. Лікування слід починати до того, як відбудеться зниження ФЖЄЛ, і прагнути до запобігання прогресуванню.
Для СС як рідкісного захворювання особливо важливо об’єднати дані в більшу когорту. Це можливо лише за участю в регістрах. І тому за ініціативою Всеукраїнської асоціації ревматологів, ми звернулися і заповнили всі необхідні анкети для того, щоб Україна була включена в регістри EUSTAR. Якщо ми братимемо участь у цьому регістрі, то матимемо доступ як до всіх міжнародних даних, так і до даних щодо своєї країни. Вона запропонувала підтримати цю ініціативу.
Підбиваючи підсумки дискусії, академік В.М. Коваленко підкреслив та зробив такі висновки: СС — мультиорганне захворювання зі складним патогенезом і вираженою гетерогенністю клінічних варіантів, тому при плануванні терапії необхідно враховувати такі фактори, як стадія й активність захворювання, швидкість прогресування, характер провідних клінічних проявів, наявність несприятливих факторів прогнозу. При ранній стадії, гострому перебігу і клінічних ознаках загального запального процесу (що включає поліартрит, поліміозит, кардит, серозит та ін.) перевагу доцільно віддавати протизапальній терапії. Якщо ж у якості домінуючого клінічного прояву виступає ІЗЛ, особливо хронічного перебігу, з превалюванням процесів фіброзування, які погано піддаються стандартній терапії імуносупресантами, доцільно розглянути призначення нінтеданібу.
У висновках Ради експертів представлені результати обговорення питань діагностики та терапії ІЗЛ при СС. Причиною цього обговорення послужила поява нових даних про застосування препарату нінтеданіб у цієї категорії пацієнтів.
Терапію препаратом нінтеданіб призначають пацієнтам з урахуванням вихідної тяжкості ІЗЛ, асоційованої з СС, і при очевидному ризику його прогресування. Активна терапія показана хворим з верифікованим за даними КТВРЗ ІЗЛ при СС з клінічними проявами (задишка, кашель) ураження легень і ФЖЄЛ ≤70% та/або ДЗЛ ≤60% від належних величин на момент діагностики [16]. Також терапія може бути ініційована при прогресуванні ІЗЛ при СС, критеріями якого є [17]:
- зниження ФЖЄЛ (в абсолютних значеннях) на 10% і більше від показників попереднього дослідження;
- зниження ФЖЄЛ (в абсолютних значеннях) на 5–10% від показників попереднього дослідження із збільшенням вираженості симптомів (при об’єктивній оцінці);
- зниження ФЖЄЛ (в абсолютних значеннях) на 5–10% від показників попереднього дослідження зі збільшенням обсягів ураження легень за даними КТВРЗ;
- збільшення обсягів ураження легень за даними КТВРЗ і збільшення вираженості симптомів (при об’єктивній оцінці).
Необхідно враховувати представлені критерії тільки за відсутності: 1) даних, що свідчать про наявність легеневої інфекції, альтернативних причин респіраторних симптомів; 2) наростання змін при КТВРЗ при лівошлуночковій серцевій недостатності, тромбоемболії легеневої артерії або інших причинах інтерстиціального ураження легень.
Виходячи з прийнятих критеріїв прогресування ІЗЛ, описаних вище, запропоновано алгоритм призначення антифібротичних препаратів у пацієнтів з ІЗЛ, асоційованим з СС (див. рисунок). Лікування тривале, протягом року і більше, з обов’язковим контролем показників ФЛТ. За необхідності можливе поєднання нінтеданібу з імуносупресантами, зокрема з мікофенолату мофетилом.
Отже, виходячи з викладеного вище, учасники Ради експертів вважають за доцільне:
- актуалізувати проблему діагностики і терапії ІЗЛ при СС як на національному, так і на регіональному рівні;
- керуватися мультидисциплінарним підходом до діагностики та лікування ІЗЛ при СС з обов’язковим залученням фахівців: ревматолога і рентгенолога (спеціаліста з КТ-діагностики), за необхідності диференційної діагностики в складних клінічних ситуаціях — пульмонолога;
- рекомендувати включення препарату нінтеданіб в національні та регіональні клінічні рекомендації з лікування ІЗЛ при СС.
Голова Експертної ради:
Коваленко Володимир Миколайович, д.м.н., професор, академік НАМН України, директор ДУ ННЦ «Інститут кардіології ім. М.Д. Стражеска», президент Всеукраїнської асоціації ревматологів України, м. Київ
Робоча група експертів:
Гнилорибов Андрій Михайлович, д.м.н., професор, керівник центру клінічних досліджень «Клініки сучасної ревматології», м. Київ
Курята Олександр Вікторович, д.м.н., професор, завідувач кафедри госпітальної терапії № 1 та профпатології державного закладу «Дніпропетровська медична академія МОЗ України»
Надашкевич Олег Никонович, д.м.н., професор, ревматолог вищої категорії, академік АН ВО України, завідувач кафедри Львівського національного медичного університету імені Данила Галицького, член президії Асоціації ревматологів України
Островський Микола Миколайович, д.м.н., професор, завідувач кафедри фтизіатрії і пульмонології з курсом професійних хвороб, Національний медичний університет, м. Івано-Франківськ, заслужений діяч науки і техніки України
Рекалов Дмитро Геннадійович, д.м.н., професор, завідувач відділення ревматології Запорізької обласної клінічної лікарні, професор кафедри внутрішніх хвороб № 3 Запорізького державного медичного університету
Станіславчук Микола Адамович, д.м.н., завідувач кафедри внутрішньої медицини № 1 Вінницького національного медичного університету ім. М.І. Пирогова
Яременко Олег Борисович, д.м.н., професор, завідувач кафедри внутрішньої медицини № 3 Національного медичного університету імені О.О. Богомольця, член Президії правління Всеукраїнської асоціації ревматологів України, президент Асоціації ревматологів, м. Київ
Яцишин Роман Іванович, д.м.н., декан медичного факультету Івано-Франківського національного медичного університету, професор, віцепрезидент Всеукраїнської асоціації ревматологів України
Гарміш Олена Олексіївна, к.м.н., старший науковий співробітник відділу некоронарних хвороб серця, ревматології та терапії ДУ ННЦ «Інститут кардіології ім. акад. М.Д. Стражеска», м. Київ
Меффорд Тетяна Олександрівна, к.м.н., завідувач ревматологічного відділення № 2 Олександрівської клінічної лікарні
Синенький Омелян Володимирович, к.м.н., завідувач ревматологічного відділення Львівської обласної клінічної лікарні
Трипілка Світлана Анатоліївна, к.м.н., доцент, головний спеціаліст з ревматології департаменту охорони здоров’я Харківської облдержадміністрації, лікар-ревматолог КНП ХОР «Обласна клінічна лікарня», м. Харків
Василець Вікторія Вікторівна, головний позаштатний ревматолог ДОЗ ОДА, лікар-ревматолог вищої категорії Багатопрофільного медичного центру (Університетська клініка № 1) ОНМедУ, м. Одеса
Список використаної літератури
- 1. Van den Hoogen F., Khanna D., Fransen J. et al. (2013) Classification criteria for systemic sclerosis: an American College of Rheumatology/European League against Rheumatism collaborative initiative. Ann Rheum Dis.
- 2. Walker U.A., Tyndall A., Czirjak L. et al. (2007) Clinical risk assessment of organ manifestations in systemic sclerosis: a report from the EULAR Scleroderma Trials and Research group database. Ann. Rheum. Dis.
- 3. Jaeger V.K., Wirz E.G., Allanore Y. et al. (2016) Incidences and risk factors of organ manifestations in the early course of systemic sclerosis: a longitudinal EUSTAR study. PLoS One.
- 4. Frantz C., Avouac J., Distler O. et al. (2016) Impaired quality of life in systemic sclerosis and patient perception of the disease: a large international survey. Semin Arthritis Rheum.; 46: 115–23. doi: 10.1016/j.semarthrit.
- 5. Fischer A., Zimovetz E., Ling C. et al. (2017) Humanistic and cost burden of systemic sclerosis: a review of the literature. Autoimmun Rev.
- 6. Elhai M., Meune C., Boubaya M. et al. (2017) Mapping and predicting mortality from systemic sclerosis. Ann. Rheum. Dis.
- 7. Tashkin D.P., Elashoff R., Clements P.J. et al. (2006) Cyclophosphamide versus placebo in scleroderma lung disease. N. Engl. J. Med.
- 8. Tashkin D.P., Roth M.D., Clements P.J. et al. (2016) Mycophenolate mofetil versus oral clophosphamide in scleroderma-related interstitial lung disease (SLS II): a randomized controlled, double-blind, parallel group trial. Lancet Respir Med.
- 9. Wollin L., Wex E., Pautsch A. et al. (2015) Mode of action of nintedanib in the treatment of idiopathic idiopathic pulmonary fibrosis. Eur. Respir. J.
- 10. Richeldi L., Costabel U., Selman M. et al. (2011) Efficacy of a tyrosine kinase inhibitor in idiopathic pulmonary fibrosis. N. Engl. J. Med.
- 11. Richeldi L., du Bois R.M., Raghu G. et al. (2014) Efficacy and safety of nintedanib in idiopathic pulmonary fibrosis. N. Engl. J. Med.
- 12. Kikuchi K., Kadono T., Ihn H. et al. (1995) Growth regulation in scleroderma fibroblasts: increased response to transforming growth factor-beta 1. J. Invest. Dermatol.
- 13. Hsu E., Shi H., Jordan R.M. et al. (2011) Lung tissues in patients with systemic sclerosis have gene expression patterns unique to pulmonary fibrosis and pulmonary hypertension. Arthritis Rheum.
- 14. Lam A.P., Flozak A.S., Russell S. et al. (2011) Nuclear β-catenin is increased in systemic sclerosis ulmonary fibrosis and promotes lung fibroblast migration and proliferation.
- 15. Huang J., Maier C., Zhang Y. et al. (2017) Nintedanib inhibits macrophage activation and ameliorates vascular and fibrotic manifestations in the Fra2 mouse model of systemic sclerosis. Ann. Rheum. Dis.
- 16. Distler O., Highland K.B., Gahlemann M. et al. (2019) Nintedanib for systemic sclerosis-associated interstitial lung disease. N. Engl. J. Med.
- 17. Flaherty K.R., Wells A.U., Vincent Cottin V. et al. (2019) Nintedanib in progressive fibrosing interstitial lung diseases. N. Engl. J. Med.
Резолюция Совета экспертов, посвященного теме «Интерстициальные заболевания легких при системной склеродермии» (16 декабря 2020 г.)
Резюме. 16 декабря 2020 г. в онлайн-формате состоялось заседание группы ведущих украинских экспертов-ревматологов «Интерстициальные заболевания легких при системной склеродермии» под председательством доктора медицинских наук, профессора, академика Национальной академии медицинских наук Украины Владимира Николаевича Коваленко. В выводах Совета экспертов представлены результаты обсуждения вопросов диагностики и терапии интерстициальных заболеваний легких (ИЗЛ) при системной склеродермии (СС). Причиной данного обсуждения послужило появление новых данных о применении препарата нинтеданиб у этой категории пациентов. Так, в исследовании SENSCIS оценивались эффективность и безопасность нинтеданиба у пациентов с ИЗЛ при СС. Это исследование включало 576 пациентов, получивших хотя бы одну дозу нинтеданиба или плацебо. При исходной оценке у 51,9% пациентов выявлена диффузная кожная форма СС, 48,4% пациентов получали микофенолата мофетил. При анализе первичной конечной точки скорость изменения функции жизненной емкости легких составляла 52,4 мл в год в группе лечения нинтеданибом и 93,3 мл в год в группе плацебо (разница — 41,0 мл в год; 95% доверительный интервал 2,9–79,0; p=0,04). Участники Совета экспертов считают целесообразным актуализировать проблему диагностики и терапии ИЗЛ при СС как на национальном, так и на региональном уровне; руководствоваться мультидисциплинарным подходом к диагностике и лечению ИЗЛ при СС с обязательным привлечением специалистов: ревматолога и рентгенолога (специалиста по КТ-диагностике), при необходимости дифференциальной диагностики в сложных клинических ситуациях — пульмонолога; рекомендовать включение препарата нинтеданиб в национальные и региональные клинические рекомендации по лечению ИЗЛ при СС.

Leave a comment