СТАН МІКРОБІОТИ ПОРОЖНИНИ ТОВСТОЇ КИШКИ У ПАЦІЄНТІВ З РЕВМАТОЇДНИМ АРТРИТОМ, АСОЦІЙОВАНИМ ІЗ BORRELIA BURGDORFERI
Сміян С.І., Юськевич В.В., Маховська О.С.
Резюме. Кишкова мікробіота та патологія запальних захворювань суглобів у ревматології взаємопов’язані. З одного боку — це порушення кількісного та якісного складу мікробіоти товстої кишки з розвитком вираженого дисбіозу після тривалого прийому фармакологічних препаратів, а з іншого — роль кишкової мікрофлори в патогенезі автоімунних ревматологічних захворювань. Мета: встановити особливості кишкової мікробіоти у пацієнтів з ревматоїдним артритом (РА), асоційованим з Borrelia burgdorferi (B. burgdorferi). Матеріали і методи. Обстежено 96 пацієнтів, яких розподілили на дві групи: 52 (1-ша група) — хворі на РА, асоційований з B. burgdorferi, 44 (2-га група) — з ізольованим РА віком від 21 до 78 років. Діагноз РА верифікований згідно з класифікаційними критеріями (ACR/EULAR 2010). Специфічні IgМ та IgG в сироватці крові пацієнтів 1-ї групи до комплексу B. burgdorferi визначали за допомогою реакції імунного блотингу. Додатково усім хворим проведено бактеріологічне дослідження калу та встановлено ступінь дисбіозу товстої кишки. Результати й обговорення. У пацієнтів з РА, асоційованим з B. burgdorferi, відзначали достовірне зниження біфідобактерій (р=0,012), лактобактерій (р=0,013), кишкової палички (р=0,04). Вміст грибів роду Candida у хворих з наявною B. burgdorferi був майже в 1,5 раза вищий, ніж у пацієнтів з ізольованим РА (р=0,002). Дисбіозу ІV ступеня у жодного обстеженого пацієнта з ізольованим РА не виявлено, тоді, як у 3 (6,1%) пацієнтів з наявною B. burgdorferi його діагностовано, серед яких також переважав дисбіоз ІII ступеня (59,2%). У 57,9% хворих з ізольованим РА відзначали дисбіоз ІІ ступеня. Висновки. Хворі з наявною B. burgdorferi до призначення лікування мають більш виражені порушення мікробіоти товстої кишки з розвитком тяжчого ступеня дисбіозу, аніж хворі з ізольованим РА, які отримували базисні протиревматичні препарати, нестероїдні протизапальні препарати і біологічні препарати, що також негативно впливають на склад мікробіома, проте дисбіотичні зміни у пацієнтів були менш виражені.
УДК: 616–022.772:616–052:612.36
DOI: 10.32471/rheumatology.2707-6970.80.15262
Вступ
Мікробіота людини — метаболічний «орган», який не тільки бере участь у травленні їжі, але й синтезує різні біологічно активні речовини, стимулює функції вродженого і набутого імунітету, перешкоджає інвазії патогенних мікроорганізмів, виконує детоксикаційну, антиканцерогенну, синтетичну функції [1, 2]. На сьогодні накопичується все більше даних щодо взаємозв’язку між кишковою мікрофлорою та розвитком патології опорно-рухового апарату. Досить детально вивчено роль кишкової мікрофлори в патогенезі автоімунних захворювань, у тому числі запальних захворювань суглобів — ревматоїдного артриту (РА), анкілозуючого спондилоартриту і псоріатичного артриту [15, 17]. У процесі експериментальних робіт детально вивчено значення кишкової мікрофлори в генезі та підтримці запального ушкодження хряща [7]. Одним із факторів, що провокують це пошкодження, вважають бактеріальні ліпополісахариди, що виробляються кишковими мікроорганізмами — грамнегативними бактеріями. В умовах підвищеної кишкової проникності рівень ліпополісахаридів підвищується у пацієнтів з РА не тільки в крові, але й в синовіальній рідині, причому концентрація їх корелює з тяжкістю ураження суглобів, інтенсивністю больового синдрому і ступенем звуження суглобової щілини [8].
Який же можливий механізм впливу кишкових мікроорганізмів на суглоби? Грамнегативна кишкова мікрофлора здатна продукувати, а потім виділяти везикули, що містять ліпополісахариди та протеїни. Везикули, особливо за підвищеної кишкової проникності, здатні всмоктуватися у кров і поширюватися по всьому організму, в тому числі проникати в порожнину суглобів. Залежно від свого складу такі везикули можуть зумовлювати як про-, так і протизапальну дію. Прозапальний ефект ліпополісахаридів значною мірою зумовлений ліпідом А, сполученим із ліпідзв’язувальним протеїном. Подібний прозапальний комплекс активує нейтрофіли і макрофаги. Активовані клітини запускають запальний каскад, що включає інтерлейкін (IL)-1β, фактор некрозу пухлини-альфа, матриксні металопротеїнази, вільні радикали, які несприятливо впливають на суглобові структури [10].
Важливе значення в активації запального процесу у хворих на РА має такий кишковий мікроорганізм, як Prevotella copri [12]. Мікроорганізми роду Prevotella мають високий прозапальний потенціал та активують Т-хелпер-17 (Th17)-опосередкований механізм запалення. Пусковим моментом у цьому механізмі є стимуляція TLR2 з подальшим підвищенням синтезу IL-23, IL-1, IL-6 та IL-8, яку на сьогодні пов’язують з розвитком РА, індукованого кишковою мікробіотою [9, 16]. У багатьох світових дослідженнях встановлено, що Prevotella copri у великій кількості збільшується на доклінічній стадії у нелікованих пацієнтів з РА, причому рівень їх є достовірно вищий порівняно з тими, які отримували лікування, та здоровими особами [5, 11]. При РА також було відмічено, що імунна відповідь IgA проти Prevotella copri корелює з вродженими (MIP-1), Th1 (IFNg та IL-12), Th17 (IL-23, IL-17) та антисеропозитивністю до цитрулінових пептидних антитіл (АТ ЦЦП) [13].
Активність РА корелює з дисбактеріозом кишечнику, а стан дисбактеріозу частково усувається в період ремісії після лікування традиційними або біологічними хворобомодифікуючими препаратами [6, 14].
Серед причин, які призводять до порушення нормального мікробіоценозу товстого кишечнику, важливе місце займає вплив фармакологічних препаратів. Рядом досліджень встановлений негативний вплив антибіотикотерапії на стан мікробіому кишечнику, що корелює з ризиком розвитку РА. У разі повторних курсів антибіотикотерапії виникають великі труднощі у відновленні кількісного та якісного складу мікрофлори кишки, що спричиняє функціональні та метаболічні порушення у її роботі з високою вірогідністю розвитку автоімунних захворювань [4]. Крім антибіотиків, на стан мікробіому кишечнику впливають протиревматичні засоби, імунобіологічна терапія. За даними деяких авторів, у 76% хворих на РА, які застосовували нестероїдні протизапальні препарати (НПЗП) та метотрексат, виявляли дисбіоз кишечнику, переважно ІІІ–ІV ступеня [3].
Мета — встановити особливості кишкової мікробіоти у пацієнтів з РА, асоційованим з B. burgdorferi.
Матеріали і методи
Під нашим спостереженням перебували 96 пацієнтів, які зверталися в ревматологічне відділення Тернопільської університетської лікарні віком 21–78 років. Серед них — 32 (33,3%) чоловіки і 64 (66,7%) жінки. Пацієнтів розподілили на дві групи: 52 (1-ша група) — хворі на РА, асоційований із B. burgdorferi, 44 (2-га група) — з ізольованим РА. Усі обстежувані з середньою та високою активністю процесу. Діагноз РА верифікований згідно з класифікаційними критеріями (ACR/EULAR 2010). Усім пацієнтам проводили стандартні обстеження відповідно до протоколів надання допомоги № 263 (11.04.2014 р.) та № 218 (16.05.2005 р.). Специфічні IgМ та IgG у сироватці крові пацієнтів до комплексу B. burgdorferi визначали за допомогою реакції імунного блотингу. Також усім хворим проведено бактеріологічне дослідження калу. Дослідження якісного і кількісного складу мікрофлори товстої кишки проводили методом посіву десятикратних розведень (10–1–10–9) калу на стандартний набір cелективних і диференційно-діагностичних поживних середовищ для виділення аеробних та анаеробних мікроорганізмів. Ступінь дисбіозу товстої кишки оцінювали за класифікацією І.Б. Куваєвої, К.С. Ладодо (1991). На момент обстеження 52 пацієнти 1-ї групи призначене лікування ще не отримували, базисну протиревматичну терапію (метотрексат 10–20 мг/тиж) отримували 44 пацієнти 2-ї групи, із них додатково глюкокортикостероїди (преднізолон, метилпреднізолон) застосовували 36 пацієнтів, біологічні хворобомодифікуючі препарати (адалімумаб) — 2 хворих, додатково призначали НПЗП коротким курсом (до 5–7 днів) 9 пацієнтам. Статистичну обробку отриманих результатів проводили відомими методами варіаційної статистики у пакеті прикладних програм «MS Excel» та «IBM Statistics SPSS 22». Достовірність відмінностей оцінювали за допомогою t-критерію Стьюдента (при параметричному розподілі), U-критерію Манна — Уїтні (при непараметричному розподілі). Нормальність розподілу оцінювали за критерієм Шапіро — Уїлка. При перевірці статистичних гіпотез критичним рівнем значущості відмінностей вважали р<0,05.
Результати й обговорення
У пацієнтів обох груп при дослідженні мікрофлори кишки визначали порушення якісного та кількісного складу як анаеробних, так і аеробних представників (таблиця).
| Рід і вид мікроорганізму lg КУО/г | Пацієнти, n (%) | Значення p | |
|---|---|---|---|
| n=52 (54,2%) | n=44 (45,8%) | ||
| 1-ша група | 2-га група | ||
| Біфідобактерії | 5,25±0,15 | 6,44±0,17 | 0,012 |
| Лактобактерії | 4,96±0,14 | 5,68±0,20 | 0,013 |
| Загальна кількість кишкової палички | 5,15±0,19 | 6,07±0,22 | 0,004 |
| Гриби родини Candida | 5,92±0,16 | 4,68±0,17 | 0,002 |
| Стафілококи (St. аureus, St. epidermidis) | 5,13±0,15 | 4,41±0,16 | 0,009 |
| УПМ (Clostridium, Proteus mirabilis, Pseudomonas, E. coli гемолітична, Enterococcus, Klebsiella pneumoniae) | 6,07±0,24 | 4,54±0,19 | 0,007 |
| p – достовірна різниця між показниками 1-ї та 2-ї групи. | |||
Аналіз мікробного складу калу в обстежених хворих обох груп свідчить про виражені зміни в якісному і кількісному складі мікрофлори товстої кишки. Визначали зниження рівня представників анаеробної флори: біфідобактерій <107, а також лактобактерій <106 у всіх пацієнтів, що супроводжувалося збільшенням кількості представників умовно-патогенної мікрофлори. У пацієнтів 1-ї групи спостерігали достовірне зниження біфідобактерій (р=0,012), лактобактерій (р=0,013), кишкової палички (р=0,004) при порівнянні з аналогічним показником пацієнтів 2-ї групи, що свідчить про більш достовірний вплив на мікробіоту кишки B. burgdorferi. Підвищений вміст стафілококів та грибів роду Candida діагностований практично в кожного обстежуваного пацієнта, проте вміст грибів роду Candida у пацієнтів з наявною B. burgdorferi був майже в 1,5 раза вищий за такий самий показник хворих 2-ї групи (р=0,002). Збільшення кількості іншої умовно-патогенної мікрофлори також спостерігалося в осіб обох груп. Серед пацієнтів 2-ї групи переважали Proteus mirabilis (36,8%) та E. coli гемолітична (31,6%), а в учасників 1-ї групи відмічали значний ріст, що перевищував норму, Enterococcus faecium (32,6%), Klebsiella pneumoniae (22,4%) та E. coli гемолітичної (18,4%) (рис. 1).
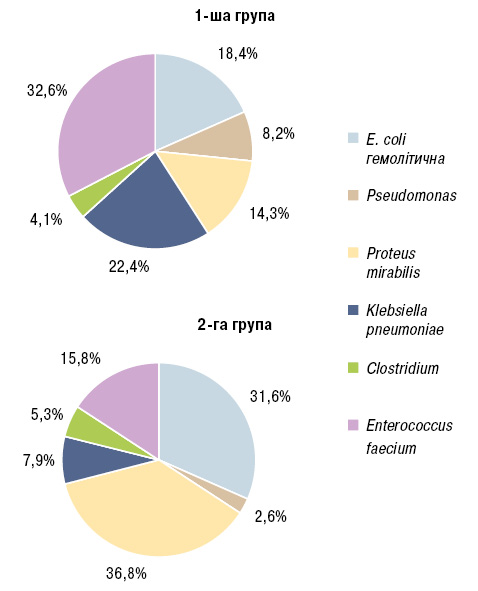
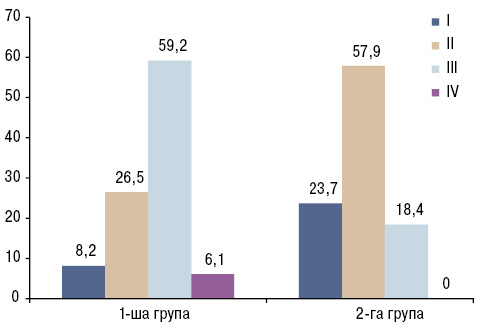
При бактеріологічному дослідженні калу 96 пацієнтів порушення дисбіозу товстого кишечнику виявлено у 87 осіб з обох груп, серед яких дисбіоз ІII ступеня переважав у пацієнтів з РА в асоціації з B. burgdorferi (59,2%) та в пацієнтів з ізольованим РА — дисбіоз ІІ ступеня (57,9%). Дисбіозу ІV ступеня у жодного обстеженого пацієнта 2-ї групи не виявлено, тоді як у 3 (6,1%) пацієнтів 1-ї групи його діагностовано. І ступінь дисбіозу переважав серед пацієнтів з ізольованим РА — у 9 (23,7%) обстежуваних порівняно з 4 (8,2%) пацієнтами 1-ї групи (рис. 2).
Висновок
Різні види тривалого патогенетичного лікування РА з часом призводять у пацієнтів до розвитку дисбіозу товстої кишки різного ступеня тяжкості. У хворих на РА, асоційований з B. burgdorferi, до призначення курсу антибіотикотерапії діагностовано більш виражені порушення мікробіоти товстої кишки з розвитком тяжчого ступеня дисбіозу за рахунок підвищення умовно-патогенної мікрофлори та значного зменшення кількості нормальної мікробіоти порівняно з пацієнтами, які отримували базисні протиревматичні препарати, НПЗП та біологічні препарати, які також чинять негативний вплив на склад мікробіома, проте дисбіотичні зміни у осіб з ізольованим РА були менш вираженими.
Список використаної літератури
- 1. Булгакова С.В., Тренева Е.В., Захарова Н.О., Труханова И.Г. (2019) Кишечная микробиота: связь с возраст-ассоциированными заболеваниями (обзор литературы). Клин. лаб. диагностика, 64(4): 250–256.
- 2. Кузнецова Э.Э., Горохова В.Г., Богородская С.Л. (2016) Микробиота кишечника. Роль в развитии различных патологий. Клин. лаб. диагностика, 61(10): 723–726.
- 3. Лисенко Г.І., Білько І.П., Нікольська О.І., Теслюк Л.В. (1999) Діагностика та лікування дисбактеріозу кишечнику у ревматологічних хворих: Метод. рекомендації. Знання, Київ, 22 с.
- 4. Меркулова А. (2016) Антибиотикотерапия, дисбактериоз и возможные риски. Здоров’я України — ХХІ сторіччя, 20: 72–73.
- 5. Alpizar-Rodriguez D., Lesker T.R., Gronow A. et al. (2019) Prevotella copri in individuals at risk for rheumatoid arthritis. Ann. Rheum. Dis., 78(5): 590–593.
- 6. Chen J., Wright K., Davis J.M. et al. (2016) An expansion of rare lineage intestinal microbes characterizes rheumatoid arthritis. J. Gen. Med., 8(1): 43.
- 7. Hernandez C.J. (2017) The Microbiome and bone and joint disease. Curr. Rheumatol. Rep., 19(12): 77.
- 8. Huang Z., Stabler T., Pei F., Kraus V.B. (2016) Both systemic and local lipopolysaccharide (LPS) burden are associated with knee OA severity and inflammation. J. Osteoarthritis Cartilage, 24(10): 1769–1775.
- 9. Larsen J.M. (2017) The immune response to Prevotella bacteria in chronic inflammatory disease. J. Immunol., 151(4): 363–374.
- 10. Lorenz W., Buhrmann C., Mobasheri A. et al. (2013) Bacterial lipopolysaccharides form procollagen-endotoxin complexes that trigger cartilage inflammation and degeneration: implications for the development of rheumatoid arthritis. Arthritis Res. Ther., 15(5): R111.
- 11. Maeda Y., Kurakawa T., Umemoto E. et al. (2016) Dysbiosis contributes to arthritis development via activation of autoreactive Tells in the intestine. Arthritis Rheum., 68(11): 2646–2661.
- 12. Maeda Y., Takeda K. (2017) Role of gut microbiota in rheumatoid arthritis. J. Clin. Med., 6(6): 60.
- 13. Pianta A., Arvikar S.L., Strle K. et al. (2017) Two rheumatoid arthritis-specific autoantigens correlate microbial immunity with autoimmune responses in joints. J. Clin. Invest., 127(8): 2946–2956.
- 14. Picchianti-Diamanti A., Panebianco C., Salemi S. et al. (2018) Analysis of gut microbiota in rheumatoid arthritis patients: disease-related dysbiosis and modifications induced by etanercept. Int. J. Mol. Sci., 19(10): 2938.
- 15. Picchianti-Diamanti A., Rosado M.M., D’Amelio R. (2018) Infectious agents and inflammation: the role of microbiota in autoimmune arthritis. Front. Microbiol., 8: 2696.
- 16. Sakkas L.I., Bogdanos D.P. (2018) Multiple hit infection and autoimmunity: the dysbiotic microbiota–ACPA connection in rheumatoid arthritis. Curr. Opin. Rheumatol., 30(4): 403–409.
- 17. Zhong D., Wu C., Zeng X., Wang Q. (2018) The role of gut microbiota in the pathogenesis of rheumatic diseases. Clin. Rheumatol., 37(1): 25–34.
Состояние микробиоты полости толстой кишки у пациентов с ревматоидным артритом, ассоциированным с Borrelia burgdorferi
Тернопольский национальный медицинский университет им. И.Я. Горбачевского МЗ Украины
Резюме. Кишечная микробиота и патология воспалительных заболеваний суставов в ревматологии взаимосвязаны. С одной стороны — это нарушение количественного и качественного состава микробиоты толстой кишки с развитием выраженного дисбактериоза после длительного приема фармакологических препаратов, а с другой — роль кишечной микрофлоры в патогенезе аутоиммунных ревматических заболеваний. Цель — установить особенности кишечной микробиоты у пациентов с ревматоидным артритом (РА), ассоциированным с Borrelia burgdorferi (B. burgdorferi). Материалы и методы. Обследовано 96 пациентов, которых распределили на две группы: 52 (1-я группа) — больные с РА, ассоциированным с B. burgdorferi, 44 (2-я группа) — с изолированным РА в возрасте от 21 до 78 лет. Диагноз РА верифицирован согласно классификационным критериям (ACR/EULAR 2010). Специфические IgМ и IgG в сыворотке крови пациентов 1-й группы к комплексу B. burgdorferi определяли с помощью реакции иммунного блоттинга. Дополнительно всем больным проведено бактериологическое исследование кала и установлена степень дисбиоза толстой кишки. Результаты и обсуждение. У пациентов с РА, ассоциированным с B. burgdorferi, отмечали достоверное снижение уровня бифидобактерий (р=0,012), лактобактерий (р=0,013), кишечной палочки (р=0,04). Содержание грибов рода Candida у больных с имеющейся B. burgdorferi было почти в 1,5 раза выше, чем у пациентов с изолированным РА (р = 0,002). Дисбиоза IV степени ни у одного обследованного пациента с изолированным РА не выявлено, тогда как у 3 (6,1%) пациентов с имеющейся B. burgdorferi он диагностирован, среди которых также преобладал дисбиоз II степени (59,2%). У 57,9% больных с изолированным РА отмечали дисбиоз II степени. Выводы. Больные с имеющейся B. burgdorferi до назначения лечения имеют более выраженные нарушения микробиоты толстой кишки с развитием более тяжелой степени дисбиоза, чем больные с изолированным РА, получавшие базисные противовоспалительные препараты, нестероидные противовоспалительные препараты и биологические препараты, которые также негативно влияют на состав микробиома, однако дисбиотические изменения у пациентов были менее выраженными.
Ключевые слова: Borrelia burgdorferi, ревматоидный артрит, микробиота, дисбиоз, толстая кишка.
Адреса для листування:
Сміян Світлана Іванівна
46001, Тернопiль, майдан Волi, 1
ДВНЗ «Тернопільський державний медичний
університет ім. І.Я. Горбачевського МОЗ України», кафедра внутрішньої медицини № 2

Leave a comment