СИСТЕМНІ ХВОРОБИ СПОЛУЧНОЇ ТКАНИНИ ЯК ПРОЯВ ПАРАНЕОПЛАСТИЧНОГО СИНДРОМУ У ХВОРИХ НА РАК ЛЕГЕНІ
Синяченко О.В., Єрмолаєва М.В., Степко П.А., Верзілов С.М., Лівенцова К.В.
Резюме. Актуальність. При запальних аутоімунних ревматичних захворюваннях підвищується ризик розвитку злоякісних новоутворень. Такі коморбідні хвороби, як прояви паранеопластичного синдрому (ПНПС), впливають на перебіг раку легені (РЛ) та знижують виживаність хворих. Мета і завдання дослідження: визначити частоту, клінічні ознаки й чинники ризику ревматологічного ПНПС при РЛ, встановити характер взаємовпливу обох патологічних процесів. Матеріал і методи. Під спостереженням перебували 1669 пацієнтів із РЛ віком від 24 до 87 років (у середньому — 59 років), серед яких дрібноклітинний гістологічний варіант захворювання діагностовано у 18% спостережень, а недрібноклітинний — у 82%. Співвідношення IB, IIA, IIB, IIIA, IIIB, IV стадій захворювання становило 1:2:6:58:43:57. Середній показник інтегральної стадійності пухлинного процесу був 6 в.о., а його тяжкості перебігу — 3 в.о. Частота коморбідних ревматоїдного артриту, системного червоного вовчака, системної склеродермії, хвороби Шегрена, дерматополіміозиту та імуноглобулін-G4-асоційованого захворювання (як проявів ПНПС) співвідносилася 8:7:4:3:2:1. Результати. Доведено зв’язок розвитку РЛ і коморбідних системних аутоімунних захворювань сполучної тканини, визначено частоту виникнення такого ПНПС, клінічні ознаки його перебігу (шкірно-суглобово-м’язові прояви, вісцерити) і зв’язок із фоновим пухлинним процесом (тяжкість неоплазми, характер проростання в сусідні органи й метастазування, верхівкова локалізація, дрібноклітинний та недрібноклітинний гістологічний варіант), наведено відмінності клініко-лабораторних ознак «пухлинних» варіантів ревматичних хвороб і «первинних» (ідіопатичних), негативний вплив ПНПС на виживаність хворих на РЛ, залежність появи ПНПС від застосовуваних препаратів хіміотерапії (антиметаболітів, алкалоїдів барвінку, антрациклінів) і розвитку ускладнень від лікувальних заходів (легенева гіпертензія, порушення мозкового кровообігу, променевий пневмофіброз, жовтяниця, тромбофлебіт). Висновки. Подальше вивчення ревматологічного ПНПС при РЛ дозволить поліпшити якість ранньої діагностики обох груп захворювань, розробити прогностичні критерії та підвищити ефективність індивідуальної комбінованої медичної технології лікування хворих.
УДК 616.72-002-77:616.24-006]-07-092
DOI: 10.32471/rheumatology.2707-6970.80.14814
Актуальність
Рак легені (РЛ) вважається найчастішою формою злоякісних новоутворень (Muzamil J. et al., 2017; Wilkins C.M. et al., 2017; Latimer K.M., 2018). При цьому аутоімунні ревматичні параканкрозні зміни виникають у 0,5–4,0% хворих на РЛ (Мiret М. et al., 2017). Паранеопластичний синдром (ПНПС) безпосередньо не пов’язаний із первинною неоплазмою та її метастазами, а зумовлений складними запальними системними чи локальними дистантними змінами, перебіг його часто відбувається у вигляді «перехресту» (overlap) ревматичного й пухлинного захворювань (Hébant B. et al., 2016; Ramírez-Bellver J.L. et al., 2017). Вивчення такого ПНПС при РЛ є актуальною проблемою сучасної ревматології та онкології (Durieux V. et al., 2017), при цьому його клініко-лабораторні прояви (артрит, вовчакоподібний, псевдосклеродермічний синдроми) виникають у 15% хворих з цією формою неоплазми (Pileckyte M. et al., 2018), частіше з наявністю метастазів у кістки (Hakkou J. et al., 2012).
Доведено, що при таких ревматичних захворюваннях, як системний червоний вовчак (СЧВ), системна склеродермія (ССД), хвороба Шегрена (ХШ), дерматополіміозит (ДПМ) і ревматоїдний артрит (РА), підвищується ризик розвитку злоякісних новоутворень (Picano E. et al., 2014; Radner H., 2016), які наявні майже у 2% цих пацієнтів (Wang H.L. et al., 2017). Ці коморбідні хвороби знижують виживаність пацієнтів із РЛ (Azar L., Khasnis A., 2013; Katzen J.B. et al., 2015; Park J.K. et al., 2016).
Факт взаємозв’язків ревматологічної та онкологічної патології багато в чому визначається наявністю вираженої дисрегуляції системи імунітету при обох групах хвороб (Kanaji N. et al., 2014; Goobie G.C. et al., 2015; Azrielant S. et al., 2017). Існує думка, що частота розвитку злоякісних новоутворень пов’язана не з самим ревматичним системним аутоімунним захворюванням, а із застосуванням препаратів патогенетичної терапії, але ці питання потребують додаткового вивчення (Świerkot J. et al., 2013; Tokuda H. et al., 2017). Водночас успішне лікування РЛ (оперативне, радіохіміотерапія) може супроводжуватися зникненням ознак ПНПС (Stummvoll G.H. et al., 2010; Beel A.J. et al., 2018).
Мета і завдання дослідження — визначити частоту та клінічні ознаки ПНПС при РЛ, перебіг яких відбувається у вигляді системних ревматичних аутоімунних захворювань, вивчити характер взаємовпливу з перебігом пухлинного процесу, оцінити фактори ризику розвитку ПНПС.
Матеріал і методи дослідження
Під спостереженням перебували 1669 хворих на РЛ віком від 24 до 87 років (в середньому — 59,0±0,2 року), серед яких 89% чоловіки і 11% жінки. Правобічна локалізація ракового процесу мала місце у 57% пацієнтів, лівобічна — у 42%, двобічна — у 1%. Верхньочастковий РЛ встановлено у 29% випадків, середньоверхньочастковий — в 21%, верхньонижньочастковий зліва — в 20%, нижньочастковий — в 13%, медіастинальний — в 11%, середньочастковий — у 3%, середньо-нижньочастковий — у 2% випадків. Дрібноклітинний гістологічний варіант захворювання діагностовано у 19% спостережень, а недрібноклітинний — у 82%, серед яких аденокарциному констатовано у 37% обстежених пацієнтів і у 46% осіб з недрібноклітинною формою, плоскоклітинну карциному — у 35 та 43%, великоклітинну — у 9 і 11% відповідно.
Захворювання IB і ІІА стадії виявлено відповідно в 1% випадків РЛ, IIB — у 4%, IIIA — у 35%, IIIB — у 26%, IV — у 34% випадків. Середній показник інтегральної стадійності пухлини (SТT) становив 5,9±0,03 в.о., інтегрального індексу тяжкості пухлинного процесу (IWT) — 2,9±0,02 в.о., який оцінювали за формулою:
IWT = ln[T + N2 + (SM)2],
де ln — натуральний логарифм, Т — міжнародний показник характеру первинної пухлини, N — міжнародний показник метастатичного ураження регіонарних лімфатичних вузлів, SМ — сума віддалених органів з метастазами. З проявів РЛ у 10% хворих відзначено ексудативний плеврит, у 8% — компресійний синдром, у 7% — проростання пухлини у трахею, у 3% — відповідно в ребра і грудну стінку, у 2% — у стравохід і у 1% — в перикард, у 4% — обтураційний ателектаз, у 3% — здавлення поворотного нерва і у 2% — верхньої порожнистої вени. Метастази в лімфатичних вузлах виявлено у 81% випадків РЛ, у віддалених органах — у 31%, у скелеті — у 20%.
Серед обстежених хворих на РЛ відібрано основну (1-шу) групу зі 157 (9%) осіб віком від 23 до 79 років (в середньому — 58,0±0,8 року), у яких виявлено ті чи інші ознаки ПНПС за типом аутоімунних запальних ревматичних захворювань (ревматоїдоподібний артрит (РПА), СЧВ, ССД, ХШ, ДПМ, імуноглобулін-G4-асоційоване захворювання — IgG4). Додатково представників основної групи розподілено на дві підгрупи — 79 хворих (5% загальної кількості та 50% кількості 1-ї групи) з РПА (підгрупа А) і 78 (також 5 і 50% відповідно) із системними захворюваннями сполучної тканини (підгрупа Б). Співвідношення частоти ДПМ, ССД, СЧВ, ХШ і IgG4 у групі Б становило 7:4:3:2:1. Перебіг РПА, СЧВ, ССД, ХШ, ДПМ та IgG4 порівнювали з таким відповідно у 105; 93; 77; 37; 35 і 16 пацієнтів із класичними «первинними» захворюваннями, які відповідали за статтю, віком і тривалістю захворювання.
Для діагностики РЛ і його метастазів використовували методи рентгенографії, комп’ютерної томографії та магнітно-резонансної томографії (апарати Multix-Compact-Siеmens, Німеччина, Somazom-Emotion-6-Siemens, Німеччина, Gygoscan-Intera-Philips, Нідерланди, циклотрон Siemens-RDS- Eclipse-RD, Німеччина), фіброскоп Olympus-GIF-Q20 (Японія) і сонограф Envisor-Philips (Нідерланди).
Статистичну обробку отриманих результатів досліджень проведено за допомогою комп’ютерного варіаційного, непараметричного, кореляційного, одно- (ANOVA) і багатофакторного (ANOVA/MANOVA) дисперсійного аналізу (програми Microsoft Excel та Statistica-Stat-Soft, США). Оцінювали середні значення, їх стандартні помилки й відхилення, коефіцієнти параметричної кореляції Пірсона та непараметричної Кендалла, критерії однорідності дисперсії Брауна — Форсайта (BF) і Уїлкоксона — Рао, відмінностей Стьюдента і Макнемара — Фішера, а також достовірність статистичних показників. Критичним рівнем значущості перевірки статистичних гіпотез у цьому дослідженні вважали такий, що становив 0,05.
Результати дослідження
У хворих основної групи були достовірно (на 9%) вищими показники SТT і IWT (на 25%). При цьому 1-ша група відрізнялася від 2-ї у 2,1 раза вищою частотою ексудативного плевриту, у 3,2 раза — проростання пухлини в грудну стінку і в 4,7 раза — здавлення верхньої порожнистої вени. За даними багатофакторного аналізу Уїлкоксона — Рао, клінічні ознаки перебігу РЛ впливають на характер ПНПС. Ми відібрали ті ознаки РЛ, які одночасно мали з ПНПС дисперсійні зв’язки Брауна — Форсайта та кореляційні Кендалла. Виявилося, що кількість складових проявів ПНПС збільшується з віком хворих на РЛ, з підвищенням стадійності й тяжкості перебігу захворювання. На обидві підгрупи пацієнтів із ПНПС (А, Б) впливають локалізація пухлинного процесу, форма РЛ, плоскоклітинний гістологічний його варіант, параметри IWT. За даними аналізу однорідності дисперсії Брауна — Форсайта, на кількість проявів ПНПС чинять вплив проростання пухлини у стравохід, грудну стінку і верхню порожнисту вену. У підгрупі А така дія стосується здавлення РЛ верхньої порожнистої вени, проростання у трахею, стравохід та грудну стінку, а ПНПС у підгрупі Б пов’язаний з наявністю ексудативного плевриту й проростанням пухлини в перикард (рис. 1).
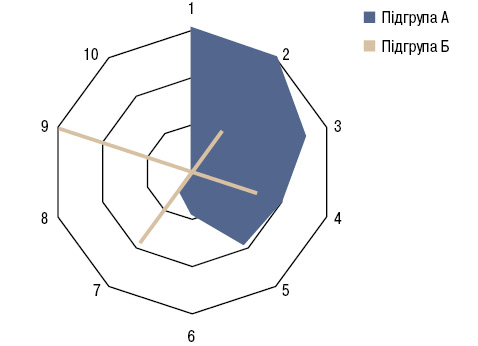
Відмінності частоти ураження окремих суглобів при РПА і «первинному» РА наведено на рис. 2.
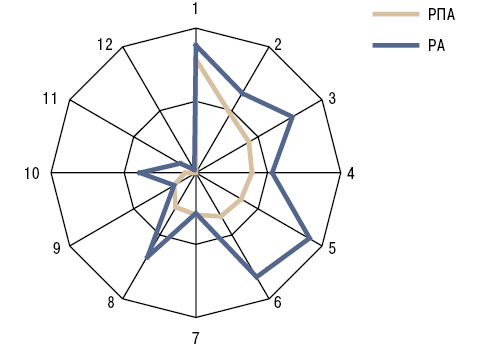
У першій групі цих хворих співвідношення поліартриту і олігоартриту становило 2:1, а в другій (група порівняння) — 34:1 (відмінності достовірні). При цьому симетричність ураження суглобів у разі РПА спостерігалася у 13 разів рідше. У пацієнтів із ПНПС без РПА були відсутні ентезопатії, наявні у 22% спостережень РПА, у 3,7 раза рідше відзначали остеоартропатію Бамбергера, у 7,9 раза — тендовагініт. При зіставленні з хворими на РА у разі РПА відзначали у 16 разів вищу частоту серонегативності захворювання за ревматоїдним фактором, у 1,5 раза — за антитілами до циклічного цитрулінового пептиду, у 1,3 раза — за антитілами до віментину. Остеоузури, інтраартикулярні хондромні тіла, тіла Штайді та Гоффа відповідно виявлено у 51; 24; 6 і 4% хворих на РА, ці рентгеносонографічні ознаки суглобового синдрому при РПА були відсутні. У пацієнтів з РЛ на ¼ нижчими виявилися рівні індексів DAS і Лансбурі (відмінності достовірні).
ПНПС у вигляді РПА (підгрупа А) мав дисперсійний та прямий кореляційний зв’язок із метастазами у скелеті, ПНПС у підгрупі Б — з метастазами у віддалених органах. Як свідчіть аналіз Макнемара — Фішера, СЧВ при ПНПС у підгрупі Б характеризувався частішим розвитком лімфаденопатії, периферичної нейропатії та офтальмопатії (увеїту), а також наяності антитіл до Смітт-антигену, ССД — базального пневмофіброзу та антитопоізомеразних антитіл у крові, ХШ — підвищенням показників антинуклеарного фактора та кріоглобулінів у крові, ДПМ — розвитку синдрому Готтрона та ураження шкіри долоней і п’ят, IgG4 — інтерстиціального пневмоніту й підвищення концентрації у крові трансформуючого фактора росту-β1. Для паранеопластичного СЧВ виявилися нетиповими хронічні дискоїдні зміни шкіри, виразковий стоматит і хейліт, гломерулонефрит і високі показники антитіл до кардіоліпіну й вовчакового антикоагулянту, для ССД — зміни шкіри тулуба, остеоліз кінчиків пальців, ураження стравоходу та наявність антитіл до рибонуклеопротеїну, для ХШ — серопозитивність за ревматоїдним фактором і ураження нирок у вигляді тубулоінтерстиціального нефриту, для ДПМ — дигітальний некроз пальців і формування антисинтетазних антитіл, для IgG4 — аутоімунні тиреоїдит і панкреатит.
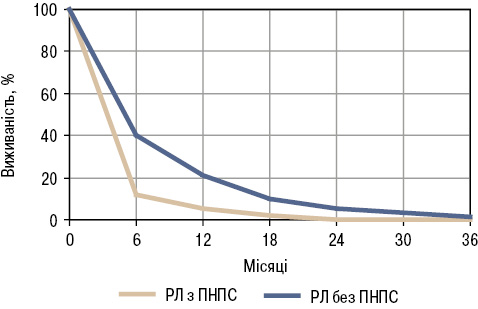
Показники трирічної виживаності хворих основної групи (з ПНПС) виявилися значно гіршими, аніж у групі порівняння (рис. 3), і до 24-го місяця всі представники з РПА, СЧВ, ССД, ХШ, ДПМ та IgG4 померли. У цих пацієнтів тривалість життя після встановлення діагнозу РЛ була в середньому на 4 міс меншою.
Обговорення результатів
За даними літератури, РЛ частіше приєднується до тривалого перебігу склеродермічного пневмофіброзу (Grund D., Siegert E., 2016) із серопозитивністю за антитопоізомеразними антитілами (Katzen J.B. et al., 2015), антитіл до амілоїдних білків SSA і SSB (Ido M. et al., 2015) і до рибонуклеїнової полімерази-ІІІ (Bachmeyer C., Rein C., 2015; Motegi S. et al., 2015; Shah A.A. et al., 2017). Поява пухлинного процесу на тлі СЧВ частіше виникає у хворих із високим рівнем у крові вовчакового антикоагулянту, антитіл до фосфоліпідів і кардіоліпіну (Fei X. et al., 2017), у разі ДПМ — транскрипційного проміжного фактора-1β (Ohashi M. et al., 2010; Taki E. et al., 2016) і антисинтетазних антитіл (Boleto G. et al., 2017), а при всіх системних захворюваннях сполучної тканини — параметри у крові трансформуючого фактора росту-β1 та інших тумороасоційованих чинників (De Luca G. et al., 2015; Dolcino M. et al., 2018).
Необхідно відзначити, що деякі варіанти ПНПС у хворих на РЛ можуть виникати внаслідок ускладнень проведеної хіміотерапії (Kieffer J.M. et al., 2017), що, перш за все, стосується препаратів платини і таксанів (Kolb N.A. et al., 2016). Як свідчить аналіз однорідності дисперсії Брауна — Форсайта та непараметричний кореляційний Кендалла, на формування ПНПС при РЛ у підгрупах А і Б чинять негативний прямий вплив потужність проведеної променевої терапії, застосування із 8 груп препаратів у складі хіміотерапії антиметаболітів (гемцитабіну, метотрексату, пеметрекседу, флуороурацилу), алкалоїдів барвінку (вінбластину, вінкристину), антрациклінів (блеоміцину, доксорубіцину, ідарубіцину, мітоміцину, епірубіцину).
У процесі радіохіміотерапії мієлодепресія розвинулася у 7% випадків, гострий променевий пневмоніт і легенева гіпертензія — у 3%, променевий езофагіт, гострий коронарний синдром, променевий фіброз легень та неприборкане блювання — у 2%, відповідно гострий тубулоінтерстиціальний нефрит, порушення мозкового кровообігу, гострий тромбофлебіт, стійка діарея, жовтяниця, тромбоемболія гілок легеневої артерії — у 1%. Багатофакторний аналіз Уїлкоксона — Рао продемонстрував вплив характеру ПНПС на ускладнення радіохіміотерапії. За даними непараметричного порівняльного аналізу Макнемара — Фішера, у разі наявності ПНПС у підгрупах А і Б частіше появлялися легенева гіпертензія, порушення мозкового кровообігу, променевий пневмофіброз, жовтяниця і тромбофлебіт.
На підставі статистичної обробки отриманих даних дослідження зроблено такі висновки, що мають певну практичну спрямованість (ступінь прогнозування пропонованого результату моделі був >70%): 1) верхівковий рак Панкоста — Тобіаса є чинником ризику розвитку ревматичного ПНПС; 2) факторами ризику виникнення такого ПНПС слід вважати ексудативний плеврит, здавлення верхньої порожнистої вени і проростання пухлини в грудну стінку; 3) поява коморбідних системних аутоімунних захворювань сполучної тканини у хворих на РЛ потребує відміни препаратів груп антиметаболітів, алкалоїдів барвінку та антрациклінів.
З урахуванням отриманих даних надамо деякі коментарі. Відоме почастішання випадків приєднання РЛ у хворих на РА, а рецидивуючий серонегативний синовіт за відсутності ефекту від глюкокортикоїдної терапії має насторожувати щодо пухлинного процесу (Jeong H. et al., 2017). Достовірний ризик розвитку РЛ спостерігається і на тлі СЧВ (Ni J. et al., 2014; Cao L. et al., 2015; Wu Y., Hou Q., 2016), ССД і ХШ (Sargın G. et al., 2015; Topuzoglu S. et al., 2015; Bernal-Bello D. et al., 2017; Kim H.J. et al., 2017), ДПМ (Zarrabi K. et al., 2017; Zerdes I. et al., 2017). Підвищує частоту взаємозв’язків розвитку системних хвороб сполучної тканини і РЛ наявність генетичної схильності одночасно до обох патологічних процесів, зокрема мутацій генів GSAs і DEGs (Hong G. et al., 2017; Rosenberger A. et al., 2017).
Висновки
Доведено зв’язок розвитку РЛ і коморбідних системних аутоімунних захворювань сполучної тканини (РА, СЧВ, ССД, ХШ, ДПМ, IgG4), визначено частоту виникнення такого ПНПС, клінічні ознаки його перебігу (шкірно-суглобово-м’язові прояви, вісцерити) і зв’язок із фоновим пухлинним процесом (тяжкість неоплазми, характер проростання в сусідні органи й метастазування, верхівкова локалізація, дрібноклітинний та недрібноклітинний гістологічний варіант). Існують відмінності клініко-лабораторних ознак «пухлинних» варіантів ревматичних хвороб і «первинних» (ідіопатичних), встановлено негативний вплив ПНПС на виживаність хворих на РЛ, залежність появи ПНПС від застосовуваних деяких груп препаратів хіміотерапії (антиметаболітів, алкалоїдів барвінку, антрациклінів) і розвитку ускладнень лікувальних заходів (легенева гіпертензія, порушення мозкового кровообігу, променевий пневмофіброз, жовтяниця, тромбофлебіт). Подальше вивчення ревматологічного ПНПС при РЛ імовірно дозволить поліпшити якість ранньої діагностики обох груп захворювань, розробити прогностичні критерії та підвищити ефективність індивідуальної комбінованої медичної технології лікування пацієнтів.
Список використаної літератури
- Azar L., Khasnis A. (2013) Paraneoplastic rheumatologic syndromes. Curr. Opin. Rheumatol., 25(1): 44–49.
- Azrielant S., Tiosano S., Watad A. et al. (2017) Correlation between systemic lupus erythematosus and malignancies: a cross-sectional population-based study. Immunol. Res., 65(2): 464–469.
- Bachmeyer C., Rein C. (2015) Anti-RNA polymerase III autoantibody-positive scleroderma as a paraneoplastic syndrome. Arthritis Care. Res., 67(3): 453–459.
- Beel A.J., Demos D.S., Chung A. et al. (2018) Ground-glass opacity heralding invasive lung adenocarcinoma with prodromal dermatomyositis: a case report. J. Cardiothorac. Surg., 13(1): 20–28.
- Bernal-Bello D., de Tena J.G., Guillén-Del Castillo A. et al. (2017) Novel risk factors related to cancer in scleroderma. Autoimmun. Rev., 16(5): 461–468.
- Boleto G., Perotin J.M., Eschard J.P. et al. (2017) Squamous cell carcinoma of the lung associated with anti-Jo1 antisynthetase syndrome: a case report and review of the literature. Rheumatol. Int., 37(7): 1203–1206.
- Cao L., Tong H., Xu G. et al. (2015) Systemic lupus erythematous and malignancy risk: a meta-analysis. PLoS One, 10(4): 0122964.
- De Luca G., Bosello S.L., Berardi G. et al. (2015) Tumour-associated antigens in systemic sclerosis patients with interstitial lung disease: association with lung involvement and cancer risk. Rheumatology, 54(11): 1991–1999.
- Dolcino M., Pelosi A., Fiore P.F. et al. (2018) Gene profiling in patients with systemic sclerosis reveals the presence of oncogenic gene signatures. Front. Immunol., 6(9): 449–459.
- Durieux V., Coureau M., Meert A.P. et al. (2017) Autoimmune paraneoplastic syndromes associated to lung cancer: A systematic review of the literature. Lung. Cancer., 106(4): 102–109.
- Fei X., Wang H., Jiang L. et al. (2017) Clinical and prognostic significance of lupus anticoagulant measurement in patients with lung cancer. Technol. Cancer. Res. Treat., 11(1): 153303.
- Goobie G.C., Bernatsky S., Ramsey-Goldman R. et al. (2015) Malignancies in systemic lupus erythematosus: a 2015 update. Curr. Opin. Rheumatol., 27(5): 454–460.
- Grund D., Siegert E. (2016) Pulmonary fibrosis in rheumatic diseases. Z. Rheumatol., 75(8): 795–808.
- Hakkou J., Rostom S., Bahiri R. et al. (2012) Paraneoplastic rheumatic syndromes: report of eight cases and review of literature. Rheumatol. Int., 32(6): 1485–1489.
- Hébant B., Miret N., Berthelot L. et al. (2016) Generalized pruritus preceding paraneoplastic neuropathy. J. Clin. Neurosci, 26: 156–157.
- Hong G., Li H., Li M. et al. (2017) A simple way to detect disease-associated cellular molecular alterations from mixed-cell blood samples. Brief. Bioinform., 14(2): 177–186.
- Ido M., Mishima H., Kimura K. et al. (2015) A case of gastric cancer associated with Sjögren’s syndrome and interstitial pneumonia. Gan To Kagaku Ryoho, 42(12): 1974–1976.
- Jeong H., Baek S.Y., Kim S.W. et al. (2017) PLoS One, 12(4): 0176260.
- Kanaji N., Watanabe N., Kita N. et al. (2014) Paraneoplastic syndromes associated with lung cancer. World J. Clin. Oncol., 5(3): 197–223.
- Katzen J.B., Raparia K., Agrawal R. et al. (2015) Early stage lung cancer detection in systemic sclerosis does not portend survival benefit: a cross sectional study. PLoS One, 10(2): 0117829.
- Kieffer J.M., Postma T.J., van de Poll-Franse L. et al. (2017) Evaluation of the psychometric properties of the EORTC chemotherapy-induced peripheral neuropathy questionnaire (QLQ-CIPN20). Qual. Life Res., 20(6): 172–178.
- Kim H.J., Kim K.H., Hann H.J. et al. (2017) Incidence, mortality, and causes of death in physician-diagnosed primary Sjögren’s syndrome in Korea: A nationwide, population-based study. Semin. Arthritis Rheum., 8(3): 234–239.
- Kolb N.A., Smith A.G., Singleton J.R. et al. (2016) The association of chemotherapy-induced peripheral neuropathy symptoms and the risk of falling. JAMA Neurol., 73(7): 860–866.
- Latimer K.M. (2018) Lung cancer: clinical presentation and diagnosis. FP Essent., 464(1): 23–26.
- Miret M., Horváth-Puhó E., Déruaz-Luyet A. et al. (2017) Potential paraneoplastic syndromes and selected autoimmune conditions in patients with non-small cell lung cancer and small cell lung cancer: A population-based cohort study. PLoS One, 12(8): 0181564.
- Motegi S., Toki S., Yamada K. et al. (2015) Demographic and clinical features of systemic sclerosis patients with anti-RNA polymerase III antibodies. J. Dermatol., 42(2): 189–192.
- Muzamil J., Bashir S., Guru F.R. et al. (2017) Squamous cell carcinoma lung with skeletal muscle involvement: a 8-year study of a tertiary care hospital in Kashmir. Indian J. Med. Paediatr. Oncol., 38(4): 456–460.
- Ni J., Qiu L.J., Hu L.F. et al. (2014) Lung, liver, prostate, bladder malignancies risk in systemic lupus erythematosus: evidence from a meta-analysis. Lupus, 23(3): 284–292.
- Ohashi M., Shu E., Tokuzumi M. (2010) Anti-p155/140 antibody-positive dermatomyositis with metastases originating from an unknown site. Acta Dermato-Venereol., 91(1): 84–85.
- Park J.K., Yang J.A., Ahn E.Y. et al. (2016) Survival rates of cancer patients with and without rheumatic disease: a retrospective cohort analysis. BMC Cancer, 16(4): 381–391.
- Picano E., Semelka R., Ravenel J. et al. (2014) Rheumatological diseases and cancer: the hidden variable of radiation exposure. Ann. Rheum. Dis., 73(12): 2065–2068.
- Pileckyte M., Baliūnaite R., Tamulaitiene V. (2018) Paraneoplastic rheumatic syndromes. Medicina, 39(5): 443–447.
- Radner H. (2016) Multimorbidity in rheumatic conditions. Wien Klin. Wochenschr., 128(21–22): 786–790.
- Ramírez-Bellver J.L., Macías E., Bernárdez C. et al. (2017) Anti-NXP2-positive paraneoplastic dermatomyositis with histopathologic changes confined to the acrosyringia. Am. J. Dermatopathol., 39(1): 3–7.
- Rosenberger A., Sohns M., Friedrichs S. et al. (2017) Gene-set meta-analysis of lung cancer identifies pathway related to systemic lupuserythematosus. PLoS One, 12(3): 0173339.
- Sargın G., Şentürk T., Yavaşoğlu İ. (2015) Refractory anemia in systemic sclerosis: myelodisplastic syndrome. Eur. J. Rheumatol., 2(3): 120–121.
- Shah A.A., Xu G., Rosen A. et al. (2017) Anti-RNPC-3 antibodies as a marker of cancer-associated scleroderma. Arthritis Rheumatol., 69(6): 1306–1312.
- Stummvoll G.H., Aringer M., Machold K.P. et al. (2010) Cancer polyarthritis resembling rheumatoid arthritis as a first sign of hidden neoplasms. Report of two cases and review of the literature. Scand. J. Rheumatol., 30(1): 40–44.
- Świerkot J., Lewandowicz-Uszyńska A., Bogunia-Kubik K. (2013) Tumors in rheumatic diseases. Postepy Hig. Med. Dosw., 67(11): 1254–1260.
- Taki E., Shimizu M., Soeda Y. et al. (2016) Anti-TIF1-γ-positive young adult dermatomyositis with germ cell tumour. Eur. J. Dermatol., 26(6): 623–624.
- Tokuda H., Harigai M., Kameda H. et al. (2017) Consensus statements for medical practice: Biological agents and lung disease. Respir. Investig., 55(3): 229–251.
- Topuzoglu S., Knobler R., Movadat O. et al. (2015) Incidence of lung cancer in patients with systemic sclerosis treated with extracorporeal photopheresis. Photodermatol. Photoimmunol. Photomed., 31(4): 175–183.
- Wang H.L., Zhou Y.M., Zhu G.Z. et al. (2017) Malignancy as a comorbidity in rheumatic diseases: a retrospective hospital-based study. Clin. Rheumatol., 16(5): 162–167.
- Wilkins C.M., Johnson V.L., Fargason R.E. et al. (2017) Psychosis as a sequelae of paraneoplastic syndrome in small-cell lung carcinoma: A psycho-neuroendocrine interface. Clin. Schizophr. Relat. Psychoses., 22(11): 153–158.
- Wu Y., Hou Q. (2016) Systemic lupus erythematous increased lung cancer risk: Evidence from a meta-analysis. J. Cancer Res. Ther., 12(2): 721–724.
- Zarrabi K., Choy T., Sweeney K. et al. (2017) Paraneoplastic edematous dermatomyositis: A rare syndrome observed in a case of small cell lung cancer. Clin. Pract., 7(4): 982–988.
- Zerdes I., Tolia M., Nikolaou M. et al. (2017) How can we effectively address the paraneoplastic dermatomyositis: diagnosis, risk factors and treatment options. J. BUON, 22(4): 1073–1080.
Системные БОЛЕЗНИ соединительной ткани КАК ПРОЯВЛЕНИЯ ПАРАНЕОПЛАСТИЧЕСКОГО СИНДРОМА У БОЛЬНЫХ РАКОМ ЛЕГКОГО
Резюме. Актуальность. При воспалительных аутоиммунных ревматических заболеваниях повышается риск развития злокачественных новообразований. Такие коморбидные болезни, как проявления паранеопластического синдрома (ПНПС), влияют на течение рака легкого (РЛ) и снижают выживаемость больных. Цель и задачи исследования: определить частоту, клинические признаки и факторы риска ревматологического ПНПС при РЛ, установить характер взаимовлияния обоих патологических процессов. Материал и методы. Под наблюдением находились 1669 больных РЛ в возрасте от 24 до 87 лет (в среднем — 59 лет), среди которых мелкоклеточный гистологический вариант заболевания диагностирован в 18% наблюдений, а немелкоклеточный — в 82%. Соотношение IB, IIA, IIB, IIIA, IIIB, IV стадий заболевания составило 1:2:6:58:43:57. Средний показатель интегральной стадийности опухолевого процесса составил 6 о.е., а его тяжести течения — 3 о.е. Частота коморбидных ревматоидного артрита, системной красной волчанки, системной склеродермии, болезни Шегрена, дерматополимиозита и иммуноглобулин-G4-ассоциированного заболевания (как проявлений ПНПС) соотносилась 8:7:4:3:2:1. Результаты. Доказаны взаимосвязи развития РЛ и коморбидных системных аутоиммунных заболеваний соединительной ткани, определены частота возникновения такого ПНПС, клинические признаки его течения (кожно-суставно-мышечные проявления, висцериты) и связь с фоновым опухолевым процессом (тяжесть неоплазмы, характер прорастания в соседние органы и метастазирования, верхушечная локализация, мелкоклеточный и немелкоклеточный гистологический вариант), представлены отличия клинико-лабораторных признаков «опухолевых» вариантов ревматических болезней и «первичных» (идиопатических), негативное влияние ПНПС на выживаемость больных РЛ, зависимость появления ПНПС от применяемых препаратов химиотерапии (антиметаболитов, алкалоидов барвинка, антрациклинов) и развития осложнений лечебных мероприятий (легочная гипертензия, нарушение мозгового кровообращения, лучевой пневмофиброз, желтуха, тромбофлебит). Выводы. Дальнейшее изучение ревматологического ПНПС при РЛ позволит улучшить качество ранней диагностики обех групп заболеваний, разработать прогностические критерии и повысить эффективность индивидуальной комбинированной медицинской технологии лечения пациентов.
Ключевые слова: рак, легкие, ревматические болезни, паранеопластический синдром.
Адреса для листування:
Синяченко Олег Володимирович
84404, Донецька обл., м. Лиман,
вул. Привокзальна, 27
Донецький національний медичний університет,
кафедра внутрішньої медицини № 1
E-mail: synyachenko@ukr.net

Leave a comment