Результати ретроспективного 10-річного аналізу стаціонарних хворих на псоріатичний артрит: 1. Демографічна, клініко-анамнестична характеристика, лікування
Яременко О.Б., Федьков Д.Л. , Петелицька Л.Б., Шинькарук Ю.Л., Комкіна М.О., Івашківський О.І., Тер-Вартаньян С.Х.
Резюме. Вивчено демографічну, клініко-анамнестичну характеристику та зміст медикаментозної терапії у 281 хворого на псоріатичний артрит (ПсА) на час першої госпіталізації в ревматологічне відділення. Артрит дебютував у віці від 5 до 74 років (у середньому — 38), у 69% випадків — на тлі шкірного псоріазу (ПС) (в середньому через 13 років після його появи), ПсА і ПС розвивалися одночасно у 13%, артрит передував ПС у 11% хворих (у середньому за 8 років), 7% хворих мали лише сімейний анамнез ПС. Псоріатичне ураження нігтів спостерігалось у 14% хворих. Під час першої госпіталізації вже 46% пацієнтів мали III та IV рентгенологічну стадію захворювання і 62% — функціональну недостатність суглобів II і III ступеня, що може бути пов’язано із запізнілою госпіталізацією у спеціалізований стаціонар (в середньому через 8 років після початку артриту) і неоптимальним амбулаторним лікуванням. Базисні препарати на час госпіталізації отримували лише 38% хворих, глюкокортикоїди — 25%, у стаціонарі вони були призначені відповідно 90 і 50% хворих.
ВСТУП
Псоріатичний артрит (ПcА) належить до групи серонегативних спондилоартропатій і характеризується розвитком синовіту, ентезиту, дактиліту і спондиліту, яким зазвичай передує псоріатичне ураження шкіри та нігтів [27].
Поширеність запальних артропатій у загальній популяції становить 2–3%, серед хворих на псоріаз (ПС) — 6–42% [12, 32]. Точна поширеність і захворюваність на ПсА невідомі у зв’язку з відсутністю на момент проведення основних епідеміологічних досліджень загальноприйнятої класифікації та діагностичних критеріїв [15, 21].
За різними джерелами, поширеність ПсА в популяції коливається від 0,04 до 0,25% [5, 32], а захворюваність значно залежить від етнічної популяції і становить від 0,1 випадку/105 в Японії до 23,1 випадку/105 — в Європі та Північній Америці [11, 36, 37].
Найвища поширеність ПсА у хворих на ПС спостерігалася серед населення країн Європи та Південної Америки. Так, за усередненими даними 266 досліджень з Європи поширеність ПсА серед хворих на ПС становить 22,7%, у 10 дослідженнях з Південної Америки — 21,5%, у 3 дослідженнях з Африки — 15,5%, у 59 дослідженнях з Азії — 14,0% і в 47 дослідженнях з Північної Америки — 9,5% [6].
У більшості хворих спочатку виникають шкірні ураження, а потім артрит; однак у деяких пацієнтів шкірні та суглобові симптоми розвиваються одночасно, а у 10–15% — артрит маніфестує першим [32, 34].
У понад 50% хворих розвивається прогресуючий ерозивний артрит, що часто супроводжується функціональними порушеннями [30]. Більше 20% хворих мають тяжкі деструктивні форми артриту.
ПсА може виникати в будь-якому віці. За даними різних авторів, середній вік, в якому починається захворювання, становить 34 [40]–42 роки [39, 26], віковий пік захворюваності коливається між 30 і 50 роками [41], а вперше хворі звертаються у спеціалізовану клініку з приводу ПсА у віці близько 43,5 року [17]. У дитячому віці ПсА частіше наявний в осіб жіночої статі. Вважається, що у дорослих захворюваність серед чоловіків та жінок приблизно однакова [9], хоча за деякими спостереженнями співвідношення жінки:чоловіки серед хворих на ПсА коливається залежно від популяції від 1:1,8 [20] до 1:0,66 [35].
У середньому артрит розвивається через 10 років після початку ПС, однак у 13–17% випадків він може передувати шкірним проявам [19]; згідно з даними окремих досліджень, артрит розвивався до появи ПС у 30% хворих [23]. Ураження нігтів трапляється у 40–45% хворих на ПС без артриту і у 87% хворих на ПсА [16].
Хворі на ПсА мають високу поширеність серцево-судинних факторів ризику, їм також притаманна вища частота серцево-судинних захворювань. Частота виникнення артеріальної гіпертензії, цукрового діабету та ожиріння у них вища, ніж у популяції [33].
Варто зауважити, що прийнятним джерелом інформації щодо загальної характеристики хворих є лише дані обсерваційних, проспективних досліджень, кількість яких незначна. Показники ж хворих, що є учасниками рандомізованих клінічних досліджень, зумовлені певними критеріями включення, суттєво відрізняються між собою і не відповідають таким у популяції хворих на ПсА (табл. 1). Те ж саме стосується і результатів таких реєстрів, як CORRONA (Consortium of Rheumatology Researchers of North America), який містить переважно інформацію про хворих, що брали участь у рандомізованих дослідженнях. Так, серед 2426 хворих на ПсА, дані яких представлено у CORRONA, 56,2% отримували інгібітори фактора некрозу пухлини (ФНП) і тому мали в середньому лише 2,2 болючих та 1,5 набряклих суглобів [18], тоді як в реєстрі IPART (International Psoriasis and Arthritis Research Team) інгібітори ФНП використовували у 18,4% хворих, а кількість болючих і набряклих суглобів становила відповідно 7,3 і 3,5.
| Ознаки | IPART, 2010 [18] | КлінікаТоронто, 2005 [19] | Рандомізовані дослідження | |||||
|---|---|---|---|---|---|---|---|---|
| Clegg D.О., 1996 [13] | Kaltwasser J.P., 2004 [22] | Mease P.J., 2000 [28] | Mease P.J., 2004 [29] | Antoni C., 2002 [7] | Kavanaugh A., 2004 [24] | |||
| Кількість хворих, n | 1671 | 650 | 221 | 190 | 60 | 205 | 102 | 200 |
| Тривалість ПсА, років | 7,0 | 7,5 | 12 | 10,5 | 10 | 9 | 16 | 5,4 |
| Кількість болючих суглобів, n | 7,3 | 10 | 13 | 19 | 20 | – | 20 | 23 |
| Кількість набряклих суглобів, n | 3,5 | 3 | – | 12 | 14 | – | 13 | 12 |
| Спондилоартрит, % | – | 37 | 74 | – | – | 3 | – | 8 |
Отже, дані літератури щодо клініко-демографічної характеристики хворих на ПсА нечисленні й досить неоднорідні, вітчизняний контингент хворих на ПсА залишається недостатньо вивченим. Мета нашого дослідження — вивчити демографічну та клініко-анамнестичну характеристику, а також зміст медикаментозної терапії у хворих на ПсА, яких було вперше госпіталізовано в ревматологічний стаціонар.
ОБ’ЄКТ І МЕТОДИ ДОСЛІДЖЕННЯ
Проведено аналіз історій хвороби 281 пацієнта з ПсА на час першої госпіталізації в ревматологічні відділення (РВ) Олександрівської клінічної лікарні м. Києва у 2001–2010 рр. Для встановлення діагнозу ПсА використовували діагностичні критерії Moll та Wright [31] (до 2007 р.) та критерії CASPAR (The ClASsification of Psoriatic ARthritis) [38] (у 2007–2010 рр.). У всіх хворих, госпіталізованих у 2001–2006 рр., підтверджено діагноз щодо відповідності критеріям CASPAR. Ступінь активності ПсА, рентгенологічну стадію та функціональну недостатність суглобів (ФНС) визначали згідно з вітчизняними рекомендаціями [1].
Оцінювали такі параметри: вік, стать, дата початку ПС та суглобового синдрому, часовий зв’язок між шкірними проявами та артритом, сімейний анамнез, складові діагнозу (включаючи активність, рентгенологічну стадію, ФНС), наявність псоріатичного ураження нігтів. Також оцінювали медикаментозну терапію на догоспітальному та госпітальному етапах.
Усі показники аналізували на час першої госпіталізації в РВ з приводу ПсА. Статистичний аналіз результатів проводили за допомогою програми Statistica 6.0.
РЕЗУЛЬТАТИ ТА ЇХ ОБГОВОРЕННЯ
Результати аналізу основних анамнестичних, демографічних, клінічних та рентгенологічних показників на час першої госпіталізації в РВ наведено в табл. 2.
| Показники | ||
|---|---|---|
| Стать, n (%) | чол. | 106 (37,7) |
| жін. | 175 (62,3) | |
| Вік, років (М±σ) | 46,3±13,5 | |
| Вік хворих, на період дебюту артриту (n=281), років (М±σ) | 37,8±17,3 | |
| Тривалість артриту на час госпіталізації (n=276), років (М±σ) | 8,00±5,43 | |
| Тривалість ПС на час госпіталізації (n=210), років (М±σ) | 17,0±13,0 | |
| Активність, n (%) | I | 88 (32,2) |
| II | 154 (56,4) | |
| III | 31 (11,4) | |
| Рентгенологічна стадія, n (%) | І | 16 (7,7) |
| ІІ | 96 (46,4) | |
| ІІІ | 77 (37,2) | |
| IV | 18 (8,7) | |
| ФНС, n (%) | І | 106 (37,7) |
| ІІ | 168 (59,8) | |
| III | 7 (2,5) | |
| Псоріатичне ураження нігтів, n (%) | 39 (13,9) | |
| Лікування на час госпіталізації, n (%) | НПЗП | 159 (56,6) |
| ГК | 71 (25,3) | |
| БП | 108 (38,4) | |
Тут і далі: НПЗП — нестероїдні протизапальні препарати; ГК — глюкокортикоїди; БП — базисні препарати.
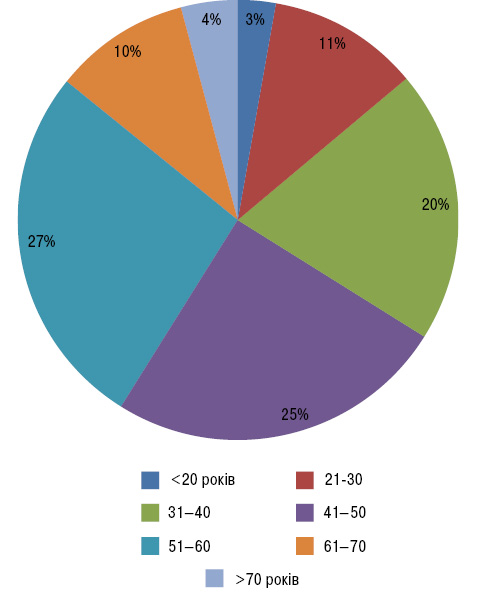
Як видно (див. табл. 2), серед госпіталізованих хворих переважали жінки (співвідношення жінки : чоловіки — 1,7:1). Вік хворих на час госпіталізації та на момент дебюту артриту коливався відповідно від 17 до 76 та від 5 до 74 років. Більшість (72%) хворих увійшли у вікову групу від 31 до 60 років (рис. 1).
Виявлено значні рентгенологічні та функціональні зміни у пацієнтів із ПсА: у 45,9% учасників дослідження — ІІІ та ІV рентгенологічна стадія захворювання, у 62,3% — ФНС ІІ та ІІІ ступеня. Такий досить тяжкий загальний стан хворих можна пояснити значною тривалістю артриту до моменту першої госпіталізації (у середньому 8 років) та неадекватністю терапії на амбулаторному етапі. Так, лише 38,4% хворих отримували БП, хоча у 67,8% учасників — ІІ та ІІІ ступінь активності захворювання, тривалість ранкової скутості становила 3,14±3,49 год (n=88), при цьому лише у 8,7% хворих її не було взагалі. Основними препаратами, які застосовували на догоспітальному етапі, були НПЗП; ГК отримував кожен четвертий хворий.
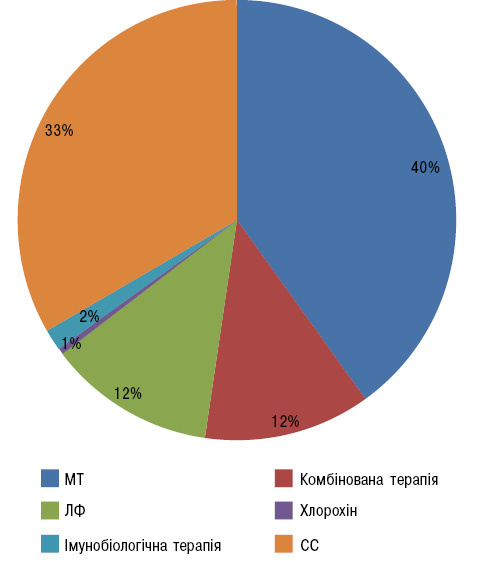
Під час перебування у стаціонарі характер лікування суттєво змінювався, що відображало його неоптимальність на долікарняному етапі. Так, 94% хворих застосовували НПЗП. БП було призначено 89,7% пацієнтам. Як видно з рис. 2, 40% хворих приймали метотрексат (МТ) у дозі від 5 мг до 22,5 мг/тиж (середня доза — 11,2±8,7 мг/тиж), третина — сульфасалазин (СС) в дозі 2 г/добу, кожен восьмий хворий отримував лефлуномід (ЛФ) (100 мг/добу протягом 3 днів, потім — 20 мг/добу) або комбіновану базисну терапію (МТ+ЛФ, СС+ЛФ, МТ+СС, МТ+антималярійні препарати, СС+антималярійні препарати, СС+тауредон). У 4 хворих використовували імунобіологічну терапію — інфліксимаб (3 хворих) та адалімумаб (1 хворий).
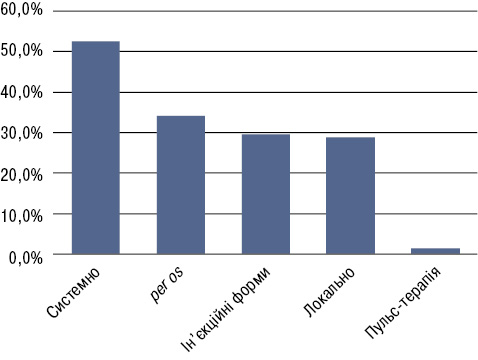
Половина хворих (141 особа) потребували призначення ГК (рис. 3). При цьому у 52,6% хворих їх застосовували системно, у 28,8% — локально ін’єкційно (внутрішньосуглобово та періартикулярно), стан 4 хворих вимагав призначення пульс-терапії ГК.
За даними літератури, в реальній медичній практиці ГК призначають 4,6% [10]–29,8% хворих на ПсА, а при переважно аксіальному ураженні частота застосування ГК сягає 40,6% [42]. На початкових стадіях ГК використовують для швидкого усунення запалення, внутрішньосуглобові ін’єкції ГК застосовують при стійких моно- або олігоартритах [14]. Частота призначення БП значно відрізняється у різних країнах: від 40,5% [10]–61,7% [25] у Канаді та Швеції до 83,9% — у Німеччині [42], при цьому, за даними німецьких дослідників (2006), МТ отримували 65,9% хворих, СС — 12%, антималярійні препарати — 2,7%, біологічні БП — 2,1%, інші БП та комбіновану біологічну терапію призначали 7,5 та 13% хворих відповідно [8]. НПЗП призначають 30,6–55,9% хворих на ПсА [25]. Відомо, що існують певні застереження стосовно системного застосування ГК при ПсА у зв’язку з ризиком загострення шкірних уражень, особливо після зниження дози/відміни ГК [8]. З огляду на можливість загострення ПС та внаслідок недоведеної ефективності не рекомендується використовувати амінохінолінові похідні [2–4].
Отже, отримані дані свідчать про недостатньо кваліфіковану оцінку стану тяжкості хворих на ПС із наявним суглобовим синдромом на догоспітальному етапі та важливість максимально ранньої їх госпіталізації у РВ з метою верифікації діагнозу та своєчасного призначення адекватної терапії.
Згідно з результатами нашого дослідження, у 69,4% хворих суглобовому синдрому передувало ураження шкіри. Артрит у середньому розвивався через 13 років після перших проявів ПС, максимально — через 61 рік. Одночасний розвиток суглобового синдрому та ПС шкіри відзначали у 12,7% хворих, розвиток ПС після розвитку артриту — у 10,9% хворих. При цьому середній час від початку артриту до розвитку ПС у цих хворих становив 7,67±7,59 року, мінімальний — 0,5 року, максимальний — 26 років. У 7% хворих визначали лише обтяжений сімейний анамнез ПС. Найчастіше (42,2% випадків) ПсА асоціювався із псоріатичним ураженням волосистої ділянки голови. Типове ураження нігтів виявлено у 13,9% хворих на ПсА. Значно нижча порівняно з даними літератури частота ураження нігтів, ймовірно, зумовлена недостатньою увагою лікарів до виявлення цього прояву ПС/ПсА або його неповним відображенням у медичній документації.
Серед системних проявів ПсА найчастіше відзначали гіпертермію (14,6% хворих), зменшення маси тіла (6,8%), синдром Рейно (1,8%) та міалгії (0,7%).
Висновки
- У хворих на ПсА, які були госпіталізовані в РВ, дещо переважали (62%) жінки, артрит дебютував у віці від 5 до 74 років (у середньому — 38), у 69% випадків — на тлі шкірного ПС (в середньому через 13 років після його появи), ПсА і ПС розвивалися одночасно у 13%, артрит передував ПС у 11% хворих (у середньому за 8 років), 7% хворих мали лише сімейний анамнез ПС.
- На час першої госпіталізації в РВ у 68% хворих був ПсА ІІ або ІІІ ступеня активності, близько половини хворих мали значні функціональні порушення (ФНС ІІ або ІІІ — у 62%) і незворотні зміни опорно-рухового апарату (III або IV рентгенологічна стадія — у 46%), що може бути пов’язано з неоптимальним лікуванням на амбулаторному етапі та пізньою госпіталізацією у спеціалізований стаціонар (у середньому через 8 років після появи артриту).
- Госпіталізація у РВ істотно впливала на медикаментозну терапію ПсА: БП були призначені 90% хворих (амбулаторно — 38%), а кількість пацієнтів, які отримували ГК, збільшилася вдвічі (з 25 до 50%).
Список використаної літератури
- Коваленко В.Н., Шуба Н.М., Проценко Г.А. та ін. (2002) Ревматические болезни. Номенклатура, классификация, стандарты диагностики и лечения. Катран груп, Киев, 214 с.
- Мазуров В.И. (2001) Клиническая ревматология: Руковод. практ. врач.). Фолиант, Санкт-Петербург, 416 с.
- Насонов Е.Л., Насонова В.А. (2008) Ревматология: национальное руководство. ГЭОТАР-Медиа, Москва, 720с.
- Свінціцький А.С., Яременко О.Б., Пузанова О.Г., Хомченкова Н.І. (2006) Ревматичні хвороби та синдроми. Книга плюс, Київ, 680 с.
- Alamanos Y., Voulgari P.V., Drosos A.A. (2008) Incidence and prevalence of psoriatic arthritis: a systematic review. J. Rheumatol., 35: 1354–1358.
- Alinaghi F., Calov M., Kristensen L.E. et al. (2019) Prevalence of psoriatic arthritis in patients with psoriasis: a systematic review and meta-analysis of observational and clinical studies. J. Am. Acad. Dermatol., 80(1): 251–265.
- Antoni C., Kavanaugh A., Kirkham B. et al. (2002) The infliximab multinational psoriatic arthritis controlled trial (IMPACT). Arthr. Rheum., 46: 381.
- Ash Z., Gaujoux-Viala С., Gossec L. et al. (2012) A systematic literature review of drug therapies for the treatment of psoriatic arthritis: current evidence and meta-analysis informing the EULAR recommendations for the management of psoriatic arthritis. Ann. Rheum. Dis., 71: 319–326.
- Bennett R.M. (2005) Psoriatic arthritis. In: W.J. Koopman, L.W. Moreland (Eds.) Arthritis and Allied Conditions. A textbook of Rheumatology. 15th Ed., Lippincott, Williams and Wilkins, Philadelphia, p. 1357–1374.
- Bond S.J., Farewell V.T., Schentag C.T. et al. (2007) Predictors for radiological damage in psoriatic arthritis: results from a single centre. Ann. Rheum. Dis., 66: 370–376.
- Bruce I.N. (2003) Psoriatic arthritis: clinical features. In: M.C. Hochberg, J.S. Silman, M.E. Smolen, M. Weinblatt, M. Weisman (Eds.) Rheumatology, 3rd Ed., Mosby, Philadelphia, p. 1241–1252.
- Chandran V., Raychaudhuri S.P. (2010) Geoepidemiology and environmental factors of psoriasis and psoriatic arthritis. J. Autoimmun., 34(3): 314–321.
- Clegg D.O., Reda D.J., Mejias E. et al. (1996) Comparison of sulfasalazine and placebo in the treatment of psoriatic arthritis. A Department of Veterans Affairs Cooperative Study. Arthr. Rheum., 39: 2013–2020.
- Coates L.C., Kavanaugh A., Mease P.J. et al. (2016) Group for Research and Assessment of Psoriasis and Psoriatic Arthritis 2015 treatment recommendations for psoriatic arthritis. Arthr. Rheum., 68: 1060–1071.
- Gladman D.D. (1995) Psoriatic arthritis. Baillieres Clin. Rheumatol., 9: 319–329.
- Gladman D.D., Anhorn K.A., Schachter R.K., Mervart H. (1986) HLA antigens in psoriatic arthritis. J. Rheumatol., 13: 586–592.
- Gladman D.D., Antoni C., Mease P. et al. (2005) Psoriatic arthritis: epidemiology, clinical features, course, and outcome. Ann. Rheum. Dis., 64: 14–17.
- Gladman D.D., Chandran V. (2011) Observational cohort studies: lessons learnt from the University of Toronto Psoriatic Arthritis Program. J. Rheumatol., 50(1): 25–31.
- Gladman D.D., Shuchett R., Russell M.L. et al. (1987) Psoriatic arthritis — an analysis of 220 patient. Q. J. Med., 62(238): 127–141.
- Helliwell P.S., Marchesoni A., Peters M. et al. (1991) A re-evaluation of the osteoarticular manifestations of psoriasis. Br. J. Rheumatol., 30: 339–345.
- Helliwell P.S., Taylor W.J. (2005) Classification and diagnostic criteria for psoriatic arthritis. Ann. Rheum. Dis., 64 (2): 3–8.
- Kaltwasser J.P., Nash P., Gladman D. et al. (2004) Efficacy and safety of leflunomide in the treatment of psoriatic arthritis and psoriasis: a multinational, double-blind, randomized, placebo-controlled clinical trial. Arthr. Rheum., 50: 1939–1950.
- Kammer G.M., Soter N.A., Gibson D.J., Schur P.H. (1979) Psoriatic arthritis: a clinical, immunologic and HLA study of 100 patients. Semin Arthr. Rheum., 9: 75–97.
- Kavanaugh A., Krueger G.G., DeVlam K. et al. (2004) Infliximab improves arthritis and psoriasis in patients with active polyarticular psoriatic arthritis. Results of the IMPACT 2 trial. Ann. Rheum. Dis., 63(1): 402.
- Kristensen L.E., Gülfe A., Saxne T. et al. (2008) Efficacy and tolerability of anti-tumour necrosis factor therapy in psoriatic arthritis patients: results from the South Swedish Arthritis Treatment Group register. Ann. Rheum. Dis., 67: 364–369.
- Marsal S., Armadans-Gil L., Martinez M. et al. (1999) Clinical, radiographic and HLA associations as markers for different patterns of psoriatic arthritis. Rheumatology (Oxford), 38: 332–337.
- Mease P.J. (2011) Psoriatic arthritis: update on pathophysiology, assessment and management. Ann. Rheum. Dis., 70: 77–84.
- Mease P.J., Goffe B.S., Metz J. et al. (2000) Etanercept in the treatment of psoriatic arthritis and psoriasis: a randomised trial. Lancet, 356: 385–390.
- Mease P.J., Kivitz A.J., Burch F.X. et al. (2004) Etanercept treatment of psoriatic arthritis: safety, efficacy and effect on disease progession. Arthr. Rheum., 50: 2264–2272.
- Mease P.J., Ory P., Sharp J.T. et al. (2009) Adalimumab for long-term treatment of psoriatic arthritis: 2-year data from the Adalimumab Effectiveness in Psoriatic Arthritis Trial (ADEPT). Ann. Rheum. Dis., 68: 702–709.
- Moll J.M., Wright V. (1973) Psoriatic arthritis. Semin Arthr. Rheum., 3: 55–78.
- Ogdie A., Weiss P. (2015) The epidemiology of psoriatic arthritis. Rheum. Dis. Clin. North Am., 41: 545–568.
- Queiro R., Lorenzo A., Tejón P. et al. (2019) Polyarticular evolution and late‐onset psoriasis may be associated with cardiovascular disease in psoriatic arthritis. Int. J. Rheum. Dis., 22: 269–274.
- Ritchlin C.T., Colbert R.A., Gladman D.D. (2017) Psoriatic arthritis. N. Engl. J. Med., 376: 2095–2096.
- Roberts M.E., Wright V., Hill A.G., Mehra A.C. (1976) Psoriatic arthritis. Follow-up study. Ann. Rheum. Dis., 35: 206–212.
- Savolainen E., Kaipiainen-Seppanen O., Kroger L., Luosujarvi R. (2003) Total incidence and distribution of inflammatory joint diseases in a defined population: results from the Kuopio 2000 arthritis survey. J. Rheumatol., 30: 2460–2468.
- Soderlin M.K., Borjesson O., Kautiainen H. et al. (2002) Annual incidence of inflammatory joint diseases in a population based study in southern Sweden. Ann. Rheum. Dis., 61: 911–915.
- Taylor W., Gladman D., Helliwell P. et al. (2006) Classification criteria for psoriatic arthritis: development of new criteria from a large international study. Arthr. Rheum., 54: 2665–2673.
- Trabace S., Cappellacci S., Ciccarone P. et al. (1994) Psoriatic arthritis: a clinical, radiological and genetic study of 58 Italian patients. Acta Derm. Venereol., Suppl. (Stockh.), 186: 69–70.
- Veale D., Rogers S., Fitzgerald O. (1994) Classification of clinical subsets in psoriatic arthritis. Br. J. Rheumatol., 33: 133–138.
- Winchester R. (2008) Psoriatic arthritis. In: K. Wolff, L.A. Goldsmith, S.I. Katz, B.A. Gilchrest, et al. Fitzpatrick’s Dermatology in General Medicine. 7th ed. McGraw-Hill, New York, p. 194–207.
- Zink A., Thiele K., Huscher D. et al. (2006) Healthcare and burden of disease in psoriatic arthritis. A comparison with rheumatoid arthritis and ankylosing spondylitis. J. Rheumatol., 33: 86–90.
РЕЗУЛЬТАТЫ РЕТРОСПЕКТИВНОГО 10-ЛЕТНЕГО АНАЛИЗА СТАЦИОНАРНЫХ БОЛЬНЫХ ПСОРИАТИЧЕСКИМ АРТРИТОМ: 1. ДЕМОГРАФИЧЕСКАЯ, КЛИНИКО-АНАМНЕСТИЧЕСКАЯ ХАРАКТЕРИСТИКА ЛЕЧЕНИЯ
Резюме. Изучены демографическая, клинико-анамнестическая характеристика и содержание медикаментозной терапии у 281 больного псориатическим артритом (ПсА) на время первой госпитализации в ревматологическое отделение. Артрит дебютировал в возрасте от 5 до 74 лет (в среднем — 38), в 69% случаев — на фоне кожного псориаза (ПС) (в среднем через 13 лет после его появления), ПсА и ПС развивались одновременно у 13%, артрит предшествовал ПС у 11% больных (в среднем за 8 лет), 7% больных имели только семейный анамнез ПС. Псориатическое поражения ногтей наблюдалось у 14% больных. Во время первой госпитализации уже 46% больных имели III и IV рентгенологическую стадию заболевания и 62% — функциональную недостаточность суставов II и III степени, что может быть связано с несвоевременной госпитализацией в специализированный стационар (в среднем через 8 лет после начала артрита) и неоптимальным амбулаторным лечением. Базисные препараты на время госпитализации получали только 38% больных, глюкокортикоиды — 25%, в стационаре они были назначены соответственно 90 и 50% больных.
псориатический артрит, псориаз, суставной синдром, ревматологический стационар, медикаментозная терапия, базисные препараты.
Адреса для листування:
Яременко Олег Борисович
01601, Київ, бульв. Тараса Шевченка, 13
Національний медичний університет ім. О.О. Богомольця,
кафедра внутрішньої медицини № 3

Leave a comment