Ревматоїдний артрит і ураження органів дихання: поєднання з вирішальним значенням
Резюме. Ураження органів дихання — один із найчастіших позасуглобових проявів ревматоїдного артриту (РА). Цей огляд висвітлює основні особливості ураження органів дихання у пацієнтів з РА. Продемонстровано, що залучення респіраторної системи, особливо паренхіми легені, призводить до вірогідного підвищення смертності у пацієнтів з РА. Пріоритетом у тактиці ведення цих пацієнтів є визначення ранніх методів діагностики, розроблення терапевтичної стратегії, а також способів прогнозування результату, відповіді й моніторингу ефективності терапії, що проводиться.
Поражение органов дыхания (ОД) является одним из наиболее частых внесуставных проявлений ревматоидного артрита (РА), которое, согласно некоторым данным, развивается у 60–80% пациентов с РА (Cortet B. et al., 1997; Turesson С. et al., 2003). Поражение, ассоциированное с РА, может возникать на любом уровне и с вовлечение практически всех структур респираторной системы: дыхательных путей, паренхимы легкого, серозной оболочки (Suda T., 2015), в то же время поражение сосудов легкого — явление крайне редкое (Fischer A., du Bois R., 2012) (рис. 1).
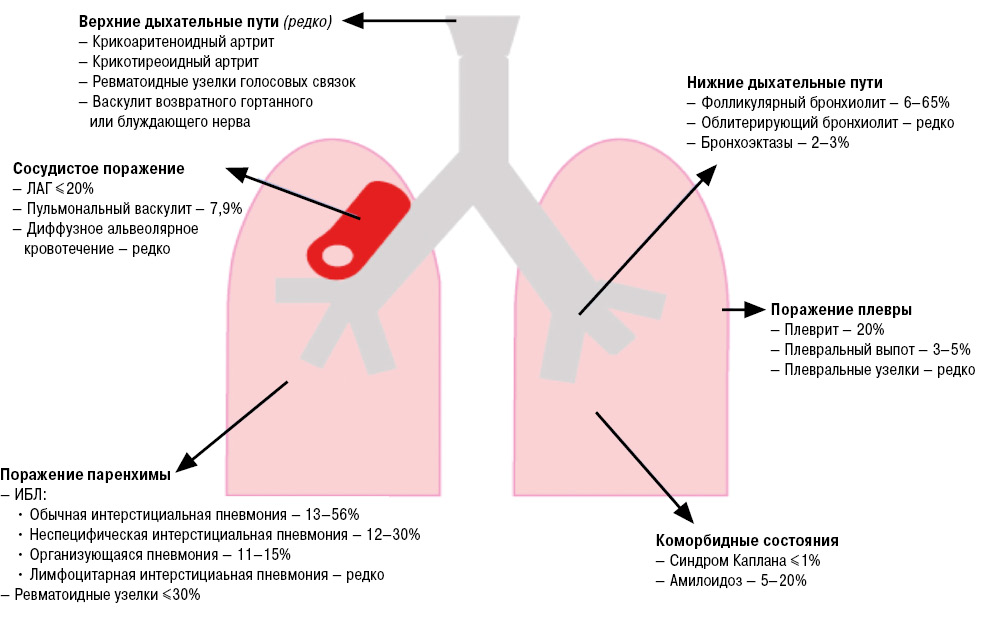
Патологические изменения, возникающие в ОД при РА, могут быть как вариантом вторичного поражения на фоне основного заболевания, так и формой нежелательного явления от проводимой терапии, например развитие оппортунистических инфекций либо непосредственно медикаментозная токсичность (Bongartz T. et al., 2010).
Вариабельность частоты вовлечения ОД при РА зависит от структуры изучаемой популяции пациентов, а также использования диагностических методов идентификации. Так, при оценке клинической симптоматики и изменений при помощи рентгенографии органов грудной клетки распространенность поражения составляет 30–40%, при использовании компьютерной томографии высокого разрешения (КТВР) — возрастает до 50–70% соответственно (Urisman A., Jones K.D., 2014). При этом у 10–20% пациентов с РА симптомы поражения ОД возникают уже в дебюте заболевания.
Поражение респираторной системы у пациентов с РА заслуживает особого внимания, поскольку является достоверной причиной повышения уровня заболеваемости и смертности. Так, по данным наблюдения в когорте пациентов с РА клиники Мейо, у 13% наличие поражения паренхимы легкого являлось причиной преждевременной смерти, второй по частоте после поражения сердечно-сосудистой системы (Bongartz T. et al., 2010).
A.L. Olson и соавторами (2011) установлено, что количество свидетельств о смерти, выданных в CША, среди пациентов с РА, у которых как клинически значимое состояние была указана ИБЛ, составило 6,8% у женщин и 9,8% — у мужчин. Позже в исследовании T.J. Doyle и соавторов (2015) отмечено, что уровни распространенности и заболеваемости ИБЛ у пациентов с РА не отображают реальной ситуации ввиду недостаточного уровня их диагностики и невысокой настороженности в целом. Это в том числе связано и с отсутствием достоверных методик прогнозирования индивидуального риска прогрессирования субклинической в клинически значимую ИБЛ, ассоциированную с РА (РА-ИБЛ).
Среди основных факторов риска развития ИБЛ у пациентов с РА принято выделять пожилой возраст, мужской пол, курение в анамнезе, серопозитивность по ревматоидному фактору и/или антитела к циклическому цитруллинированному пептиду (АЦЦП) (Kelly C.A. et al., 2014). Отметим, что курение ассоциируется с повышением риска развития как РА, так и РА-ИБЛ (Saag K.G. et al., 1997; Doyle T.J. et al., 2015). Также описана вероятная ассоциативная связь активности РА с развитием РА-ИБЛ, хотя эта взаимосвязь менее изучена (Koduri G. et al., 2010).
С учетом клинической и прогностической значимости понимание основных механизмов, которые лежат в основе развития и прогрессирования поражения ОД при РА, их взаимодействия с течением заболевания и проводимой терапией, имеет огромное практическое значение и обусловливает необходимость разработки специфичных и высокоэффективных терапевтических подходов.
Поражение плевры. По данным аутопсий распространенность поражения плевры у пациентов с РА составляет до 50–70%, при этом клинически значимая симптоматика возникает лишь у 5–7%. У ряда пациентов с РА признаки перенесенного плеврита часто выявляются даже при отсутствии в анамнезе каких-либо респираторных симптомов (Shaw M. et al., 2015). Наиболее частыми формами поражения плевры при РА являются плеврит, плевральный выпот и плевральные узелки. Развитие пневмоторакса — явление крайне редкое, а фиброторакс принято рассматривать как позднее осложнение рецидивирующего и нелеченного плеврита (Сorcoran J.P. et al., 2014). Нетипичным для РА является одновременное возникновение плеврального и перикардиального выпота (Balbir-Gurman A. et al., 2006). В исследовании D. Bouros и соавторов описано вероятное развитие плеврита и плеврального выпота у пациентов на поздних стадиях заболевания, которое часто ассоциируется с наличием подкожных ревматоидных узелков.
Плевральный выпот у пациентов с РА в 70% случаев является односторонним (преимущественно левосторонним) экссудатом, со смешанным клеточным составом, высоким содержанием лактатдегидрогеназы, низким рH и низким содержанием глюкозы. Чаще плевральный выпот у пациентов с РА ввиду незначительного объема имеет бессимптомное течение и выявляется как находка при проведении рентгенографии. При значительном объеме выпота, способного раздражать рецепторы париетальной плевры, развивается типичная клиническая симптоматика хорошо локализованного болевого синдрома в грудной клетке, усиливающегося при глубоком дыхании и кашле. Большинство пациентов с РА и поражением плевры не требуют проведения специфической терапии, состояние хорошо разрешается на фоне применения базисных антиревматических препаратов (БАРП) (Balbir-Gurman A. et al., 2006).
Сосудистое поражение легких при РА. Точная распространенность ЛАГ в случае РА окончательно неизвестна, но в целом состояние крайне редкое, возникающее преимущественно у лиц пожилого возраста с длительным течением РА. Рядом исследований, в которых установлено повышение распространенности ЛАГ (до 20%) по данным эхокардиографии, проведенной у пациентов без какой-либо симптоматики, был поднят вопрос о том, насколько клинически и прогностически значимым является повышение давления в легочной артерии в данной когорте больных. Достоверно чаще развивается ЛАГ у пациентов с РА на фоне сопутствующего заболевания легких, при этом в таких клинических случаях эффективных терапевтических средств на сегодняшний день недостаточно (Shahane A., 2013).
Пульмональный васкулит — проявление системного васкулита, хорошо известного, но редкого внесуставного проявления при РА, характеризующегося одновременным поражением кожи (pyoderma gangrenosum) и периферической нервной системы (множественная мононейропатия — mononeuritis multiplex) и возможностью вовлечения в процесс легких. В последнее время частота системного васкулита достоверно снизилась, в том числе в результате улучшения подходов к диагностике и контролю заболевания. При проведении КТВР пульмональный васкулит характеризуется картиной узлового фенотипа поражения с формированием полостей, напоминающего картину АНЦА (антинейтрофильные цитоплазматические антитела)-ассоциированного васкулита (Bartels M. et al., 2010; Tourin O. et al., 2013).
Диффузное альвеолярное кровотечение (ДАК) характеризуется внутриальвеолярным накоплением эритроцитов в результате значительного повреждения альвеолярно-капиллярной мембраны легких, являющейся гистологической основой острого респираторного дистресс-синдрома (Urisman A., Jones K.D., 2014). На ранних стадиях ДАК характеризуется развитием отека внутриальвеолярных перегородок и кровоизлиянием во внутриперегородочное пространство. Впоследствии процесс распространяется и на структуру альвеол, приводя к фибриноидному некрозу, лейкоцитоклазии, накоплению нейтрофилов и внутриальвеолярному кровоизлиянию (Urisman A., Jones K.D., 2014). Данное состояние является редким и часто фатальным, при этом описана четкая связь с применением некоторых синтетических БАРП, а именно лефлуномида (Keng L.-T. et al., 2016). Дифференциальный диагноз следует проводить с АНЦА-ассоциированными васкулитами, а именно с микроскопическим полиангиитом, учитывая его роль в развитии большинства случаев ДАК в клинической практике (Krause M.L. et al., 2012).
Поражение дыхательных путей. Частота вовлечения дыхательных путей у пациентов с РА при использовании КТВР составляет 39–60% (Metafratzi Z.M. et al., 2007), при этом локализация поражения возможна как в верхних, так и нижних дыхательных путях.
Достаточно редкой, но наиболее распространенной и заслуживающей внимания формой поражения верхних дыхательных путей является крикоаритеноидный артрит. Так, согласно данным КТВР области шеи, признаки крикоаритеноидного артрита выявляются у 9 из 15 пациентов с РА, но при проведении ларингоскопии верифицируется только у двоих, подтверждая то, что клинически значимые изменения данной локализации у пациентов с РА являются нечастыми (Greco A. et al., 2012).
Основные жалобы пациента с крикоаритеноидным артритом: легкая дисфагия, осиплость голоса, боль в горле, одышка при физической нагрузке. Крайне редко данный вид поражения проявляется симптоматикой внезапного подсвязочного стеноза с рисками развития острой дыхательной недостаточности, требующей эндотрахеальной интубации (Abe K. et al., 2013). Подобно другим поражениям синовиальных суставов, крикоаритеноидный артрит характеризуется утолщением синовиальной оболочки, выпотом в сустав, что в результате может привести к эрозированию хряща и подвывиху сустава.
Поражение бронхов при РА составляет по различным данным от 10–60%, при этом наиболее частыми вариантами поражения нижних дыхательных путей у пациентов с РА являются бронхиолит и бронхоэктазы (БЭ).
БЭ — постоянная необратимая дилатация дыхательных путей, содержащих хрящ, клинически проявляющаяся кашлем, выделением мокроты, и развитием респираторных инфекции. Одновременно аномально расширенные бронхи приводят к снижению защитных свойств, обусловливают бактериальную инфекцию и воспаление дыхательных путей, замыкая таким образом порочный круг (Chalmers J.D., Hill A.T., 2013). У пациентов с РА продемонстрирована достоверно более высокая распространенность БЭ (2,7%) по сравнению со здоровой популяцией (0,03%). При этом в случае проведения КТВР частота БЭ возрастает до 30% (Allain J. et al., 1997), а при наличии хронической респираторной симптоматики тракционные БЭ выявляют у 75% пациентов с РА.
Временные взаимосвязи между БЭ и РА длительное время являются предметом дискуссии. Данными одних исследований описаны БЭ, предшествующие дебюту РА, рядом других — БЭ определяются как позднее осложнение РА (McMahon M.J. et al., 1993; Shadick N.A. et al., 1994). Наиболее правдоподобной выглядит гипотеза о том, что хроническая бронхиальная инфекция (как результат наличия БЭ) является источником длительной антигенной нагрузки, которая приводит к нарушению иммунной толерантности и последующему развитию РА у генетически предрасположенных пациентов (Quirke A.-M. et al., 2015). Рядом исследований с применением КТВР доказана высокая распространенность субклиничеcкого течения заболевания дыхательных путей по типу БЭ в дебюте или даже на доклинических стадиях РА (Demoruelle M.K. et al., 2012; Wilsher M. et al., 2012).
Одновременное наличие БЭ и РА оказывает достоверное влияние на статус и прогноз пациента, особенно на фоне терапии БАРП, в связи с достоверным повышением риска развития инфекционных осложнений. Такой контингент пациентов имеет уровни смертности в 7,3 раза выше в сравнении со здоровой популяцией; в 5 раз выше по сравнению с пациентами только с РА и в 2,4 раза выше по сравнению с пациентами только с БЭ (Swinson D.R. et al., 1997).
Бронхиолит при РА представлен двумя основными формами: фолликулярный или констриктивный облитерирующий. В основе развития бронхиолита лежит сужение просвета бронха, при этом, если в случае фолликулярного бронхиолита это результат гиперплазии бронхиальной лимфоидной ткани, то при констриктивном облитерирующем — констриктивного фиброза просвета бронха (Urisman A., Jones K.D. et al., 2014).
Фолликулярный бронхиолит характеризуется более мягким течением с доминированием воспалительного компонента, изменениями дыхательных тестов по рестриктивному типу, а на КТВР выявляется утолщение стенок бронхов и центрилобулярные перибронхиальные узелки.
Отличие констриктивного бронхиолита состоит в гистологической основе — развитии фиброзного процесса с концентрическим сужением мембранозной и респираторной бронхиол, вызванных перибронхиальным воспалением и фиброзом, без признаков лимфоидной гиперплазии. Констриктивный бронхиолит чаще развивается у женщин с длительным и нелеченным РА. Данный вариант бронхиолита характеризуется более тяжелым течением, проявляется быстропрогрессирующей одышкой и выделением мокроты. Дыхательные тесты характеризуются изменениями по обструктивному типу, а при проведении КТВР определяются признаки утолщения стенок бронхиол, центролобулярная эмфизема и БЭ (Tansey D. et al., 2004). Несмотря на достаточно пессимистический прогноз в целом, вследствие быстрого развития дыхательной недостаточности на протяжении нескольких месяцев–лет, данные некоторых исследований продемонстрировали потенциальную эффективность применения макролидов (Lynch J. et al., 2012) и ингибиторов фактора некроза опухи (ФНО)-α (Cortot A.B. et al., 2005) при констриктивном бронхиолите у пациентов с РА.
Поражение паренхимы. ИБЛ представлена более чем 200 патологическими состояниями, возникающими в паренхиме легкого, бо`льшая часть которых являются редкими (Flaherty K.R. et al., 2017). РА-ИБЛ охватывает спектр поражения паренхимы легкого, который возникает, начиная с ранних стадий РА, чаще не вызывая какой-либо клинической симптоматики, с последующим развитием прогрессирующего фиброза (Koduri G. et al., 2010).
Гистопатологическая классификация ИБЛ, ассоциированной с ревматическими заболеваниями, базируется на основании пересмотренной в 2013 г. классификации идиопатической интерстициальной пневмонии (ИП) American Thoracic Society/European Respiratory Society (табл. 1).
| Основные идиопатические ИП |
|---|
| Идиопатический пульмональный фиброз (ИПФ) |
| Идиопатическая неспецифическая ИП (НИП) |
| Респираторный бронхиолит — ИБЛ |
| Десквамационная ИП |
| Криптогенная организующаяся пневмония |
| Острая ИП |
| Редкие идиопатические ИП |
| Идиопатическая лимфоидная ИП |
| Идиопатический плевропаренхиматозный фиброэластоз |
На основании данной классификации было принято решение выделять основные категории ИП и ассоциированные с ними клинико-рентгенологические диагнозы, а также патоморфологические фенотипы поражения паренхимы легкого (табл. 2).
| Категория | Клинико-рентгенологически-патологический диагноз | Ассоциированный рентгенологический и/или патологически-морфологический фенотип |
|---|---|---|
| Хроническая фиброзирующая ИП | ИПФ, идиопатическая НИП | Обычная ИП, НИП |
| ИП, обусловленная курением | Респираторный бронхиолит–ИБЛ, десквамационная ИП | Респираторный бронхиолит, десквамационная ИП |
| Острая/подострая ИП | Криптогенная организующаяся пневмония, острая ИП | Организующаяся пневмония, диффузное альвеолярное повреждение |
У пациентов с РА больше чем в половине случаев основной вариант поражения паренхимы легких — обычная интерстициальная пневмония (ОИП), в отличие от системных заболеваний соединительной ткани, при которых основное влияние имеет патоморфологический вариант поражения легких по типу идиопатической НИП (Suda T. et al., 2015).
Невзирая на то что золотым стандартом диагностики ИБЛ является биопсия, данными ряда исследований продемонстрирована высокая степень корреляции между изменениями, выявляемыми при проведении КТВР, и патогистологическими признаками поражения паренхимы, особенно в случае ОИП. Важность определения патогистологического типа поражения паренхимы легких состоит в том, что исходно фенотип поражения в случае РА-ИБЛ определяет тяжесть состояния, особенности течения и отдаленный прогноз пациента (Kim E.J. et al., 2009).
Существуют данные, подтверждающие оverlap-синдром между РА-ОИП и ИПФ, которые легли в основу гипотезы о подобных механизмах повреждения эпителиальных/эндотелиальных клеток, нарушений дифференциации/пролиферации фибробластов, тканевом ремоделировании и развитии фиброза в случае обоих заболеваний. В то же время доказанный иммунологический триггерный фактор, который запускает данный предполагаемый аутоиммунный ответ, не выявлен (Wilson M.S., Wynn T.A., 2009).
Потенциальные пути взаимодействия и хронологической взаимосвязи поражения сустава и легкого при РА принято рассматривать, согласно двум основным концепциям (Paulin F. et al., 2015). В первом случае индукцией РА-ИБЛ являются изменения, возникающие в синовиальной оболочке сустава с последующим развитием перекрестной реакции с подобными антигенами в легком. Правдоподобие данной гипотезы состоит в том, что, действительно, у большинства пациентов с РА развитие суставного синдрома предшествует поражению легкого. В случаях такой хронологии чаще развивается гистологический фенотип поражения паренхимы по типу НИП.
В случае второй патогенетической парадигмы нарушение иммунной толерантности первоначально происходит в легком и ИБЛ (гистологический вариант, соответствующий ОИП), обусловливая запуск иммунного ответа против цитруллинированных пептидов, который в последующем вторично распространяется на суставы (Bongartz T. et al., 2007). В целом патогенез поражения паренхимы легкого, ассоциированного с РА, достаточно сложный и остается окончательно непонятным, но несмотря на это именно легкое принято рассматривать основным местом нарушения иммунной толерантности.
На сегодняшний день разработана обобщенная модель патогенеза основных изменений, которые способствуют прогрессированию фиброзных изменений в паренхиме при РА-ИБЛ (рис. 2).
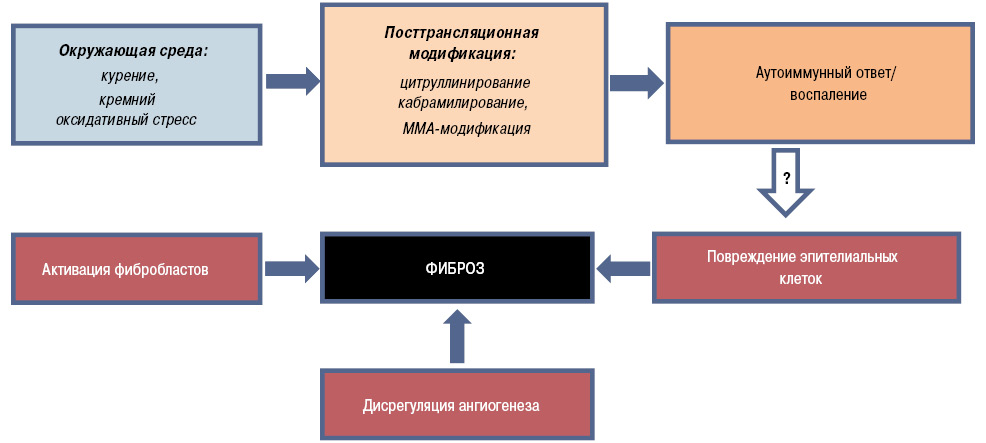
Следовательно, триггерные факторы окружающей среды (например курение) приводят к развитию оксидативного стресса, который в сочетании с посттрансляционной модификацией и ассоциированными вариантами аутоиммунного ответа запускает воспалительный процесс, характеризующийся клеточной инфильтрацией и выделением ряда цитокинов, хемокинов и факторов роста. Факторы роста, а именно тромбоцитарный фактор роста, вместе с цитокинами (интерлейкином (ИЛ)-4, ИЛ-3, трансформирующим фактором роста (ТФР-β)) способствуют пролиферации и дифференциации фибробластов, формируя взаимосвязь между воспалением и фиброзом. Матриксные металлопротеиназы (ММП), которые выделяются из поврежденного эпителия через нарушенные тканевые барьеры, также содействуют клеточной инфильтрации, активируя, в свою очередь, ряд цитокинов и профибротические медиаторы, усугубляя перекрестную реакцию между провоспалительным каскадом и тканевым ремоделированием. Точно также, как и при ИПФ, доказанной является и роль ангиогенеза в данной патогенетической модели, вызывающего формирование прямых связей между воспалением и фиброзом (Smadja D.M. et al., 2014).
Вариант поражения паренхимы легкого при РА-ИБЛ по типу ОИП возникает в 40–62% случаев, ассоциируется с более тяжелым течением, быстрым нарушением функции ОД и худшим прогнозом (Kelly C.A. et al., 2014; Solomon J.J. et al., 2016). По своим патогистологическим и клиническим характеристикам ОИП имеет сходные признаки с ИПФ. Рентгенологическая картина ОИП при КТВР гетерогенная и характеризуется наличием ретикулярных изменений, тракционных БЭ/бронхиолоэктазы, признаков «сотового легкого» (рис. 3).
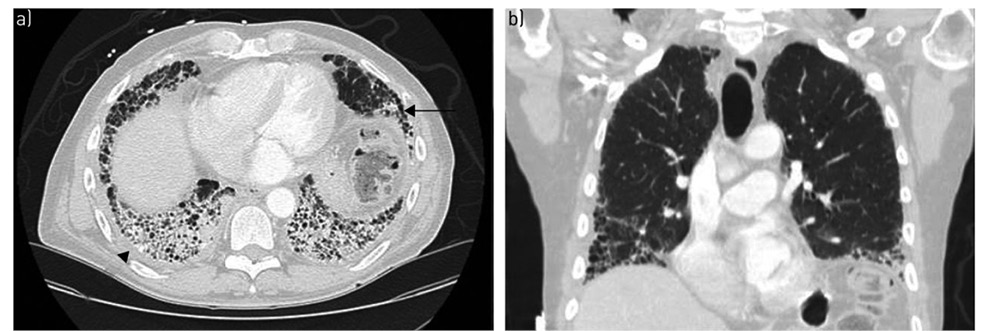
Пациенты с гистологическим фенотипом РА-ОИН — чаще пожилого возраста, мужского пола, активные курильщики или курильщики в анамнезе (Zamora-Legoff J.A. et al., 2017). РА-ОИП характеризуется частым возникновением острого респираторного приступа — состояние декомпенсации, клинически проявляющегося достоверным ухудшением одышки и дыхательной функции с длительностью симптоматики до 1 мес, с возникновением легочных инфильтратов на рентгенограмме или КТВР, при условии отсутствия симптомов сердечной недостаточности и признаков задержки жидкости (Collard H.R. et al., 2016).
Доказано, что у пациентов с РА-ОИП более высокие показатели госпитализации, потребность в проведении оксигенотерапии и более быстрое прогрессирование нарушений функции дыхания. Так, если средняя продолжительность жизни при РА-ИБЛ составляет 5 лет, то при выравнивании по типу поражения в случае РА-ОИП она не отличается от таковой при ИПФ и является хуже, чем при НИП (РА-НИП) — 3,2 vs 6,6 года соответственно (Kim E.J. et al., 2010). Значительная распространенность ОИП обусловливает высокую смертность у пациентов с РА-ИБЛ.
НИП (РА-НИП) — возникает в 11–32% случаев РА-ИБЛ, достоверно реже, чем при системных заболеваниях соединительной ткани. Гистологической основой НИП является диффузное утолщение альвеолярных мембран с лимфоплазматическим воспалением, преимущественно вокруг бронхиол, с преобладанием фиброза над признаками воспаления (рис. 4).
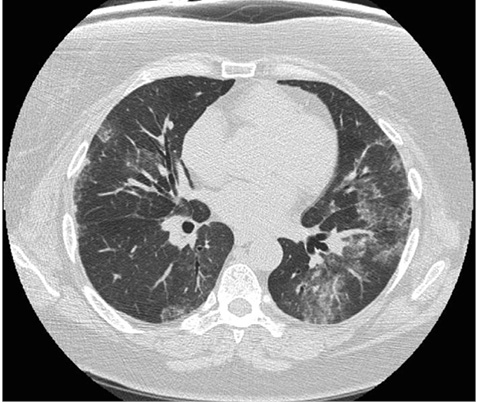
Данный тип поражения паренхимы легкого чаще возникает при дольшей продолжительности суставного синдрома, характеризуется более низким риском прогрессирования, лучшим ответом на терапию, более благоприятным прогнозом и исходом в целом. Основная особенность рентгенологической картины — однотипность поражения: развитие двухстороннего симметричного базального симптома «матового» стекла, без признаков «сотового легкого» и поражения субплевральных участков (Kono M. et al., 2016). Течение РА-НИП как гистологического фенотипа является гетерогенным. Так, часть пациентов остаются относительно стабильными, другие (в меньшей степени) — характеризуются быстрым развитием дыхательной недостаточности (Hozumi H. et al., 2013).
Клиническая картина РА-ИБЛ полностью аналогична той, которая развивается при идиопатических ИП. При этом, однако, отличительной особенностью РА-ИБЛ является то, что несмотря на выраженные рентгенологические изменения, течение заболевания в большинстве случаев бессимптомное. Так, наиболее частые симптомы РА-ИБЛ — это непродуктивный кашель и экспираторная одышка, которая у пациентов с выраженной функциональной недостаточностью суставов маскируется ввиду ограничения мобильности. Невзирая на выраженность рентгенологической картины, физикальные изменения чаще минимальные и проявляются в виде тахипноэ, а при аускультации — хрипы на вдохе, преимущественно в нижних отделах легких (Shaw M. et al., 2015).
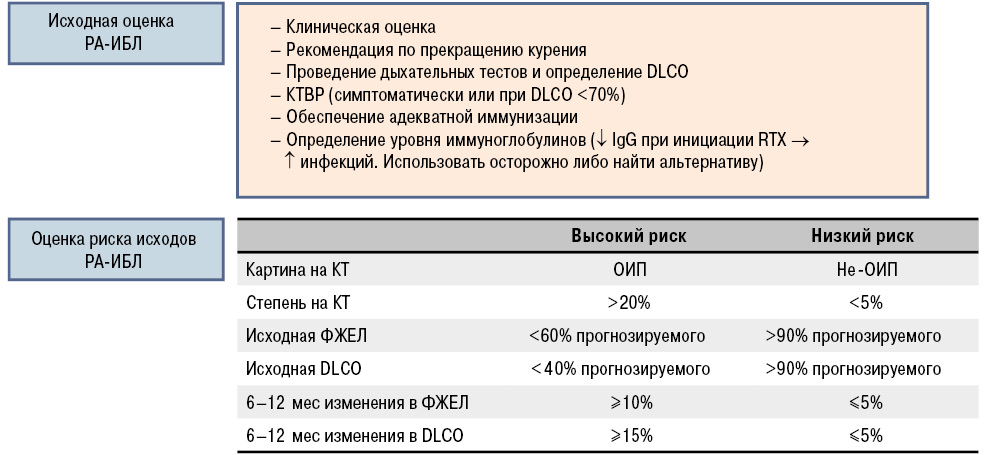
Оценка статуса пациента с РА-ИБЛ состоит в определении степени тяжести респираторных нарушений на основании клинической симптоматики, результатах дыхательных тестов, а также определении типа поражения по данным КТВР.
Клинический осмотр подразумевает количественную оценку переносимости нагрузки при помощи шкалы одышки или 6-минутного шагового теста (снижение сатурации менее 88% ассоциируется с плохим прогнозом). Дыхательные тесты следует проводить всем пациентам с клиническими нарушениями дыхательной функции, подтверждающими РА-ИБЛ. Так, исходно низкая форсированная жизненная емкость легких (ФЖЕЛ) <60% либо снижение диффузной способности легких по монооксиду углерода (DLСО) <40% — независимые предикторы ранней смертности у пациентов с идиопатической ИБЛ. Важным предиктором неблагоприятного прогноза, который ассоциируется с достоверным повышением смертности пациентов с ИБЛ, является отклонение ФЖЕЛ >10% и/или DLСО >15% за 6–12-месячный период при регулярном мониторинге.
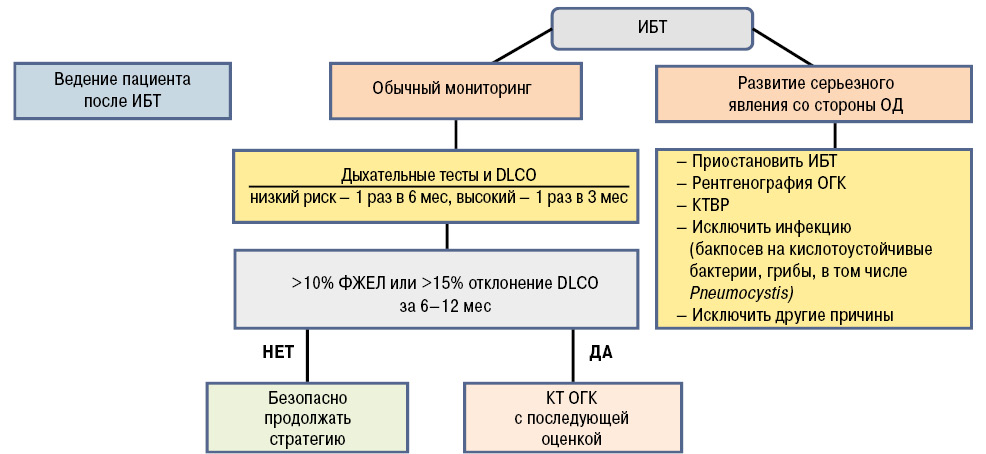
Основное показание для проведения КТВР у пациентов с РА — наличие клинической симптоматики патологии легких, а при бессимптомном течении — снижение DLСО <70% прогнозируемого. На сегодняшний день не разработана шкала, позволяющая проводить количеcтвенную оценку изменений при КТВР (Sathi N. et al., 2011). Основной предиктор неблагоприятного прогноза — наличие либо изменений по типу ОИП, либо вовлечение в процесс более чем 20% поверхности паренхимы легких. Резюмируя данные факты был разработан алгоритм оценки, позволяющий оценить риски РА-ИБЛ перед инициацией иммунобиологической терапии, а также в период последующего наблюдения (Jani M. et al., 2014). Данный подход позволяет прогнозировать краткосрочное прогрессирование процесса независимо от проводимой терапии (рис. 5).
Терапия РА-ИБЛ. Разработка руководства по терапевтической тактике пациентов с РА-ИБЛ осложнена ввиду отсутствия окончательного понимания природы состояния, часто бессимптомного либо субклинического его течения, отсутствия достоверных биомаркеров и предикторов прогрессирования заболевания. В связи с этим каждый пациент нуждается в тщательной оценке исходного статуса: определении тяжести процесса, варианта течения (острый, подострый, хронический), оценки соотношения риск/польза от той либо иной терапевтической стратегии. В целом терапию целесообразно назначать пациентам с достоверным нарушением статуса по результатам комплексной клинической, функциональной и рентгенологической оценки (Vij R., Strek M.E., 2013).
На сегодняшний день ввиду отсутствия завершенных рандомизированных клинических исследований, не имеется доказательной базы относительно эффективности отдельных фармакологических средств и их способности изменять течение заболевания. Исходя из этого, подход к терапии РА-ИБЛ является эмпирическим и состоит в первоначальном назначении глюкокортикоидов (ГК).
Доказано, что для пациентов с клинически значимым РА-ИБЛ ГК в высоких дозах являются препаратами первой линии. Общепринятым является подход в назначении пероральных ГК в дозе 0,5 мг/кг массы тела (эквивалент по преднизолону), с последующим постепенным снижением на протяжении недель/месяцев, зависимо от клиничеcкого ответа (Bradley B. et al., 2008).
В то же время существует целый ряд препаратов (включая метотрексат) с доказанным риском воздействия либо развития нежелательных явлений на фоне их применения, назначение которых следует ограничивать/избегать пациентам с РА-ИБЛ (табл. 3).
Рядом исследований доказана возможность применения азатиоприна, мофетила микофенолата (ММФ), циклоспорина, циклофосфамида в терапевтической стратегии РА-ИБЛ либо в сочетании с ГК на фоне снижения их дозы, либо у резистентных к ГК пациентов. Так, A. Fishcer и соавторы (2013) изучали эффективность и безопасность применения ММФ у большой когорты пациентов с ИБЛ, ассоциированных с системными заболеваниями соединительной ткани (n=125), включая 18 пациентов с РА-ИБЛ. Медиана продолжительности терапии составила 897 дней. Согласно полученным результатам, ММФ в целом хорошо переносился (с уровнем отмены ввиду нежелательных явлений <10%). Кроме того, применение ММФ приводило к улучшению показателей ФЖЕЛ и DLСО, а также снижению дозы ГК в подгруппе пациентов без ОИП и стабилизации аналогичных параметров в подгруппе ОИП. У пациентов с РА-ИБЛ показатель ФЖЕЛ до назначения ММФ имел тенденцию к снижению с последующим возрастанием на фоне терапии ММФ.
| Состояние | Препараты |
|---|---|
| Фиброз | Азатиоприн, циклофосфамид, препараты золота, сульфасалазин |
| Облитерирующий бронхиолит | Препараты золота, сульфасалазин |
| Индуцированная волчанка | Сульфасалазин, ингибиторы ФНО-α |
| Некардиогенный отек легких | Ацетилсалициловая кислота в высоких дозах, передозировка колхицина, циклофосфамид, метотрексат, нестероидные противовоспалительные препараты, ритуксимаб, тоцилизумаб |
| Пневмония | Анакинра, азатиоприн, циклофосфамид, препараты золота, лефлуномид, метотрексат, нестероидные противовоспалительные препараты, ритуксимаб, сульфасалазин, ингибиторы ФНО-α, тоцилизумаб |
В другом крупном наблюдательном исследовании у пациентов с РА, применяющих ритуксимаб (RTX) (n=700), включая 56 больных РА-ИБЛ с длительностью наблюдения около 10 лет, большинство пациентов продемонстрировали стабилизацию ФЖЕЛ и DLСО на фоне проведенной терапии. Прогрессирование зафиксировано у ⅓ пациентов с РА-ИБЛ, предикторами чего являлись наличие РА-ОИП как гистологического фенотипа поражения легких, низкие исходные параметры DLСО <46%, а также исходно быстропрогрессирующее течение (Yusof M.D. et al., 2017).
В данное время изучается возможность применения пирфенидона (Pirfinedone) — соединения, обладающего антифиброзным и противовоспалительным влиянием, с антиоксидантными свойствами, а также нинтеданиба (Nintedanib) — внутриклеточного ингибитора тирозинкиназ, а также рецепторов-1 фактора роста фибробластов, рецептора-2 сосудистого эндотелиального фактора роста и т.д. Данные препараты одобрены для лечения при ИПФ, учитывая их способность снижать нарушения дыхательной функции и скорость прогрессирования заболевания (King T.E. et al., 2014; Richedeli L. et al., 2014). С учетом принципиальной схожести РА-ОИП и ИПФ пациенты с РА-ОИП могут потенциально иметь преимущества от применения антифиброзной терапии, и эта теория изучается в клинических исследованиях. Однако одновременно существует предположение, что ингибиторы ТФР-β, в большей степени пирфенидон, в меньшей степени — нинтеданиб, могут приводить к повышению активности суставного синдрома, поскольку именно боль в суставах была наиболее частым нежелательным явлением.
Вывод
Данный обзор освещает основные моменты в распространенности поражения ОД у пациентов с РА. Продемонстрировано, что вовлечение ОД у больных РА, особенно паренхимы легкого в виде РА-ИБЛ, приводит к повышению смертности. Часто вероятность ИБЛ игнорируется у пациентов с РА преимущественно из-за достаточно неспецифической клинической симптоматики или субклинического течения заболевания. На сегодняшний день важным является определение методов раннего неинвазивного выявления (в том числе биомаркеров), применимых в ежедневной практике, а также эффективной терапии при РА-ИБЛ с целью замедления/изменения течения заболевания, способов прогнозирования прогрессирования, исхода, ответа и мониторинга результативности проводимой терапии.
Список использованной литературы
- Abe K., Mitsuka T., Yamaoka A. et al. (2013) Sudden Glottic Stenosis Caused by Cricoarytenoid Joint Involvement due to Rheumatoid. Arthr. Inter. Med., 52(21): 2469–2472.
- Allain J., Saraux A., Guedes C. et al. (1997) Prevalence of symptomatic bronchiectasis in patients with rheumatoid arthritis. Rev. Rhumat. (English Ed.), 64(10): 531–537.
- Alunno A.,Gerli R.,Giacomelli R. et al. (2017) Clinical, Epidemiological, and Histopathological Features of Respiratory Involvement in Rheumatoid Arthritis. Biomed. Res. Int., 2017: 7915340.
- Balbir-Gurman A., Yigla M., Nahir A.M., Braun-Moscovici Y. (2006) Rheumatoid pleural effusion. Semin. Arthritis Rheum.; 35(6): 368–378.
- Bartels C.M., Bell C.L., Shinki K. et al. (2010) Changing trends in serious extra-articular manifestations of rheumatoid arthritis among United State veterans over 20 years. Rheumatology (Oxford).; 49(9): 1670–1675.
- Bluett J., Jani M., Symmons D.P.M. (2017) Practical management of respiratory comorbidities in patients with rheumatoid arthritis. Rheumatol. Ther., 4: 309–332.
- Bongartz T., Cantaert T., Atkins S.R. et al. (2007) Citrullination in extra-articular manifestations of rheumatoid arthritis. Rheumatology (Oxford)., 46(1): 70–75.
- Bongartz T., Nannini C., Medina-Velasquez Y.F. et al. (2010) Incidence and mortality of interstitial lung disease in rheumatoid arthritis: a population-based study. Arthritis Rheum., 62(6): 1583–1591.
- Bouros D., Pneumatikos I., Tzouvelekis A. (2008) Pleural involvement in systemic autoimmune disorders. Respiration, 75(4): 361–71. doi: 10.1159/000119051.
- Bradley B., Branley H.M., Egan J.J. et al. (2008) Interstitial lung disease guideline: the British Thoracic Society in collaboration with the Thoracic Society of Australia and New Zealand and the Irish Thoracic Society. Thorax., 63(5): v1–58.
- Brito Y., Glassberg M.K., Ascherman D.P. (2017) Rheumatoid Arthritis-Associated Interstitial Lung Disease: Current Concepts. Curr. Rheumatol. Rep., 19(12): 79.
- Chalmers J.D., Hill A.T. (2013) Mechanisms of immune dysfunction and bacterial persistence in non-cystic fibrosis bronchiectasis. Mol. Immunol., 55(1): 27–34.
- Collard H.R., Ryerson C.J., Corte T.J. et al. (2016) Acute Exacerbation of Idiopathic Pulmonary Fibrosis. An International Working Group Report. Am. J. Respir. Crit. Care Med., 194(3): 265–275.
- Corcoran J.P., Ahmad M., Mukherjee R., Redmond K.C. (2014) Pleuro-Pulmonary Complications of Rheumatoid Arthritis, Respiratory Care, 59(4): 55–59.
- Cortet B., Perez T., Roux N. et al. (1997) Pulmonary function tests and high resolution computed tomography of the lungs in patients with rheumatoid arthritis. Ann. Rheum. Dis., 56(10): 596–600.
- Cortot A.B., Cottin V., Miossec P. et al. (2005) Improvement of refractory rheumatoid arthritis-associated constrictive bronchiolitis with etanercept. RespirMed., 99(4): 511–514.
- Demoruelle K.M., Weisman M.H., Simonian P.L. et al. (2012) Airways abnormalities and rheumatoid arthritis-related autoantibodies in subjects without arthritis: early injury or initiating site of autoimmunity? Arthritis Rheum., 64(6): 1756–1761.
- Doyle T.J., Patel A.S., Hatabu H. et al. (2015) Detection of Rheumatoid Arthritis-Interstitial Lung Disease Is Enhanced by Serum Biomarkers. Am. J. Respir. Crit. Care Med.,191(12): 1403–1412.
- Fischer A., du Bois R. (2012) Interstitial lung disease in connective tissue disorders. The Lancet, 380(9842): 689–698.
- Fischer A., Brown K.K., Du Bois R.M. et al. (2013) Mycophenolate Mofetil Improves Lung Function in Connective Tissue Disease-associated Interstitial Lung Disease. J. Rheumatol., 40(5): 640–646.
- Flaherty K.R., Brown K.K., Wells A.U. et al. (2017) Design of the PF-ILD trial: a double-blind, randomised, placebo-controlled phase III trial of nintedanib in patients with progressive fibrosing interstitial lung disease. BMJ Open Respir Res.;4(1):e000212.
- Greco A., Fusconi M., Macri G.F. et al. (2012) Cricoarytenoid joint involvement in rheumatoid arthritis: radiologic evaluation. Am. J. Otolaryngol., 33(6):.753–755.
- Hozumi H., Nakamura Y., Johkoh T. et al. (2013) Acute exacerbation in rheumatoid arthritis-associated interstitial lung disease: a retrospective case control study. BMJ Open., 3(9): e003132.
- Jani M., Hirani N., Matteson E.L., Dixon W.G. (2014) The safety of biologic therapies in RA-associated interstitial lung disease. Nat. Rev. Rheumatol., 10(5): 284–294.
- Keng L.T., Lin M.W., Huang H.N. et al. (2016) Diffuse alveolar damage in a patient with rheumatoid arthritis under prolonged leflunomide treatment: A Case Report and Literature Review. Medicine (Baltimore), 95(26): e4044.
- Kelly C.A., Saravanan V., Nisar M. et al. (2014) British Rheumatoid Interstitial Lung (BRILL) Network. Rheumatoid arthritis-related interstitial lung disease: associations, prognostic factors and physiological and radiological characteristics a large multicentre UK study. Rheumatology (Oxford)., 53(9): 1676–1682.
- Kim E.J., Collard H.R., King T.E.Jr.(2009) Rheumatoid arthritis-associated interstitial lung disease: the relevance of histopathologic and radiographic pattern. Chest., 136(5): 1397–1405.
- Kim E.J., Elicker B.M., Maldonado F. et al. (2010) Usual interstitial pneumonia in rheumatoid arthritis-associated interstitial lung disease. Eur. Respir. J., 35(6): 1322–1328.
- King T.E.Jr., Bradford W.Z., Castro-Bernardini S. et al. (2014) ASCEND Study Group.A phase 3 trial of pirfenidone in patients with idiopathic pulmonary fibrosis. N. Engl. J. Med., 370(22): 2083–2092.
- Koduri G., Norton S., Young A. et al. (2010) ERAS (Early Rheumatoid Arthritis Study). Interstitial lung disease has a poor prognosis in rheumatoid arthritis: results from an inception cohort. Rheumatology (Oxford), 49(8): 1483–1489.
- Kono M., Nakamura Y., Yoshimura K.et al. (2016) Nonspecific interstitial pneumonia preceding diagnosis of collagen vascular disease. Respir. Med., 117: 40–47.
- Krause M.L., Cartin-Ceba R., Specks U. et al. (2012) Update on Diffuse Alveolar Hemorrhage and Pulmonary Vasculitis Immunol Allergy Clin. North. Am., 32(4): 587–600.
- Lynch J.P., Weigt S.S., Der Hovanessian A. et al. (2012) Obliterative (constrictive) bronchiolitis. Seminars in respiratory and critical care medicine. 33(5): 509–532.
- McMahon M.J., Swinson D.R., Shettar S. et al. (1993) Bronchiectasis and rheumatoid arthritis: a clinical study. Ann. Rheum. Dis., 52(11): 776–779.
- Metafratzi Z.M., Georgiadis A.N., Ioannidou C.V. et al. (2007) Pulmonary involvement in patients with early rheumatoid arthritis. Scand. J. Rheumatol., 36(5): 338–344.
- Olson A.L., Swigris J.J., Sprunger D.B. et al. (2011) Rheumatoid arthritis-interstitial lung disease-associated mortality. Am. J. Respir. Crit. Care Med., 183(3): 372–378.
- Quirke A.M., Perry E., Cartwright A. et al. (2015) Bronchiectasis is a Model for Chronic Bacterial Infection Inducing Autoimmunity in Rheumatoid Arthritis. Arthritis Rheumatol., 67(9): 2335–2342.
- Paulin F., Doyle T.J., Fletcher E.A. et al. (2015) Rheumatoid Arthritis-Associated Interstitial Lung Disease and Idiopathic Pulmonary Fibrosis: Shared Mechanistic and Phenotypic Traits Suggest Overlapping Disease Mechanisms. Rev Invest Clin., 67(5): 280–286.
- Richeldi L., du Bois R.M., Raghu G. et al. (2014) INPULSIS Trial Investigators. Efficacy and safety of nintedanib in idiopathic pulmonary fibrosis. N. Engl. J. Med., 370(22): 2071–2082.
- Saag K., Cerhan J., Kolluri S. et al. (1997) Cigarette smoking and rheumatoid arthritis severity Ann. Rheum. Dis., 56(8): 463–469.
- Sathi N., Urwin T., Desmond S., Dawson J.K. (2011) Patients with limited rheumatoid arthritis-related interstitial lung disease have a better prognosis than those with extensive disease. Rheumatology (Oxford)., 50(3): 620.
- Smadja D.M., Nunes H., Juvin K.et al. (2014) Increase in both angiogenic and angiostatic mediators in patients with idiopathic pulmonary fibrosis. Pathol. Biol. (Paris)., 62(6): 391–394.
- Shadick N.A., Fanta C.H., Weinblatt M.E. et al. (1994) Bronchiectasis. A late feature of severe rheumatoid arthritis. Medicine (Baltimore), 73(3): 161–170.
- Shahane A. (2013) Pulmonary hypertension in rheumatic diseases: epidemiology and pathogenesis. Rheumatol Int., 33(7): 1655–1667.
- Shaw M., Collins B.F., Ho L.A., Raghu G.(2015) Rheumatoid arthritis-associated lung disease. Eur. Respir. Rev., 24(135): 1–16.
- Solomon J.J., Chung J.H., Cosgrove G.P. et al. (2016) Predictors of mortality in rheumatoid arthritis-associated interstitial lung disease. Eur. Respir. J., 47(2): 588–596.
- Spagnolo P., Lee J.S. et al. (2018) Lung in rheumatoid arthritis Arthr. Rheum., 70(10): 1544–1554.
- Suda T. (2015) Up-to-Date Information on Rheumatoid Arthritis-Associated Interstitial Lung Disease. Clin. Med. Insights Circ. Respir. Pulm. Med., 9(1): 155–162.
- Swinson D.R., Symmons D., Suresh U. et al. (1997) Decreased survival in patients with co-existent rheumatoid arthritis and bronchiectasis. Brit. J. Rheumatol., 36: 689–691.
- Tansey D., Wells A.U., Colby T.V. et al. (2004) Variations in histological patterns of interstitial pneumonia between connective tissue disorders and their relationship to prognosis. Histopathology, 44(6): 585–596.
- Tourin O., de la Torre Carazo S., Smith D.R., Fischer A.(2013) Pulmonary vasculitis as the first manifestation of rheumatoid arthritis. Respirat. Med. Case Rep., 8: 40–42.
- Travis W.D., Costabel U., Hansell D.M. et al. ATS/ERS Committee on Idiopathic Interstitial Pneumonias (2013) An official American Thoracic Society/European Respiratory Society statement: Update of the international multidisciplinary classification of the idiopathic interstitial pneumonias. Am. J. Respir. Crit. Care Med., 188(6): 733–748. doi: 10.1164/rccm.201308-1483ST.
- Turesson C., O’Fallon W.M., Crowson C.S. et al. (2003) Extra-articular disease manifestations in rheumatoid arthritis: incidence trends and risk factors over 46 years. Ann. Rheum. Dis., 62(8): 722–727.
- Udayakumar N., Venkatesan S., Rajendiran C. (2008) Pulmonary hypertension in rheumatoid arthritis -relation with the duration of the disease. Int. J. Cardiol., 127(3): 410–412.
- Urisman A., Jones K.D. (2014) Pulmonary pathology in connective tissue disease. Seminars in respiratory and critical care medicine, 35(2): 201–212.
- Vij R., Strek M.E. (2013) Diagnosis and treatment of connective tissue disease-associated interstitial lung disease. Chest., 143(3): 814–824.
- Wilsher M., Voight L., Milne D. et al. (2012) Prevalence of airway and parenchymal abnormalities in newly diagnosed rheumatoid arthritis. Respir Med., 106(10): 1441–1446.
- Wilson M.S., Wynn T.A. (2009) Pulmonary fibrosis: pathogenesis, etiology and regulation. Mucosal. Immunol., 2(2): 103–121.
- Yusof M.Y., Kabia A,. Darby M. et al.(2017) Effect of rituximab on the progression of rheumatoid arthritis-related interstitial lung disease: 10 years’ experience at a single centre. Rheumatology (Oxford), 56(8): 1348–1357.
- Zamora-Legoff J.A., Krause M.L., Crowson C.S. et al. (2017) Patterns of interstitial lung disease and mortality in rheumatoid arthritis. Rheumatology (Oxford), 56(3): 344–350.
Адрес для переписки:
Белявская Юлия Викторовна
03680, Киев, ул. Народного ополчения, 5
ННЦ «Институт кардиологии
им. Н.Д. Стражеско» НАМН Украины

Leave a comment