СУЧАСНА СТРАТЕГІЯ ДІАГНОСТИКИ І ДОВГОТРИВАЛОГО ЛІКУВАННЯ ПОСТМЕНОПАУЗАЛЬНОГО ОСТЕОПОРОЗУ
Резюме. В оглядовій статті представлено й узагальнено сучасні дані щодо підходів до діагностики та лікування постменопаузального остеопорозу. В огляді зроблено спробу допомогти визначити вибір лікарських засобів і забезпечити найкращі клінічні стратегії управління для жінок у постменопаузальний період. Діагноз остеопорозу базується на виокремленні пацієнтів із високим ризиком переломів і виявленні у них таких критеріїв: перенесений остеопоротичний перелом, 10-річна ймовірність перелому за регіональною моделлю FRAX перевищує поріг втручань і Т-критерій, визначений методом двофотонної рентгенівської абсорбціометрії, нижче –2,5 SD. Щодо питання, хто з пацієнток підлягає фармакологічному втручанню, то виділяють три групи: пацієнти з низькоенергетичними переломами в анамнезі, пацієнти з низькою кістковою масою і пацієнти з остеопенічним синдромом і високим ризиком виникнення остеопоротичних переломів (за даними FRAX). Медикаментозне лікування при остеопорозі спрямоване на зниження ризику переломів. Бісфосфонати є препаратами першої лінії. Особливості їх фармакології та здатність накопичуватися у кістковій тканині роблять можливим проведення пауз у лікуванні — «лікарських канікул». Рішення про тривалість терапії бісфосфонатами і довгочасність перерви в лікуванні, а також застосування препаратів з альтернативним механізмом дії необхідно приймати з урахуванням індивідуальних особливостей пацієнта з використанням щорічної оцінки факторів ризику, динаміки мінеральної щільності кістки і маркерів кісткового обороту.
Остеопороз (ОП), по образному определению президента Международного фонда остеопороза (IOF) профессора Джона Кэниса, — это «тихая эпидемия», охватившая все страны без исключения заболеванием, характеризующимся изменением в структуре костной ткани, снижением костной массы и ее прочности, что часто служит причиной переломов и необходимости оперативного вмешательства. В материалах Всемирного конгресса по остеопорозу и Х Европейского конгресса, посвященного клиническим и экономическим аспектам ОП [18], отмечается, что это состояние является одним из наиболее распространенных заболеваний, которое наряду с сердечно-сосудистой патологией, сахарным диабетом и онкологическими процессами занимает ведущее место в структуре заболеваемости и смертности населения.
ВОЗ описывает ОП как «прогрессирующее системное заболевание скелета, характеризующееся низкой костной массой и микроархитектурными нарушениями костной ткани, с последующим увеличением хрупкости костей и повышенной склонности к переломам» [21]. Значение проблемы ОП прежде всего определяется его последствиями — переломами позвонков и костей периферического скелета, обусловливающими значительный рост заболеваемости, инвалидности и смертности у этих пациентов [2, 3]. Остеопоротические переломы значительно ограничивают свободу передвижений, ухудшают качество жизни [28], повышают риск возникновения сопутствующей патологии [27], сокращают длительность жизни [17]. Таким образом, их профилактика и дальнейшее лечение имеет первостепенное значение.
Поскольку ОП — заболевание, которое характеризуется повышенным риском переломов, то, следовательно, для его лечения необходимо выявить лиц, имеющих высокий риск перелома, с тем, чтобы предпринять действия, направленные на снижение этого риска [3]. Общеизвестно, что риск переломов повышают факторы, влияющие как на прочность кости, так и на риск падений. В настоящее время существует несколько способов оценки риска переломов.
Во-первых, в настоящее время хорошо документирована связь произошедшего (предыдущего) перелома с риском последующих переломов. При этом данная связь мало зависит от минеральной плотности кости (МПК). В исследовании NORA продемонстрировано, что перелом предплечья в возрасте ≥45 лет повышает риск перелома проксимального отдела бедра в 1,9 раза [8]. Эти факты позволяют говорить об «остеопоротическом каскаде» переломов, когда за одним переломом идет следующий, а порой и серия новых переломов. Наличие устойчивой связи перенесенного ранее перелома с риском последующих привело к широкому внедрению в различных странах и системах здравоохранения выявления пациентов с высоким риском переломов среди тех, кто уже перенес перелом [3]. Таким образом, наличие остеопоротического перелома в анамнезе позволяет считать у этих пациентов высокий риск возникновения переломов.
Другой важной составляющей группы пациентов высокого риска является костная масса, измеряемая путем исследования МПК. Согласно критериям ВОЗ, ведущим диагностическим критерием ОП является низкая МПК, что определяется методом двухфотонной рентгеновской абсорбциометрии (ДРА, DXA). ДРА общепризнанно является золотым стандартом диагностики ОП и прогнозирования риска переломов костей. Каждому снижению МПК в области шейки бедренной кости на одно стандартное отклонение (SD), установленному при проведении ДРА, соответствует повышение риска переломов проксимального отдела бедренной кости в 2,6 раза и любого другого отдела — в 1,6 раза [23]. Рабочее определение ОП базируется на Т-критерии МПК, установленной в шейке бедренной кости, и интерпретируемое как величина МПК –2,5 SD или ниже среднего значения у женщин молодого возраста (Т-критерий ≤–2,5 SD). Однако следует понимать, что в целом нет такого порога МПК и значения Т-критерия, ниже которого риск перелома становится абсолютным и выше которого риск перелома абсолютно исчезает.
Сегодня описано большое количество клинических факторов риска развития переломов. Эти факторы проанализированы и представлены в новом способе оценки риска переломов, опубликованном в 2008 г. и получившем название FRAX [19]. Для алгоритма FRAX отобраны те клинические факторы риска, которые продемонстрировали ассоциацию с повышением риска перелома независимо от МПК в шейке бедра. Алгоритм FRAX дает обобщенную оценку риска переломов на основе имеющихся у пациента клинических факторов риска в сочетании (или без) с данными денситометрии [5].
Клинические факторы риска, используемые при прогнозировании 10-летней вероятности перелома (FRAX) в дополнение или вместо измерения МПК, следующие:
- Возраст.
- Пол.
- Индекс массы тела.
- Семейный анамнез перелома проксимального отдела бедра.
- Курение.
- Применение глюкокортикоидов.
- Ревматоидный артрит.
- Другие причины вторичного ОП.
- Злоупотребление алкоголем.
Отличительной особенностью модели FRAXявляется учет региональных особенностей и региональных различий в эпидемиологической ситуации по переломам и продолжительности жизни, что делает оценку прогноза более достоверной. В 2016 г. разработана и предложена для клинического использования украинская модель FRAXдля прогнозирования основных остеопоротических переломов [6]. В настоящее время она доступна на официальном интернет-ресурсе FRAX.
Алгоритм FRAX дает возможность выделить пациентов высокого риска, к которым относятся лица с риском развития основных остеопоротических переломов >20% в течение последующих 10 лет.
Одновременно модель FRAXимеет ограничения, которые необходимо учитывать при ее использовании.
Модель FRAX:
- возможно использовать только у нелеченных больных;
- не следует применять для мониторирования эффективности лечения пациентов;
- не применяют у детей и подростков;
- не применяют у женщин в пременопаузальный период;
- не учитывает детали некоторых факторов риска (например длительность и интенсивность курения; дозу и длительность применения глюкокортикоидов, а также способ их введения; длительность и активность течения ревматоидного артрита и др.);
- не учитывает другие важные факторы риска (падения, маркеры костного ремоделирования, дефицит витамина D, данные ультразвукового исследования костной ткани и др.).
Кроме модели FRAX существуют и другие способы определения порога вмешательства и выделения пациентов высокого риска перелома. Они представлены в таблице. Необходимо отметить, что все предлагаемые критерии охватывают и дублируют основные показатели пациентов высокого риска: предшествующий перелом, низкая МПК, применение глюкокортикоидов, наличие вторичного ОП, на которых в принципе базируется модель FRAX. Таким образом, с применением предложенного ВОЗ калькулятора (алгоритм) FRAX подсчитывают индивидуальную 10-летнюю вероятность возникновения остеопоротического перелома на основании комбинации клинических факторов риска и МПК; он позволяет аккуратно идентифицировать пациентов высокого риска, являющихся наилучшими кандидатами на вмешательства [2, 3, 20].
| Автор | Критерии |
|---|---|
| Watts N.B., Diab D.L., 2010 [32] | Предшествующая история переломов, низкий показатель Т-критерия, вторичный ОП вследствие длительного применения глюкокортикоидов, наличие таких заболеваний, как гипертиреоз, гиперпаратиреоз, ревматоидный артрит, вследствие длительной иммобилизации или заболеваний, приводящих к ней (например рассеянный склероз) |
| Whitaker M. et al., 2012 [33] | История переломов и Т-критерий –2,5 SD |
| McClung M. et al., 2013 [24] | Т-критерий –2,5 SD в области шейки бедра, предыдущие переломы позвонков или бедра или постоянная терапия глюкокортикоидами в высоких дозах |
| Black D.M. et al., 2012 [9] | 1) Т-критерий –2,5 SD в области шейки бедра; 2) наличие перелома позвонка и Т-критерий ≤–2,0 SD в области шейки бедра |
Таким образом, в последнее время изменился подход к оценке риска переломов при ОП, а также способы установления диагноза ОП, которые основаны прежде всего на определении высокого риска переломов и стратификации пациентов по этому принципу. Так, диагноз ОП базируется на выявлении у пациента высокого риска переломов следующих критериев:
- На основании перенесенного низкоэнергетического перелома типичной остеопоротической локализации.
- При определении 10-летней вероятности перелома по региональной модели FRAX, превышающей порог вмешательства.
- При определении МПК с помощью ДРА с Т-критерием <–2,5 SD.
На рис. 1 схематически представлен современный алгоритм установления диагноза ОП, который базируется на определении пациентов высокого риска. Так, рекомендуется устанавливать клинический диагноз ОП на основании высокого риска перелома, выявляемого при денситометрии (методом ДРА), а также у пациентов, перенесших типичный остеопоротический перелом — проксимального отдела бедренной кости (в этом случае даже при отсутствии результатов денситометрии), перелом позвонков, проксимального отдела плечевой кости, таза, ребер, в некоторых случаях — дистального отдела лучевой кости (при наличии остеопении при ДРА), и, наконец, при выявлении высокого риска переломов при использовании алгоритма FRAX[15, 31]. Исследовательская группа, возглавляемая профессором J.А. Kanis и соавторами (2015) [20], наоборот, считает, что нет необходимости в диагностических критериях ОП, следует использовать оценку риска переломов по FRAX и инициировать лечение у пациентов с риском, превышающим порог вмешательств.
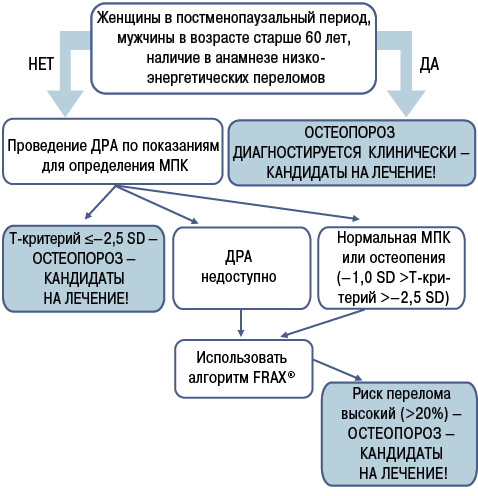
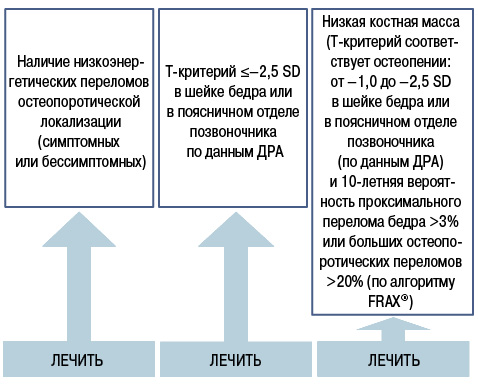
В отношении вопроса, кто из пациентов подлежит фармакологическому вмешательству, выделяют три группы пациентов. У всех них отмечают высокий риск переломов (рис. 2): пациенты с низкоэнергетическими переломами в анамнезе, пациенты с низкой костной массой (Т-критерий ≤–2,5 SD, по данным ДРА) и пациенты с остеопеническим синдромом и высоким риском возникновения остеопоротических переломов (по данным FRAX).
Сегодня в клинической практике применяют препараты, доказавшие свою эффективность в отношении снижения риска переломов различной локализации (вертебральных и невертебральных) в длительных многоцентровых плацебо-контролируемых клинических испытаниях. Выбор терапии зависит от конкретной клинической ситуации, а при назначении отдельных препаратов — также и от предпочтительного пути введения (перорально или парентерально) [1, 4]. Основной целью фармакологической терапии при ОП является снижение риска переломов за счет повышения прочности кости. Нет теста, который мог бы непосредственно измерять прочность костей у живых людей, и нет лекарственного средства, которое может полностью предотвратить все переломы. В клинической практике мы полагаемся на косвенные маркеры для оценки снижения риска переломов и мониторирования эффективности терапии, которые коррелируют с костной прочностью и риском переломов: МПК и маркеры костного ремоделирования [3].
На протяжении последних двух десятилетий для лечения при ОП препаратами первого выбора остаются бисфосфонаты (БФ), которые ингибируют опосредованный остеокластами процесс костной резорбции, в результате чего увеличивается костная масса и улучшается прочность кости, снижается риск переломов различной локализации [12]. Сорокалетний опыт применения БФ для лечения пациенток с постменопаузальным ОП подтвердил благоприятное соотношение польза/риск.
Поскольку ОП является хроническим заболеванием, то противопереломная (антиостеопоротическая) терапия гипотетически может продолжаться в течение всей оставшейся жизни пациента. К сожалению, в настоящее время доступно недостаточно данных и соответствующих рекомендаций по длительному применению БФ; также опубликовано мало данных, подтверждающих, что продолжение лечения до 10 лет у пациентов с высоким риском переломов лучше, чем остановка терапии через 3–5 лет. Использование БФ приводит к быстрому и существенному снижению интенсивности костного оборота с максимальным эффектом в течение 3–6 мес. Этот эффект нового равновесного состояния удерживается как минимум в течение 10 последующих лет при продолжающемся лечении [9, 11]. При этом каждый их четырех аминобисфосфонатов (алендронат, ризедронат, ибандронат и золедроновая кислота) имеет свой уникальный профиль сродства и связывания с костной тканью, что обусловливает клинически значимые различия в степени воздействия на костный метаболизм и накопления в костной ткани.
Предметом обсуждения последних лет стал вопрос о длительности применения БФ, особенно в свете проблем с безопасностью. При этом впервые о необходимости установления длительности терапии БФ и возможном перерыве в лечении («лекарственные каникулы») заговорили именно в связи с описанием случаев серьезных побочных эффектов, прежде всего, атипичных переломов костей и остеонекрозов челюсти [2]. Концепция «лекарственных каникул» отчасти связана с уникальными фармакологическими свойствами БФ. Особенности их фармакологии позволяют осуществлять длительные паузы между введениями препаратов (например ибандроновую кислоту перорально принимают 1 раз в месяц, золедроновую кислоту вводят парентерально 1 раз в год). Сайты связывания БФ в кости являются практически ненасыщающимися, поэтому значительное количество препарата может накапливаться в кости в течение длительного времени, создавая своеобразный «лекарственный резервуар», который постепенно используется месяцами или даже годами после прекращения лечения [13]. Именно этот факт позволил выдвинуть гипотезу об «отдыхе от терапии БФ» (или «лекарственных каникулах»), что позволит снизить частоту нежелательных побочных явлений при сохранении антипереломной активности. Именно концепция «лекарственных каникул» предусматривает временное прекращение активной терапии на безопасный период (появление нового перелома или снижение МПК ≥4% в год) [16, 32].
На основании проведенных исследований установлена приблизительная безопасная и достаточная для достижения эффекта длительность терапии с применением БФ. Для алендроната, ризедроната и ибандроната она составляет 5 лет, для золедроновой кислоты — 3 года. После этого периода может быть рассмотрена возможность «лекарственных каникул». Факторами, влияющими на продолжительность рекомендованного периода приема БФ, являются антирезорбтивный потенциал препарата и степень связывания каждого из них с костной тканью, которые обусловлены их химическим строением. Необходимо также учитывать, что перерыв в лечении БФ возможен только в том случае, когда есть уверенность, что в течение 3–5-летнего первоначального периода было непрерывное использование БФ, согласно рекомендациям врача [3].
При остановке приема БФ обозначено несколько потенциальных параметров, требующих мониторинга для определения продолжающейся потери костной массы. Предполагается, что о потере антирезорбтивного эффекта может свидетельствовать явное снижение МПК и/или повышение уровня маркеров костного ремоделирования.
Большинство рекомендаций сосредоточено на ежегодном проведении ДРА с определением МПК. Показано, что наибольший эффект антиостеопоротической терапии отмечают в первые 1–2 года применения БФ, затем МПК выходит на своеобразное плато, что удерживается в течение последующих лет [11, 29]. После паузы в терапии потеря костной массы возобновляется с ежегодными потерями на уровне 0,5–2,0%, что сопоставимо со скоростью потери костной массы у пациентов, получавших плацебо. Если потери костной массы превышают этот показатель (установлено значение максимальных потерь — ≥4% в год) или возникают остеопоротические переломы, то терапию БФ следует возобновить раньше, а «лекарственные каникулы» должны быть прерваны. Кроме этого, ежегодные сканирования МПК могут быть дополнены исследованием маркеров резорбции кости [7]. Их существенное преимущество состоит в том, что их определение можно проводить через несколько недель/месяцев после начала «лекарственных каникул» [30]. Два маркера ремоделирования кости — карбокси- и аминотерминальные телопептиды коллагена I типа (carboxyterminal collagen cross-link (СТХ) и N-telopeptide cross-links (NTX)) являются наиболее исследованными и валидными маркерами для оценки скорости костного оборота и риска переломов [22]. Повышение СТХ может произойти намного раньше, чем снижение МПК, поэтому он может быть ранним индикатором для возобновления лечения.
Наиболее развернутые рекомендации по длительному применению БФ и мониторингу терапии ОП были разработаны Британской группой экспертов (National Osteoporosis Guideline Group — NOGG) [26]. Экспертами был предложен алгоритм лечения пациентов, в котором рекомендован регулярный пересмотр терапии после 5-летнего применения пероральных БФ и 3-летнего применения парентеральной формы золедроновой кислоты (рис. 3). В настоящее время этот алгоритм продублирован в Клинических рекомендациях Великобритании (2017) по профилактике и лечению остеопороза [14]. При хорошей переносимости и эффективности лечения терапию пероральными БФ после 5 лет можно продолжить у пациентов с высоким риском. К ним относят следующие категории пациентов:
- в возрасте >75 лет;
- или имеющие в анамнезе предшествующие переломы бедра или позвонков;
- или продолжающие применение глюкокортикоидов в дозе >7,5 мг/сут (в пересчете на преднизолон).
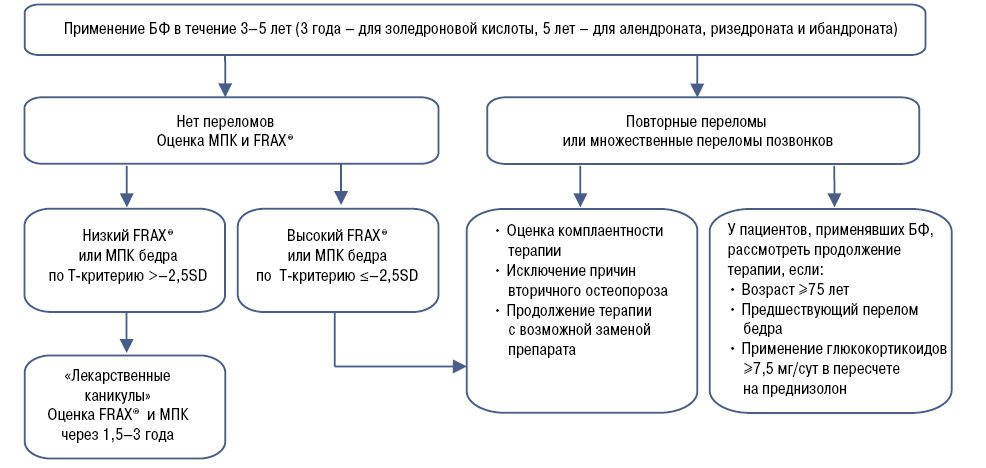
Если на фоне терапии пероральными БФ у пациента произошли один или более низкоэнергетических переломов, после оценки того, насколько пациент правильно и регулярно следовал лечению, и исключения причин вторичного ОП, лечение может быть пролонгировано и более 5 лет [14, 26]. Терапия должна быть пересмотрена в случае, если у пациента после 5-летнего применения пероральных БФ показатели МПК (Т-критерий) в шейке бедренной кости или поясничном отделе позвоночника остаются на уровне ≤–2,5 SD.
Американское общество по изучению костей и минералов (American Society for Bone and Mineral Research — ASBMR) в 2016 г. также предложило алгоритм по менеджменту женщин в постменопаузальный период и длительной терапии БФ [7], который по ключевым моментам созвучен алгоритму NOGG (рис. 4).
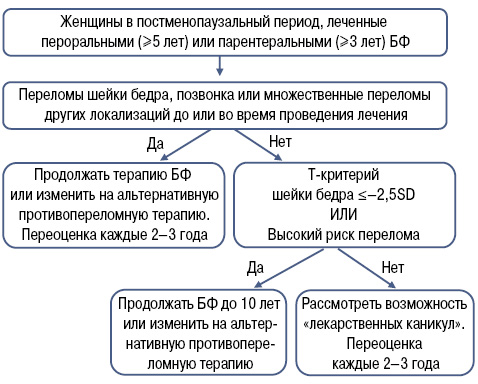
У женщин в постменопаузальный период, применявших лечение пероральными БФ в течение 5 лет и парентеральными БФ в течение 3 лет, в случае сочетания неблагоприятных факторов (прежде всего, наличие переломов во время лечения) терапия БФ может быть пролонгирована до 10 лет. Эти рекомендации базируются на данных исследований FLEX и Horizon (расширенная фаза исследований алендроната и золедроновой кислоты), где лечение было продолжено до 10 лет пероральными БФ и до 6 лет — при их внутривенном применении. В этих исследованиях продемонстрировано уменьшение количества переломов при увеличении длительности терапии БФ [10]. Одновременно указывается, что преимущества перехода на альтернативную противопереломную терапию после длительного применения БФ недостаточно изучены. Авторы данного алгоритма акцентируют внимание на том, что для оценки высокого риска переломов можно использовать не только модель FRAX, но и другие модели; основными сильными факторами риска перелома является возраст старше 75 лет, предшествующий перелом бедра и применение глюкокортикоидов в дозе >7,5 мг/сут. Мониторинг и переоценка лечения включают клиническую оценку, оценку риска перелома и изменения плотности костной ткани с помощью ДРА. Повторная оценка может потребоваться менее чем через 2 года у пациентов с новым переломом или с учетом ожидаемой ускоренной потери костной массы (например при терапии глюкокортикоидами) [7].
В Клинических рекомендациях по лечению остеопороза (2014) [15] предлагаются подходы к определению длительности терапии БФ и условия для смены препарата с другим механизмом действия (рис. 5). Так, продолжение «лекарственных каникул» (паузы в применении БФ) возможно при стабильном состоянии: потери костной массы не превышают 3% в год, отсутствие новых переломов, низкие показатели маркеров костной резорбции. Применение БФ необходимо возобновить при условии повышенных потерь костной массы (изменение МПК >4% в год в области шейки бедра и поясничного отдела позвоночника), появления новых переломов, высоких показателей маркеров костной резорбции (NTX и СТХ). Таким образом, рекомендуется рассмотреть вопрос о возобновлении антиостеопоротической терапии при выявлении следующих состояний:
1) значимое повышение уровня маркеров костной резорбции или достижение показателей костного обмена, которые были у пациента до начала лечения БФ;
2) снижение МПК до уровня остеопороза, особенно в проксимальном отделе бедренной кости;
3) показатель риска перелома по FRAX, рассчитанный с учетом данных МПК шейки бедра, выше порога терапевтического вмешательства.
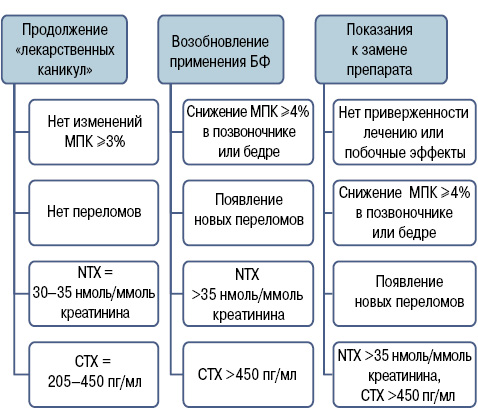
Вне зависимости от показателей маркеров костного обмена и МПК «лекарственные каникулы» могут быть прерваны в любой период, если возник новый перелом [7, 14, 25]. Для предупреждения снижения МПК во время «лекарственных каникул» необходимо продолжать применение комбинированных препаратов кальция и витамина D в рекомендованных дозах (не менее 1000 мг элементарного кальция и 400 МЕ витамина D.
Показаниями к переходу на препарат с другим механизмом действия (например на деносумаб) является появление или стойкое присутствие побочных эффектов, отсутствие приверженности лечению, снижение МПК >4% в год (при условии сохраненной приверженности), появление новых остеопоротических переломов, высокие показатели маркеров резорбции. Кроме того, пациентам с высоким риском развития переломов на период «отдыха от терапии БФ» можно назначать препарат с альтернативным механизмом действия. Например, при паузе в приеме БФ можно применять ралоксифен или деносумаб.
Другая группа авторов в 2013 г. модифицировала рекомендации по «лекарственным каникулам» в зависимости от категории риска, к которой можно отнести больного [24]. Так, при высоком риске пациенты должны продолжать лечение БФ с периодической переоценкой необходимости в нем, максимальная длительность терапии пероральными БФ составляет 10 лет, золедроновой кислотой — 6 лет. Пациенты со средним риском (Т-критерий >–2,5 SD в бедре на фоне терапии БФ, отсутствуют предшествующие переломы бедра или позвонков) после 3–5 лет лечения могут уйти на «лекарственные каникулы», но решение следует принимать индивидуально в каждом конкретном случае. Пациенты, относящиеся к категории низкого риска (без переломов в анамнезе, МПК при назначении терапии БФ составляла >–2,5 SD), могут прекратить применение препарата и возобновить его при появлении показаний. Длительность «лекарственных каникул» также зависит от риска переломов, но четко не обозначена. Так, данные о длительности паузы в лечении при низком риске отсутствуют вообще. Необходим мониторинг состояния МПК, рисков, маркеров резорбции и возобновление терапии при значительных критичных отклонениях этих показателей. При среднем риске переломов длительность «лекарственных каникул» может колебаться от 3 до 5 лет с ежегодным мониторингом. При высоком риске рекомендуется тщательно взвешивать соотношение риска перерыва в лечении и безопасности дальнейшего лечения БФ. Пациентам определенных групп показано продолжение лечения, однако также возможен перерыв на 1–2 года или переход на применение препарата с другим механизмом противоостеопоротического действия [4].
Таким образом, решение о длительности терапии и продолжительности перерыва в лечении следует принимать с учетом индивидуальных особенностей пациента с использованием ежегодной оценки факторов риска, динамики МПК и маркеров костного оборота. Накопление БФ в кости после нескольких лет терапии позволяет осуществить перерывы в лечении без снижения антипереломного эффекта, что является уникальным механизмом, свойственным только БФ. Именно этот тезис положен в основу концепции «лекарственных каникул».
Список использованной литературы
- 1. Головач И.Ю. (2015) Реализация принципа индивидуализации лечения пациентов с остеопорозом при специфических клинических сценариях. Укр. ревматол. журн., 61(3): 4–9.
- 2. Головач И.Ю. (2016) Лечение остеопороза бисфосфонатами: возможны ли «медикаментозные каникулы»? Практ. лікар, 4: 31–37.
- 3. Лесняк О.М. (ред.) (2016) Остеопороз: руководство для врачей. ГЭОТАР-Медиа, Москва, 464 с.
- 4. Никитинская О.А., Торопцова Н.В. (2017) Актуальные вопросы терапии остеопороза: кому и что назначать, как долго лечить. Терапия, 4(14): 35–41.
- 5. Поворознюк В.В., Григорьева Н.В. (2012) Роль FRAX в прогнозировании риска переломов. Проблемы остеологии, 15(1): 3–15.
- 6. Поворознюк В.В., Григор’єва Н.В., Kanis J.A., McCloskey E.V., Johansson H. (2016) Українська версія FRAX: від створення до валідизації. Боль. Суставы. Позвоночник, 3(23): 6–14.
- 7. Adler R.A., Fuleihan G.El-H., Bauer D.C. et al.(2016) Managing osteoporosis patients after long-term bisphosphonate treatment: Report of a Task Force of the American Society for Bone and Mineral Research. J. Bone Miner. Res., 31(1): 16–35.
- 8. Barrett-Connor E., Sajjan S. G., Siris E. et al. (2008) Wrist fracture as a predictor of future fractures in young and older postmenopausal women: results from the National Osteoporosis Risk Assessment (NORA). Osteoporosis Int., 19(5): 607–613.
- 9. Black D.M., Bauer D.C., Schwartz A.V. et al. (2012) Continuing bisphosphonate treatment for osteoporosis — for whom and for how long? N. Engl. J. Med., 366: 2051–2053.
- 10. Black D.M., Reid I.R., Boonen S. et al. (2012) The effect of 3 versus 6 years of zoledronic acid treatment of osteoporosis: a randomized extension to the HORIZON-Pivotal Fracture Trial (PFT). J. Bone Miner. Res., 27(2): 243–254.
- 11. Bone H., Hosking D., Devogelaer J. et al. (2004) Ten years’ experience with alendronate for osteoporosis in postmenopausal women. N. Engl. J. Med., 350: 1189–1199.
- 12. Brown J.P., Morin S., Leslie W. et al. (2014) Bisphosphonates for treatment of osteoporosis. Expected benefits, potential harms, and drug holidays. Canadian Family Physician., 60: 324–333.
- 13. Compston J., Bilezikian J. (2012) Bisphosphonate therapy for osteoporosis: The long and short of it. J. Bone Miner. Res., 27: 240–242.
- 14. Compston J., Cooper A., Cooper C. et al. (2017) UK clinical guideline for the prevention and treatment of osteoporosis. Arch. Osteoporos.,12(1): 43.
- 15. Cosman F., de Beur S.J., LeBoff M.S. et al. (2014) Clinician’s Guide to Prevention and Treatment of Osteoporosis. Osteoporosis Int., 25(10): 2359–2381.
- 16. Diab D.L., Watts N.B. (2013) Bisphosphonate drug holiday: who, when and how long. Ther. Adv. Musculoskelet. Dis., 5(3): 107–111.
- 17. Ioannidis G., Papaioannou A., Hopman W.M. et al. (2009) Relation between fractures and mortality: results from the Canadian Multicentre Osteoporosis Study. CMAJ,181(5): 265–271.
- 18. IOF World Congress on Osteoporosis and 10-th European Congress of Clinical and Economic aspects of Osteoporosis and Osteoarthritis (2010) Osteoporosis Int., 21(5): S1–S6.
- 19. Kanis J.A. (2016) World Health Organization Scientific Group Assessment of osteoporosis at the primary health-care level. Technical report. WHO Collaborating Centre, University of Sheffield, UK, 2008 (http://www.shef.ac.uk/FRAX/pdfs/ WHO_Technical_Report.pdf).
- 20. Kanis J.A., McCloskey E.V., Harvey N.C. et al. (2015) Intervention thresholds and the diagnosis of osteoporosis. J. Bone Miner. Res., 30(10): 1747–1753.
- 21. Kanis J.A., Melton L.J. 3, Christiansen C. et al. (1994) The diagnosis of osteoporosis. J. Bone Miner. Res., 9: 1137–1141.
- 22. Looker A.C., Bauer D.C., Chesnut C.H. 3et al. (2000) Clinical use of biochemical markers of bone remodeling: current status and future directions. Osteoporos Int.,11: 467–480.
- 23. Marshall D., Johnell O., Wedel H. (1996) Meta-analysis of how well measures of bone mineral density predict occurrence of osteoporotic fractures. BMJ, 312(4071): 1254–1259.
- 24. McClung M., Harris S.T., Miller P.D. et al. (2013) Bisphosphonate therapy for osteoporosis: benefits, risks, and drug holiday. Am. J. Med., 126: 13–20.
- 25. McNabb B.L., Vittinghoff E., Schwartz A.V. et al. (2013) BMD changes and predictors of increased bone loss in postmenopausal women after a 5-year course of alendronate. J. Bone Miner. Res., 28: 1319–1327.
- 26. National Osteoporosis Guideline Group (NOGG) (2014) Osteoporosis — Clinical Guideline for prevention and treatment of osteoporosis (Executive Summary) [Elecrtonic resource]. Update March 2014 (http://www.shef.ac.uk/NOGG/NOGG Executive Summary.pdf).
- 27. Papaioannou A., Adachi J.D., Parkinson W. et al. (2001) Lengthy hospitalization associated with vertebral fractures despite control for comorbid conditions. Osteoporos Int., 12(10): 870–874.
- 28. Papaioannou A., Wiktorowicz M.E., Adachi J.D. et al. (2000) Mortality, independence in living, and re-fracture one year following hip fracture in Canadians. J. Obstet Gynaecol Can., 22(8): 591–597.
- 29. Ravn P., Weiss S.R., Rodriguez-Portales J.A. et al. (2000) Alendronate in early postmenopausal women: effects on bone mass during long-term treatment and after withdrawal. Alendronate Osteoporosis Prevention Study Group. J. Clin. Endocrinol. Metab., 85: 1492–1497.
- 30. Ro C., Cooper O. (2013) Bisphosphonate drug holiday: choosing appropriate candidates. Curr. Osteoporos. Rep.,11(1): 45–51.
- 31. Siris E.S., Adler R., Bilezikian J. et al. (2014) The clinical diagnosis of osteoporosis: a position statement from the National Bone Health Alliance Working Group. Osteoporosis Int., 25(5): 1439–1443.
- 32. Watts N.B., Diab D.L. (2010) Long-term use of bisphosphonates in osteoporosis. J. Clin. Endocrinol. Metab., 95: 1555–1565.
- 33. Whitaker M., Guo J., Kehoe T. et al. (2012) Bisphosphonates for osteoporosis — where do we go from here? N. Engl. J. Med., 366: 2048–2051.
Адрес для переписки:
Головач Ирина Юрьевна
03420, Киев, ул. Академика Заболотного, 21
Клиническая больница «Феофания» ГУД,
Центр ревматологии
E-mail: golovachirina@gmail.com

Leave a comment