Диференційований підхід до лікування остеоартрозу з коморбідною патологією
Шуба Н.М., Воронова Т.Д., Крилова А.С., Хамбір Т.С., Пилипенко А.В.
Резюме. У статті наведена характеристика найбільш поширених лікарських засобів при лікуванні пацієнтів із остеоартрозом — нестероїдних протизапальних препаратів і симптоматичних протизапальних препаратів, зокрема німесуліду, мелоксикаму, діацереїну, хондроїтин сульфату, глюкозаміну сульфату, екстракту кореня імбиру. Описана їх ефективність за показниками суглобового синдрому, а саме ВАШ, індексів Лекена, WOMAC. Досліджено вплив на рівень цитокінів (IL-1β, TNF-α, IGF-1, TGF-β), вільних радикалів (NO), а також вивчено можливість застосування при коморбідній патології та вплив на показники пуринового, вуглеводного та ліпідного обмінів.
Вступ
Остеоартроз (ОА) — найбільш поширене та інвалідизуюче захворювання суглобів у світі. За даними National Health and Nutrition Examination Survey (NHANE), суглобова патологія займає третє місце за поширеністю серед хронічних станів у осіб віком старше 65 років (50% випадків) (CDC, 2001). При цьому в структурі інвалідності артриту і болю в нижній ділянці спині належать перша і друга позиція — 17,9 і 16,9% відповідно. Поширеність ОА підвищується з кожним роком, за результатами епідеміологічних досліджень у США протягом останнього десятиліття зросла з 21 до 27 млн осіб серед дорослого населення (Plotnikoff R., 2015).
Поширеність ОА значно вища у людей похилого віку, з коморбідними метаболічними порушеннями, у тому числі ожирінням, гіперурикемією, цукровим діабетом. За останні роки встановлено, що коморбідна патологія істотно погіршує порушення фізичної функції та спричиняє вищу смертність у хворих на ОА (Nü esch E. et al., 2011).
ОА вдвічі частіше розвивається при надмірній масі тіла, індекс маси тіла (ІМТ) >27 кг/м² підвищує ризик ОА на 15% (Шуба Н.М. та співавт., 2012). Збільшення маси жирової тканини призводить до акумуляції клітин запалення та, особливо, макрофагів, які секретують прозапальні цитокіни, такі як — інтерлейкін (IL)-6, фактор некрозу пухлини (TNF)-α і сироватковий амілоїд А (Richette P., Funk-Brentano T., 2010).
За результатами останніх досліджень описана роль адипоцитокінів (або адипокінів) як медіаторів запалення (Bijlsma J.W.J. (Ed.), 2013). IL-6, який переважно синтезується у жировій тканині у пацієнтів із ожирінням, також може продукуватися жировою тканиною надколінка та підколінка всередині суглоба (Richette P. et al., 2011), що підтверджує зв’язок між ожирінням та розвитком ОА через системне запалення.
Ще одним із факторів ризику розвитку ОА є цукровий діабет і порушення толерантності до глюкози. Підвищення концентрації глюкози в суглобі призводить до зміни хрящової тканини, збільшуючи кількість кінцевих продуктів гліколізу, що, в свою чергу, активує вироблення хондроцитами і синовіоцитами продегратаційних і прозапальних медіаторів і змінює структуру субхондральної кістки. Також гіперглікемія викликає невелике системне запалення, що посилює ОА. У свою чергу, вплив гіперглікемії на нервову тканину, розвиток симетричної периферичної полінейропатії та стопи Шарко призводить до нервово-м’язової недостатності, м’язової слабкості, дестабілізації суглоба та виникнення вторинного ОА (Berenbaum Francis, 2011).
При дефіциті інсуліну, цукровому діабеті виникають порушення з боку сполучної тканини та судинної стінки — порушення обміну гіалуронової кислоти та хондроїтин сульфату, зменшення синтезу мукополісахаридів, що призводить до деградації хряща суглобів (Казимирко В.К. и соавт., 2006).
Останнє десятиліття також почали вивчати взаємозв’язок ОА з гіперурикемією. Підвищений рівень сечової кислоти у сироватці крові асоціювався з генералізованим ОА у людей, які перенесли ендопротезування кульшового суглоба (Sun Y. et al., 2000), тісний зв’язок також продемонстровано між тяжкістю ОА і рівнем сечової кислоти у синовіальній рідині у пацієнтів з гонартрозом і відсутністю в анамнезі подагри (Denoble A.E. et al., 2011), було опубліковано дані щодо поширеності підвищення рівня сечової кислоти у пацієнток з ОА (Ding X., Zeng C., 2016).
Існує думка, що ОА може бути пов’язаний з метаболічним синдромом або з кожним із його компонентів (Sellam J., Berenbaum F., 2013). Експериментальні дані свідчать про те, що цукровий діабет, дисліпідемія, АГ можуть бути незалежними факторами для розвитку ОА, навіть за відсутності ожиріння.
Підвищений рівень прозапальних медіаторів, зокрема IL-6 та -18, високо корелює з ожирінням, серцево-судинною патологією, нейродегенеративними захворюваннями і ОА (Howcroft T.K. et al., 2013). У пацієнтів з ішемічною хворобою серця спостерігається суттєве підвищення рівня IL-2, -4, -6 та -18 (прозапальних цитокінів, які беруть участь у деградації хряща), причому рівень IL-6 вищий у пацієнтів з інфарктом міокарда (Tedgui A., Mallat Z., 2006).
Призначення ефективної терапії у хворих на ОА завжди було складною проблемою. А скільки пацієнти із ОА зазвичай віком старше 40 років, а отже, мають не одне коморбідне захворювання, при їх лікуванні важливо враховувати вплив застосованих препаратів на показники пуринового, вуглеводного, ліпідного обмінів та можливість безпечного застосування в осіб із супутньою патологією.
На сьогодні медикаментозне лікування ОА проводять препаратами, які розподіляють на дві групи: модифікуючі симптоми захворювання (симптоматичні) — швидкодіючі й повільнодіючі (symptomatic slow acting drugs for osteoarthritis — SYSADOA) та модифікуючі хворобу (патогенетичні) (Алексеева Л.И., 2009). До першої групи належать симптоматичні препарати швидкої дії, а саме анальгетики та нестероїдні протизапальні препарати (НПЗП), здатні зменшувати інтенсивність болю, припухлість, скутість і покращувати функцію суглобів.
На сьогодні все більш значне місце в терапії при ОА займають симптоматичні препарати повільної дії (SYSАDOA). Проте дослідження цих препаратів та дискусія щодо їх застосування триває і нині (Яременко О.Б., 2014). Зміни поглядів західних фахівців можна зрозуміти зі змін рекомендацій з лікування остеоартрозу: 2003 р., EULAR (European League Against Rheumatism — Європейська антиревматична ліга (Jordan K.M. et al., 2003)): SYSАDOA показані всім хворим, вони полегшують симптоми і гальмують розвиток хвороби; 2007 р., EULAR: показані всім хворим, але вони лише полегшують симптоми; 2008 р., OARSI (Osteoarthritis Research Society International): показані лише тим, у кого вони виявили ефективність за 6 міс прийому, можливо, полегшують симптоми ОА; 2012 р., ACR (American College of Rheumatology): не рекомендуються при ОА і не полегшують симптоматику (Zhang W. 2005; 2007; 2010; McAlindon T.E. et al., 2014). На противагу цьому, в рекомендаціях ESCEO (The European Society for Clinical and Economic Aspects of Osteoporosis, Osteoarthritis and Musculoskeletal Diseases — Європейська спільнота з клінічних та економічних аспектів остеопорозу та остеоартрозу) 2014 р. рецептурні препарати цієї групи були включені до алгоритму лікування при ОА (Bruyere O., 2014). А в 2016 р. підтверджена їх ефективність внаслідок вивчення результатів клінічних досліджень щодо впливу на симптоми та структуру ОА препаратів різних груп, в тому числі SYSАDOA (Sharma L., 2016).
Аналіз сучасної терапії при ОА послужив приводом для вивчення ефективності, впливу на біохімічні, прозапальні, імунологічні показники НПЗП та симптоматичних повільнодіючих протизапальних препаратів (SYSАDOA) у лікуванні пацієнтів із ОА, що і стало метою проведеного дослідження.
Мета дослідження — диференційний підхід до лікування пацієнтів із ОА залежно від наявності супутньої патології.
Об’єкт і методи дослідження
Досліджено 211 пацієнтів (172 жінки, 39 чоловіків) із ОА колінних суглобів I–ІІІ рентгенологічної стадії за Kellgren — Lawrence. Діагноз ОА встановлювали за критеріями ACR 1986 р. та EULAR 2010 р. перегляду. Всім пацієнтам проводили рентгенологічне дослідження колінних суглобів у прямій (передньозадній) і боковій проекції за допомогою стаціонарного рентгенівського апарата «Sirescop CX» (ВАТ «Київський завод реле та автоматики», Україна, 1999) в положенні стоячи без навантаження на досліджуваний суглоб при згинанні коліна на 30˚. Стадію ураження визначали за класифікацією J.H. Kellgren та J.S. Lawrence (1957).
Розподіл на 6 груп проведено залежно від лікування. Пацієнти 1-ї групи (n=30) приймали німесулід (Німесил, «Берлін-Хемі АГ/Менаріні Груп») у дозі 100 мг двічі на добу, 2-ї групи (n=30) — мелоксикам (Моваліс, «Boehringer Ingelheim») у дозі 15 мг 1 раз на добу протягом 14 днів. Пацієнти 3-ї групи (n=54) приймали діацереїн (Флекцерин, ПАТ «Київський вітамінний завод») у дозі 50 мг двічі на добу, а 4-ї групи (n=32) — хондроїтину сульфат-4,6 пташиного походження (Структум, «Pierre Fabre Medicament») у дозі 500 мг двічі на добу протягом 6 міс. Пацієнти 5-ї групи (n=30) приймали глюкозаміну сульфат (Сінарта, ПАТ «Фармак») у дозі 400 мг тричі на тиждень протягом 1,5 міс, 6-ї (n=35) — фітопрепарат стандартизованого екстракту кореня імбиру (Верта, ТОВ «ОМНІФАРМА КИЇВ») у дозі 300 мг 2 рази на добу протягом 2 міс.
Оцінено динаміку загальноклінічних показників: збір скарг та анамнезу, об’єктивне обстеження, оцінювання артрологічного статусу хворих, анкетування (заповнення пацієнтами адаптованих опитувальників WOMAC, Лекена, візуальна аналогова шкала (ВАШ)), лабораторних — показників ліпідного (холестерин) та вуглеводного обміну (глюкоза крові), печінкові маркери (білірубін, аланінамінотрансфераза (АлАТ), аспартатамінотрансфераза (АсАТ)), креатинін, сечова кислота у крові, С-реактивний білок (СРБ). Імунологічні дослідження включали кількісне визначення в сироватці крові рівня IL-1β («Bender MedSystems GmbH», Австрія), TNF-α («Orgenium», Фінляндія), інсуліноподібного фактора росту (IGF)-1 («DRG», Німеччина), трансформуючого фактора росту (TGF)-β («DRG», Німеччина) імуноферментним методом. Облік реакції проводили на імуноферментному аналізаторі Lab-Line-100 («WestMedica», Австрія). Для аналізу стану обміну оксиду азоту (NО) вивчали вміст у крові обстежених хворих рівня нітритів як кінцевого продукту метаболізму NО за допомогою реактиву Гріса.
Відповідність розподілу даних клінічного дослідження закону нормального розподілу перевіряли тестом Колмогорова — Смирнова. Для опису даних використовували медіану та міжквартильний інтервал (Me, IQR), при нормальному розподілі середнє арифметичне значення і стандартну похибку (M±m), частоту та стандартну похибку (Р±m). Оскільки отримані в результаті клінічного дослідження дані мали відхилення від нормального розподілу варіаційного ряду, для порівняння груп нами використано непараметричні методи статистики — U-критерій Манна — Уїтні (для незалежних груп) та критерій Вілкоксона (для залежних груп). Для дослідження взаємозв’язку кількісних показників використовували кореляційний аналіз, знаходили критерій Спірмена (r), для якісних — використовували аналіз таблиць спряженості, знаходили критерій χ, силу взаємозв’язку φ та відносний ризик (RR), 95% довірчий інтервал (CI). Застосовували програмно-математичний комплекс для персонального комп’ютера «Microsoft Exel 2007» (Microsoft) та комп’ютерні програми для статистичного аналізу та оброблення даних «STATISTICA 6.0» (StatSoft Inc., США), «SPSS Statistics 20» (IBM, США).
Результати та їх обговорення
У результаті дослідження у 211 обстежених серед супутньої патології діагностовано артеріальну гіпертензію у 94%, ішемічну хворобу серця — у 81% випадків. Відзначена висока частота сечокам’яної хвороби (СКХ) та мікронефролітіазу — 64%, що, можливо, пов’язано з наявністю гіперурикемії у більшості (62%) обстежених пацієнтів. Метаболічний синдром виявлено у 61,8% обстежених хворих. У 76% випадків відзначали поєднання декількох коморбідних захворювань.
Незважаючи на столітню історію застосування НПЗП, вони залишаються актуальними і незамінними завдяки унікальній комбінації їх протизапальної та знеболювальної дії. Особливо важливим є вибір НПЗП з урахуванням їх безпеки та впливу на хрящову тканину, а також на супутню патологію. Для цього на базі терапевтичного відділення Київської міської клінічної лікарні (КМКЛ) № 7 проведено дослідження щодо вивчення ефективності німесуліду та мелоксикаму.
На фоні проведеної терапії відзначено достовірне зменшення вираженості больового синдрому за ВАШ, при прийомі німесуліду — на 35,6%, при застосуванні мелоксикаму — на 13,34%. При оцінці альгофункціонального індексу Лекена виявлено статистично достовірне зменшення вираженості болю на 30,3% через 2 тиж прийому німесуліду, а у пацієнтів, які приймали мелоксикам, — на 25,7% через 2 тиж лікування (табл. 1).
| Показник | Німесулід | Мелоксикам | ||||||
|---|---|---|---|---|---|---|---|---|
| До лікування | Після лікування | До лікування | Після лікування | |||||
| Me | IQR | Me | IQR | Me | IQR | Me | Me | |
| ВАШ, мм | 57,5 | 53,5–65,5 | 35* | 31,25–42,25 | 60,00 | 57,00–67,00 | 55,00* | 57,5 |
| WOMAC, мм | ||||||||
| Біль | 193,00 | 117,5–340,25 | 91,00* | 48,75–160,75 | 342,50 | 51,75–434,75 | 197,00* | 26,25–261,50 |
| Скутість | 100,00 | 76,75–111,00 | 68,5* | 48,00–88,00 | 93,00 | 14,00–107,50 | 64,00* | 11,25–87,75 |
| Функціональна недостатність | 725,00 | 332,25–1167,75 | 414,00* | 166,25–734,00 | 646,00 | 64,00 | 436,50* | 44,25–577,00 |
| Індекс Лекена, балів | 9,5 | 8,00–12,75 | 6,5* | 5,25–9,00 | 11,00 | 8,00–14,00 | 8,00* | 6,00–11,00 |
| Імунологічні показники | ||||||||
| NO, мкмоль/л | 4,81 | 3,19–7,27 | 3,05* | 2,5–4,68 | 3,10 | 0,43–6,97 | 2,98 | 0,40–6,60 |
| CРБ, мг/л | 5,59 | 2,7–14,03 | 2,66* | 1,04–7,55 | 7,81 | 4,49–17,36 | 3,80* | 1,86–11,36 |
| IL-1B, пг/мл | 22,63 | 12,75–34,15 | 17,06* | 11,08–29,84 | 23,95 | 17,43–32,43 | 23,54 | 17,32–32,58 |
| IGF-1, нг/мл | 9,4 | 2,71–47,01 | 9,6 | 2,85–50,25 | 18,77 | 1,69–85,69 | 21,00 | 2,07–91,00 |
У табл. 1 і 2: *р<0,001 при використанні критерію Вілкоксона.
На фоні лікування німесулідом пацієнти відзначили підвищення фізичної активності та значне поліпшення рухового режиму, що знаходить відображення в достовірному зменшенні вираженості болю на 53,9%, скутості — на 29,7% і функціональних порушень — на 41,6%. У пацієнтів, які приймали мелоксикам, інтенсивність зменшення болю, скутості та функціональних порушень була менш вираженою: біль — на 37,3%, скутість — на 20%, функціональні порушення — на 26,6% через 2 тиж лікування (див. табл. 1).
При прийомі німесуліду виявлено статистично достовірне зниження рівня IL-1β на 14% (див. табл. 1), а також NO на 42,8%, на відміну від групи із застосуванням мелоксикаму, де ці показники не змінювалися. При застосуванні німесуліду виявлено зниження NO, основного індуктора запалення та деградації хрящової тканини при ОА, в той час як мелоксикам не впливав на рівень NO.
Циклооксигеназа (ЦОГ)-незалежні ефекти німесуліду насамперед полягають в інгібуванні активності NO-синтази і, відповідно, утворення NO і пероксинітриту (ОNOO), які є ключовими медіаторами у процесі руйнування клітин організму й елементами запальної відповіді. Оскільки ОА виникає в осіб із супутньою кардіоваскулярною патологією, то такі особливості німесуліду, як активація синтезу інгібітора тканинного активатора плазміногену, блокування синтезу тромбоцитоактивуючого фактора, є надзвичайно важливими в запобіганні тромбоемболічним ускладненням (Lane N.E. et al., 2011).
Відзначено статистично достовірне зниження рівнів CРБ у плазмі крові — в групі німесуліду на 64,4%, у групі мелоксикаму — на 50,48%, що може свідчити про зменшення вираженості запальної відповіді в обох групах.
Результати аналізу даних біохімічних показників крові (білірубін, АлАТ, АсАТ, глюкоза, креатинін) свідчать про те, що при застосуванні обох препаратів статистично достовірних змін даних не виявлено (табл. 2). Проте відзначена тенденція до зниження рівня сечової кислоти з 375,33±24,6 до 321,57±19,6 мкмоль/л після застосування німесуліду, в той час як мелоксикам не впливав на її рівень, що може бути корисним при лікуванні пацієнтів із гіперурикемією.
| Показник | Німесулід | Мелоксикам | ||
|---|---|---|---|---|
| До лікування | Після лікування | До лікування | Після лікування | |
| Білірубін, мкмоль/л | 17,59±0,55 | 17,59±0,55 | 17,01±0,9 | 16,81±0,89 |
| АлАТ, мккат/л | 0,12±0,007 | 0,13±0,009 | 0,19±0,02 | 0,19±0,02 |
| АсАТ, мккат/л | 0,17±0,05 | 0,17±0,05 | 0,18±0,022 | 0,21±0,026 |
| Глюкоза, ммоль/л | 5,1±0,16 | 5,05±0,12 | 5,03±0,22 | 5,14±0,23 |
| Креатинін, мкмоль/л | 92,6±3,24 | 92,2±2,74 | 90,9±1,94 | 91,1±2,13 |
Результати аналізу застосування селективних НПЗП свідчать про достовірний клінічний ефект в обох групах, однак німесулід, на відміну від мелоксикаму, має більш виражений клінічний ефект, а саме: зменшення вираженості больового синдрому, скутості та функціональних порушень, що, можливо, пов’язано з його коротким механізмом дії (період напіввиведення (Т½) 3,2–6 год), в той час як мелоксикам має більш пролонгований механізм (Т½ становить 15–20 год). Крім того, німесулід може бути препаратом вибору при такій супутній патології, як серцево-судинні захворювання та гіперурикемія.
За останні роки ОА розглядається як запальний процес, в основі якого лежить продукція цитокінів, які запускають каскад запальної реакції, в результаті чого виникає пошкодження хрящової тканини. Серед симптоматичних протизапальних препаратів повільної дії (SYSАDOA) є препарат, який діє як інгібітор IL-1 та його патологічних ефектів — діацереїн. IL-1 є ключовим медіатором при ОА, він спричиняє пошкодження хряща за допомогою стимуляції продукції інших цитокінів, матриксних металопротеаз (ММП) і NO, викликає запальний процес при OA, апоптоз хондроцитів, активує остеокласти субхондральної кістки, що є причинами її змін, індукує синтез PG та зумовлює стійкий больовий синдром, стимулює власну продукцію, що забезпечує постійне пошкодження хряща.
Нами проведено дослідження щодо вивчення ефективності діацереїну у 54 хворих (49 жінок і 5 чоловіків) віком 30–75 років I–III рентгенологічної стадії за Kellgren — Lawrence.
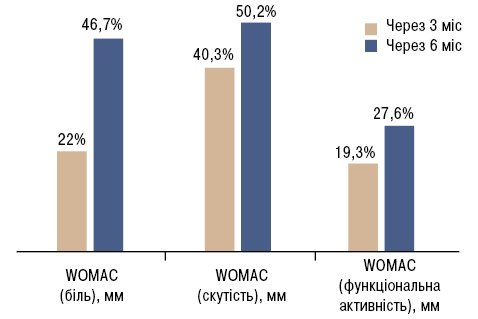
У результаті дослідження виявлено позитивний вплив діацереїну на динаміку показників суглобового синдрому, а саме статистично достовірне зниження вираженості болю за WOMAC на 46,7%, скутості — на 50,2%, покращення функціональної активності — на 27,6% (табл. 3, рис. 1).
| Показник | До лікування | Через 3 міс | Через 6 міс | |||
|---|---|---|---|---|---|---|
| Me | IQR | Me | IQR | Me | IQR | |
| WOMAC (біль), мм(0–500) | 238,00 | 217,25–287,75 | 186,00* | 125,00–202,25 | 130,50* | 98,00–168,50 |
| WOMAC (скутість), мм(0–200) | 114,00 | 92,00–134,25 | 68,00* | 55,50–76,00 | 56,50* | 46,00–68,00 |
| WOMAC (функціональна активність), мм(0–1700) | 765,50 | 612,00–902,75 | 617,00* | 528,00–692,00 | 578,00* | 437,00–643,50 |
| Сумарний індекс WOMAC(0–2400) | 1115,5 | 920,00–1312,25 | 852,00* | 721,75–969,25 | 750,00* | 657,50–858,00 |
У табл. 3, 10–17: *р<0,001, різниця вважається достовірною при р<0,05.
При застосуванні діацереїну отримано статистично достовірне зниження прозапальних цитокінів (TNF-α, IL-1), вільних радикалів, які беруть участь у деструкції хряща (NO), СРБ, а також статистично достовірне підвищення факторів росту (TGF-β, IGF-1). Отримані дані свідчать про високу клінічну ефективність, зменшення інтенсивності запального процесу та анаболічний ефект діацереїну у хворих на ОА (табл. 4).
| Показник | До лікування | Після лікування | р* | ||
|---|---|---|---|---|---|
| Me | IQR | Me | IQR | ||
| IL-1, пг/мл | 19,47 | 15,22–23,81 | 12,00 | 9,00–16,20 | 0,001 |
| NO, мкмоль/л | 4,09 | 3,00–4,19 | 2,20 | 1,00–3,44 | 0,001 |
| IGF-1,нг/мл | 38,00 | 22,00–57,50 | 98,00 | 77,00–119,25 | 0,001 |
| TNF-α, пг/мл | 22,31 | 17,33–29,30 | 11,20 | 8,70–14,70 | 0,001 |
| TGF-β, пг/мл | 25,96 | 11,66–43,58 | 109,11 | 97,47–163,87 | 0,001 |
У табл. 4–9: *різниця вважається достовірною при р<0,05.
Не відзначено динаміки лабораторних показників ліпідного обміну, білірубіну, печінкових маркерів, креатиніну та його кліренсу, що свідчить про можливість безпечного застосування препарату у пацієнтів із супутньою патологією, а статистично достовірне зниження рівня глюкози у крові — у пацієнтів із цукровим діабетом ІІ типу (табл. 5). Ці дані зіставні з іншим дослідженням 2011 р., в якому у пацієнтів із цукровим діабетом ІІ типу та ожирінням, які раніше не застосовували будь-яких діабетичних препаратів, виявлено, що застосування діацереїну підвищувало секрецію інсуліну та знижувало рівень глюкози крові (Ramos-Zavala M.G. et al., 2011), що, можливо, пов’язано зі зниженням прозапальних цитокінів (TNF-α та IL-1β), які беруть участь у апоптозі β-клітин підшлункової залози, що веде до зменшення секреції інсуліну з подальшим розвитком гіперглікемії. Згідно з отриманими нами даними, діацереїн здатний впливати на проанаболічні цитокіни, одним з яких є IGF-1, який є структурним аналогом інсуліну і має ряд спільних з ним властивостей, у проведеному нами дослідженні спостерігали статистично достовірне його підвищення, що, можливо, було пов’язано із рівнем інсуліну, що і вплинуло на рівень глюкози у сироватці крові. Аналогічним були спостереження і при дослідженні 12 пацієнтів із цукровим діабетом ІІ типу, які входили до цієї групи — глюкоза у крові статистично достовірно (р<0,007) знизилася з 7,15 (IQR: 5,23–9,30) до 6,00 (IQR: 5,00–7,00) ммоль/л.
Таблиця 5
| Показник | До лікування | Після лікування | р* | ||
|---|---|---|---|---|---|
| Me | IQR | Me | IQR | ||
| Білірубін, мкмоль/л | 16,0 | 12,35–17,05 | 16,0 | 10,15–17,25 | 0,711 |
| АлАТ, мккат/л | 0,12 | 0,11–0,14 | 0,12 | 0,11–0,14 | 0,873 |
| АсАТ, мккат/л | 0,12 | 0,107–0,14 | 0,12 | 0,08–0,15 | 0,383 |
| Холестерин, ммоль/л | 5,4 | 4,3–6,23 | 5,0 | 4,1–6,0 | 0,912 |
| Глюкоза, ммоль/л | 5,1 | 4,8–5,8 | 4,98 | 4,00–5,40 | 0,001 |
| Креатинін, мкмоль/л | 84,00 | 76,00–97,00 | 84,00 | 74,00–94,00 | 0,149 |
| Кліренс креатиніну, мл/хв | 77,00 | 63,75–92,25 | 82,00 | 68,00–96,75 | 0,125 |
| Сечова кислота, мкмоль/л | 415,50 | 347,00–452,5 | 374,00 | 318,75–423,50 | 0,001 |
При застосуванні діацереїну відзначали зниження рівня сечової кислоти, що важливо при лікуванні хворих із супутньою гіперурикемією (див. табл. 5). Зниження сечової кислоти при застосуванні діацереїну, можливо, пов’язане з його протизапальним ефектом — діацереїн є інгібітором IL-1. IL-1 через активацію інфламасоми підвищує загибель клітин і виведення (внаслідок їх руйнування) сечової кислоти (Denoble A.E. et al., 2011). У проведеному нами дослідженні отримано зниження рівня IL- 1 при застосуванні діацереїну і відповідне зниження рівня сечової кислоти.
В останні роки отримано цікаві результати, які відображають механізми дії хондроїтин сульфату (Henrotin Y., 2010). Хондроїтин сульфат перешкоджає апоптозу хондроцитів шляхом запобігання активації р38-мітогенактивуючої протеїнкінази, що викликає каскад запалення, підвищує синтез протеогліканів, знижує синтез простагландину Е2 (PGE2), ММП та IL-1, -6, -8. Серед його механізмів дії також модуляція протеолітичної активності внаслідок інгібування ММП — стромелізину та колагенази, протизапальний ефект внаслідок інгібування різних запальних факторів IL-1β, NF-kB, IL-6, ММП за рахунок пригнічення iNO-синтази, ЦОГ-2, PGE2, антиоксидантний ефект (зменшення пероксидації ліпідів, фрагментації ДНК, зменшення окиснення білків, зменшення гідроксильних радикалів кисню і супероксидних аніонів). Крім того, він має структурно-модифікуючий вплив на субхондральну кістку через регуляцію співвідношення остеопротегерину/RANKL на остеобластах.
Структурно-модифікуюча дія хондроїтин сульфату досліджувалася та дискутувалася в багатьох дослідженнях за останні роки (Michel B.A. et al., 2005; Hochberg M.C., 2008; 2010; Kahan A. et al., 2009; Wildi L., 2011; Lee J.Y. et al., 2013).
З метою вивчення ефективності хондроїтин сульфату у хворих на ОА оцінено результати дослідження за участю 32 осіб (26 жінок і 6 чоловіків) віком 35–75 років I–III рентгенологічної стадії за Kellgren — Lawrence, які становили 4-ту групу дослідження. Тривалість захворювання у пацієнтів становила від 5 до 10 років.
Як видно із представлених даних, хондроїтин сульфат-4,6 показав досить високу ефективність через 6 міс, а саме у зменшенні вираженості болю (26,4%), скутості (50,6%) та відновленні функціональної активності (11,4%) при лікуванні гонартрозу (табл. 6).
| Показник | До лікування | Через 3 міс | Через 6 міс | |||
|---|---|---|---|---|---|---|
| Me | IQR | Me | IQR | Me | IQR | |
| WOMAC (біль), мм(0–500) | 243,00 | 225,00–272,75 | 215,00* | 196,50–227,50 | 194,00* | 174,00–198,00 |
| WOMAC (скутість), мм(0–200) | 116,00 | 96,00–140,25 | 67,00* | 63,25–71,75 | 63,00* | 49,50–68,00 |
| WOMAC (функціональна активність), мм(0–1700) | 751,00 | 737,75–785,50 | 718,50* | 696,00–731,00 | 686,50* | 674,00–697,75 |
| Сумарний WOMAC, мм(0–2400) | 1127,0 | 1082,50–1207,25 | 1001,50* | 973,0–1040,5 | 937,50* | 908,75–962,50 |
Хондроїтин сульфат-4,6 суттєво впливає на перебіг ОА, зменшуючи вираженість факторів запалення та деструкції хрящової тканини. А крім того, підвищує рівень IGF-1, що свідчить про його анаболічний ефект (табл. 7).
| Показник | До лікування | Після лікування | р* | ||
|---|---|---|---|---|---|
| Me | IQR | Me | IQR | ||
| IL-1, пг/мл | 20,00 | 11,50–26,52 | 16,70 | 9,80–18,62 | 0,001 |
| NO, мкмоль/л | 3,00 | 2,05–4,00 | 2,00 | 2,00–3,00 | 0,002 |
| IGF-1,нг/мл | 33,93 | 13,50–69,55 | 101,80 | 69,10–103,16 | 0,001 |
Не відзначено динаміки лабораторних показників глюкози крові, ліпідного обміну, білірубіну, печінкових маркерів, які у більшості хворих до включення у дослідження були в межах норми (табл. 8), що важливо для пацієнтів із ОА, які мають супутню патологію.
| Показник | До лікування | Після лікування | р* | ||
|---|---|---|---|---|---|
| Me | IQR | Me | IQR | ||
| Білірубін, мкмоль/л | 16,10 | 12,80–16,80 | 16,00 | 13,00–17,00 | 0,384 |
| АлАТ, мккат/л | 0,125 | 0,10–0,14 | 0,12 | 0,11–0,14 | 0,616 |
| АсАТ, мккат/л | 0,12 | 0,083–0,140 | 0,12 | 0,11–0,14 | 0,940 |
| Холестерин, ммоль/л | 5,85 | 5,20–6,70 | 6,0 | 5,00–6,00 | 0,06 |
| Глюкоза, ммоль/л | 5,55 | 4,56–6,53 | 6,00 | 5,00–6,00 | 0,926 |
Для нас було важливим вивчення впливу ХС на пуриновий обмін (зокрема рівень сечової кислоти). При оцінці показників пуринового обміну, а саме креатиніну та його кліренсу, динаміки не спостерігалося. Проте виявлено статистично достовірне (р<0,001) підвищення рівня сечової кислоти, яка до лікування становила 404,00 (IQR: 292,25–533,00) мкмоль/л, після лікування хондроїтин сульфатом — 437,00 (IQR: 365,75–547,5) мкмоль/л (табл. 9).
| Показник | До лікування | Після лікування | р* | ||
|---|---|---|---|---|---|
| Me | IQR | Me | IQR | ||
| Креатинін, мкмоль/л | 84,00 | 75,00–99,25 | 87,00 | 82,00–96,00 | 0,261 |
| Кліренс креатиніну, мл/хв | 91,00 | 69,75–102,75 | 81,00 | 70,75–98,75 | 0,210 |
| Сечова кислота, мкмоль/л | 404,00 | 292,25–533,00 | 437,00 | 365,75–547,5 | 0,001 |
H.M. Burt і Y.C. Dutt (1986) показали, що хондроїтин сульфат і фосфатидилхолін сприяли кристалізації солей моноурату натрію in vitro, що приводило до депонування солей моноурату натрію у тканинах. У цьому дослідженні використана суміш двох ізомерів хондроїтин сульфату, хондроїтин-4-сульфат і хондроїтин-6-сульфат у невідомих пропорціях, і не виключено, що ці два ізомери можуть мати абсолютно різний вплив на депонування моноурату натрію. У проведеному нами дослідженні використано застосування хондроїтин сульфату пташиного походження (хондроїтин-4-сульфат 72%) і виявлено статистично достовірне підвищення рівня сечової кислоти. T.C. Laurent, A.E. Denoble та співавтори (Laurent T.C.,1964; Denoble A.E. et al., 2011) підтвердили, що сечова кислота in vitro була менш розчинна зі збільшенням кількості хондроїтин сульфату. Крім того, сам хондроїтин сульфат має тваринне походження (тобто багатий на пурини), що також впливає на підвищення сечової кислоти.
Як видно із представлених даних, хондроїтин сульфат достовірно підвищує рівень сечової кислоти у хворих на ОА з гіперурикемією. Але не підвищує рівня сечової кислоти у хворих з її нормальним вмістом, за даними дослідження, проведеного на базі КМКЛ № 7 у 2015 р. (Шуба Н.М., Крилова А.С., 2015).
Із врахуванням високої частоти гіперурикемії (за нашими даними 62%) у хворих на ОА метою проведеного нами дослідження було вивчення впливу окремих SYSADOA на рівень сечової кислоти у цих пацієнтів. Поряд із клінічною ефективністю хондроїтин сульфату та діацереїну виявлено підвищення сечової кислоти при лікуванні хондроїтин сульфатом і, навпаки, статистично достовірне зниження її при лікуванні діацереїном.
У групу препаратів SYSАDOA входить і глюкозаміну сульфат. Глюкозаміну сульфат стимулює синтез протеогліканів хондроцитами, гіалуронової кислоти синовіальною оболонкою (Uitterlinden E.J. et al., 2008), пригнічує активність стромелізину, колагенази, фосфоліпази А2 (McCulloch D.R. et al., 2010), агрекінази (Sandy J.D. et al., 1998), зменшує утворення супероксидних радикалів, пригнічує синтез NО та активності лізосомальних ферментів (Valvason C. et al., 2008), знижує рівень IL-1β у синовіальній рідині (Shikhman A.R. et al., 2001), збільшує співвідношення остеопротегерин/RANKL і зменшує резорбцію кісткової тканини. Цей ефект зростає, коли глюкозамін застосовують у комбінації з хондроїтин сульфатом (Tat S.K. et al., 2007). Ефективність глюкозаміну сульфату продемонстрована в декількох клінічних дослідженнях (Reginster J.Y. et al., 2001; Pavelka K. et al., 2002; Herrero-Beaumont G. et al., 2007) та висвітлена в оновленому Кокранівському огляді (Towheed T. et al., 2009).
Глюкозаміну сульфат широко застосовують у пацієнтів з ОА колінних суглобів, крім того, вивчали його ефективність у хворих з ураженням хребта у дворічному дослідженні в Нідерландах (Wim J. van Blitterswijk et al., 2003). Це стало основою для проведення нами дослідження щодо ефективності глюкозаміну сульфату (оригінальний препарат і вітчизняного виробника) у пацієнтів із первинним синдромом болю в нижній ділянці спини, поширеність якого в Україні становить від 40–80% у осіб працездатного віку. Оцінку оригінального препарату проведено ще у 2009 р. (Шуба Н.М. та співавт., 2009).
Нами проведено дослідження ефективності глюкозаміну сульфату вітчизняного виробника. У дослідженні взяли участь 30 хворих (18 жінок і 12 чоловіків) віком від 29 до 80 років. З метою об’єктивної оцінки больового синдрому та контролю ефективності терапії використовували такі методи обстеження: ВАШ та спеціальні анкети — Мак-Гілловський больовий опитувальник, опитувальник Роланда — Морріса та Освестрі.
Встановлено, що в результаті терапії глюкозаміну сульфатом у пацієнтів з первинним синдромом болю в спині через 1,5 міс відзначали: достовірне зменшення інтенсивності болю за ВАШ на 34%, поліпшення психоемоційного стану життєдіяльності пацієнтів у середньому на 43% (Мак-Гілловський больовий опитувальник), покращення якості життя в середньому відзначали на 52% (дані опитувальника Роланда — Морріса) (табл. 10).
| Показник | До лікування | Через 1,5 міс | ||
|---|---|---|---|---|
| Me | IQR | Me | IQR | |
| Мак-Гілла(0–20) | 6,00 | 4,00–10,00 | 4,00* | 2,00–6,00 |
| Роланда — Морріса(0–18) | 3,00 | 1,00–8,00 | 1,00* | 1,00–3,00 |
| ВАШ (спина), мм(0–100) | 59,00 | 47,00–75,00 | 35,00* | 24,00–39,00 |
При порівнянні ефекту лікування глюкозаміну сульфатом вітчизняного виробника з оригінальним не виявлено статистично достовірної різниці показників (t=0,66; p>0,1).
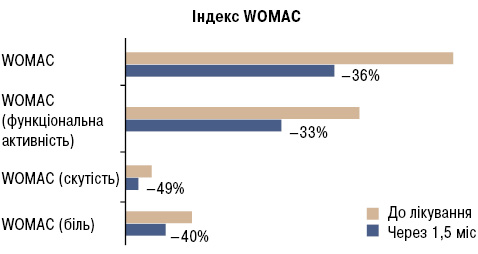
Через 1,5 міс після терапії глюкозаміну сульфатом показники ВАШ у спокої знизилися на 33%, під час ходьби — на 31%. Оцінюючи тяжкість гонартрозу за допомогою альгофункціонального індексу Лекена, нами встановлено, що в процесі лікування показники достовірно знизилися на 35%. Через 1,5 міс після лікування глюкозаміну сульфатом відзначено їх вірогідне зниження. Зокрема, показники індексу WOMAC (біль) зменшилися на 40%, WOMAC (скутість) — на 49%, WOMAC (функціональна активність) — на 33% (табл. 11, рис. 2).
| Показник | До лікування | Через 1,5 міс | ||
|---|---|---|---|---|
| Me | IQR | Me | IQR | |
| ВАШ у спокої, мм(0–100) | 23,50 | 10,00–41,75 | 12,50* | 4,75–28,00 |
| ВАШ при ходьбі, мм(0–100) | 58,00 | 40,75–69,50 | 41,50* | 20,75–51,25 |
| Індекс Лекена, балів(0–25) | 10,50 | 7,00–15,00 | 6,50* | 4,00–9,25 |
| WOMAC (біль), мм(0–500) | 158,00 | 89,00–263,00 | 82,00* | 32,25–155,25 |
| WOMAC (скутість), мм(0–200) | 52,00 | 37,25–103,50 | 24,00* | 15,00–50,50 |
| WOMAC (функціональна активність), мм(0–1700) | 529,00 | 261,00–905,00 | 342,00* | 128,00–637,00 |
| Сумарний індекс WOMAC(0–2400) | 730,50 | 387,25–1195,00 | 462,50* | 170,75–841,50 |
Під час дослідження не виявлено динаміки таких лабораторних показників, як білірубін, АлАТ, АсАТ, креатинін, сечова кислота, глюкоза та швидкість осідання еритроцитів (ШОЕ), які в більшості пацієнтів були в межах норми до включення в дослідження. Зафіксовано достовірне зниження показників СРБ на 29%, що свідчить про протизапальний ефект глюкозаміну сульфату (табл. 12).
| Показник | До лікування | Через 1,5 міс | ||
|---|---|---|---|---|
| Me | IQR | Me | IQR | |
| СРБ, мг/л | 6,00 | 4,00–8,40 | 4,00* | 4,00–6,00 |
| ШОЕ, мм/год | 12,00 | 7,75–15,25 | 10,00* | 7,75–12,50 |
| Сечова кислота, мкмоль/л | 408,00 | 317,25–477,50 | 410,50 | 311,50–475,50 |
| Білірубін, мкмоль/л | 16,30 | 10,38–16,80 | 16,20 | 10,85–16,90 |
| АлАТ, мккат/л | 0,18 | 0,11–0,29 | 0,21 | 0,11–0,30 |
| АсАТ, мккат/л | 0,24 | 0,14–0,28 | 0,24 | 0,15–0,32 |
| Креатинін, мкмоль/л | 89,00 | 82,00–94,75 | 86,5 | 79,50–98,00 |
| Холестерин, ммоль/л | 5,20 | 4,90–6,23 | 5,20 | 4,70–6,00 |
| Глюкоза, ммоль/л | 5,15 | 4,58–5,40 | 4,80 | 4,60–5,50 |
Нами зареєстровано достовірне зниження прозапальних цитокінів (IL-1) та вільних радикалів (NO), підвищення рівня анаболічних цитокінів (IGF-1). Отримані результати свідчать про зниження інтенсивності запального процесу та анаболічний ефект у пацієнтів з гонартрозом на фоні лікування глюкозаміну сульфатом (табл. 13).
| Показник | До лікування | Через 1,5 міс | ||
|---|---|---|---|---|
| Me | IQR | Me | IQR | |
| IL-1,пг/мл | 4,69 | 2,50–7,59 | 2,52* | 1,75–3,94 |
| NO, мкмоль/л | 3,28 | 2,02–4,79 | 2,37* | 1,59–3,03 |
| IGF-1,нг/мл | 43,85 | 13,82–239,63 | 80,75* | 22,51–490,47 |
Отже, глюкозаміну сульфат виявив позитивний терапевтичний ефект при гонартрозі, а також аналогічний ефект при первинному синдромі болю в нижній ділянці спини порівняно з оригінальним глюкозаміну сульфатом.
Ще одним препаратом групи SYSАDOA є екстракт кореня імбиру, який виявляє виражені знеболювальні та протизапальні, жарознижувальні властивості (Suekawa M. et al., 1984; Backon J.,1986; Борткевич О.П. и соавт., 2007). Він селективно інгібує ЦОГ-2, синтез PGE2, IL-1 та -2, лейкотрієнів, активує синтез IL-4 та -10, сприяє уповільненню деструкції хрящової тканини, індукованої TNF-α, відновленню хрящової тканини (Frondoza C.G. et al., 2004; Дядык А.И. и соавт., 2005). З метою вивчення ефективності препаратів виконано 5 клінічних досліджень (Bliddal H. et al., 2000; Altman R.D., Marcussen K.C., 2001; Wigler I. et al., 2003; Haghighi M. et al., 2005; Zakeri Z. et al., 2011) та метааналіз 2015 р. (Bartels E.M. et al., 2015).
У дослідженні ефективності екстракту кореня імбиру взяли участь 35 хворих (28 жінок і 7 чоловіків) віком від 30 до 80 років.
При оцінці впливу болю на якість життя за допомогою опитувальника Освестрі встановлено статистично достовірне зниження показників на 23% через 1 міс після лікування екстрактом кореня імбиру, а через 2 міс показники знизилися на 48% (табл. 14).
| Показник | До лікування | Через 2 міс | P | ||
|---|---|---|---|---|---|
| Me | IQR | Me | IQR | ||
| Освестрі(0–60) | 21,00 | 12,00–30,00 | 16,00 | 6,00–26,00 | <0,001 |
| Мак-Гілла(0–20) | 9,00 | 4,00–12,00 | 3,00 | 1,00–5,00 | <0,001 |
| Роланда — Морріса(0–18) | 5,00 | 3,00–7,00 | 2,00 | 0,00–4,00 | <0,001 |
| ВАШ (спина), мм(0–100) | 58,00 | 44,00–69,00 | 21,00 | 12,00–30,00 | <0,001 |
Якісна оцінка характеристики болю, що визначалася за допомогою опитувальника Мак-Гілла, показала статистично достовірне зниження показників після лікування екстрактом кореня імбиру (див. табл. 14). Вже через 1 міс після лікування показники опитувальника за кількістю слів знизилися на 34%, а через 2 міс — на 63%. Показники рангового індексу болю через 1 міс лікування знизилися на 31%, а через 2 міс — на 59%. Таким чином, у пацієнтів зменшилась інтенсивність болю, а також покращився психоемоційний стан.
За допомогою опитувальника Роланда — Морріса визначали порушення життєдіяльності пацієнтів до та після лікування екстрактом кореня імбиру. В результаті дослідження виявлено статистично достовірне зниження показників на 30% через 1 міс лікування, а через 2 міс — на 58% (див. табл. 14).
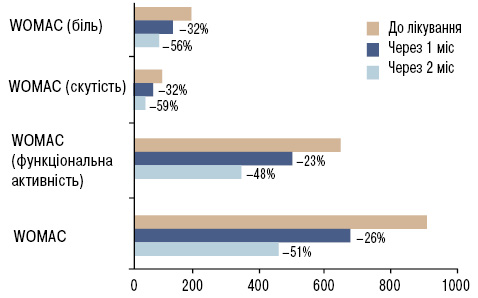
На фоні лікування екстрактом кореня імбиру показники інтенсивності болю за шкалою ВАШ статистично достовірно знизилися, через 2 міс ВАШ у спокої зменшився на 49%, ВАШ при ходьбі — на 41%, індекс Лекена статистично достовірно знизився на 54% (табл. 15). Сумарний індекс WOMAC через 2 міс знизився на 51%. Через 2 міс після лікування показники індексу WOMAC (біль) знизилися на 56%,WOMAC (скутість) — на 59%, а WOMAC (функціональна активність) — на 48% (табл. 15, рис. 3).
| Показник | До лікування | Через 2 міс | р* | ||
|---|---|---|---|---|---|
| Me | IQR | Me | IQR | ||
| ВАШ у спокої, мм(0–100) | 37,00 | 22,00–48,00 | 13,00 | 7,00–28,00 | <0,001 |
| ВАШ при ходьбі, мм(0–100) | 62,00 | 50,00–71,00 | 37,00 | 22,00–48,00 | <0,001 |
| Індекс Лекена, бали(0–25) | 37,00 | 22,00–48,00 | 5,00 | 3,00–8,00 | <0,001 |
| WOMAC (біль), мм(0–500) | 163,00 | 112,00–229,00 | 52,00 | 26,00–117,00 | <0,001 |
| WOMAC (скутість),мм(0–200) | 85,00 | 57,00–107,00 | 30,00 | 19,00–42,00 | <0,001 |
| WOMAC (функціональна активність), мм(0–1700) | 623,00 | 320,00–872,00 | 257,00 | 105,00–422,00 | <0,001 |
| Сумарний індекс WOMAC(0–2400) | 837,00 | 422,00–1123,75 | 296,50 | 97,00–542,75 | <0,001 |
Не виявлено негативного впливу на динаміку загальноклінічних показників, таких як білірубін, АлАТ, АсАТ, креатинін, що у більшості пацієнтів були в межах норми на етапі включення у дослідження, що підтверджує відсутність негативного впливу на показники функції печінки та нирок при тривалому застосуванні препарату. Відзначено статистично достовірне зниження показників СРБ та ШОЕ на 20%, що свідчить про протизапальний ефект екстракту кореня імбиру (табл. 16).
| Показник | До лікування | Через 2 міс | р* | ||
|---|---|---|---|---|---|
| Me | IQR | Me | IQR | ||
| СРБ, мг/л | 6,00 | 4,00–6,00 | 4,00 | 4,00–4,00 | <0,001 |
| ШОЕ, мм/год | 13,00 | 10,00–16,00 | 10,00 | 8,00–15,00 | 0,001 |
| Сечова кислота, мкмоль/л | 389,00 | 321,00–482,00 | 380,00 | 326,00–460,00 | <0,05 |
| Білірубін, мкмоль/л | 16,20 | 12,40–17,20 | 16,00 | 12,30–16,80 | >0,05 |
| АлАТ | 0,24 | 0,18–0,31 | 0,23 | 0,18–0,30 | >0,05 |
| АсАТ | 0,24 | 0,22–0,32 | 0,24 | 0,21–0,32 | >0,05 |
| Креатинін, мкмоль/л | 95,00 | 77,00–110,00 | 92,00 | 77,00–100,00 | >0,05 |
| Холестерин, ммоль/л | 5,80 | 5,10–6,20 | 5,50 | 5,00–5,90 | >0,001 |
| Глюкоза, ммоль/л | 5,50 | 5,00–5,70 | 5,30 | 4,80–5,50 | >0,05 |
Через 2 міс лікування екстрактом кореня імбиру отримано статистично достовірне зниження IL-1β, NO, що свідчить про зниження інтенсивності запального процесу у хворих на гонартроз (табл. 17).
| Показник | До лікування | Через 2 міс | р* | ||
|---|---|---|---|---|---|
| Me | IQR | Me | IQR | ||
| IL-1,пг/мл | 8,46 | 3,31–12,63 | 4,80 | 2,19–7,51 | <0,001 |
| NO, мкмоль/л | 2,39 | 1,83–3,94 | 1,67 | 1,24–2,57 | <0,001 |
| IGF-1,нг/мл | 98,00 | 36,04–541,50 | 207,00 | 13,78–600,00 | >0,05 |
Крім того, у більшості пацієнтів виявили незначне зменшення маси тіла та ІМТ після лікування (табл. 18), що може бути пояснено тим, що 6-гінгерол та 6-шогаол (складові екстракту кореня імбиру) здатні пригнічувати адипогенез преадипоцитів та їх диференціювання, а також ліпідне накопичення у зрілих адипоцитах (Rani M.P. et al., 2012; Tzeng T.F., Liu I.M., 2013; Tzeng T.F. et al., 2014).
| Показник | До лікування | Через 2 міс | р | ||
|---|---|---|---|---|---|
| Me | IQR | Me | IQR | ||
| Маса тіла, кг | 82,00 | 74,00–90,00 | 80,00 | 72,00–87,00 | <0,001 |
| ІМТ | 30,12 | 28,20–34,37 | 29,99 | 27,05–32,42 | <0,001 |
Отже, застосування екстракту кореня імбиру зумовило позитивну терапевтичну дію при гонартрозі, а також ефект при первинному синдромі болю в нижній ділянці спини та зниження ІМТ, що важливо за наявності ожиріння.
Висновки
У дослідженні показано, що препаратом вибору для усунення больового синдрому протягом перших 14 днів є німесулід (Німесил), який ефективніший, ніж мелоксикам, а, крім того, знижує рівень NО, важливого прозапального фактора. Німесулід (Німесил), на відміну від мелоксикаму, надає більш виражений клінічний ефект, а саме: зменшення вираженості больового синдрому, скутості функціональних порушень, що, можливо, пов’язано з його коротким механізмом дії (Т½ — 3,2–6 год), в той час як мелоксикам виявляє більш пролонгований механізм дії (Т½ — 15–20 год).
Встановлено, що у 62% обстежених пацієнтів із ОА спостерігалась гіперурикемія, що спричиняла більш тяжкий перебіг ОА та більш виражені рентгенологічні зміни. За наявності гіперурикемії у хворих на ОА застосування діацереїну призводило до зниження рівня сечової кислоти та більшої ефективності порівняно з хондроїтин сульфатом, у зв’язку з чим діацереїн може бути препаратом вибору у цих пацієнтів. Враховуючи зниження рівня глюкози при застосуванні діацереїну у хворих на ОА, доцільно його застосування при цукровому діабеті ІІ типу.
Глюкозаміну сульфат показав позитивний терапевтичний ефект при гонартрозі, а також аналогічний ефект при первинному синдромі болю в нижній ділянці спини. Екстракт кореня імбиру також зумовив позитивний клінічний ефект при гонартрозі та при первинному синдромі болю в нижній ділянці спини, крім того, при його застосуванні відзначали зменшення маси тіла та зниження ІМТ.
СПИСОК ВИКОРИСТАНОЇ ЛітературИ
- Алексеева Л.И. (2009) Симптоматические препараты замедленного действия при лечении остеоартроза. Consilium medicus., 11(9): 100–104.
- Борткевич О.П., Поскрипко Ю.А., Тимошенко Е.Ю. (2007) Зинаксин с позиции доказательной медицини. Укр. ревматол. журн., 4(30): 1–4.
- Дядык А.И., Шпитевая Н.И., Здиховская И.И. (2005) Растительный препарат Зинаксин как один из важнейших компонентов в лечении остеоартроза. Здоров’я України, 18(127): 35–36.
- Казимирко В.К., Коваленко В.Н., Мальцев В.И. (2006) Первичный (возрастзависимый, инволюционный) остеоартроз. МОРИОН, Киев, 176 с.
- Шуба Н.М., Крилова А.С. (2015) Ефективність структурно-модифікувальних препаратів у пацієнтів з остеоартрозом і гіперурикемією. Ортопедия, травматология и протезирование, 4: 69–73.
- Шуба Н.М., Воронова Т.Д., Тарасенко Т.М., Крилова А.С. (2012) Нові аспекти патогенезу остеоартрозу та шляхи корекції. Укр. ревматол. журн., 1(47): 51–58.
- Шуба Н.М., Воронова Т.Д., Карташова Ж.В. (2009) Оценка эффективности оригинального глюкозамина сульфата и декскетопрофена в лечении пациентов с первичным синдромом боли в нижней части спины. Здоров’я України, 17: 44–45.
- Яременко О.Б. (2014) Современная терапия остеоартроза на основании новых рекомендаций и доказательств: новые подходы и перспективы. Здоров’я України. Хірургія. Ортопедія. Травматологія, 2: 40–41.
- Altman R.D., Marcussen K.C. (2001) Effects of a ginger extract on knee pain in patients with osteoarthritis. Arthritis Rheum., 44(11): 2531–2538.
- Backon J. (1986) Ginger: inhibition of thromboxane synthase and stimulation of prostacyclin: relevance for medicine and psychiatry. Med. Hypotheses, 20: 271–278.
- Bartels E.M., Folmer V.N., Bliddal H. et al. (2015) Efficacy and safety of ginger in osteoarthritis patients: a meta-analysis of randomized placebo-controlled trials. Osteoarth. Cartilage., 23(1): 13–21.
- Berenbaum Francis (2011) Diabetes-induced osteoarthritis: from a new paradigm to a new phenotype. Ann. Rheum. Dis.,70: 1354–1356.
- Bijlsma J.W.J. (Ed.) (2013) Textbook on Rheumatic Diseases Eular, 1302 p.
- Bliddal H., Rosetzsky A., Schlichting P. et al. (2000) A randomized, placebo–controlled, crossover study of ginger extracts and Ibuprofen in osteoarthritis. Ed. H. Bliddal. Osteoarthritis Cartilage, 8: 9–12.
- Bruyere O., Cooper C., Pelletier J.P. (2014) An algorithm recommendation for the management of knee osteoarthritis in Europe and internationally: A report from a task force of the European Society for Clinical and Economic Aspects of Osteoporosis and Osteoarthritis (ESCEO). Semin. Arthritis Rheum., 44(3): 253–263.
- Burt H.M., Dutt Y.C. (1986) Growth of monosodium urate monohydrate crystals: effect of cartilage and synovial fluid components on in vitro growth rates. Ann. Rheum. Dis., 45: 858–864.
- Centers for Disease Control and Prevention (CDC) (2001) Prevalence of disabilities and associated health conditions among adults — United States, 1999. MMWR Morb. Mortal. Wkly Rep., 50(7): 120–125.
- Denoble A.E., Huffman K.M., Stabler T.V. (2011) Uric acid is a danger signal of increasing risk for osteoarthritis through inflammasome activation. Proc. Natl. Acad. Sci USA, 108: 2088–2093.
- Ding X., Zeng C. (2016) The associations of serum uric acid level and hyperuricemia with knee osteoarthritis. Rheumatol. Int., 36(4): 567–573.
- Frondoza C.G., Sohrabi A., Polotsky A. et al. (2004) An in vitro screening assay for inhibitors of proinflammatory mediators in herbal extracts using human synoviocyte cultures in vitro. Cell. Dev. Biol. Anim., 40: 95–101.
- Haghighi M., Khalvat A., Toliat T., Jallaei S. (2005) Comparing the effects of ginger (Zingiber officinale) extract and ibuprofen on patients with. Arch. Iran. Med., 8: 267–271.
- Henrotin Y. (2010) Review: Advances in the Treatment of Osteoarthritis and the Role of Chondroitin Sulphate. Europ. Musculoskel. Rev., 5(2): 11–17.
- Herrero-Beaumont G., Ivorra J.A., DelCarmen Trabado M.C. et al. (2007) Glucosamine sulfate in the treatment of knee osteoarthritis symptoms: a randomised, double-blind, placebo-controlled study using acetaminophen as a side comparator. Arthritis Rheum., 56: 555–567.
- Hochberg M.C. (2008) Mortality in osteoarthritis. J. Clin. Exp. Rheumatol., 26: 120–124.
- Hochberg M.C. (2010) Structure-modifying effects of chondroitin sulfate in knee osteoarthritis: an updated meta-analysis of randomized placebo-controlled trials of 2-year duration. Osteoarthritis Cartilage, 18: 28–31.
- Howcroft T.K., Campisi J., Louis G.B. et al. (2013) The role of inflammation in age-related disease. Aging (Albany NY), 5(1): 84–93.
- Jordan K.M., Arden N.K., Doherty M. (2003) EULAR Recommendation 2003: an evidence based approach to the management of knee osteoarthritis: Report of a Task Force of the Standing Committee for International Clinical Studies Including Therapeutic Trials (ESCISIT). Ann. Rheum. Dis., 62: 1145–1155.
- Kahan A., Uebelhart D., De Vathaire F. et al. (2009) Long-term effects of chondroitins 4 and 6 sulfate on knee osteoarthritis: the study on osteoarthritis progression prevention, a two-year, randomized, double-blind, placebo-controlled trial. Arthritis Rheum., 60: 524–533.
- Lane N.E., Brandt K., Hawker G. et al. (2011) OARSI-FDA initiative: defining the disease state of Osteoarthritis. Osteoarth. Cartil., 19(5): 478–482.
- Laurent T.C. (1964) Solubility of sodium urate in the presence of chondroitin-4-sulphate. Nature, 202: 1334.
- Lee J.Y., Harvey W.F., Price L.L. et al. (2013) Relationship of bone mineral density to progression of knee osteoarthritis. Arthritis Rheum., 65: 1541–1546.
- McAlindon T.E., Bannuru R.R., Sullivan M.C. (2014) OARSI guidelines for the non-surgical management of knee osteoarthritis. Osteoarthritis Cartilage, 22(3): 363–388.
- McCulloch D.R., Wylie J.D., Longpre J.M. et al. (2010) 10 mM glucosamine prevents activation of proADAMTS-5 (aggrecanase 2) in transfected cells by interference with post translational modification of furin. Osteoarthritis Cartilage, 18(3): 455–463.
- Michel B.A., Stucki G., Frey D. (2005) Chondroitin 4 and 6 sulfate in osteoarthritis of the knee: A randomized, controlled trial. Arthritis Rheum., 52(3): 779–786.
- Nü esch E., Dieppe P., Reichenbach S. et al. (2011) All cause and disease specific mortality in patients with knee or hip osteoarthritis: population based cohort study. BMJ, 342: d1165.
- Pavelka K., Gatterova J., Olejarova M. et al. (2002) Glucosamine sulfate use and delay of progression of knee osteoarthritis: a 3-year, randomized, placebo-controlled, double-blind study. Arch. Intern. Med., 162: 2113–2123.
- Plotnikoff R. (2015) Osteoarthritis prevalence and modifiable factors: a population study. BMC Public Health, 15: 1195.
- Ramos-Zavala M G., González-Ortiz M., Martínez-Abundis E. et al. (2011) Effect of diacerein on insulin secretion and metabolic control in drug-naïve patients with type 2 diabetes. Diabetes Care, 34(7): 1591–1594.
- Rani M.P., Krishna M.S., Padmakumari K.P. et al. (2012) Zingiber officinale extractexhibits antidiabetic potential via modulating glucose uptake, protein glycation and inhibiting adipocyte differentiation: Anin vitro study. J. Sci. Food Agric., 92: 1948–1955.
- Reginster J.Y., Deroisy R., Rovati L.C. et al. (2001) Long-term effects of glucosamine sulfate on osteoarthritis progression: a randomized, placebo-controlled clinical trial. Lancet, 357: 251–256.
- Richette P., Funk-Brentano T. (2010) What is new on the ostheoarthritis front? Eur. Musculoskeletal Rev., 5(2): 8–10.
- Richette P., Poitou C., Garnero P. (2011) Benefits of massive weight loss on symptoms, systemic inflammation and cartilage turnover in obese patients with knee osteoarthritis. Ann. Rheum. Dis., 1(70): 139–144.
- Sandy J.D., Gamett D., Thompson V., Verscharen C. (1998) Chondrocyte mediated catabolism of aggrecan: aggrecanase dependent cleavage induced by interleukin 1 or retinoic acid can be inhibited by glucosamine. Biochem. J., 335(1): 59–66.
- Sellam J., Berenbaum F. (2013) Is osteoarthritis a metabolic disease? Joint Bone Spine, 80(6): 568–573.
- Sharma L. (2016) Osteoarthritis year in review 2015: clinical. Osteoarthritis Cartilage, 24(1): 36–48.
- Shikhman A.R., Kuhn K., Alaaeddine N., Lotz M. (2001) N-acetylglucosamine prevents IL-1 beta-mediated activation of human chondrocytes. J. Immunol., 166(8): 5155–5160.
- Suekawa M., Ishige A., Yuasa K. (1984) Pharmacological studies of ginger. I. Pharmacological actions of pungent constituents, (6)-gingerol and (6)-shogaol. J. Pharmacobiodyn., 7: 836–848.
- Sun Y., Brenner H., Sauerland S. (2000) Serum uric acid and patterns of radiographic osteoarthritis — the Ulm osteoarthritis study. Scand. J. Rheumatol., 29: 380–386.
- Tat S.K., Pelletier J.P., Vergés J. et al. (2007) Chondroitin and glucosamine sulfate in combination decrease the pro resorptive properties of human osteoarthritis subchondral bone osteoblasts: a basic science study. Arthritis Res. Ther., 9(6): 117.
- Tedgui A., Mallat Z. (2006) Cytokines in atherosclerosis: pathogenic and regulatory pathways. Physiol. Rev., 86(2): 515–581.
- Towheed T., Maxwell L., Anastassiades T.P. et al. (2009) Glucosamine therapy for treating osteoarthritis. Cochrane Database Syst. Rev., 2. CD002946.
- Tzeng T.F., Liu I.M. (2013) 6-gingerol preventsadipogenesis and the accumulation of cytoplasmic lipiddroplets in 3T3-L1 cells. Phytomedicine, 20: 481–487.
- Tzeng T.F., Chang C.J., Liu I.M. (2014) 6-gingerolinhibits rosiglitazone-induced adipogenesis in 3T3–L1adipocytes. Phytother. Res., 28: 187–192.
- Uitterlinden E.J., Koevoet J.L., Verkoelen C.F. et al. (2008) Glucosamine increases hyaluronic acid production in human osteoarthritic synovium explants. BMC Musculoskelet Disord., 9: 120.
- Valvason C., Musacchio E., Pozzuoli A. et al. (2008) Influence of glucosamine sulphate on oxidative stress in human osteoarthritic chondrocytes: effects on HO 1, p22 (Phox) and iNOS expression. Rheumatology (Oxford), 47(1): 31–35.
- Wigler I., Grotto I., Caspi D., Yaron M.(2003) The effects of Zintona EC (a ginger extract) on symptomatic gonarthritis. Osteoarthritis Cartilage, 11(11): 783–789.
- Wildi L. (2011) Chondroitin sulphate reduces both cartilage volume loss and bone marrow lesions in knee OA patients starting as early as 6 months after initiation of therapy: a randomized, double-blind, placebo controlled pilot study using MRI. Ann. Rheum. Dis., 70: 982–989.
- Wim J. van Blitterswijk, Jos C.M. van de Nes, Paul I.J.M. Wuisman (2003) Glucosamine and chondroitin sulfate supplementation to treat symptomatic disc degeneration: Biochemical rationale and case report. BMC Complement Altern. Med., 3: 2.
- Zakeri Z., Izadi S., Bari Z. et al. (2011) Evaluating the effects of ginger extract on knee pain, stiffness and difficulty in patients with knee osteoarthritis. J. Med. Plants Res., 5: 3375–3379.
- Zhang W., Doherty M., Arden N. et.al. (2005) EULAR evidence based recommendations for the management of hip osteoarthritis: report of task force of the EULAR Standing Committee for International Clinical Studies Including Therapeutic (ESCISIT). Ann. Rheum. Dis., 64: 669–681.
- Zhang W., Doherty M., Leeb B.F. et al. (2007) EULAR evidence based recommendations for the management of hand osteoarthritis: report of a task force of the EULAR Standing Committee for International Clinical Studies Including Therapeutics (ESCISIT). Ann. Rheum. Dis., 66: 377–388.
- Zhang W., Nuki G., Moskowitz R.W. et al. (2010) OARSI recommendations for the management of hip and knee osteoarthritis: part III: Changes in evidence following systematic cumulative update of research published through January 2009. Osteoarthritis and Cartilage., 18, Iss. 4, Publisher: Elsevier Ltd., р. 476–499.
Дифференцированный подход к лечению остеоартроза с коморбидной патологией
Резюме. В статье представлена характеристика наиболее распространенных лекарственных средств при лечении пациентов с остеоартрозом — нестероидных противовоспалительных препаратов и симптоматических противовоспалительных препаратов, в частности нимесулида, мелоксикама, диацереина, хондроитин сульфата, глюкозамина сульфата, экстракта корня имбиря. Выявлена их эффективность по показателям суставного синдрома, а именно ВАШ, индексов Лекена, WOMAC. Исследовано влияние на уровень цитокинов (IL-1β, TNF-α, IGF-1, TGF-β), свободных радикалов (NO), а также возможность применения при коморбидной патологии и влияние на показатели пуринового, углеводного, липидного обменов.
остеоартрит, противовоспалительный эффект, сопутствующие заболевания, нимесулид, диацереин, хондроитин сульфат.
Адреса для листування:
Шуба Неоніла Михайлівна
04112, Київ, вул. Дорогожицька, 9
Національна медична академія
післядипломної освіти
ім. П.Л. Шупика

Leave a comment