КОМОРБІДНІСТЬ: ВИЗНАЧЕННЯ, МОЖЛИВІ НАПРЯМКИ ДІАГНОСТИКИ ТА ЛІКУВАННЯ
Коваленко В.М., Борткевич О.П.
Резюме. Надані визначення та сучасні уявлення про коморбідність як поєднання різних хвороб, що об’єднані спільними патогенетичними механізмами. Особлива увага приділена серцево-судинній та ревматологічній патології, віковим аспектам і психосоціальним факторам, які є визначальними у розвитку коморбідних станів.
Регламент сучасної клінічної медицини базується на настановах, протоколах та стандартах, розроблених на основі доказової медицини.
Доказова медицина стандартизувала і регламентувала медицину на основі детального вивчення окремих нозологічних захворювань або їх дефініцій, що сприяло створенню і втіленню протоколів та стандартів. Поряд з тим поза межами доказової медицини залишилася проблема одночасного поєднання різних хвороб організму людини, в тому числі коморбідність (з лат. со — разом + morbus — хвороба) — наявність декількох хронічних захворювань, пов’язаних між собою єдиним патогенетичним механізмом. У зв’язку з цим набуває особливої уваги також проблема персоніфікації пацієнта щодо коморбідності. Ця проблема хвилювала мислячу частину лікарського суспільства протягом багатьох років. Свідчення цьому — велика кількість назв, якими лікарі в історичному аспекті визначали цей термін: поліморбідність, мультиморбідність, мультифакторність, системність уражень, поліпатія, подвійний діагноз, плюрипатологія — та багато інших.
На наш погляд, з вищенаведеного, термін «системність уражень» найбільшою мірою відповідає ураженням органів і тканин, перш за все, при ревматичних хворобах.
Видатний американський лікар-епідеміолог Alvan R. Feinstein (1925–2001) увів поняття «коморбідність» (лат. со — разом, morbus — хвороба). У цей термін він вкладав наявність додаткової клінічної картини, що вже існує, або може проявитися самостійно, незалежно від основного захворювання, та завжди відрізняється від останнього. Коморбідність — сполучення в одного пацієнта двох і/чи більше хронічних захворювань, що патогенетично пов’язані між собою, чи зіставні за часом в одного пацієнта, поза залежністю від активності кожного з них (Kraemer H.C., 1995; van den Akker М., 1996).
Таким чином, коморбідність — це не просто поєднання декількох хвороб, вона передбачає наявність нових механізмів розвитку хвороб, додаткової клінічної картини, ускладнень та перебігу, не властивих основній хворобі, а також суттєвий вплив на якість і тривалість життя.
Дискусійним є питання, чи можуть бути результати доказової медицини, які отримані на рандомізованих, селективно відібраних когортах хворих, перенесені на загальну популяцію хворих з одним і тим же захворюванням, але з безліччю дефініцій, пов’язаних як з коморбідністю, так і поєднанням хвороб, особливо з наявністю технічних пристроїв, які повністю або частково замінюють окремі органи або частини тіла, а також пацієнтів із трансплантованими органами. Кількість цих пацієнтів прогресивно зростає.
Необхідно також розділяти наявну сукупність хвороб у окремого пацієнта і коморбідність як дві окремі проблеми сучасної медицини. Вони потребують нових методологічних підходів діагностики й лікування та застосування цифрових технологій і штучного інтелекту.
Актуальність проблеми коморбідності базується на таких обставинах:
1. Поєднання поширених хронологічно зумовлених (вікових) хвороб у людей середнього і старшого віку.
2. Диференціація лікарів-спеціалістів і концентрація їх знань та професійної діяльності згідно з протоколами і стандартами щодо окремих найпоширеніших хвороб. Дефіцит знань та професійних навичок лікарів-спеціалістів у загальних питаннях навіть найбільш поєднаних захворювань.
3. Реальна відсутність командного принципу діагностики та лікування, а також недостатня кількість нормативних документів щодо поєднання та коморбідності хвороб організму людини як на міжнародному рівні, так і в Україні.
4. Недостатній рівень підготовки стосовно коморбідності лікарів первинної ланки.
5. Обмежена кількість фундаментальних досліджень щодо механізмів розвитку, обґрунтування та прогнозування коморбідності. Здебільшого вона діагностується за фактом клінічно реалізованої маніфестації.
Коморбідна патологія: гіпотези щодо співіснування хвороб
На думку E. Nüesch та співавторів (2011), C. Cadet та співавторів (2015), вікзалежні хвороби можуть накопичуватися незалежно у процесі старіння. Захворювання можуть мати взаємний вплив та потенціювати розвиток одне одного, крім того, вони можуть мати спільні патофізіологічні механізми патогенезу.
Загальноприйнятим є факт, що коморбідна патологія істотно посилює біль, погіршує фізичну функцію та підвищує на 55% смертність у хворих на остеоартрит (ОА), що в основному спричинена серцево-судинною патологією (Nüesch E. et al., 2011).
Результати аналізу коморбідності в 10-річному популяційному австралійському дослідженні свідчать, що кількість коморбідних станів суттєво підвищується з віком — від 10% у осіб віком до 19 років до 80% в осіб віком ≥80 років. Крім того, серед пацієнтів із серцево-судинними хворобами 60% мають артрит, 20% — діабет, 10% — астму чи психічні розлади (Caughey G.E. et al., 2008).
Серед основних хвороб організму людини в Україні найбільшу частку коморбідних станів становлять патології системи кровообігу, органів дихання і травлення, хвороби кістково-м’язової та ендокринної систем (табл. 1).
| Нозології | Абс. дані | На 100 тис. |
|---|---|---|
| Хвороби системи кровообігу | 26 123 952 | 69 488 |
| Гіпертонічна хвороба (усі форми) | 12 292 642 | 32 697 |
| Ішемічна хвороба серця | 8 843 165 | 23 455,8 |
| Гострий інфаркт міокарда | 50 004 | 132,6 |
| Інсульти (усі форми) | 110 753 | 294,6 |
| Хвороби кістково-м’язової системи та сполучної тканини | 3 927 304 | 10 411,5 |
| у тому числі ревматоїдний артрит (РА) | 116 492 | 309,0 |
| Артроз | 1 275 265 | 3382,5 |
| у тому числі деформуючий артроз | 922 849 | 2447,8 |
| сольові артропатії | 92 782 | 234,0 |
| Системний червоний вовчак (СЧВ) | 6605 | 14,4 |
| Хвороби органів травлення | 7 037 769 | 18 667,1 |
| Хвороби стравоходу, шлунка та дванадцятипалої кишки | 1 044 245 | 2769,8 |
| Хвороби органів дихання | 9 230 648 | 24 483,5 |
| бронхіт хронічний | 1 129 074 | 2994,8 |
| бронхіальна астма | 191 006 | 506,6 |
| Хвороби ендокринної системи, розладу харчування та порушення обміну речовин | 3 072 738 | 8150,2 |
| Цукровий діабет | 1 264 500 | 2773,1 |
| Усі причини | 69 458 403 | 184 754,9 |
*Близько 30 млн дорослого населення за даними 2012 р.
Коморбідність: уніфікація визначень та понять
- Причина: викликана паралельним ураженням різних органів і систем, яка зумовлена єдиним патологічним агентом, наприклад системне ураження при системних захворюваннях сполучної тканини (СЗСТ), або алкогольна вісцеропатія у пацієнтів із хронічною алкогольною інтоксикацією.
- Ускладнена: є результатом основного захворювання і зазвичай послідовно через деякий час після його дестабілізації виявляється у вигляді ураження органів-мішеней. Приклад: хронічна ниркова недостатність внаслідок діабетичної нефропатії у хворих на цукровий діабет ІІ типу або ж розвиток інфаркту головного мозку в результаті ускладненого гіпертонічного кризу у пацієнтів із гіпертонічною хворобою.
- Ятрогенна: виявляється при вимушеній негативній дії лікаря щодо пацієнта, за умови заздалегідь встановленої небезпеки тієї чи іншої медичної процедури. Приклад: глюкокортикоїд (ГК)-індукований остеопороз, лікарський гепатит у результаті хіміопрофілактики туберкульозу легень, що призначена з приводу віража туберкулінових проб.
- Неуточнена: припускає наявність єдиних патогенетичних механізмів розвитку захворювань, що є складовими, але потребує проведення ряду досліджень, які підтверджують гіпотезу дослідника чи клініциста. Приклад: розвиток еректильної дисфункції у пацієнтів з атеросклерозом і артеріальною гіпертензією; ерозивно-виразкові ураження слизової оболонки верхніх відділів шлунково-кишкового тракту у хворих, які застосовують нестероїдні протизапальні препарати (НПЗП)/ГК.
- Випадкова: наприклад поєднання ішемічної хвороби серця і жовчнокам’яної хвороби або ж комбінація придбаної вади серця і псоріазу. Проте «випадковість» і на перший погляд алогічність цих комбінацій незабаром можуть бути пояснені з клінічних і наукових позицій.
Методи оцінки коморбідності з метою стандартизації наукових досліджень (Peterson J.C. et al., 2011):
- Індекс Чарлсона (Charlson Index) використовують для прогнозу летальності.
- Кумулятивна шкала рейтингу захворювань (Cumulative Illness Rating Scale — Сirs) оцінює всі системи організму без специфічних діагнозів.
- Індекс поєднаної хвороби (Index of Coexisting Disease — ICED) враховує тяжкість захворювання і непрацездатність.
Одним із широко використовуваних методів оцінки коморбідності є індекс Чарлсона (рис. 1).

Звичайно, з віком характер та вираженість супутніх хвороб змінюється: вік є незалежним фактором ризику коморбідних станів (Barnett K. et al., 2012). Поширеність коморбідності становить 62% серед осіб віком 65–74 років та 82% — старше 85 років (Boyd C.D. et al., 2012). Якість і прогноз життя людей похилого віку визначаються, перш за все, наявністю і вираженістю геріатричних синдромів, а не хронічними захворюваннями (Fried L.P. et al., 2001).
Вікзалежні хвороби можуть накопичуватися незалежно у процесі старіння; захворювання можуть мати взаємний вплив та потенціювати розвиток одне одного; захворювання можуть мати спільні патофізіологічні механізми патогенезу (Cadet C. et al., 2015). Коморбідна патологія істотно посилює біль, погіршує фізичну функцію та підвищує на 55% смертність у пацієнтів із найпоширенішим захворюванням опорно-рухового апарату — ОА, що в основному спричинена серцево-судинною патологією (Nüesch E. et al., 2011).
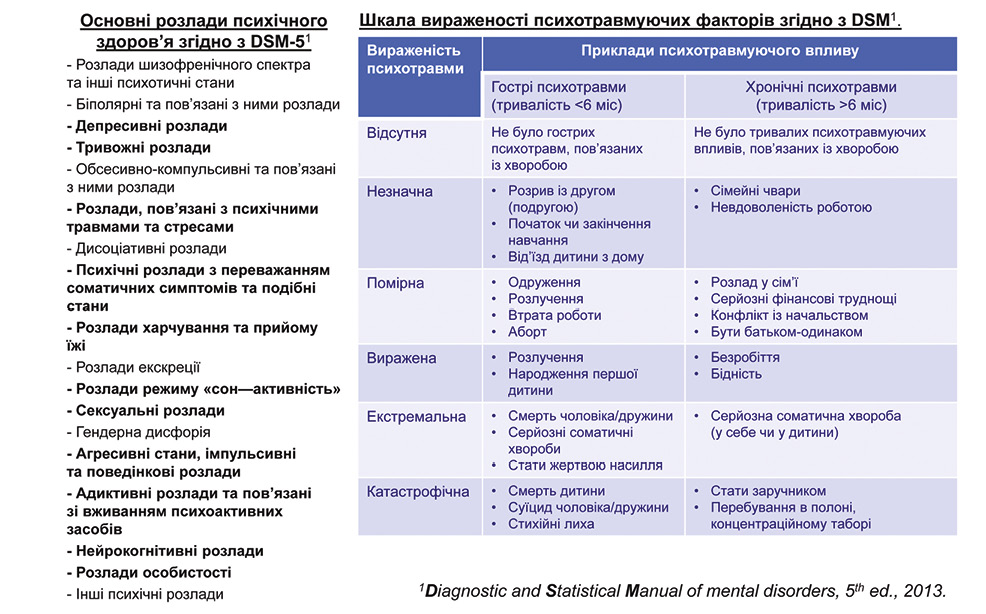
Геріатричний синдром — багатофакторний вікасоційований клінічний стан, який підвищує ризик несприятливих наслідків (смерть, повторні госпіталізації, залежність від сторонньої допомоги, потреба у тривалому догляді тощо) та функціональних порушень (Diagnostic and Statistical Manual of mental disorders, fifth edition, 2013).
Основні геріатричні синдроми: деменція, деліріум, неутримання, падіння, порушення ходьби, запаморочення, синкопе, порушення слуху, порушення зору, остеопенія, порушення харчування, сну та поведінки, пролежні, старість (R54 за Міжнародною класифікацією хвороб 10-го перегляду (МКХ-10), стареча астенія, дряхлість — як кардинальний стан для модифікації всієї служби охорони здоров’я. На відміну від традиційного клінічного синдрому, геріатричний синдром відображає сукупність змін у декількох системах організму, а не є проявом патології одного органа чи системи організму. Відомо, що повний геріатричний синдром або його компоненти тісно пов’язані з коморбідністю (поліморбідністю) (Tinetti M.E. et al., 2000).
На наш погляд, вікова еволюція коморбідності виглядає так (зазначимо, що вікові категорії носять умовну градацію, можуть не відповідати геріатричним стандартам та мають свої особливості для країн з різною тривалістю життя) (Barnett K. et al., 2012; Boyd C.D. et al., 2012):
- Вікова категорія до 50 років: вплив факторів ризику, в тому числі поведінковий, які формують плацдарм коморбідності на рівні загального гомеостазу організму (імунна, кровотворна система, обмін речовин, кисню, запальні процеси низьких градацій, генетична та спадкова схильність тощо).
- Вікова категорія до 70 років: негативний вплив біологічних вікових факторів старіння (імунний та гормональний дисбаланс, функціональні та патологічні порушення системного гомеостазу. Реалізація генетичних та спадкових програм розвитку окремих неінфекційних хвороб, виникнення та загострення захворювань та в кінцевому етапі — формування коморбідності).
- Вікова категорія старше 70 років: реалізовані стадії коморбідності з ускладненнями.
- Вікова категорія старше 80 років: резистентні до лікування стани коморбідності та фатальні ускладнення.
Згідно з даними доказової медицини, вік є незалежним фактором ризику коморбідних станів (Barnett K. et al., 2012), причому поширеність коморбідності зростає з віком і становить 62% серед осіб віком 65–74 років та 82% — старше 85 років (Barnett K. et al., 2012; Boyd C.D. et al., 2012).
Важливим аспектом формування коморбідності є психосоціальні розлади, які зумовлюють суттєвий несприятливий вплив на ризик розвитку, перебіг та прогноз серцево-судинних захворювань, особливо в осіб із соціально значимими серцево-судинними захворюваннями та груп високого серцево-судинного ризику (Piepoli M.F. et al., 2016).
До найбільш значимих посттравматичних стресових розладів відносяться: психічні розлади, в тому числі посттравматичні стресові розлади, низький соціально-економічний статус, соціальна ізоляція, хронічний стрес на роботі та в сім’ї, депресія, тривожність (типовими складовими тривоги є страх, сором, відчуття провини, перенос негативних емоцій з минулого у сьогодення, створення негативної моделі майбутнього) тощо (рис. 2). Посттравматичні стресові розлади пов’язані з поведінковими факторами ризику серцево-судинних захворювань: нездоровим способом життя — куріння, алкоголь, неправильне харчування, гіподинамія тощо.
Прихильність до лікування як фактор прогнозу у коморбідних хворих
Низька прихильність до лікування є однією з головних причин зменшення вираженості терапевтичного ефекту, значного підвищення ризику розвитку ускладнень основного захворювання та прогресування коморбідних хвороб, зниження якості життя та підвищення вартості лікування (Koch-Weser S. et al., 2009). Оцінка прихильності пацієнта до лікування за своєю значимістю не поступається клінічній, лабораторно-інструментальній оцінці хворого, а при виборі схем лікування — суттєво впливає на ефективність та безпеку останніх. Прихильність до лікування має визначатися до його призначення («потенційна» прихильність) та впродовж лікування (фактична прихильність), тобто реальне виконання пацієнтом лікарських рекомендацій.
Комплаєнс лікаря та пацієнта із психосоціальною коморбідністю (Wright V., Hopkins R., 1977; Koch-Weser S. et al., 2009): приділяти достатньо часу пацієнту, уважно слухати та повторювати суттєві ключові слова; враховувати психосоціальні та культуральні аспекти, залежні від віку, статі, рівня освіти та соціального статусу; підтримувати висловлювання емоцій, не спрощувати психосоціальні труднощі та проблеми пацієнта; пояснювати важливу медичну інформацію на доступному пацієнту рівні, виражати надію та допомагати звільнитися від почуття провини, підтримувати у діях; з’ясовувати преференції в лікуванні та приймати спільні рішення щодо подальших діагностичних та лікувальних дій; узагальнювати важливі моменти консультації з метою підтвердження їх усвідомлення пацієнтом; пропонувати пацієнту регулярне спостереження; за необхідності рекомендувати консультацію психотерапевта/психіатра.
У віковому аспекті наявними проблемами коморбідності є: поєднання поширених хронічних хвороб у людей середнього та старшого віку, щорічне прогресуюче збільшення медичної спеціалізованої інформації та складність використання на первинному рівні, диференціація лікарів-спеціалістів та концентрація їх знань і професійної діяльності згідно з протоколами і стандартів щодо окремих найпоширеніших хвороб. Крім того, є дефіцит знань та професійних навичок лікарів-спеціалістів у загальних питаннях навіть щодо найбільш поєднаних захворювань.
Реальна відсутність командного принципу діагностики та лікування, а також недостатня кількість нормативних документів щодо поєднання та коморбідності хвороб організму людини як на міжнародному рівні, так і в Україні, веде до недостатнього рівня підготовки відносно коморбідності лікарів первинної ланки. Обмежена кількість фундаментальних досліджень щодо механізмів розвитку, обґрунтування та прогнозування коморбідності (здебільшого вона діагностується за фактом клінічно реалізованої маніфестації) є причиною недостатності даних доказової медицини щодо поєднання хвороб внутрішніх органів.
Концепція методології прогнозування та визначення статусу коморбідності може бути сформована таким чином: визначається патогенетична платформа коморбідності як плацдарм, на якому в майбутньому формується нова або прогресує існуюча хвороба (порушення гомеостазу, імунний статус, спадковість, генетика, професійні особливості, соціум (сім’я, умови життя, етнічність, географія проживання), вікові особливості, базове гостре (хронічне) захворювання, наявна сукупність захворювань, відомі взаємно індуковані негативні наслідки, прогнозовані прояви коморбідності, конкретне визначення проявів коморбідності), неадекватна маніфестація та прогресування окремих симптомів, не властивих окремій хворобі, непрогнозовані ускладнення, не властиві основній хворобі.
Необхідно враховувати, що визначення коморбідності має розглядатися не ретроспективно, а проспективно.
Можливі шляхи запобігання та лікування коморбідності:
- Прогнозування розвитку коморбідності на основі відомих даних, в тому числі доказової медицини.
- Обґрунтований вибір фармакотерапії на основі доказової медицини та фармакотерапевтичних особливостей лікарських засобів.
- Генетика і спадковість.
- Профілактична фармакотерапія: протитуберкульозні, антивірусні засоби, антиаритмічні, антиатеросклеротичні тощо.
- Вакцинація.
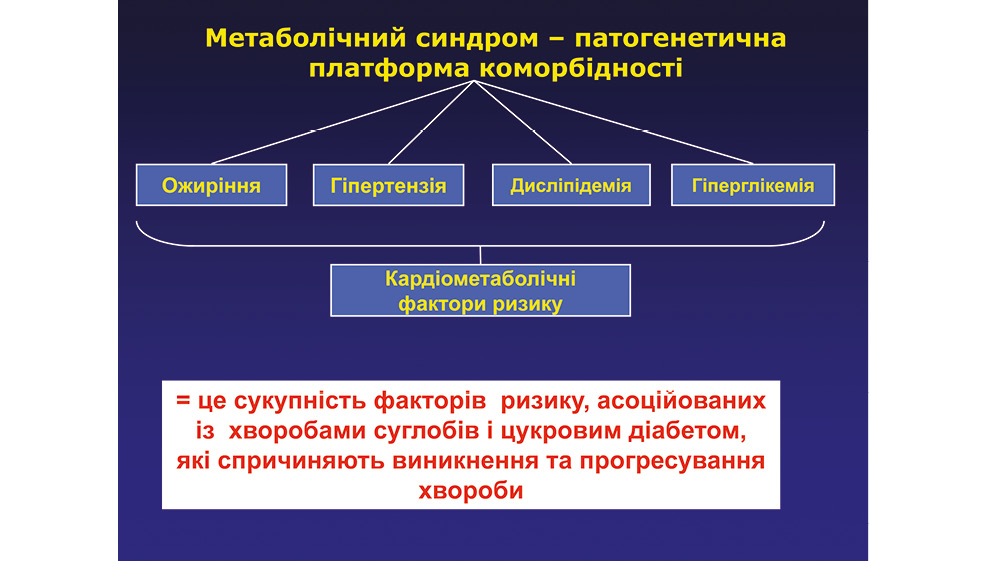
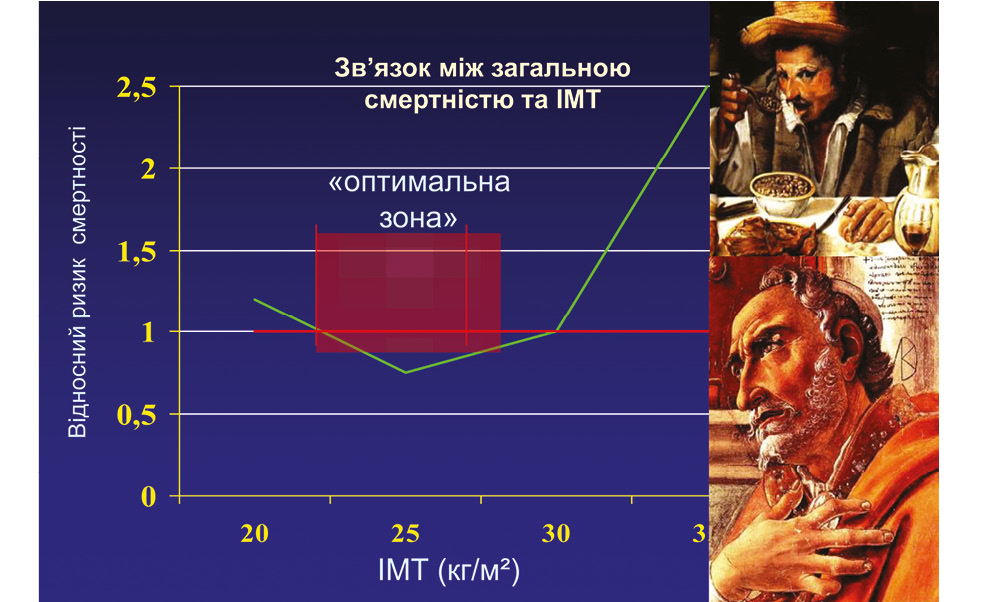
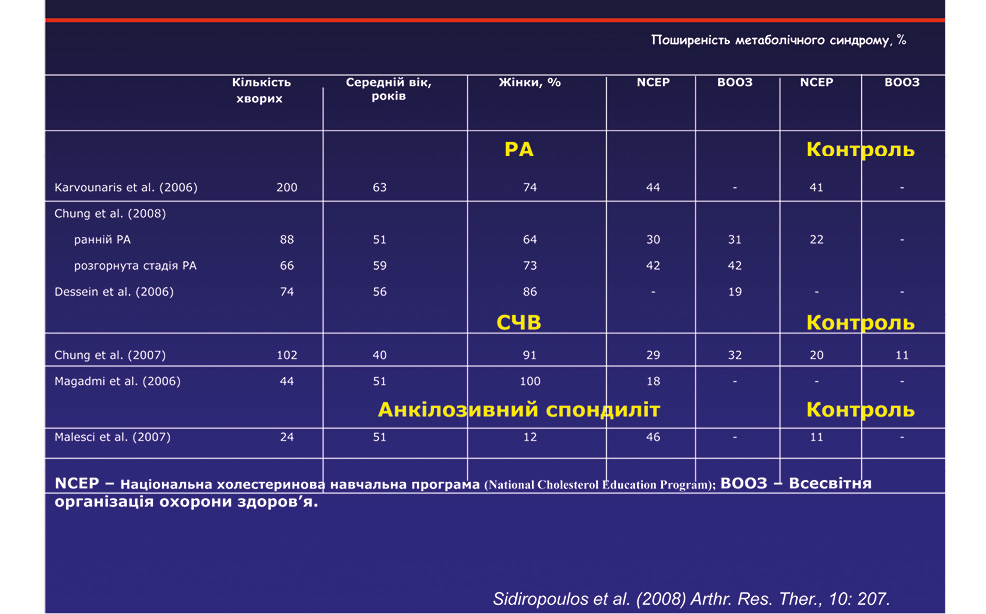
Метаболічний синдром — патогенетична платформа коморбідності (рис. 3–5): ожиріння, гіпертензія, дисліпідемія, гіперглікемія, кардіометаболічні фактори ризику — це сукупність факторів ризику, асоційованих із хворобами суглобів і цукровим діабетом, які спричиняють виникнення та прогресування хвороби.
Ревматичні хвороби та коморбідність
Системне аутоімунне запалення — загальна біологічна платформа коморбідності (Szekanecz Z., Koch A.E., 2008). Серед основних механізмів та медіаторів системного запалення при ревматичних хворобах зазначимо: білки гострої фази відповіді (C-реактивний білок, фібриноген), ліпопротеїн (a), дефіцит фолієвої кислоти та вітаміну В12, CD4/CD28 T-клітини, аутоантитіла (антитіла до циклічного цитрулінового пептиду, ревматоїдний фактор, анти-охLDL (anti-oxidized low density lipoprotein), антифосфоліпідні антитіла, анти-Hsp), проатерогенні цитокіни (фактор некрозу пухлини (ФНП)-α, інтерлейкін (ІЛ)-6): хемокіни, ангомогенні фактори росту, металопротеїнази деградації матриксу, молекулярна експресія, що підвищує клітинну адгезію, гіпергомоцистеїнемія, порушення апоптозу тощо.
Найчастіші патологічні стани, що супроводжують хронічний запальний процес: серцево-судинні захворювання (метаболічний синдром, атеросклероз), інфекції (властиві для захворювання/зумовлені терапією), остеопороз: (остеоімунологія, наприклад RANKL/OPG), психічні порушення (первинні чи вторинні), онкогенез (властивий хворобі/зумовлений терапією), соціоекономічні хвороби.
Багатьма авторами визначено патогенетичні зв’язки запалення й атеросклерозу (Libby P., 1995; Ross R., 1999), а саме: запалення може визначати стабільність бляшки (в «нестабільній бляшці» за рахунок збільшення кількості лейкоцитарних інфільтратів, в ділянці розриву домінують Т-клітини та макрофаги, цитокіни та металопротеїнази впливають на «стабільність» та деградацію фіброзної «кришки», зниження рівня ліпідів приводить до зменшення інтенсивності запалення бляшки.
Хронічний біль як окрема коморбідність
- Хронічний біль — це окрема нозологічна одиниця. Очікувана МКХ-11 вже містить 6 градацій хронічного болю. Поширеність болю набула загрозливих масштабів пандемії. Негативний вплив чинять урбанізація населення, малорухливий спосіб життя, зміна рухливих стереотипів, характеру харчування та інші фактори.
- Хронічний біль, на відміну від гострого, який виконує фізіологічну функцію, є патологічним станом, який призводить до постійних страждань пацієнта, що посилюються з часом, формування гіпералгезії та алодинії, ускладнює лікування коморбідних хвороб.
- Лікування пацієнтів із хронічним болем полягає у мультимодальному підході, який поряд із фармакотерапією передбачає навчання пацієнта, фізичну реабілітацію, психотерапію, когнітивну терапію, психологічну підтримку, соціальну адаптацію, мануальну терапію, медитацію, релаксацію тощо.
Важливу роль у розвитку коморбідності відіграють також системні метаболічні порушення, наприклад, порушення обміну сечової кислоти, яке тісно пов’язане з іншими метаболічними порушеннями, порушення вуглеводного обміну (знижена толерантність до глюкози, спостерігається у 7–74% хворих), порушення ліпідного обміну (гіперхолестеринемія, гіпертригліцеридемія — у 50–75% хворих), артеріальна гіпертензія (25–50% хворих). Зазначимо, що такі порушення спостерігаються як на стадії гіперурикемії, так і на фоні клінічно маніфестованого подагричного поліартриту. Крім того, серед причин смерті хворих на подагру більше половини становлять серцево-судинні захворювання.
Фармакотерапія в ревматології як платформа коморбідності
Деякі лікарські засоби, що застосовують у лікуванні при ревматичних хворобах, є причиною виникнення побічних явищ, перш за все, з боку органів травлення та серцево-судинної системи (Peters M.J. et al., 2010) (табл. 2). НПЗП — неселективні та селективні інгібітори циклооксигенази-2 можуть при нераціональному застосуванні бути причиною таких станів, як патологія шлунково-кишкового тракту — виразки з кровотечею чи перфорацією, хронічна серцева недостатність, артеріальна гіпертензія, гострий коронарний синдром (Peters M.J. et al., 2010). Роль коксибів та більшості НПЗП як факторів серцево-судинного ризику досі остаточно не встановлена та потребує подальшого вивчення. Отже, потрібно бути досить обережним у призначенні їх пацієнтам, особливо у разі наявності вже задокументованого серцево-судинного захворювання або за наявності серцево-судинних факторів ризику (категорія С). ГК мають застосовуватись у максимально можливо найнижчих дозах (категорія С). Імуносупресанти також можуть бути причиною атеросклерозу, артеріальної гіпертензії, хронічної серцевої недостатності. Для модифікуючих структуру кісткової та хрящової тканини препаратів (так званих хондропротекторів) зв’язок не встановлений.
| Препарати | Позитивні ефекти | Негативні ефекти |
|---|---|---|
| НПЗП | Протизапальний ефект. Нормалізація вазодилатації (целекоксиб). Відміна НПЗП приводить до підвищення частоти гострого інфаркту міокарда при ревматичних хворобах (за даними клінічних досліджень) | Підвищення артеріального тиску. Затримка рідини. Порушення ритму серця. За епідеміологічними даними можуть підвищувати ризик кардіоваскулярних катастроф |
| ГК | Пригнічення синтезу прозапальних/проатерогенних медіаторів. Корекція дисліпідемії. Покращує вазодилатацію. Зниження резистентності до інсуліну | Підвищення артеріального тиску. Затримка рідини. Гіперглікемія. Ожиріння. Тривалий прийом у високих (>10 мг) дозах асоціюють зі збільшенням частоти кардіоваскулярних катастроф і декомпенсації серцевої недостатності (за даними клінічних досліджень) |
| Гідроксихлорохін | Корекція дисліпідемії, гіперглікемії. Помірний антитромботичний ефект. Зниження ризику розвитку цукрового діабету при РА, серцево-судинних катастроф при РА і СЧВ. Потенційно показаний усім пацієнтам із ревматичними хворобами, які одержують ГК, а також при антифосфоліпідному синдромі | Немає даних доказової медицини |
| Метотрексат | Зниження ризику кардіоваскулярних катастроф | Гіпергомоцистеїнемія |
| Циклоспорин | Пригнічення запалення і активації Т-клітин | Артеріальна гіпертензія. Порушення ниркової функції |
| Лефлуномід | Пригнічення запалення і активації Т-лімфоцитів | Артеріальна гіпертензія |
| Інгібітори ФНП | Зниження концентрації прозапальних і проатерогенних медіаторів: С-реактивний білок, ІЛ-6, ФНП-α тощо. Підвищення концентрації холестерину ліпопротеїнів високої щільності. Зниження рівня CD4 CD28 Т-клітин. Збільшення ендотеліальних прогеніторних клітин | Транзиторне посилення вазоконстрикції. Пригнічення розвитку артеріальних колатералей. Відсутність впливу на судинну резистентність. Індукують декомпенсацію кровообігу |
| Мікофенолату мофетил | Антиатерогенний ефект. Зниження розвитку атеросклерозу після трансплантації органів | Немає даних |
| Статини | Зниження кардіоваскулярних катастроф. Зниження рівня проатерогенних ліпідів і маркерів окисного стресу. Пригнічення синтезу прозапальних цитокінів | Небажані лікарські взаємодії?Підвищення ризику побічних ефектів базової терапії? |
| Ритуксимаб | Виснаження В-клітин в атеросклеротичній бляшці | Немає даних |
Щодо біологічної терапії показано, що анти-ФНП-α терапія покращує ендотеліальну функцію при РА, системну вазодилативну здатність ендотелію (Bilsborough W. et al., 2006). Застосування інгібіторів ФНП-α в терапії у разі серцево-судинних ускладнень при ревматичних хворобах інтенсивно вивчається і продемонстрована в рандомізованих клінічних дослідженнях. Застосування цієї терапії в лікуванні серцево-судинних захворювань, цукрового діабету ІІ типу вимагає додаткового вивчення і проведення великих клінічних досліджень з тривалим періодом спостереження, які можуть обґрунтувати доцільність застосування цієї терапії для зниження високого ризику розвитку серцево-судинних хвороб/ускладнень при різних ревматичних хворобах.
Рекомендації EULAR стосовно серцево-судинної коморбідності в ревматології (Рекомендації ЕULAR з контролю серцево-судинного ризику у пацієнтів з РА та з іншими формами запальних артритів) опубліковані у 2016 р. (Agca R. еt al., 2016) та містять такі положення:
1. РА має розглядатись як стан, асоційований з підвищеним ризиком розвитку серцево-судинних захворювань. Зазначений підвищений ризик пов’язаний як із традиційними факторами ризику, так і наявністю запального стану (категорія В).
2. Для зниження серцево-судинного ризику необхідним є адекватний контроль активності захворювання (категорія В).
3. Для всіх пацієнтів з РА оцінка серцево-судинного ризику має проводитися згідно з національними стандартами та має виконуватися повторно у разі зміни антиревматичного лікування (категорія С).
4. Моделі оціночних шкал повинні бути адаптовані для пацієнтів з РА за рахунок збільшення у 1,5 раза. Це збільшення має проводитись у тому разі, якщо пацієнт відповідає хоча б одному з нижчезазначених критеріїв (категорія С): тривалість захворювання більше 10 років; серопозитивність за ревматоїдним фактором або антитіла до циклічного цитрулінового пептиду; наявність очевидних позасуглобових проявів.
5. При використанні шкали SCORE має застосовуватись співвідношення загальний холестерин/ліпопротеїни високої щільності.
Остеоартрит і коморбідна патологія
94% хворих на ОА мають як мінімум одну коморбідну патологію, серед найпоширеніших (Richette P. et al., 2011; Cadet C. et al., 2015):
- Метаболічний синдром — у 5 разів частіше у хворих на ОА порівняно із загальною популяцією!
- Артеріальна гіпертензія — 57,3% — за рахунок спільних патогенетичних механізмів, що призводять до ураження як судин, так і суглобів.
- Цукровий діабет — 16,1% — незалежний фактор ризику ОА — за рахунок індукції оксидативного стресу та гіперпродукції прозапальних цитокінів, накопичення глікованих залишків у суглобовій порожнині внаслідок тривалого підвищення рівня глюкози, стимуляції інсулінорезистентністю запалення у суглобах.
- Підвищений серцево-судинний ризик (атеросклероз та ішемічна хвороба серця) — 40% (високий ризик — 44,2%, помірний — 28,5%, низький ризик — 27,3%). ОА за рахунок оксидативного стресу спричиняє розвиток атеросклерозу (рис. 6). Оксидативний стрес знижує життєздатність хондроцитів шляхом індукції різних каскадів клітинної регуляції.
- Надмірна маса тіла та ожиріння — 45%. ОА вдвічі частіше розвивається при надмірній масі тіла, ІМТ >27 кг/м² підвищує ризик ОА на 15%. Негативний вплив ожиріння найбільший при гонартрозі, а також у осіб молодого віку. Крім механічного фактора (перевантаження суглобового апарата вагою), важливу роль приділяють спільним для ОА та ожиріння факторам системного запалення.
- Ментальні порушення (тривожність і депресія) — 80%. Виражена і тяжка депресія — 20%.
- Підвищений гастроінтестинальний ризик — 86,6% (високий — 22,3%).
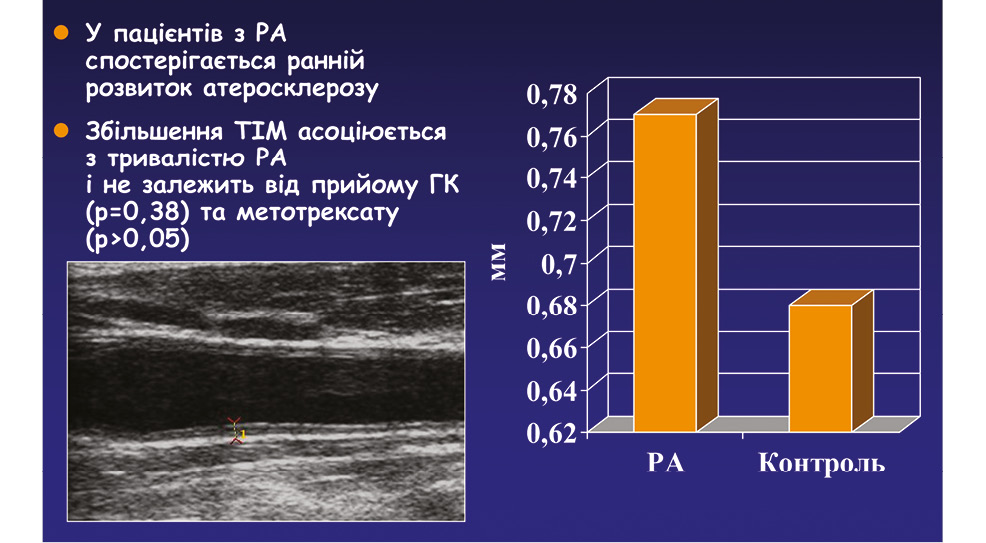
Підвищений рівень сечової кислоти у сироватці крові асоціювався з генералізованим ОА у людей, які перенесли ендопротезування кульшового суглоба, в той же час тісний зв’язок також продемонстровано між тяжкістю ОА і рівнем сечової кислоти у синовіальній рідині у пацієнтів із гонартрозом і відсутністю в анамнезі подагри, а також опубліковано дані щодо поширеності підвищення рівня сечової кислоти у пацієнток з ОА. Дані доказової медицини свідчать, що цукровий діабет, дисліпідемія, артеріальна гіпертензія, гіперурикемія можуть бути незалежними факторами для розвитку ОА, навіть за відсутності ожиріння (Шуба Н.М. та співавт., 2017).
Ревматичні та онкологічні хвороби: поєднання чи коморбідність?
«Ревматичні маски» злоякісних пухлин у вигляді паранеопластичного синдрому — тобто «ревматична» маніфестація злоякісних пухлин — часто є ознаками розвитку онкологічного процесу у пацієнтів із ревматичними хворобами. До спільних причин розвитку ревматичних хвороб та онкології відносять: інфекційні (вірусні тощо), хімічні, імунологічні, генетичні тощо, інфекційні (вірусні тощо), хімічні, імунологічні, генетичні та ін. (Abu-Shakra M. et al., 2001).
Зазначимо, що дермато-/поліміозит і системна склеродермія — найчастіші причини вторинних (паранеопластичних) СЗСТ, які трапляються в рутинній клінічній практиці лікаря-ревматолога. Вторинний дермато-(полі-)міозит як прояв онкологічної хвороби діагностують відносно часто, причому вік хворих частіше старше 40 років, переважає картина гострого/підгострого поліміозиту/міопатії, спостерігається відносна резистентність до стандартної протиревматичної терапії (базисні чинники, ГК, в тому числі пульс-терапія). При своєчасному виявленні пухлини та адекватному її лікуванні прояви дермато-/поліміозиту зазвичай зникають.
Ще одним «нетиповим» проявом паранеопластичного процесу є гіпертрофічна остеоартропатія та синдром плече-кисть (альгодистрофія). Причина — найчастіше пухлина органів грудної клітки (бронхогенний рак легені). Ознаки — потовщення дистальних відділів пальців за типом «барабанних паличок» та зміни нігтів «часове скло», за наявністю періоститу з новоутвореною кістковою структурою (за даними рентгенографії), вегетосудинних порушень (можливо, за типом синдрому Рейно). У хворих спостерігають набряк периферичних відділів кінцівок, зміни шкіри, відносну неефективність ГК).
То як розглядати ревматичні та онкологічні хвороби: це загальний процес чи коморбідність? На сьогодні доведено етіологічну і тригерну роль вірусів у розвитку ревматичних хвороб щодо таких збудників, як ретровіруси, цитомегаловіруси, вірус Епштейна — Барр, гепаденовіруси тощо, причому віруси зазначених груп можуть викликати імунну відповідь, активацію аутоімунних процесів, а також ревматичні та онкологічні хвороби (Abu-Shakra M. et al., 2001) (табл. 3).
Найчастіші паранеопластичні процеси, що викликають суглобовий синдром: артрит, асоційований із пухлинами; пальмарний фасцит із контрактурами, панікуліт, підшкірні вузлики, вторинна подагра, альгодистрофія, «заморожене плече», гіпертрофічна остеоартропатія.
Частіше відзначають такі варіанти суглобового синдрому при онкологічній патології:
- Перебіг, аналогічний такому при РА, але частіше проходить атипово, з гострим початком, асиметричним ураженням суглобів, відсутністю підшкірних вузликів і негативним ревматоїдним фактором. У більшості хворих визначають переважання ураження суглобів нижніх кінцівок і зап’ясть, неспецифічні гістологічні зміни синовіальної оболонки.
- Рецидивуючий серонегативний симетричний синовіт із набряком кисті, часто з раптовим початком у чоловіків літнього віку, також може бути проявом злоякісної пухлини (рак легені, кишечнику, передміхурової залози). Нерідко поєднується з лихоманкою, активацією оперізувального герпесу, втратою маси тіла і відсутністю ефекту від прийому ГК.
- Паранеопластичний серонегативний поліартрит з ураженням періартикулярних тканин, контрактурами, переважно у жінок молодого і середнього віку (лімфопроліферативні хвороби, рак яєчника на ранній стадії). Рефрактерний до ГК, але може регресувати при успішному лікуванні пухлини у разі її виявлення.
- Панікуліт і підшкірні вузлики (некроз клітковини), артрит, серозит описані при раку підшлункової залози та інших захворюваннях.
Зазвичай суглобовий синдром передує виявленню злоякісної пухлини за декілька місяців (до двох років) або з’являється при рецидиві неоплазми. Іноді він може служити критерієм або парадигмою пухлинного захворювання, сприяючи ранній його діагностиці.
| Віруси | Хвороби | |
|---|---|---|
| ревматичні | онкологічні | |
| Гепатит В (HBV) та С (HCV) | Системні васкуліти: вузликовий поліартеріїт тощо, кріоглобулінемія | Рак печінки, В-клітинна лімфома |
| Епштейна — Барр (HHV-4) | СЗСТ (СЧВ, системна склеродермія, синдром Шегрена тощо) | Лімфома Беркітта, лімфогранулематоз, рак носоглотки |
| Цитомегаловірус (HHV-5) | СЧВ, системна склеродермія, синдром Шегрена | Дані не уточнені |
| Вірус герпесу 8-го типу (HHV-8) | Модель вивчення вірус-індукованого імунітету | Саркома Капоші, лімфопроліферативна патологія |
| Парвовірус В19 | Артрит | Онкогематологічні хвороби |
| Ретровірус 5 (HRV-5) | СЧВ, синдром Шегрена тощо |
Лейкоз, лімфома, саркома |
| Т-лімфотропний вірус 1-го типу (HTLV-1) | Синдром Шегрена, поліміозит, альвеоліт, РА (?) | Т-клітинна лімфома |
| Ендогенні ретровіруси (HEVR) | СЧВ, РА, синдром Шегрена |
Онкопатологія |
Відомо, що віруси гепатиту можуть бути коморбідними факторами ревматичних хвороб. Ідентифіковано 7 видів — А, В, С, D, E, G і ТТ. Тривала персистенція та реплікація в організмі (поза межею печінки) доведена для HBV і HCV та пов’язана з аутоімунними та системними проявами у пацієнтів із ревматичними хворобами. HBV є причиною суглобового, м’язового та шкірного синдромів, полінейропатії, вісцеритів та аутоімунних проявів (наприклад вузликового поліартеріїту). HCV має лімфотропні властивості, що є причиною васкулітів, синдрому Рейно, артритів та артралгії, поліміозиту та полінейропатії, ураження внутрішніх органів — легень, серця, нирок тощо. Асоціюється з аутоімунним тиреоїдитом, В-клітинною лімфомою.
Межі біологічної інволюції та медико-технічного прогресу
Глобальна стратегія — розподіл повноважень медикаментозних стратегій, технічних пристроїв, електронних систем, у тому числі штучного інтелекту (рис. 7, 8).
Використання технологій штучного інтелекту в кардіології та ревматології:
- Забезпечує точну оцінку факторів серцево-судинного ризику та вірогідності розвитку серцево-судинних подій.
- Дає можливість швидше прийняти рішення у клінічно складних випадках.
- Особливо цінним є для раннього прогнозування зупинки серця, виявлення складних порушень ритму і провідності.
Таким чином, на підставі викладеного можна зробити такі висновки:
- Коморбідні хвороби у пацієнтів ревматичного профілю виявляють часто, причому підвищена частота коморбідності не може бути пояснена тільки високою поширеністю ревматичних хвороб.
- У пацієнтів з ревматичними хворобами та коморбідними станами зростає тяжкість основного захворювання та погіршується прогноз.
- Коморбідність необхідно враховувати при діагностиці ревматичних хвороб.
- Лікування при ревматичних хворобах потребує врахування коморбідності.
- Лікування коморбідної патології вимагає врахування взаємовпливу лікарських засобів.
- Коморбідні хвороби потребують значного збільшення медичних ресурсів.
- Збільшення кількості лікарських засобів підвищує ризик побічних ефектів.
- Коморбідні хвороби знижують комплаєнтність пацієнтів.
- Необхідні подальші наукові дослідження діагностики та лікування коморбідних станів.
- Важливо розробити оптимальну стратегію менеджменту коморбідних пацієнтів при ревматичних хворобах.
- До рекомендацій щодо діагностики та лікування ревматичних хвороб доцільно включати розділи про коморбідні захворювання та стани.
Список використаної літератури
- Гарміш О.О., Левченко В.Г., Мітченко О.І. (2016) Клініко-демографічні особливості поширеності серцево-судинного ризику при ревматоїдному артриті в осіб жіночої статі за результатами аналізу показників mSCORE. Запорож. мед. журн., 6: 12–16 (http://nbuv.gov.ua/UJRN/Zmzh_2016_6_4).
- Коваленко В.М., Корнацький В.М. (2013) Динаміка стану здоров’я народу України та регіональні особливості. Інститут кардіології ім. М.Д. Стражеска АМН України, Київ, 82 с.
- Шуба Н.М., Воронова Т.Д., Литвиненко С.В. (2017) Роль гиперурикемии в развитии кардиоваскулярной патологии. Укр. ревматол. журн., 68(2): 38–46.
- Abu-Shakra M., Buskila D., Ehrenfeld M. et al. (2001) Cancer and autoimmunity: autoimmune andrheumatic features in patients with malignancies. Ann. Rheum. Dis., 60: 433–440.
- Agca R., Heslinga S.C., Rollefstad S. et al. (2016) EULAR recommendations for cardiovascular disease risk management in patients with rheumatoid arthritis and other forms of inflammatory joint disorders: 2015/2016 update (http://dx.doi.org/10.1136/annrheumdis-2016–209775).
- Barnett K., Mercer S.W., Norbury M. et al. (2012) Epidemiology of multimorbidity and implications for health care, research, and medical education: a cross-sectional study. Lancet, 380(9836): 37–43. doi: 10.1016/S0140-6736(12)60240-2.
- Bilsborough W., Keen H., Taylor A. et al. (2006) Anti-tumour necrosis factor-alpha therapy over conventional therapy improves endothelial function in adults with rheumatoid arthritis. Rheumatol. Int., 26(12): 1125–1131.
- Boyd C.D., McNabney M.K., Brandt N. et al. (2012) Guiding principles for the care of older adults with multimorbidity: an approach for clinicians: American Geriatrics Society Expert Panel on the Care of Older Adults with Multimorbidity. J. Am. Geriatr. Soc., 60(10): E1–E25. doi: 10.1111/j.1532–5415.2012.04188.x.
- Cadet C., Maheu E., Breville P. et al. (2015) Clinical phenotypes: There is not one osteoarthritis but several. Comorbidities. Les cahiers de l’année gérontologique. 7(2): 52–57.
- Caughey G.E., Vitry A.I., Gilbert A.L., Roughead E.E. (2008) Prevalence of comorbidity of chronic diseases in Australia. BMC Public Health., 8: 221.
- Charlson M.E., Pompei P., Ales K.L. et al. (1987) A new method of classifying prognostic comorbidity in longitudinal studies: development and validation. J. Chron. Dis., 40(5): 373–383.
- Diagnostic and Statistical Manual of mental disorders, 5 ed. (2013) 518 р.
- Fried L.P., Tangen C.M., Walston J. et al. (2001) Cardiovascular Health Study Collaborative Research Group.Frailty in older adults: evidence for a phenotype. J. Gerontol. A Biol. Sci Med. Sci., 56(3): M146–156.
- Koch-Weser S., Dejong W., Rudd R.E. (2009) Health expectations: an international journal of public participation in health care and health policy. Health Expect, 12(4): 371–382. doi: 10.1111/j.1369–7625.2009.00555.x.
- Kraemer H.C. (1995) Statistical issues in assessing comorbidity. Stat. Med., 14: 721–723.
- Libby P. (1995)Molecular bases of the acute coronary syndromes. Circulation., 91(11): 2844–2850.
- Nüesch E., Dieppe P., Reichenbach S. et al. (2011) All cause and disease specific mortality in patients with knee or hip osteoarthritis: population based cohort study. BMJ, 342: d1165. doi: 10.1136/bmj.d1165.
- Peters M.J., Symmons D.P., McCarey D. et al. (2010) EULAR evidence-based recommendations for cardiovascular risk management in patients with rheumatoid arthritis and other forms of inflammatory arthritis. Ann. Rheum. Dis., 69(2): 325–331. doi: 10.1136/ard.2009.113696.
- Peterson J.C., Paget S.A., Lachs M.S. et al. (2011) The risk of comorbidity. ARD (http://dx.doi.org/10.1136/annrheumdis-2011-200473).
- Piepoli M.F., Hoes A.W., Agewall S.et al. (2016) European Guidelines on cardiovascular disease prevention in clinical practice: The sixth joint task force of the European Society of Cardiology and other societies on cardiovascular disease prevention in clinical practice (constituted by representatives of 10 societies and by invited experts) developed with the special contribution of the European Association for Cardiovascular Prevention & Rehabilitation (EACPR). Eur. Heart J., 37(29): 2315–2381. doi: 10.1093/eurheartj/ehw106.
- Richette P., Hilliquin P., Bertin P. et al. (2011) Comparison of general practitioners and rheumatologists’ prescription patterns for patients with knee osteoarthritis. BMC Musculoskelet Disord., 12: 72. doi: 10.1186/1471-2474-12-72.
- Ross R. (1999)Atherosclerosis — an inflammatory disease. N. Engl. J. Med., 340(2): 115–126.
- Szekanecz Z., Koch A.E. (2008) Vascular involvement in rheumatic diseases: ‘vascular rheumatology’. Arthritis Res. Ther., 10(5): 224. doi: 10.1186/ar2515.
- Tinetti M.E., Williams C.S., Gill T.M. (2000) Dizziness among older adults: a possible geriatric syndrome. Ann. Intern. Med., 132(5): 337–344.
- van den Akker M., Buntinx F., Roos S., Knottnerus J.A. (1996)Comorbidity or multimorbidity: what’s in a name? A review of the literature. Eur. J. Gen. Pract., 2(2): 65–70.
- Wright V., Hopkins R. (1977) Communicating with the rheumatic patient. Rheumatol. Rehabilitat., 16: 107–118.
Коморбидность: определение, возможные направления диагностики и лечения
Резюме. Даны определения и современные представления о коморбидности как сочетании различных заболеваний, объединенных общими патогенетическими механизмами. Особое внимание уделено сердечно-сосудистой и ревматической патологии, возрастным аспектам и психосоциальным факторам, являющимся определяющими в формировании коморбидных состояний.
коморбидность, патогенез, возраст, психосоциальные факторы, сердечно-сосудистые заболевания, ревматические болезни.
Адреса для листування:
Коваленко Володимир Миколайович
03680, Київ, вул. Народного ополчення, 5
ДУ «Національний науковий центр
«Інститут кардіології ім. М.Д. Стражеска»
НАМН України»

Leave a comment