УРАЖЕННЯ ОПОРНО-РУХОВОГО АПАРАТУ ПРИ ANCA-АСОЦІЙОВАНОМУ СИСТЕМНОМУ ВАСКУЛІТІ
Ермолаева М.В., Помазан Д.В., Синяченко О.В., Суярко В.И., Верзилов С.Н.
Резюме. Актуальність. Ураження суглобів і параартикулярних тканин належить до найчастіших ознак системного васкуліту (СВ), асоційованого з антинейтрофільними цитоплазматичними антитілами (ANCA) — при мікроскопічному поліангіїті (МПА), гранулематозі з поліангіїтом Вегенера (ГПА), еозинофільному поліангіїті Черджа — Стросс (ЕПА), але характер перебігу й патогенез патології опорно-рухового апарату у цих хворих потребує подальшого вивчення. Мета і завдання: провести порівняльну оцінку клініко-рентгено-сонографічних ознак патології суглобів та параартикулярних тканин при окремих формах ANCA-CB, встановити особливості патогенетичних структур, виокремити чинники ризику. Об’єкт і методи. Під наглядом перебували 147 хворих на ANCA-CB (89 — на МПА, 28 — на ГПА, 30 — на ЭПА), відповідно їх середній вік становив 45; 46 і 42 років, тривалість захворювання — 7; 4 і 11 років. Співвідношення мінімального, помірного й високого ступеня активності хвороби в цих групах відповідно становило 1:3:6, 1:7:6 та 1:3:4. Результати. Ураження опорно-рухового апарату виявлено у 79% хворих на МПА, у 61% — на ГПА і 77% — на ЕПА, при цьому для МПА виявився характернішим міозит кінцівок (39%), для ГПА — периферична нейропатія (71%) і альгодистрофія (18%), для ЕПА — сакроілеїт (17%), спондилопатія (26%), тендовагініт (30%) і ентезопатія (26%). При МПА констатовано відносно часте залучення до патологічного процесу колінних, гомілковостопних і променезап’ясткових зчленувань, при ЕПА — верхньощелепних, тоді як при ГПА були відсутні випадки артритів груднино-ключичних, плеснофалангових і кульшових суглобів. Інтегральна тяжкість вісцеритів у хворих на МПА мала одночасні дисперсійні та прямі кореляційні співвідношення з розвитком остеоузур, при ГПА — з наявністю інтраартикулярних тіл Гоффа, при ЕПА — лігаментозу. З параметрами у крові ANCA (антитіл до мієлопероксидази та протеїнази-3) у пацієнтів із МПА було тісно пов’язано формування периферичного артриту, а з ЕПА — тендовагініту, у разі МПА в розвитку змін опорно-рухового апарату важливе значення належить антитілам до кардіоліпіну, ГПА — ендотеліальній дисфункції судин, ЕПА — антитілам до дезоксирибонуклеїнової кислоти. Особливості патогенезу ANCA-CB потребують створення індивідуальної медичної технології лікування при ураженнях опорно-рухового апарату.
УДК 616.13/.14:616.72-07-092
Актуальность
Системные васкулиты (СВ) — гетерогенная группа заболеваний, основным признаком которых считается иммунное воспаление с некрозом сосудистой стенки (Demir S. et al., 2018; Elefante E. et al., 2018). Распространенность СВ ежегодно повсеместно повышается (Mohammad A.J. et al., 2012; Jariwala M.P., Laxer R.M., 2018), а их изучение относится к динамично развивающимся областям клинической медицины (Lamprecht P. et al., 2018).
Поражение суставов и параартикулярных тканей является наиболее частым признаком СВ, ассоциированным с антинейтрофильными цитоплазматическими антителами (ANCA) (Синяченко О.В. и соавт., 2015; Calatroni M. et al., 2017; Apel F. et al., 2018). Артропатия при разных вариантах СВ диагностируется в 30–70% случаев, что зависит от длительности заболевания, степени активности патологического процесса, наличия и тяжести течения легочной и почечной патологии (Syniachenko O. et al., 2017), но отмечается в основном в дебюте ANCA-CB — микроскопического полиангиита (МПА), гранулематоза с полиангиитом Вегенера (ГПА) и эозинофильного полиангиита Черджа — Стросс (ЭПА) (Itabashi M. et al., 2014; Jeleniewicz R. et al., 2018). При этом характер течения и патогенеза суставного и параартикулярного синдромов при МПА (Tsuchiya N., 2012), ГПА (Salazar-Exaire D. et al., 2012; Soriano A. et al., 2012) и ЭПА (Gendelman S. et al., 2013; Oiwa H., Nishioka K., 2016) требуют дальнейшего изучения.
Цель и задачи исследования
Провести сравнительную оценку клинико-рентгено-сонографических признаков патологии суставов и параартикулярных тканей при отдельных формах ANCA-CB, установить особенности патогенетических построений, выделить факторы риска.
Объект и методы исследования
Под наблюдением находились 147 больных ANCA-CB (89 — с МПА, 28 — с ГПА, 30 — с ЭПА), соответственно мужчин/женщин 1:1,3; 1,3:1 и 1:1,1, средний возраст составил 45,2±1,47; 46,0±2,41 и 41,9±2,48 года, длительность заболевания — 6,6±0,79; 4,3±0,83 и 10,6±1,88 года, острое или подострое течение патологического процесса в 27,0; 35,7 и 23,3% случаев. Соотношение минимальной, умеренной и высокой степеней активности болезни в этих группах ANCA-CB составило 1:3:6, 1:7:6 и 1:3:4 соответственно. У больных МПА в сыворотке крови ANCA выявлены в 76,4% случаев (в 68,5% антитела к миелопероксидазе — АМР и в 7,9% — одновременно АМР и антитела к протеиназе-3 — АР3), при ГПА — в 92,8% (АР3 — в 78,6% и АР3 + АМР — в 14,3%), при ЭПА — в 50,0% (АМР — в 43,3% и АР3 — в 6,7%).
Рентгенологическое исследование периферических суставов, крестцово-подвздошных сочленений и позвоночника выполняли на аппарате «Multix-Compact-Siеmens» (Германия), ультразвуковое исследование суставов — на сонографе «Envisor-Philips» (Нидерланды). Для оценки лабораторных показателей использовали анализатор «Olympus-AU640» (Япония), ридер «PR2100-Sanofi diagnostic pasteur» (Франция), иммуноблот «Euroline-Euroimmun» (Германия). Подсчитывали показатели суставного счета (JPN), индексов Лансбури (LI), активности артрита (DAS) и интегральной тяжести артрита (ASI) по формуле:

Статистическая обработка полученных результатов исследований проведена с помощью компьютерного корреляционного, одно- (ANOVA) и многофакторного (ANOVA/MANOVA) дисперсионного анализа (программы «Microsoft-Excel» и «Statistica-Stat-Soft», США). Оценивали средние значения (М), их стандартные отклонения и ошибки (SE), коэффициенты параметрической корреляции Пирсона (r) и непараметрической Кендалла (t), критерии однофакторного (D) и многофакторного Уилкоксона — Рао (WR) дисперсионного анализа, различий Стьюдента и достоверность статистических показателей (р).
Результаты и их обсуждение
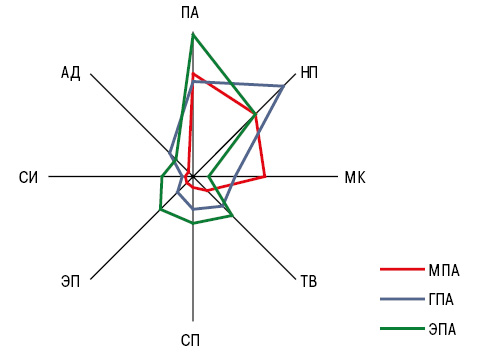
Поражение опорно-двигательного аппарата выявлено у 78,7% больных МПА, у 60,7% — ГПА и 76,7% — ЭПА, при этом для МПА оказался относительно более характерным миозит конечностей (МК — 39,3%), для ГПА — периферическая нейропатия (НП — 70,6%) и альгодистрофия (АД — 17,7%), для ЭПА — сакроилеит (СИ — 17,4%), спондилопатия (СП — 26,1%), тендовагинит (ТВ — 30,4%) и энтезопатия (ЭП — 26,1%), что отражено на рис. 1. СИ во всех случаях был либо односторонним, либо двусторонним асимметричным и не зависел от нозологии СВ. СП в виде остеохондроза позвоночника и спондилоартроза проявлялась болевым синдромом дисгемического, дисфиксационного, воспалительного и механического характера при всех ANCA-СВ примерно в соотношении 10:5:4:1. У двух больных МПА течение НП было в виде синдрома Гийена — Барре.
По результатам выполненного анализа Уилкоксона — Рао, на интегральное состояние опорно-двигательного аппарата при МПА, ГПА и ЭПА оказывает влияние общая тяжесть висцеритов (соответственно WR=3,25, p<0,001, WR=2,22, p=0,032, WR=3,02, p=0,033), у больных МПА, кроме того, функциональное состояние почек (WR=1,61, p=0,023), при ГПА — кожный синдром (WR=6,95, p<0,001), а при ЭПА — респираторная функция (WR=2,63, p=0,049). Как показал дисперсионный и корреляционный анализ, степень тяжести периферического артрита (ПА) тесно связана с интегральной тяжестью поражений внутренних органов при всех вариантах ANCA-CB — МПА (D=34,94, p<0,001; t=+0,487, p<0,001), ГПА (D=5,99, p=0,022; t=+0,549, p<0,001), ЭПА (D=4,21, p=0,049; t=+0,265, p=0,040).
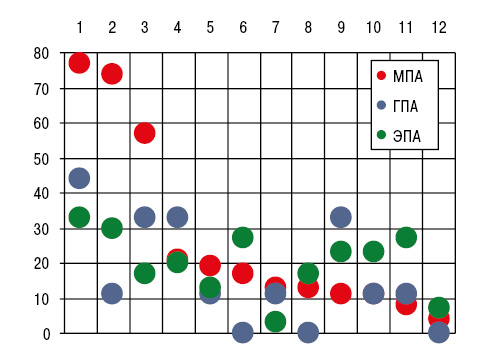
Как видно из рис. 2, при МПА констатировано относительно частое вовлечение в патологический процесс коленных (77,4%), голеностопных (73,6%) и лучезапястных (56,6%) сочленений, при ЭПА — верхнечелюстных (26,7%), тогда как при ГПА отсутствовали случаи артрита грудино-ключичных, плюснефаланговых и тазобедренных суставов. Частота отдельных рентгено-сонографических признаков суставного синдрома представлена на рис. 3.
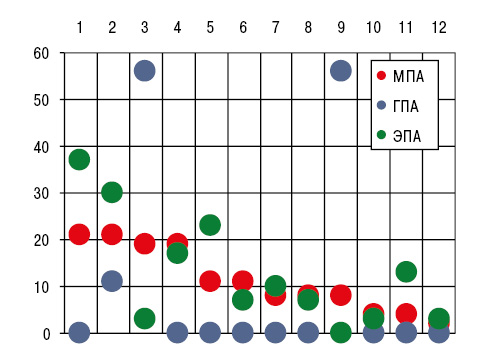
Отметим, что разнообразие таких проявлений артропатии у больных ГПА оказалось относительно скудным, но выявлена высокая распространенность лигаментоза и интраартикулярных жировых тел Гоффа (соответственно 55,6%). Последние при ЭПА в полостях суставов вообще отсутствовали.
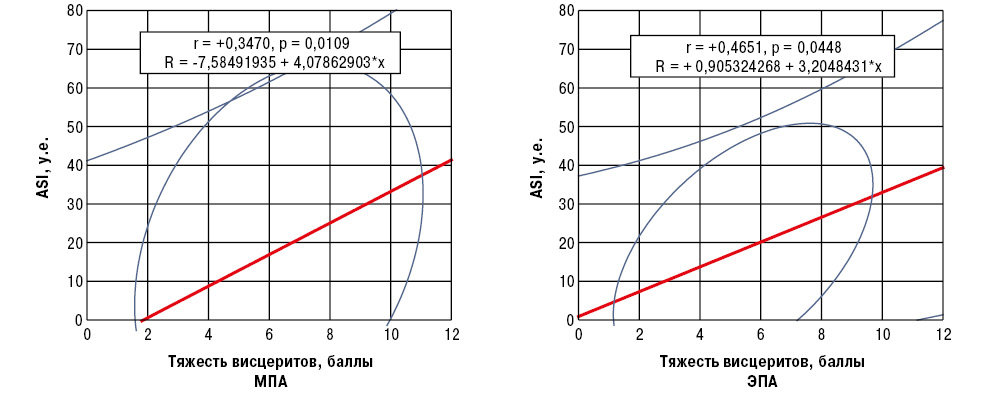
В таблице представлены показатели тяжести суставного синдрома у больных ANCA-CB. Моноолигоартрит при МПА установлен в 39,6% случаев, при ГПА — в 33,3%, при ЭПА — лишь в 16,7%. Следует подчеркнуть, что интегральная выраженность висцеритов имела прямые корреляционные связи Пирсона с параметром ASI у больных МПА и ЭПА (рис. 4).
| Показатель суставного синдрома | Варианты ANCA-CB | ||
|---|---|---|---|
| МПА | ГПА | ЭПА | |
| JPN, абс. | 9,3±1,81 | 14,4±4,79 | 13,2±2,62 |
| DAS, о.е. | 2,9±0,24 | 3,3±0,67 | 3,0±0,27 |
| LI, баллы | 61,8±6,25 | 48,0±17,07 | 57,8±11,11 |
| ASI, у.е. | 16,8±2,87 | 18,8±8,33 | 16,5±3,70 |
Интегральная тяжесть висцерита у больных МПА имела одновременные дисперсионные и прямые корреляционные соотношения с развитием остеоузур (D=3,98, p=0,048; t=+0,271, p=0,004), при ГПА — с наличием интраартикулярных тел Гоффа (D=6,49, p=0,038; t=+0,707, p=0,008), при ЭПА — лигаментоза (D=7,46, p=0,009; t=+0,544, p=0,001). C показателем ASI при всех вариантах ANCA-CB отмечали позитивные корреляции развития ТВ (в случаях МПА t=+0,385, p<0,001, ГПА — t=+0,745, p=0,005, ЭПА — t=+0,450, p=0,007). Кроме того, МПА сопровождался прямыми связями ASI с СИ (t=+0,227, p=0,016) и МК (t=+0,202, p=0,033), а ЭПА с ЭП (t=+0,329, p=0,049).
С параметрами в крови ANCA (антител к АМР и АР3) у пациентов с МПА было тесно связано формирование ПА (D=4,07, p=0,040), а с ЭПА — ТВ (D=3,89, p=0,048), в случаях МПА в развитии изменений опорно-двигательного аппарата немаловажное значение отводится антителам к кардиолипину (D=6,50, p=0,014), ГПА — эндотелиальной дисфункции сосудов с увеличением соотношения тромбоксанемии/простациклинемии (D=3,11, p=0,036), ЭПА — антителам к дезоксирибонуклеиновой кислоте (D=7,37, p=0,012).
В заключение отметим, что по данным литературы для ГПА нехарактерны поражение суставов пальцев рук (Kisacik B. et al., 2018) и грудино-ключичный артрит (Kim S.D. et al., 2013). Полученные нами результаты исследований также показали отсутствие воспаления грудино-ключичных сочленений при данном варианте ANCA-CB, но артрит суставов кистей констатирован у каждого третьего пациента. Имеются сведения, что течение ГПА возможно в виде серопозитивного по ревматоидному фактору полиартрита, напоминающего ревматоидный, причем даже дебютировать с такого варианта суставного синдрома (Macri A. et al., 2014). В проведенном нами исследовании таких больных не было, как и редких форм патологии опорно-двигательного аппарата при МПА, ГПА и ЭПА, какими являются подвывихи плечевых (van Hooff L. et al., 2018) и атлантоаксиальных сочленений (Mohapatra A. et al., 2016), периартикулярные кожные кисты (Fukuyama M. et al., 2017) и периостит костей голеней (Gladue H.S., Fox D.A., 2013).
Выводы
Поражение опорно-двигательного аппарата выявлено у 60–80% больных ANCA-CB, причем для МПА был более характерен МК, для ГПА — НП и АД, для ЭПА — СИ, СП, ТВ И ЭП. При МПА констатировано относительно частое вовлечение в патологический процесс коленных, голеностопных и лучезапястных сочленений, при ЭПА — верхнечелюстных, тогда как при ГПА отсутствовали случаи артрита грудино-ключичных, плюснефаланговых и тазобедренных суставов. Интегральная тяжесть висцерита у больных МПА имела прямые соотношения с развитием остеоузур, при ГПА — с наличием интраартикулярных тел Гоффа, при ЭПА — лигаментоза. С параметрами в крови ANCA у пациентов с МПА тесно связано формирование ПА, а с ЭПА — ТВ, в случаях МПА в развитии изменений опорно-двигательного аппарата немаловажное значение отводится антителам к кардиолипину, ГПА — эндотелиальной дисфункции сосудов, ЭПА — антителам к дезоксирибонуклеиновой кислоте. Особенности патогенеза ANCA-CB требуют создания индивидуальной медицинской технологии лечения поражений опорно-двигательного аппарата.
Список использованной литературы
- Синяченко О.В., Ермолаева М.В., Егудина Е.Д., Седая Л.В. (2015) Поражение суставов при системном васкулите. Укр. ревматол. журн., 59(1): 66–71.
- Apel F., Zychlinsky A., Kenny E.F. (2018) The role of neutrophil extracellular traps in rheumatic diseases. Nat. Rev. Rheumatol., 21(6): 152–159.
- Calatroni M., Oliva E., Gianfreda D. et al. (2017) ANCA-associated vasculitis in childhood: recent advances. Ital. J. Pediatr., 43(1): 46–49.
- Demir S., Sonmez H.E., Ozen S. (2018) Vasculitis: decade in review. Curr. Rheumatol. Rev., 25(7): 93731.
- Elefante E., Bond M., Monti S. et al. (2018) One year in review 2018: systemic vasculitis. Clin. Exp. Rheumatol., 36(111): 12–32.
- Fukuyama M., Sato Y., Hayakawa J., Ohyama M. (2017) Cutaneous metaplastic synovial cyst: case report and literature review from the dermatological point of view. Keio J. Med., 66(1): 9–13.
- Gendelman S., Zeft A., Spalding S.J. (2013) Childhood-onset eosinophilic granulomatosis with polyangiitis (formerly Churg-Strauss syndrome): a contemporary single-center cohort. J. Rheumatol., 40(6): 929–935.
- Gladue H.S., Fox D.A. (2013) Voriconazole-induced periostitis causing arthralgias mimicking a flare of granulomatosis with polyangiitis. J. Clin. Rheumatol., 19(8): 444–445.
- Itabashi M., Takei T., Moriyama T. et al. (2014) Long-term damage assessment in patients with microscopic polyangiitis and renal-limited vasculitis using the Vasculitis Damage Index. Mod. Rheumatol., 24(1): 112–119.
- Jariwala M.P., Laxer R.M. (2018) Primary vasculitis in childhood: GPA and MPA in childhood. Front Pediatr., 16(6): 226–229.
- Jeleniewicz R., Suszek D., Majdan M. (2018) Musculoskeletal symptoms in a group of granulomatosis with polyangiitis patients. Wiad. Lek., 71(1): 17–20.
- Kim S.D., Kim G.W., Kim T.E. et al. (2013) Granulomatosis with polyangiitis (Wegener granulomatosis) as a differential diagnosis of sternal osteomyelitis: the challenges in diagnosis. J. Clin. Rheumatol., 19(8): 446–448.
- Kisacik B., Önder M.E., Sayarlioğlu M., Onat A.M. (2018) Symmetric polyarthritis as an initial symptom in granulomatosis with polyangiitis: A report of six cases and review of the literature. Eur. J. Rheumatol., 5(3): 191–193.
- Lamprecht P., Kerstein A., Klapa S. et al. (2018) Pathogenetic and clinical aspects of anti-neutrophil cytoplasmic autoantibody-associated vasculitides. Front Immunol., 9(9): 680.
- Macri A., Ulmeanu R., Mihălţan F. et al. (2014) Delayed diagnosis in a case of granulomatosis with polyangiitis (Wegener’s) with initial predominance of joint involvement. Pneumologia, 63(1): 53–59.
- Mohammad A.J., Jacobsson L.T., Westman K.W., Sturfelt G. (2012) Incidence and survival rates in Wegener’s granulomatosis, microscopic polyangiitis, Churg-Strauss syndrome and polyarteritis nodosa. Rheumatology, 48(12): 1560–1565.
- Mohapatra A., Khan T., Diaz J. et al. (2016) Granulomatosis with polyangiitis (Wegener’s granulomatosis) causing atlantoaxial instability: a case report. Spine J., 16(10): 717–720.
- Oiwa H., Nishioka K. (2016) Janeway lesions in eosinophilic granulomatosis with polyangiitis. Intern. Med., 55(5): 549–550.
- Salazar-Exaire D., Ramos-Gordillo M., Vela-Ojeda J. et al. (2012) Silent ischemic heart disease in a patient with necrotizing glomerulonephritis due to Wegener’s granulomatosis. Cardiorenal. Med., 2(3): 218–224.
- Soriano A., Lo Vullo M., Casale M. et al. (2012) Meningeal involvement in Wegener granulomatosis: case report and review of the literature. Int. J. Immunopathol. Pharmacol., 25(4): 1137–1141.
- Syniachenko O., Khaniukov O., Yehudina Y. et al. (2017) Characteristics of articular syndrome in systemic vasculitis. Georgian Med. News., 273(12): 69–75.
- Tsuchiya N. (2012) Genetics of ANCA-associated vasculitis in Japan: a role for HLA-DRB1*09:01 haplotype. Clin. Exp. Nephrol., 23(11): 132–136.
- Van Hooff L., Barten D.G., Potjewijd J., van Paassen P. (2018) Necrotizing vasculitis in immediate response to a shoulder dislocation. Am. J. Emerg. Med., 36(8): 1523.
Адрес для переписки:
Синяченко Олег Владимирович
84404, Донецкая обл. Лиман, ул. Привокзальная, 27
Донецкий национальный медицинский университет,
кафедра внутренней медицины № 1
E-mail: synyachenko@ukr.net

Leave a comment