Клінічні особливості перебігу остеоартрозу у поєднанні з гіперурикемією
Шуба Н.М.1, Воронова Т.Д.2, Крилова А.С.1, Пилипенко А.В.3, Хамбір Т.С.3
- 1Національна медична академія післядипломної освіти ім. П.Л.Шупика
- 2
- 3Національна медична академія післядипломної освіти ім. П.Л. Шупика, Київ
Резюме. У статті наведено сучасні дані літератури про поєднання остеоартрозу та гіперурикемії. Проаналізовано тривалість захворювання,стадію ураження за рентгенологічними ознаками, клінічні особливості суглобового синдрому у хворих на остеоартроз та гіперурикемію. Досліджено роль запального компонента у розвитку поєднаної патології. Враховуючи отримані дані, можна зробити висновок, що слід планувати диференційований підхід до лікування пацієнтів з остеоартрозом та гіперурикемією.
Остеоартроз (ОА) — найчастіше захворювання суглобів у багатьох популяціях земної кулі, яке зазвичай проявляється у осіб віком старше 40 років та вважається найбільш поширеним інвалідизуючим захворюванням суглобів у світі. Більше того, його поширеність і превалювання зростають, що пояснюється старінням населення, збільшенням тривалості життя та зміною його способу, що веде до подальшого збільшення кількості пацієнтів з ОА (Bijlsma J.W. et al., 2011).
На ОА переважно хворіють люди похилого віку, які мають супутню патологію — ішемічну хворобу серця, ураження центральної нервової системи, печінки, метаболічний синдром (Шуба Н.М. та співавт., 2012).
Тому на сьогодні розглядається взаємозв’язок ОА з іншою супутньою патологією та його залежність від віку, статі, ожиріння та гіперурикемії (подагри). Гіперурикемія значно підвищує ризик виникнення та ускладнює перебіг такої патології, як кардіоваскулярні, цереброваскулярні події, цукрового діабету, ожиріння, а найбільше — артеріальної гіпертензії.
Гіперурикемія може формувати клінічно маніфестну подагру. Дослідженню взаємозв’язку подагри та ОА присвячено багато робіт. Результати великих контрольованих досліджень свідчать, що суглоби пацієнтів, які мали гострі напади подагри, мають більш виражені клінічні та рентгенологічні ознаки ОА, ніж ураження суглобів у осіб без гострих нападів подагри (Roddy E. et al., 2007). Це стосується першого плюснефалангового суглоба, суглобів середнього відділу стопи, колінного суглоба та дистальних міжфалангових суглобів. Крайове наростання кристалів моноурату натрію спостерігалося на фрагментах суглобового хряща (Pascual E. et al., 1998.) Нещодавнє дослідження 7855 екземплярів постсекційного матеріалу таранної кістки виявило сильну кореляцію між розміщенням відкладень кристалів моноурату натрію і кальцію пірофосфату та ділянками пошкодження в суглобовому хрящі (Muehleman C. et al., 2008). Пошкодження хряща зазвичай локалізувалися в місцях біомеханічного стресу, таких як артикулярна поверхня голівки великогомілкової чи малогомілкової кістки або там, де таранна кістка була протиставлена переднім остеофітам великогомілкової кістки.
Характерний для ОА кістковий набряк, який клінічно виявляється і корелює з рентгенологічною стадією ОА, крепітацією і обмеженням рухів у суглобі, може також виникати як результат вторинного пошкодження суглобів внаслідок подагри (Roddy E. et al., 2007).
Цілком можливо, що асоціація між подагрою і генералізованим ОА може бути пояснена спільними факторами ризику старіння і ожиріння (Roddy E., Doherty M., 2012) (рис. 1).
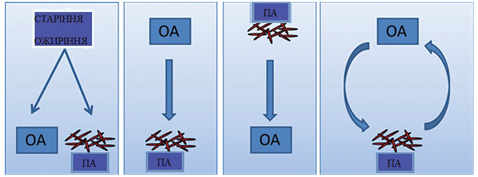
Як видно (див. рис. 1), спостерігається взаємозв’язок між подагрою та ОА як «замкнене коло», які посилюють один одного, а також посилюються старінням і ожирінням.
Як ОА, так і подагра мають подібні патогенетичні механізми розвитку, пов’язані з вивільненням прозапальних цитокінів, які призводять до запалення. Рівень сечової кислоти в синовіальній рідині корелює з інтерлейкіном (IL)-1β. Солі моноурату натрію стимулюють інфламасоми та каспазу-1 у моноцитах та синовіальних мононуклеарних клітинах, з активацією IL-1β (Martinon F. et al., 2006). Утворення IL-1β та фактора некрозу пухлини (TNF)-α підвищує приплив нейтрофільних гранулоцитів у суглоб та розвиток запалення (Cronstein B.N., Terkeltaub R., 2006; Martinon F. et al., 2006).
Проте, незважаючи на результати проведених досліджень, проблема поєднання ОА та гіперурикемії залишається недостатньо вивченою.
Тісний зв’язок між тяжкістю ОА і рівнем сечової кислоти в синовіальній рідині продемонстровано у пацієнтів із гонартрозом і відсутністю в анамнезі подагри, вказуючи, що цей зв’язок може бути використаний як біомаркер тяжкості та прогресування ОА (Denoble A.E. et al., 2011).
Враховуючи вищезазначене, на базі терапевтичного відділення Клінічної міської лікарні № 7 м. Києва виконано роботу з вивчення клінічних особливостей перебігу ОА в поєднанні з гіперурикемією.
Об’єкт і методи дослідження
У дослідження включено 91 пацієнта з ОА (78 жінок та 13 чоловіків) віком від 35 до 80 років. Учасників залежно від рівня сечової кислоти у сироватці крові розподілили на дві групи. 1-шу групу становили 36 осіб, які мали ОА без гіперурикемії, середній вік яких становив 59,31±1,70 року, 2-гу групу — 55 осіб, які мали ОА та гіперурикемію (рівень сечової кислоти у сироватці крові >360 мкмоль/л), середній вік яких становив 60,45±1,39 року. Загальна характеристика обстежених хворих — у табл. 1.
| Показник | Група | |
|---|---|---|
| 1-ша | 2-га | |
| Кількість хворих | 36 | 55 |
| Середній вік, років | 59,31±1,70 | 60,45±1,39 |
| Стать:- чоловіки- жінки | 234 | 1144 |
| Маса тіла, кг | 82±2,69 | 90,76±2,21 |
| Індекс маси тіла (ІМТ) | 30,28±1,03 | 33,21±0,81 |
| Тривалість ОА, років | 8,30±0,83 | 9,06±0,85 |
| Сечова кислота, мкмоль/л | 290±7,65 | 478,67±14,23 |
Обидві групи були зіставні за загальноклінічними показниками (табл. 2).
| Показник | Група | |
|---|---|---|
| 1-ша | 2-га | |
| Білірубін, мкмоль/л | 17,05±0,68 | 15,45±0,59 |
| Креатинін, мкмоль/л | 90,74±3,00 | 95,60±3,07 |
| Аланінамінотрансфераза (АлАТ) | 0,14±0,03 | 0,12±0,01 |
| Аспартатамінотрансфераза (АсАТ) | 0,11±0,01 | 0,12±0,01 |
| Холестерин, ммоль/л | 5,20±0,20 | 5,30±0,20 |
| Глюкоза, ммоль/л | 5,38±0,33 | 5,42±0,14 |
Діагноз ОА встановлювали за критеріями EULAR.
Наявність гіперурикемії вважали у тому разі, коли рівень сечової кислоти у сироватці крові був >360 мкмоль/л.
Усім хворим проводили традиційні клінічні методи дослідження, що включали збір сімейного та індивідуального анамнезу.
ІМТ розраховували за формулою:
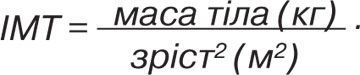
Вираженість суглобового синдрому оцінювали за такими параметрами: індекс WOMAC (за ВАШ), індекс Лекена.
Усім пацієнтам на початку спостереження проводили рентгенологічне дослідження колінних суглобів у прямій (передньозадній) і боковій проекціях. Рентгенологічну стадію ОА визначали за класифікацією J.H. Kellgren та J.S. Lawrence (1957).
З метою діагностики сечокам’яної хвороби чи іншої ниркової патології проводили ультразвукове дослідження органів позаочеревинного простору.
Усім хворим виконували загальноклінічні обстеження: загальний аналіз крові та сечі, глюкоза крові (ммоль/л), біохімічний аналіз крові з визначенням білірубіну (мкмоль/л), АлАТ, АсАТ, креатиніну (мкмоль/л), сечовини (ммоль/л).
Для визначення С-реактивного протеїну (СРП) використовували набір реагентів, який призначається для кількісного визначення СРП у сироватці крові. Рівень СРП визначали ≤5 мг/л — як низький, >5 мг/л — підвищений. Визначення швидкості осідання еритроцитів (ШОЕ) проводили за методом Панченка. Концентрацію сечової кислоти у крові визначали за допомогою набору реактивів «Філіст-Діагностика», Україна. Імунологічні дослідження включали кількісне визначення в сироватці крові рівня IL-1β («Bender MedSystems GmbH», Австрія),TNF-α («Orgenium», Фінляндія), IGF-1 («DRG», Німеччина), NO — імуноферментним методом. Облік реакції проводили на імуноферментному аналізаторі Lab-line — 100 («WestMedica», Австрія).
Для статистичної обробки даних застосовували програмно-математичний комплекс для персонального комп’ютера «Microsoft Exel 2007» (Microsoft) та комп’ютерні програми для статистичного аналізу та оброблення даних «Биостатистика», «STATISTICA 6.0» («StatSoftInc.», США), «SPSS Statistics 20» («IBM», США).
Отримані результати
Як видно із загальної характеристики учасників дослідження, тривалість захворювання на ОА була вищою у пацієнтів із гіперурикемією. У 1-й та 2-й групах переважали пацієнти із тривалістю захворювання 8–15 років (табл. 3). У 2-й групі відзначали більшу частку (14%) пацієнтів із тривалістю захворювання понад 16 років. Крім того, у 2-й групі 24% становили пацієнти із тривалістю захворювання до 3 років, що свідчить про більш ранній розвиток ОА за наявності гіперурикемії.
| Давність захворювання, років | Група | |||
|---|---|---|---|---|
| 1-ша | 2-га | |||
| n | % | n | % | |
| ≤3 | 6 | 17 | 13 | 24 |
| 4–7 | 11 | 31 | 10 | 18 |
| 8–15 | 16 | 44 | 24 | 44 |
| ≥16 | 3 | 8 | 8 | 14 |
Аналізуючи тяжкість ураження за рентгенологічними ознаками, можна відзначити, що у пацієнтів обох груп виявили ОА переважно ІІ стадії за класифікацією J.H. Kellgren та J.S. Lawrence (75 та 72% відповідно). Проте слід зазначити, що у 1-й групі у 8% діагностовано ОА І стадії, в той час як у 2-й групі ця стадія була відсутньою. Крім того, у 2-й групі була більша частка ОА ІІІ рентгенологічної стадії (28%) порівняно з 1-ю групою (17%) (табл. 4).
| Рентгенологічна стадія хвороби | Пацієнти | |||
|---|---|---|---|---|
| ОА (1-ша група) |
ОА і гіперурикемія(2-га група) | |||
| n | % | n | % | |
| І | 3 | 8 | – | – |
| ІІ | 27 | 75 | 40 | 72 |
| ІІІ | 6 | 17 | 15 | 28 |
| Усього | 36 | 100 | 55 | 100 |
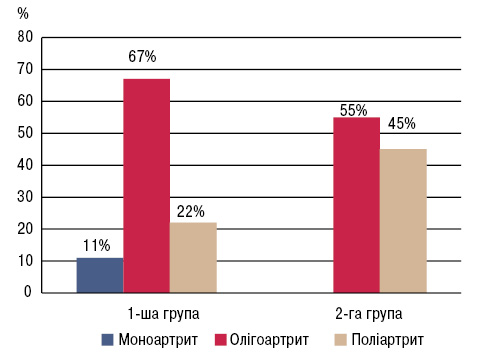
Результати детального аналізу характеру ураження опорно-рухового апарату свідчать про майже однакову частоту олігоартритичного ураження в обох групах (67 та 55% відповідно). У хворих із гіперурикемією виявлено частіше виникнення поліартриту (45%) порівняно з пацієнтами без гіперурикемії (22%). Моноартрит спостерігався у незначної частки (11%) учасників 1-ї групи, в той час у 2-й групі моноартриту зовсім не виявлено (рис. 2).
При дослідженні артрологічного статусу за індексами Лекена та WOMAC больовий синдром був практично однаковий в обох групах (табл. 5). Ранкова скутість за індексом WOMAC у 1-й групі становила 102,39±6,75 мм, в той час у пацієнтів 2-ї групи була дещо вищою — 110,76±5,44 мм, але статистично недостовірною. У хворих на ОА з гіперурикемією були статистично достовірно вищі показники болю за ВАШ та обмеження повсякденної активності за індексом WOMAC.
| Показник | ОА (1-ша група) |
ОА і гіперурикемія (2-га група) |
|---|---|---|
| ВАШ, мм | 47,22±1,36 | 52,89±1,11 |
| Індекс Лекена, балів | 11,78±0,76 | 11,82±0,47 |
| WOMAC, мм: | ||
| – біль | 231,97±18,67 | 230,65±11,75 |
| – скутість | 102,39±6,75 | 110,76±5,44 |
| – функціональна активність | 628,79±35,79 | 781,52±36,44 |
*Достовірність відмінностей р<0,05.
У 1-й групі рівень ШОЕ не перевищував норми та становив 14,03±1,44 мм/год, а у 2-й групі — був вищим, ніж у 1-й — 18,25±1,70 мм/год — та перевищував норму.
СРП у 2-й групі був значно вищим (статистично достовірно — р<0,05) — 11,85±1,74 мг/л, порівняно з 1-ю групою (6,3±2,0 мг/л). Результати можуть свідчити про наявність більш вираженого запального процесу у пацієнтів із ОА та гіперурикемією.
При дослідженні прозапальних цитокінів виявлено підвищений рівень TNF-α та IL-1 в обох групах. У пацієнтів із ОА та гіперурикемією ці показники були дещо вищі, хоча і статистично недостовірно. Так, у 1-й групі — TNF-α 23,56±2,64 нг/мл та IL-1 — 20,36±1,56 пг/мл, у 2-й — 32,86±5,13 та 22,73±3,88 пг/мл відповідно.
Рівень NO не відрізнявся в обох групах і становив 3,49±0,39 мкмоль/л у 1-й групі та 3,26±0,52 мкмоль/л — у другій.
Ще одним із важливих цитокінів, що бере участь у метаболізмі хряща, є IGF-1. IGF-1 сприяє проліферації та диференціюванню хондроцитів і гальмує апоптоз. Нами визначено, що рівень IGF-1 був нижчим за норму в обох групах. Проте більш значне його зниження спостерігалося у 2-й групі (44,78±3,91нг/мл) порівняно з 1-ю (68,68±5,44 нг/мл) (р<0,05), що можна пояснити більш вираженим зниженням процесів регенерації у пацієнтів із гіперурикемією.
Внаслідок проведеного аналізу отриманих даних, викладених вище, можна зробити такі висновки:
1. У пацієнтів з ОА та гіперурикемією тривалість захворювання на ОА була більшою.
2. Хворі на ОА з гіперурикемією мали більш ранній початок ОА та більш виражену рентгенологічну стадію, порівняно з пацієнтами з ОА без гіперурикемії.
3. Для пацієнтів із ОА з гіперурикемією більш характерний поліартрит та відсутність моноартриту.
4. Дані клінічного обстеження свідчать, що пацієнти з ОА та гіперурикемією відрізнялися більш тяжким перебігом ОА, а саме вираженістю болю за ВАШ та обмеженістю функціональної активності за індексом WOMAC.
5. Пацієнти з ОА та гіперурикемією характеризувалися наявністю більш вираженого запального процесу (за даними СРП) та зниження процесів регенерації (за даними IGF-1).
Отже, враховуючи отримані дані, слід планувати диференційований підхід до лікування пацієнтів з ОА та гіперурикемією.
Список використаної літератури
- Шуба Н.М., Воронова Т.Д., Тарасенко Т.М. та ін. (2012) Нові аспекти патогенезу остеоартрозу та шляхи корекції. Укр. ревматол. журн., 1(47): 51–58.
- Bijlsma J.W., Berenbaum F., Lafeber F.P. (2011) Osteoarthritis: an update with relevance for clinical practice. Lancet, 377: 2115–2126.
- Cronstein B.N., Terkeltaub R. (2006) The inflammatory process of gout and its treatment. Arthritis Res. Ther., 8(Suppl. 1): S3.
- Denoble A.E., Huffman K.M., Stabler T.V. et al. (2011) Uric acid is a danger signal of increasing risk for osteoarthritis through inflammasome activation. Proc. Natl. Acad. Sci USA, 108: 2088–2093.
- Kellgren J.H., Lawrence J.S. (1957) Radiological assessment of osteoarthrosis. Ann. Rheum. Dis., 16: 494–501.
- Martinon F., Pétrilli V., Mayor A. et al. (2006) Gout-associated uric acid crystals activate the NALP3 inflammasome. Nature, 440: 237–241.
- Muehleman C., Li J., Aigner T. et al. (2008) Association between crystals and cartilage degeneration in the ankle. J. Rheumatol., 35: 1108–1117.
- Pascual E., Ordonez S. (1998) Orderly arrayed deposit of urate crystas in gout suggest epitaxial formation. Ann. Rheum. Dis., 57: 255.
- Roddy E., Zhang W., Doherty M. (2007) Are joints affected by gout also affected by osteoarthritis? Ann. Rheum. Dis., 66: 1374–1377.
- Roddy E., Doherty M. (2012) Gout and osteoarthritis: A pathogenetic link? Joint Bone Spine, 79: 425–427.
Клинические особенности течения остеоартроза в сочетании с гиперурикемией
Резюме. В статье представлены современные данные литературы о сочетании остеоартроза и гиперурикемии. Проанализировано длительность заболевания, стадию поражения по рентгенологическим признакам, клинические особенности суставного синдрома у больных остеоартрозом и гиперурикемией. Исследована роль воспалительного компонента в развитии сочетанной патологии. С учетом полученных данных можно сделать вывод, что следует планировать дифференцированный подход к лечению пациентов с остеоартрозом и гиперурикемией.
остеоартроз, гиперурикемия, суставной синдром.
Адреса для листування:
Шуба Неоніла Михайлівна
04112, Київ, вул. Дорогожицька, 9
Національна медична академія
післядипломної освіти
ім. П.Л. Шупика

Leave a comment