Патогенетичне обҐрунтування застосування біологічних агентів при ревматичних хворобах з урахуванням сучасних наукових досліджень та рекомендацій
Резюме. У статті висвітлені останні рекомендації EULAR 2013 р. з лікування ревматоїдного артриту (РА), де зазначено відсутність переваг між біологічними агентами при першому їх призначенні, крім того, в рекомендаціях надається перевага в лікуванні РА комбінаціям біологічних агентів із синтетичними базовими протизапальними препаратами. Зазначено, що призначенню ритуксимабу надають перевагу перед іншими біологічними препаратами за певних умов. В останніх дослідженнях показано, що ритуксимаб більш ефективний у пацієнтів із серопозитивним РА порівняно із серонегативним, а також, що комбінація лефлуномід + ритуксимаб порівняно з комбінацією метотрексат + ритуксимаб має більш високі можливості синергічного ефекту. У дослідженнях 2012–2013 рр. показано пріоритетність монотерапії тоцилізумабом при РА над терапією блокаторами фактора некрозу пухлини-α, а також відсутність клінічної переваги комбінації тоцилізумаб + метотрексат над монотерапією тоцилізумабом з частішим підвищенням рівня трансаміназ при комбінації тоцилізумаб + метотрексат. Тоцилізумаб має переваги у лікуванні пацієнтів похилого віку, які приймають глюкокортикоїди у високих дозах та мають патологію верхніх дихальних шляхів, для запобігання виникненню серйозних інфекцій.
Агрессивное применение традиционных болезнь-модифицирующих препаратов и внедрение биологических препаратов привело к «жесткому контролю воспаления», а, следовательно, снижению инвалидности и нетрудоспособности, что является желательной терапевтической стратегией. Такие выводы были сделаны E. Krishnan и соавторами (2012) на основании проанализированных анкетных данных Health Assessment Questionnaire Disability Index (HAQDI) у 4651 взрослого пациента с ревматоидным артритом (РА) с 1983 по 2006 г. [1].
Ежегодно проводится обновление консенсуса по применению биологических препаратов в лечении ревматических болезней, в который добавляются новые биологические препараты, а также расширяются показания для уже внедренных в практику препаратов. Кроме того, в 2010 г. созданы новые клинические рекомендации по ведению РА, а в 2013 г. произошло их обновление. В последние годы благодаря внедрению в практику ведения больных РА биологических агентов получен значительный успех в достижении значительного клинического эффекта и в снижении радиографического прогрессирования РА.
Важным в менеджменте РА является выбор биологического препарата с наиболее оптимальной индивидуальной эффективностью [2].
В настоящее время выделяются три основных группы препаратов для лечения РА (рис. 1):
- Цитокиновые блокаторы.
- Лимфоцитонаправленные препараты.
- Низкомолекулярные ингибиторы путей передачи сигналов.
|
Цитокиновые блокаторы Например ингибитор ФНО (этанерцепт, адалимумаб и т.д.) и IL-6R (тоцилизумаб) |
Лимфоцитонаправленные препараты Например путем воздействия на В-клетки (ритуксимаб) и Т-клетки (абатацепт) |
Низкомолекулярные ингибиторы путем передачи сигналов Например ингибирование путей передачи сигнала JAK-STAT (тофацитиниб) |
Тут и далее: JAK — Янус-киназа; STAT — переносчики сигнала и активаторы транскрипции; ФНО — фактор некроза опухоли
Для выбора лекарственного средства необходимы достаточно надежные биомаркеры РА. Однако надежные биомаркеры для прогнозирования ответа на биологические препараты еще не установлены.
Следует указать, что биомаркеры, отображающие активность заболевания на ранних стадиях артрита, могут помочь принять индивидуальные решения относительно лечения.
Исследования связи с геномом могут быть полезны для определения прогрессирования хронического заболевания, ответа на отдельные биологические препараты, вероятного исхода с учетом безопасности и переносимости различных биологических препаратов.
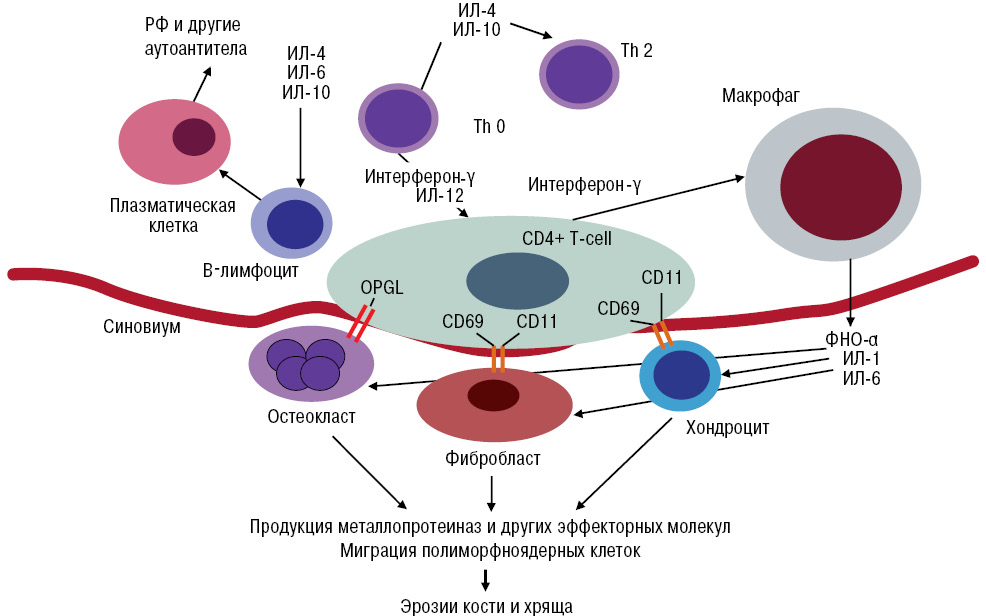
С учетом понимания механизмов действия препаратов важно рассмотреть патогенез РА (рис. 2).
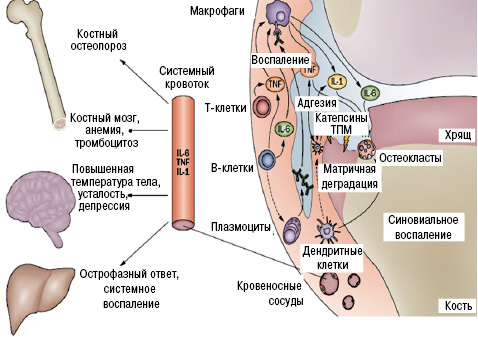
Как видно (см. рис. 2), синовиальное и системное воспаление ассоциируют с клиническими симптомами. Одной лишь оценки симптомов недостаточно для идентификации патологических механизмов и прогнозирования течения заболевания и ответа на конкретную терапию, в частности принимая во внимание важность вмешательства на максимально ранних стадиях заболевания.
При отсутствии надежных биомаркеров механизм действия может быть полезным инструментом при выборе биологического препарата для лечения больных РА [2].
Различные биологические препараты могут быть более или менее приемлемы у разных пациентов. Например, побочные явления, вызываемые разными биологическими препаратами, отличаются. Классоспецифические побочные явления отражают биологическую роль мишени. Так, ингибитор рецептора интерлейкина (ИЛ)-6 (тоцилизумаб) ассоциируют с улучшением показателей при анемии; тофацитиниб, низкомолекулярный селективный ингибитор JAK, снижает уровень гемоглобина.
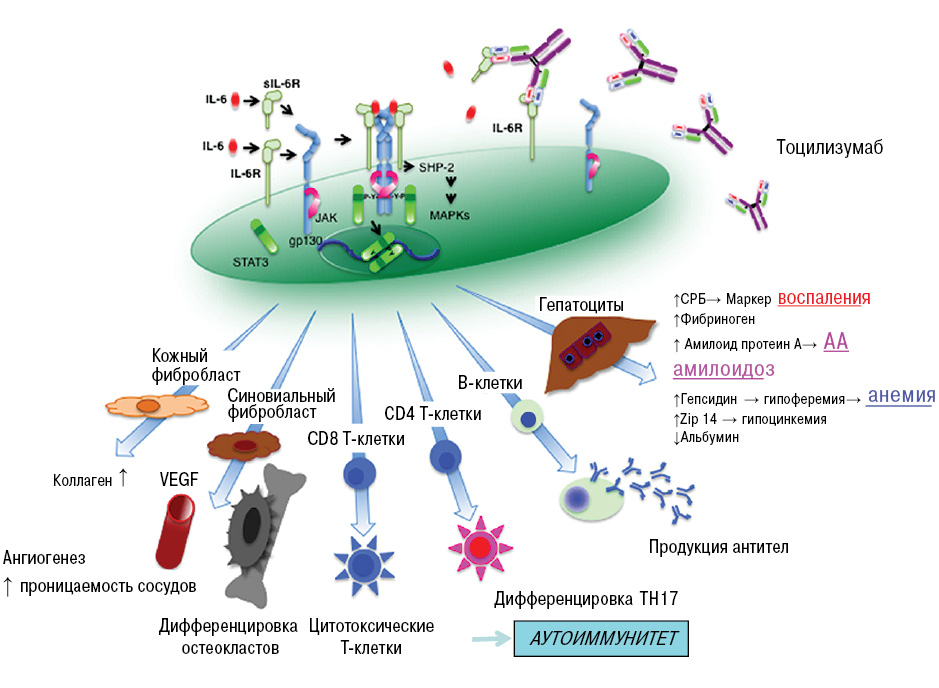
Для выбора биологического агента в лечении РА важно понимать механизм действия цитокинов, против которых направлен биологический агент. Например, цитокина ИЛ-6. С этой целью представлен рисунок по плейотропной активности ИЛ-6 (рис. 3).
Следует отметить, что различные цитокины используют разные пути передачи сигнала, то есть переход от одного пути передачи к другому может быть целесообразным [2](рис. 4).
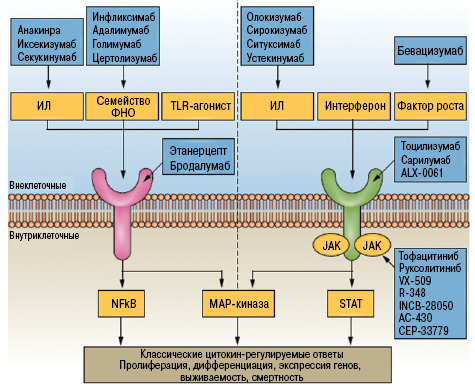
- Идентификация альтернативного режима передачи сигнала ИЛ-6 посредством растворимого рецептора ИЛ-6 значительно изменила традиционные взгляды на иерархию цитокинов.
- ФНО и ИЛ‑6 все чаще демонстрируют уникальную активность при РА.
- Переход от ингибирования ФНО до ИЛ‑6 может считаться целесообразным у пациентов, у которых лечение ингибированием ФНО оказалось неэффективным.
Комбинирование биологических агентов и синтетических базовых противовоспалительных препаратов (БПВП) в лечении ревматических болезней — потенциальный подход к улучшению исхода. Комбинации биологических препаратов могут действовать синергически, обеспечивая возможность значительного снижения дозы, кроме того, уменьшения частоты побочных эффектов, и в результате этого — комбинированная терапия может стать более экономически целесообразной [2].
В обновленных рекомендациях Европейской антиревматической лиги (EULAR) 2013 г., которые мы предлагаем к рассмотрению, отмечается отсутствие преимущества одного биологического агента над другим в лечении РА.
Рекомендации EULAR по лечению ревматоидного артрита [4] (рис. 5):
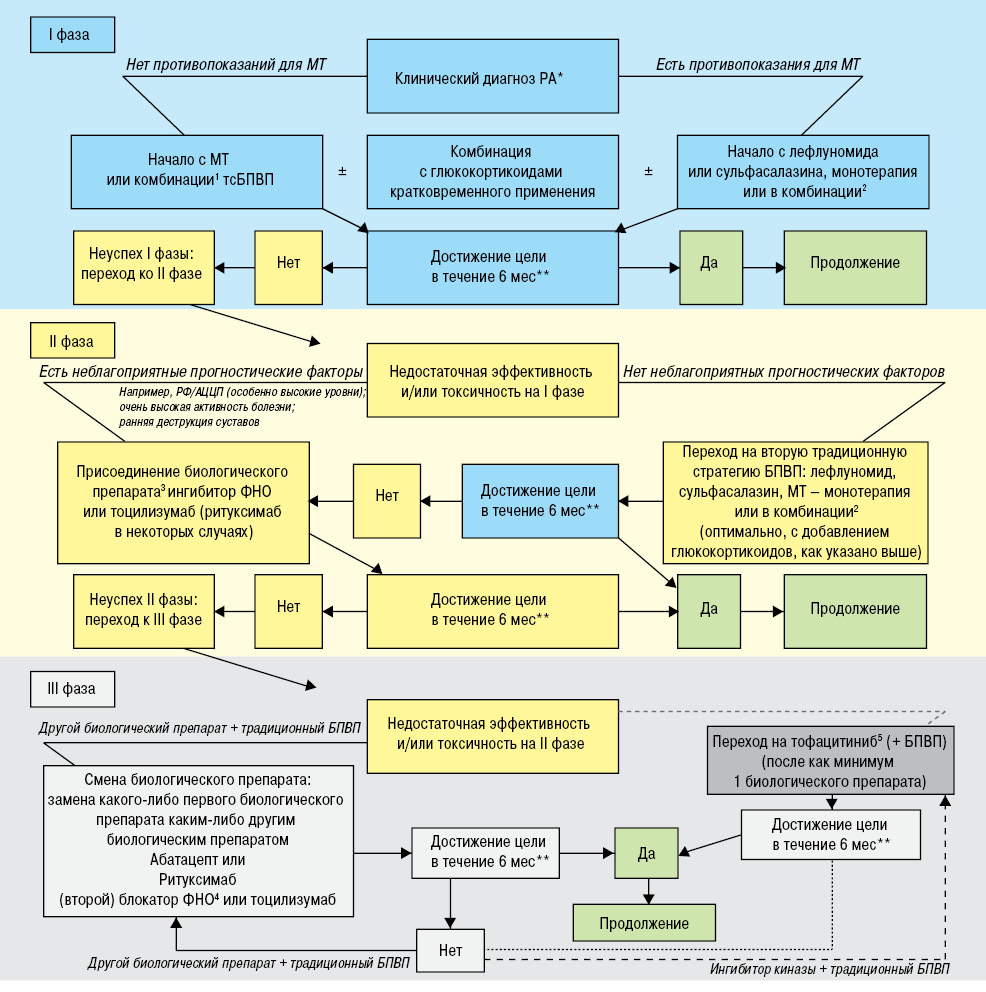
1. Терапию БПВП следует начать, как только установлен диагноз РА.
2. Целью лечения должно быть достижение ремиссии или низкой активности заболевания у каждого пациента.
3. Требуется ввести регулярный мониторинг при активной форме заболевания (каждые 1–3 мес); при отсутствии улучшения — максимум через 3 мес после начала лечения, или если цель не была достигнута через 6 мес, терапию следует корригировать.
4. У пациентов с активным РА метотрексат (МТ) следует применять как часть первой стратегии лечения.
5. При наличии противопоказаний к МТ (или ранней непереносимости), в рамках (первой) стратегии лечения следует применять сульфасалазин или лефлуномид.
6. У пациентов, ранее не получавших БПВП, независимо от приема глюкокортикоидов, следует проводить монотерапию традиционными синтетическими (тсБПВП) или комбинированную терапию тсБПВП.
7. Глюкокортикоиды в невысоких дозах следует применять в рамках начальной стратегии лечения (в комбинации с одним или несколькими тсБПВП) в течение максимум 6 мес, однако их дозу следует снижать сразу же после того, как это станет целесообразно с клинической точки зрения.
8. Если цель лечения не достигнута с помощью первой стратегии БПВП, при отсутствии неблагоприятных прогностических факторов, следует рассмотреть возможность перехода на другую стратегию тсБПВП; при наличии неблагоприятных прогностических факторов — рассмотреть возможность комбинированного лечения с применением биологических (бБПВП).
9. У пациентов с недостаточным ответом на МТ и/или другие стратегии тсБПВП, в комбинации с глюкокортикоидами или без них, бБПВП (ингибиторы ФНО*, абатецепт или тоцилизумаб и, в некоторых случаях, ритуксимаб) следует принимать в комбинации с МТ.
10. При неэффективности первой стратегии бБПВП пациенты начинают принимать другой бБПВП; при неэффективности первой терапии ингибиторами ФНО — пациенты могут получать другой ингибитор ФНО* или биологический препарат с другим механизмом действия.
11. Применение тофацитиниба можно рассмотреть после неэффективности лечения биологическим препаратом.
12. Если у пациента отмечается устойчивая ремиссия после снижения дозы глюкокортикоидов, можно рассмотреть возможность снижения дозыбБПВП, особенно если лечение проводится в комбинации с тсБПВП.
13. В случаях устойчивой долгосрочной ремиссии следует рассмотреть возможность осмотрительного снижения дозы тсБПВП на основе совместного решения пациента и врача.
14. При потребности в коррекции терапии необходимо учесть другие факторы, кроме активности заболевания, например прогрессирование структурных поражений, сопутствующие заболевания или аспекты безопасности.
В рекомендациях Рабочая группа пришла к тому, что все биологические агенты следует применять предпочтительно в комбинации с МТ или другими синтетическими (сБПВП). Ни для ингибиторов ФНО, ни для ритуксимаба или абатацепта не было достоверно установлено, что монотерапия ими была более эффективна по сравнению с МТ, однако более высокая эффективность комбинированной терапии была подтверждена.
При наличии неблагоприятных факторов при РА по рекомендациям обновленного консенсуса терапию РА можно начинать с биологических агентов без предшествующего назначения сБПВП.
Только тоцилизумаб многократно продемонстрировал более высокую эффективность в качестве монотерапии по сравнению с МТ или другими сБПВП. Тоцилизумаб в комбинации с МТ показал более высокую эффективность по сравнению с МТ. Прямое сравнительное исследование среди пациентов с РА, прекративших прием МТ, продемонстрировало, что монотерапия тоцилизумабом более эффективна по сравнению с монотерапией адалимумабом по большинству конечных точек [3].
При наличии неблагоприятных факторов при РА по рекомендациям обновленного консенсуса терапию РА можно начинать с биологических агентов без предшествующего применения сБПВП.
Однако раннее применение биологического препарата у пациентов, ранее не принимавших сБПВП, следует рассматривать в исключительных случаях по последним рекомендациям EULAR 2013 г.
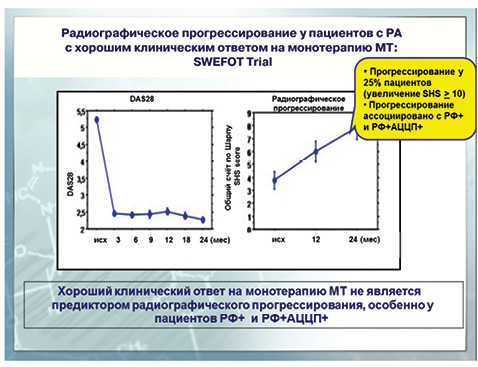
Основанием для применения биологической терапии является и тот факт, что монотерапия МТ в исследовании SWEFOT достигла хорошего клинического эффекта, однако радиографическое прогрессирование наблюдалось у 25% пациентов [5, 6] (рис. 6).
Препаратом, который может блокировать В-лимфоциты, а в последующем и цитокины, является ритуксимаб [4]. При наличии определенных противопоказаний для других биологических агентов, таких как наличие недавней лимфомы в анамнезе, латентный туберкулез, при наличии противопоказаний к использованию химиопрофилактики, а также у живущих в эндемичных по туберкулезу регионах, или при предыдущем анамнезе демиелинизирующих заболеваний, ритуксимаб можно рассматривать в качестве первой линии биологического агента. Также приоритет ритуксимабу отдают у пациентов с любой злокачественной опухолью в анамнезе, поскольку отсутствуют данные, что применение ритуксимаба связано с возникновением малигнизации.
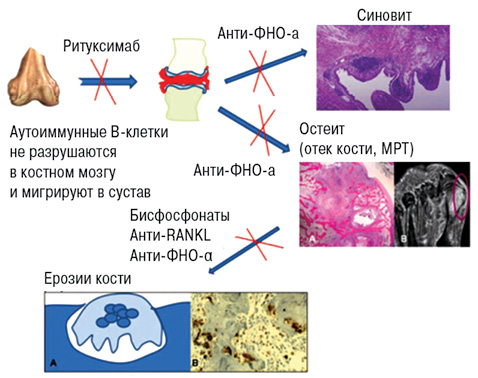
Основной механизм действия ритуксимаба — это истощение В-лимфоцитов, запускающих механизм развития РА, прерывая воспаление и развитие эрозий [8] (рис. 8).
Результаты исследования John D. Isaacs и соавторов (2013) [9] свидетельствуют, что ритуксимаб более эффективен у пациентов с сероположительным РА, чем у пациентов с сероотрицательным РА.
Результаты исследования CERERRA [10] при анализе 10 Европейских регистров с участием 1195 пациентов показали, что комбинация лефлуномид + ритуксимаб по эффективности и безопасности является альтернативой комбинации МТ + ритуксимаб и имеет более высокие возможности синергического эффекта.
В 2-летнем рандомизированном контролируемом исследовании IMAGE[11], посвященном изучению постоянного ингибирования радиологической прогрессии поражения суставов, обусловленного применением ритуксимаба с МТ при раннем активном РА, установлено, что лечение 755 пациентов ритуксимабом 1000 мг 2 раза в сутки + МТ привело к стабильному улучшению радиографических, клинических и фунциональных признаков после 2-летнего лечения. Исследование H.G. Raterman и соавторов (2013) [12] продемонстрировало положительные эффекты лечения ритуксимабом на уровень холестерина и снижения активности заболевания.
Препаратом, который может блокировать и клеточный, и гуморальный иммунитет, является тоцилизумаб — блокатор рецепторов к ИЛ-6. В обновленном консенсусе 2012 г. FDA предложили начинать терапию тоцилизумабом с 4 мг/кг массы тела с последующим повышением до 8 мг/кг каждые 4 нед при необходимости [13, 14] (таблица).
| EMA-регион | FDA-регион | Япония | |
|---|---|---|---|
| РА | 8 мг/кг каждые 4 нед | 4 мг/кг каждые 4 нед, инициация, с повышением до 8 мг/кг каждые 4 нед при необходимости | 8 мг/кг каждые 4 нед |
| Болезнь Кастелмана |
8 мг/кг каждые 2 нед (интервал может быть уменьшен до 1 нед) |
В исследовании Rose study [15] у пациентов, которые адекватно не отреагировали на базисную терапию химическими препаратами, отмечен быстрый эффект тоцилизумаба: выраженность клинических симптомов по DAS28, а также значительное снижение уровня СРБ отмечали уже в начале 1-й недели терапии.
По данным постмаркетингового исследования у больных РА в Японии [16], в котором участвовал 3881 пациент, тоцилизумаб является приемлемой и безопасной терапией в реальной клинической практике. Тоцилизумаб необходимо применять с учетом соотношения польза/риск, чтобы избежать серьезных инфекций у пациентов пожилого возраста и тех, кто применяет глюкортикоиды в высоких дозах или с наличием патологии дыхательной системы.
В последних исследованиях 2013 г. показана эффективность монотерапии тоцилизумабом.
Результаты исследования ACT-RAY [17] у 556 пациентов с РА через 24 нед показали отсутствие клинического превосходства комбинации тоцилизумаб + МТ по сравнению с монотерапией тоцилизумабом. На фоне комбинированного лечения тоцилизумаб + МТ чаще отмечали повышенный уровень трансаминаз. Значимого клинического и рентгенологического ответа удалось достичь на фоне обеих схем лечения, что указывает на возможную ценность монотерапии тоцилизумабом у пациентов с РА данной категории.
В исследовании S. Finzel и соавторов (2013) [18] выявлено, что блокада рецепторов к ИЛ-6 ассоциируется с репарацией костных эрозий у пациентов с РА. Репарация блокаторами рецептора ИЛ-6 основана на уменьшении ширины и глубины эрозий, в отличие от репарации блокаторами ФНО-α, где наблюдалось только уменьшение глубины эрозий.
В исследовании DREAM [19] изучены возможности достижения безмедикаментозной ремиссии/низкой активности заболевания у пациентов с РА после отмены монотерапии тоцилизумабом. По полученным данным, монотерапия тоцилизумабом может индуцировать безбиологическую ремиссию/низкую активность заболевания, без сопутствующего применения сБПВП. Среди пациентов, достигших низкой активности заболевания (70,8% из них имели ремиссию по DAS28) в течение длительной монотерапии тоцилизумабом, эффективность сохранялась в течение 1 года после отмены тоцилизумаба без дополнительного применения сБПВП или иммуносупрессантов; у 79% этих пациентов эффективность сохранялась также и без сопутствующего применения глюкокортикоидов и нестероидных противовоспалительных препаратов. Исследователи также определили, что уровни ИЛ-6 и матриксных металлопротеиназ-3 в сыворотке крови могут быть полезными маркерами для идентификации пациентов, которые могли бы прекратить прием тоцилизумаба без обострения заболевания.
Исследование ADACTA [20] убедительно продемонстрировало, что монотерапия тоцилизумабом превосходит по эффективности монотерапию адалимумабом по снижению активности РА у пациентов, у которых отсутствует ответ на предшествующую терапию МТ или продолжение лечения МТ невозможно (или не показано). При этом профиль безопасности обоих препаратов соответствовал представленным ранее данным клинических исследований.
Применение иммунобиологической терапии, особенно в комбинации с сБПВП, приводит к значительному снижению иммунного ответа, повышенному риску заболевания гриппом, поэтому очень важно решение вопроса о возможности вакцинации. S. Mori и соавторы(2012) [21] изучали влияние терапии тоцилизумабом на иммунный ответ на вакцинацию против гриппа у больных РА. Результаты исследования показали, что тоцилизумаб не препятствует иммунному ответу на вакцинацию против гриппа у пациентов с РА. Вакцинация против гриппа считается эффективной в защите пациентов с РА, получавших терапию тоцилизумабом с или без МТ.
Как итог изложенного можно сделать следующее заключение:
- важным в рекомендациях EULAR 2013 г. явилось отсутствие предпочтений в биологических агентах при первом их назначении;
- в рекомендациях EULAR 2013 г. отдается предпочтение в лечении больных РА комбинациями биологических агентов с сБПВП;
- предпочтение назначения ритуксимаба при определенных условиях;
- ритуксимаб более эффективен у пациентов с серо(+) РА, по сравнению с серо(–);
- комбинация лефлуномид + ритуксимаб по сравнению с МТ + ритуксимаб имеет более высокие возможности синергического эффекта;
- в обновленном консенсусе 2012 г. показана возможность (по FDA) начинать терапию тоцилизумабом с 4 мг/кг, а при необходимости — повышать дозу до 8 мг/кг;
- установлено предпочтение назначения тоцилизумаба как монотерапии в отличие от блокаторов ФНО-α;
- тоцилизумаб предпочтительнее назначать, чтобы избежать серьезных инфекций у лиц пожилого возраста и тех, кто применяет глюкокортикоиды в высоких дозах или с наличием патологии дыхательной системы;
- вакцинация против гриппа считается эффективной в защите больных РА, применявших терапию тоцилизумабом с или без МТ.
Список использованной литературы
1. Eswar Krishnan et аl. (2012) Disability in rheumatoid arthritis in the era of biological treatments. Ann. Rheum. Dis., 71: 213–218.
2. Choy E.H. et аl. (2013) The problem of choice: current biologic agents and future prospects in RA. Nat. Rev. Rheumatol., 9:154–163.
3. Tanaka T. et al. (2011) Anti-interleukin-6 receptor antibody, tocilizumab, for the treatment of autoimmune diseases . FEBA Lett. (doi:10/1016/i.febslet.2011.03.03).
4. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs: 2013 update. Josef S. Smolen et al. (2013) ARD Online First, published on October 25, 2013 as 10.1136/annrheumdis-2013-204573
5. Wallin H. et al. (2010) In early Rheumatoid Arthritis, patients with a good initial response to mtx monotherapy have excellent clinical outcomes over two years of therapy but radiological progression is not completely prevented EULAR 2010. Abstract THU0198
6. Rezaei H. et al. (2010) Radiological progression in patients with early ra and a good clinical response to mtx monotherapy: predictors and clinical implications EULAR 2010. Abstract op0041
7. Choy E.H.S., Panayi G.S. (2001) Cytokine Pathways and Joint Inflammation in Rheumatoid Arthritis. N. Engl. J. Med., 344: 907–916.
8. The ‘disconnect’ between synovitis and erosion in rheumatoid arthritis: a result of treatment or intrinsic to the disease process itself? (2011) Fiona McQueen, Esperanza Naredo. Ann. Rheum. Dis., 70 (241244 10.1136/ard.2010.139535).
9. John D. Isaacs et al. (2013) Effect of baseline rheumatoid factor and anticitrullinated peptide antibody serotype on rituximab clinical response: a meta-analysis. Ann. Rheum. Dis., 72(3): 329–336.
10. Katerina Chatzidionysiou, Elisabeth Lie et al. (2012) Effectiveness of disease-modifying antirheumatic drug co-therapy with methotrexate and leflunomide in rituximab-treated rheumatoid arthritis patients: results of a 1-year follow-up study from the CERERRA collaboration. Ann. Rheum. Dis., 71: 374–377.
11. Paul P. Tak et al. (2012) Sustained inhibition of progressive joint damage with rituximab plus methotrexate in early active rheumatoid arthritis: 2-year results from the randomised controlled trial IMAGE. Ann. Rheum. Dis., 71: 351–357.
12. Hennie G. Raterman et al. (2013) HDL protein composition alters from proatherogenic into less atherogenic and proinfl ammatory in rheumatoid arthritis patients responding to rituximab. Ann. Rheum. Dis., 72(4): 560–565.
13. Alexandra N. et al. (2012) Colebatch EULAR recommendations for the use of imaging of the joints in the clinical management of rheumatoid arthritis. Ann. Rheum. Dis.,70(Suppl. 1) (1i2-i36, doi 1136|ard 2010 146852).
14. Khalid Muhammad et al. (2011) Impact of IL-6 receptor inhibition on human memory B cells in vivo: impaired somatic hypermutation in preswitch memory B cells and modulation of mutational targeting in memory B-cells. Ann. Rheum., 70 (1507–1510. doi:10.1136/ard.2010.141325).
15. Yusuf Yazici et al. (2012) Efficacy of tocilizumab in patients with moderate to severe active rheumatoid arthritis and a previous inadequate response to disease-modifying antirheumatic drugs: the ROSE study. Ann. Rheum. Dis., 71: 198–205.
16. TaKao Koike et al. (2011) Postmarketing surveillance of tocilizumab for rheumatoid arthritis in Japan: interim analysis of 3881 patients. Ann. Rheum. Dis., 70: 2148–2151.
17. Dougados M. et al. (2013) Adding tocilizumab or switching to tocilizumab monotherapy in methotrexate inadequate responders: 24-week symptomatic and structural results of a 2-year randomised controlled strategy trial in rheumatoid arthritis (ACT-RAY). Ann. Rheum. Dis., 72(1): 43–50.
18. Finzel St. et al. (2013) Interleukin-6 receptor blockade induces limited repair of bone erosions in rheumatoid arthritis: a micro CT study. Ann. Rheum. Dis., 72: 396–400.
19. Drug free Remission/low disease activity after cessation of tocilizumab (Actemra) Monotherapy (DREAM) study Norihiro Nishimoto et al. (2013) Mod. Rheumatol., Japan College of Rheumatology, 15 April 2013.
20. Gabay С. et al. (2012) Tocilizumab (tcz) monotherapy is superior to adalimumab (ada) monotherapy in reducing disease activity in patients with rheumatoid arthritis (ra): 24-week data from the phase 4 adacta trial EULAR 2012-5765.
21. Mori S. et al. (2012) Impact of tocilizumab therapy on antibody response to influenza vaccine in patients with rheumatoid arthritis. Ann. Rheum. Dis., 71: 2006–2010.
Адрес для переписки:
Шуба Неонила Михайловна
04112, Киев, ул. Дорогожицкая, 9
Национальная медицинская академия
последипломного образования
им. П.Л. Шупика

Leave a comment