Ревматичні імунозалежні побічні ефекти імунотерапії раку
Golovach I.Yu.1, Yehudina Ye.D.2, Ter-Vartanіan S.Kh.2
- 1Клінічна лікарня «Феофанія» Державного управління справами, Київ
- 2Клиника современной ревматологии, Киев
Резюме. Протягом останніх десятиліть імунотерапія зробила революцію в лікуванні ракових захворювань. Однак швидке зростання застосування сімейства терапевтичних агентів, відомих як інгібітори імунних контрольних точок (ІІКТ), асоційоване з виникненням нової групи клінічних станів — імунозалежних побічних ефектів (ІЗПЕ), при яких у патологічний процес втягується практично будь-яка система органів. Мета дослідження: проаналізувати і підсумувати наявну інформацію про ІЗПЕ і ревматичні ІЗПЕ. Матеріал і методи. Виконано огляд сучасної літератури, присвяченої ревматичним ІЗПЕ, які розвинулися внаслідок імунотерапії раку. Пошук проведений з використанням п’яти баз даних: Medline, Medline Complete, Academic Search Complete, The Cochrane Library і PubMed в період 2013–2019 рр. Використовували такі ключові слова: інгібітори імунної контрольної точки, імунозалежні побічні ефекти, ревматологічний, артрит, міозит, ревматична поліміалгія, імунотерапія, імунна токсичність, менеджмент. Результати та обговорення. Ревматичні ІЗПЕ — досить поширене ускладнення ІІКТ, вони мають свої відмінні риси, включаючи мінливий час клінічного початку і здатність зберігатися на невизначений термін, навіть після припинення терапії ІІКТ. Роль ревматологів і їх участь у менеджменті пацієнтів із ревматичними ІЗПЕ (артрит, міозит, сухий синдром, васкуліт, міокардит, пульмоніт та ін.) є провідними. У цьому огляді літератури описані механізми дії ІІКТ, що спричиняють ревматичні ІЗПЕ, епідеміологія, клінічна характеристика, менеджмент пацієнтів із ревматичними ІЗПЕ згідно з провідними керівними принципами. Висновки. Ревматологи повинні знати цей новий вид ревматичних станів і стати центральними партнерами в міжпрофесійних командах, які займаються менеджментом ІЗПЕ у процесі імунотерапії пацієнтів з раковими захворюваннями.
Резюме. Последние десятилетия иммунотерапия произвела революцию в лечении раковых заболеваниях. Однако быстрый рост применения семейства терапевтических агентов, известных как ингибиторы иммунных контрольных точек (ИИКТ), ассоциирован с возникновением новой группы клинических состояний — иммунозависимых побочных эффектов (ИЗПЭ), при которых в патологический процесс вовлекается практически любая система органов. Цель исследования: проанализировать и суммировать существующую информацию об ИЗПЭ и ревматических ИЗПЭ. Материал и методы. Выполнен обзор современной литературы, посвященной ревматическим ИЗПЭ, развившимся вследствие иммунотерапии рака. Поиск проведен с использованием пяти баз данных: Medline, Medline Complete, Academic Search Complete, The Cochrane Library и PubMed в период 2013–2019 гг. Использовались такие ключевые слова: ингибиторы иммунных контрольных точек, иммунозависимые побочные эффекты, ревматологический, артрит, миозит, ревматическая полимиалгия, иммунотерапия, иммунные токсические эффекты, менеджмент. Результаты и обсуждения. Ревматические ИЗПЭ — достаточно распространенное осложнение терапии ИИКТ, имеющее отличительные особенности, включая изменчивое время клинического начала и способность сохраняться на неопределенный срок, даже после прекращения терапии ИИКТ. Роль ревматологов и их участие в ведении пациентов с ревматическими ИЗПЭ (артрит, миозит, сухой синдром, васкулит, миокардит, пульмонит и др.) являются ведущими. В этом обзоре литературы описаны механизмы действия ИИКТ, обусловливающие ревматические ИЗПЭ, эпидемиология, клиническая характеристика, менеджмент пациентов с ревматическими ИЗПЭ согласно ведущим руководящим принципам. Выводы. Ревматологи должны знать этот новый вид ревматических состояний и стать центральными партнерами в межпрофессиональных командах, занимающихся менеджментом ИЗПЭ в процессе иммунотерапии пациентов с онкологическими заболеваниями.
DOI: 10.32471/rheumatology.2707-6970.78.12977
Иммунотерапия совершила революцию в лечении рака и теперь занимает центральную роль в клиническом менеджменте пациентов со злокачественными новообразованиями [26]. И хотя существуют различные методы лечения злокачественных новообразований, включая прорыв в клеточной терапии, наиболее часто используемый подход заключается в назначении моноклональных антител, специфичных к молекулам иммунной контрольной точки (ИКТ), так называемые ингибиторы иммунных контрольных точек (ИИКТ).
Разработка новых ИИКТ развивается стремительно, в ближайшие годы ученые прогнозируют дальнейшее увеличение числа пациентов, получавших ИИКТ, кроме того, 50 новых ИИКТ уже находятся в клинической разработке. В Соединенных Штатах Америки продолжаются клинические испытания >800 иммунотерапевтических препаратов с участием >100 тыс. больных раком [64].
ИИКТ регулируют активацию и эффекторную функцию Т-клеток и являются высокоэффективным подходом при лечении широкого спектра раковых заболеваний [10]. В результате применения этого метода лечения произошли изменения в профиле токсичности использования противораковой терапии: уменьшение иммуносупрессивных осложнений, таких как тяжелые инфекции, связанные с традиционной химиотерапией, и увеличение выраженности и частоты аутоиммунных или аутовоспалительных побочных явлений — иммунозависимых побочных эффектов (ИЗПЭ) [53]. ИЗПЭ могут возникать в виде изолированных или комбинированных токсических эффектов в результате иммунной активации, патогенез которой не совсем понятен на сегодняшний день.
Примечательно, что течение ИЗПЭ происходит с вовлечением любой системы органов [53]. Среди этих побочных эффектов одним из наиболее частых являются ревматические осложнения [64]. ИЗПЭ являются сложной задачей для специалистов как в диагностике, так и в лечении, они могут быть жизнеугрожающими, проявляться поражением различных органов и систем, иногда трансформироваться в хронические заболевания. ИЗПЭ могут приобретать самостоятельное течение, независимо от применяемой иммунотерапии рака, и доминировать в клинической картине. В связи с быстрым развитием и распространением терапии ИИКТ в настоящее время понимание патогенеза, знание необходимых диагностических процедур, проведение профилактики и лечения ревматических ИЗПЭ крайне важно для ревматологов, поскольку их участие в ведении этих пациентов является ведущим. Ревматологам есть что добавить в плане диагностических мероприятий и терапевтических вмешательств для пациентов, у которых развиваются типичные ревматические ИЗПЭ, такие как артрит, миозит, «сухой синдром», васкулит, миокардит, пульмонит и др.
В данном обзоре литературы представлены наиболее часто отмечаемые ревматические ИЗПЭ на фоне терапии ИИКТ, их иммунопатогенез, эпидемиология, клинические проявления, подходы к менеджменту этих пациентов.
ИКТ и их ингибиторы
Растущие знания об ИЗПЭ в целом, и ревматических ИЗПЭ в частности, требуют фундаментального понимания основ биологии иммунологических контрольных точек и последствий их ингибирования [66]. Генерализованная активация иммунной системы обусловлена нейтрализацией ИКТ. Данные доклинических экспериментов и клинических исследований подтверждают важную роль ИКТ в поддержании иммунной толерантности и защите «хозяина» от аутоиммунных и аутовоспалительных заболеваний [67]. В исследованиях на животных с нокаутированными цитотоксическими T-лимфоцитассоциированными антигенами 4 (CTLA4) и запрограммированным лигандом гибели клеток 1 (PD-1) выявлены аутоиммунные и аутовоспалительные заболевания различной степени выраженности [52]. У лиц с дисфункцией или недостаточной экспрессией CTLA4 было выявлено несколько первичных иммунодефицитов, ассоциированных с развитием аутоиммунных заболеваний [43]. Отметим, что в двух исследования предоставлены доказательства того, что как минимум при двух ревматических заболеваниях (ревматоидный артрит [24] и гигантоклеточный артериит (ГКА) [70]) дефектная передача сигналов от ингибированных PD-1 участвует в патогенезе этих состояний. Исследования также свидетельствуют, что дисфункция ИКТ может вносить непосредственный вклад в патогенез аутоиммунных заболеваний и активность болезни, предоставляя объяснение тому, как ИИКТ могут вызвать аутоиммунные реакции.
Целевые лиганды ИИКТ, в основном экспрессируясь на поверхности Т-клеток, приводят к ингибированию персистирующих Т-клеточных ответов. Эти лиганды, известные как ИКТ, функционируют для защиты «хозяина» в условиях хронического воздействия антигена и, по-видимому, ограничивают вторичное повреждение во время иммунных реакций в ответ на хроническую инфекцию (например вирус гепатита С или ВИЧ) или злокачественную опухоль [27]. Т-клетки в условиях хронической стимуляции становятся истощенными. Истощенные Т-клетки экспрессируют молекулы ИКТ на клеточной поверхности и подвергаются многоуровневой потере эффекторных функций и изменению их метаболических и эпигенетических профилей [8]. Кроме того, в исследовании аутоиммунных заболеваний, включая васкулиты, ассоциированные с антиядерными цитоплазматическими антителами (ANCA), и системную красную волчанку, истощение Т-клеток коррелирует с низкой активностью заболевания [46]. Понимание того, что терапия ИИКТ связана с переходом от истощенного T-клеточного фенотипа к активному эффекторному фенотипу, может помочь объяснить общую иммунную активацию, которая может способствовать патогенезу как ревматических, так и неревматических ИЗПЭ [28]. Еще одним доказательством генерализованной иммунной активации на фоне терапии ИИКТ являются свидетельства увеличения выработки воспалительных цитокинов (включая интерлейкин (ИЛ)-17), а также демонстрация того, что избирательное нацеливание на цитокины (особенно ингибиторами фактора некроза опухоли (ФНО)) эффективно при лечении таких осложнений [20].
Таким образом, ИКТ функционируют в качестве «тормозов» для хронически активированной иммунной системы, а ИИКТ, противодействуя этому, активизируют иммунный ответ [8]. Биология Т-клеточных контрольных точек и патогенез их ингибирования представлены на рис. 1 и 2.
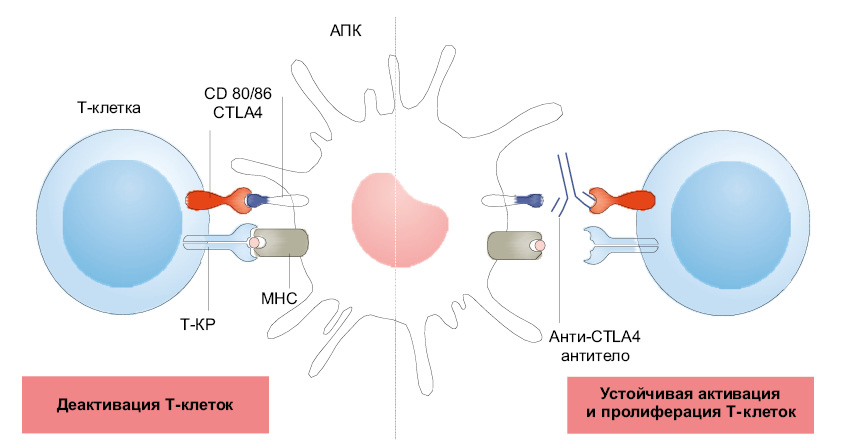
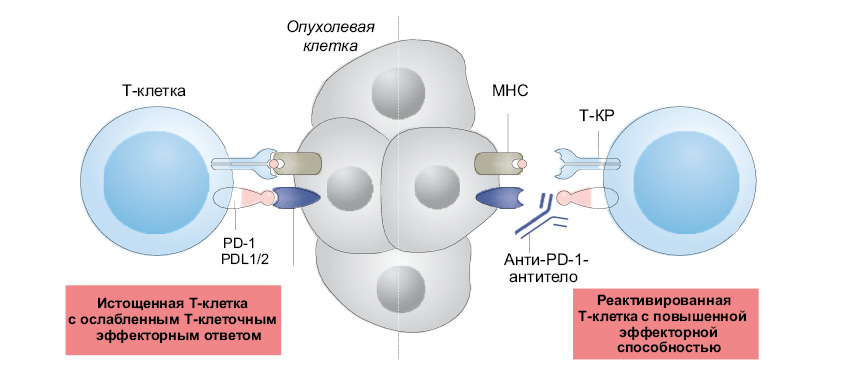
На рис. 1 и 2: MHC — главный комплекс гистосовместимости; АПК — антигенпрезентирующая клетка; T-КР — T-клеточный рецептор.
В лимфатических узлах наивные Т-клетки активируются сигналом 1 (родственный антиген, представленный антигенпрезентирующей клеткой) и сигналом 2 (CD28, взаимодействующие с CD80 или CD86), что приводит к пролиферации и активации эффекторных Т-клеток [56]. Эти события увеличивают экспрессию на клеточной поверхности CTLA4, которые могут связывать CD80 и CD86 с большей авидностью, чем CD28 (см. рис. 1а). Это взаимодействие функционирует как ранняя контрольная точка, приводящая к деактивации Т-клеток. Анти-CTLA4 ИИКТ нейтрализует эту центральную контрольную точку и, как следствие, порог активации Т-клеток уменьшается, что приводит к пролиферации Т-клеток (см. рис. 1b), за которой следует сопутствующее увеличение разнообразия спектра Т-клеток [29]. Эти события могут усиливать противоопухолевую активность реактивированных Т-клеток, но могут также вызывать ИЗПЭ.
В отличие от CTLA4, который функционирует рано и преимущественно во вторичных лимфоидных тканях, запрограммированный белок гибели клеток 1 (PD-1) (член суперсемейства CD28) экспрессируется на Т-клетках, которые эмигрируют от лимфатических узлов и функционируют в периферических тканях, например в таких, как опухоль. PD-1 связывается либо с PD-L1 (широко экспрессируемым во многих тканях), либо с PD-L2 (ограниченным антигенпрезентирующими клетками) [5]. Ингибирование PD-1 ИИКТ является комплексным, учитывая, что одобренные Управлением по санитарному надзору за качеством пищевых продуктов и лекарственных средств США (FDA) препараты могут по-разному нацеливаться либо на PD-1, либо на PD-L1 (табл. 1). Специфичные для PD-L1 ингибиторы воздействуют и на PD-L2, который, по-видимому, необходим для эффективного иммунитета, опосредованного CD4+ T-клетками [32]. Последствия этой специфичности заключаются в развитии различных ИЗПЭ [2].
| Лекарственный препарат | Одобрен в году | Терапевтическая мишень | Показания |
|---|---|---|---|
| Атезолизумаб | 2016 | PD-L1 | Немелкоклеточный рак
Уротелиальный рак |
| Авелумаб | 2017 | PD-L1 | Клеточная карцинома Меркеля
Уротелиальный рак |
| Цемиплимаб | 2018 | PD-L1 | Кожный плоскоклеточный рак |
| Дурвалумаб | 2017 | PD-L1 | Уротелиальный рак
Немелкоклеточный рак |
| Ипилимумаб | 2011 | CTLA-4 | Меланома |
| Ниволумаб | 2014 | PD-1 | Классическая лимфома Ходжкина
Гепатоцеллюлярная карцинома Меланома Немелкоклеточный рак легкого Карцинома почек Мелкоклеточный рак легкого Плоскоклеточный рак головы и шеи Уротелиальный рак |
| Пембролизумаб | 2014 | PD-1 | Рак шейки матки
Классическая лимфома Ходжкина Гастральная или гастроэзофагеальная аденокарцинома Гепатоцеллюлярная карцинома Меланома Солидные опухоли MSI-H или dMMR Немелкоклеточный рак легкого Плоскоклеточный рак легкого Медиастинальная В-клеточная лимфома Плоскоклеточный рак головы и шеи Уротелиальный рак |
| Комбинации ипилимумаба и ниволумаба | 2015 | CTLA-4/ PD-1 | Меланома
Колоректальная карцинома Карцинома почек Немелкоклеточный рак легкого |
Для иммунотерапии рака FDA и Европейским агентством по лекарственным средствам (EMA) одобрены семь ИИКТ (см. табл. 1). Как уже упоминалось, механизм их действия направлен на восстановление нормального противоопухолевого иммунного ответа путем блокирования ингибиторных рецепторов Т-лимфоцитов, так называемых ключевых точек иммунитета, и связанных с ними ингибиторных сигналов, позволяющих опухолевым клеткам уклоняться («ускользать») от иммунологического надзора [66].
Неревматические ИЗПЭ
Течение ИЗПЭ может происходить с вовлечением практически любой системы органов и очень часто они отмечаются у пациентов, получающих ИИКТ (рис. 3).
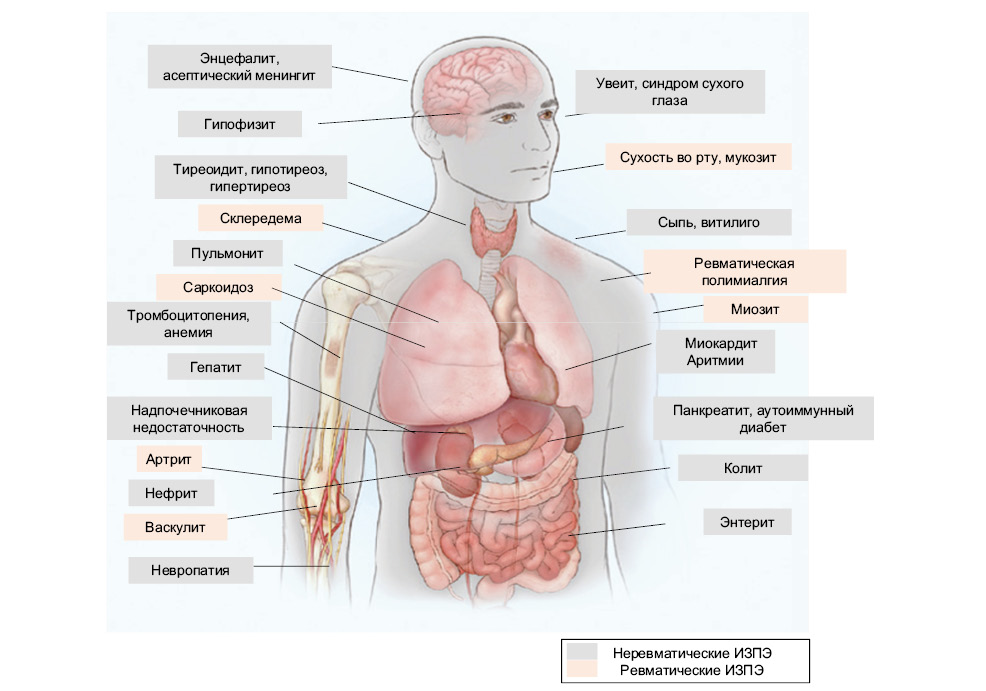
В некоторых клинических испытаниях ИЗПЭ любой степени токсичности регистрировались у ≈90% пациентов, получавших терапию ИИКТ [19]. В метаанализе A. Bertrand и соавторов (2015) частота ИЗПЭ, ассоциированных с терапией анти-CTLA4, составила ≈75%, а с анти-PD-1 и/или анти-PD-L1 — ≈30% [4]. Оценку степени выраженности ИЗПЭ можно провести, используя общие терминологические критерии для нежелательных явлений Национального института рака США (CTCAE), согласно которой 1-й и 2-й классы токсичности считаются легкими, 3-й и 4-й классы — тяжелыми, а 5-й — жизнеугрожающим и летальным [54].
Хотя ИЗПЭ могут возникать на фоне лечения любого типа опухоли любым ИИКТ, некоторые паттерны токсичности ассоциированы со специфическими лекарственными средствами или разновидностями опухоли [33]. Как правило, токсичность зависит от класса лекарственного средства. Так, отмечено, что анти-CTLA4 более токсичны, чем антитела, направленные на PD-1 или PD-L1: у 43% пациентов, получавших ипилимумаб (анти-CTLA4-антитело), развивались ИЗПЭ 3-й степени токсичности (или более), по сравнению с <20% пациентов, получавших анти-PD-1 или анти-PD-L1 антитела [54]. Кроме того, на паттерн ИЗПЭ влияет тип опухоли, при этом в систематическом обзоре L. Khoja и соавторов (2017) проспективных исследований монотерапии ИИКТ сообщается о более высокой частоте возникновения колита (отношение шансов (ОШ) 4,2, 95% доверительный интервал (ДИ) 1,3–14,0), кожных ИЗПЭ (ОШ 1,8, 95% ДИ 1,4–2,3) и меньшей частоте пневмонита (ОШ 0,4, 95% ДИ 0,3–0,7) у пациентов с меланомой в сравнении с пациентами с немелкоклеточным раком легкого [33].
Несмотря на то что большинство ИЗПЭ проявляются легкой или умеренной степенью тяжести, фатальные осложнения могут возникать у 2% пациентов, получающих ИИКТ (в зависимости от конкретного терапевтического агента) [54], которые в основном вызваны фульминантным поражением кишечника или легких (пневмонитом), реже — миокардитом, токсическим эпидермальным некролизом, энцефалитом и диабетом I типа с острым кетоацидозом. При развитии ИЗПЭ чаще всего в патологический процесс вовлекаются кожа, кишечник, эндокринные органы, легкие или костно-мышечная система, реже могут возникнуть неврологические, офтальмологические, почечные и кардиоваскулярные осложнения. Получение точных данных об относительной частоте и степени тяжести ИЗПЭ в различных системах органов является сложной задачей, поскольку терминология CTCAE не унифицирована среди онкологов [69].
Основные принципы оптимального менеджмента ИЗПЭ включают раннее распознавание, своевременное вмешательство и межпрофессиональное сотрудничество/консультирование. В целом наблюдение и поддерживающее лечение показаны для легких побочных эффектов, а для пациентов с более тяжелыми осложнениями необходимо применение иммунодепрессантов, обычно глюкокортикоидов (ГК), реже — иммуномодулирующих биологических агентов (например ингибиторов ФНО или антиметаболитов [25]).
Ревматические ИЗПЭ
Ревматические ИЗПЭ являются потенциальным следствием иммунотерапии рака современными противоопухолевыми средствами. Они характеризуются развитием фенотипически сходных с классическими ревматическими заболеваниями ИЗПЭ de novo. Основные категории ревматических ИЗПЭ включают воспалительный артрит, миозит, полимиалгияподобный и сухой синдром. Сходства и различия между некоторыми ревматическими ИЗПЭ и классическими ревматическими заболеваниями приведены в табл. 2.
| Ревматические ИЗПЭ | Ревматические заболевания | Сходство с ревматическими заболеваниями | Различия с ревматическими заболеваниями |
|---|---|---|---|
| Воспалительный артрит | Ревматоидный артрит |
|
|
| Спондилоартрит, псориатический артрит, реактивный артрит |
|
|
|
| Ревматическая полимиалгия и/или ГКА | Ревматическая полимиалгия и/или ГКА |
|
|
| Воспалительные миопатии | Дерматомиозит, полимиозит и аутоиммунная некротизирующая миопатия |
|
|
| Сухой синдром | Синдром Шегрена |
|
|
Эпидемиология
Заболеваемость ревматическими ИЗПЭ описана в литературе в меньшей степени, чем заболеваемость другими ИЗПЭ, такими как колит, пневмонит и поражение щитовидной железы. Причина этого многофакторна. В клинических испытаниях ИИКТ-обусловленных нежелательных явлений используются несколько взаимоисключающих кодов для обозначения скелетно-мышечных симптомов [12]. Например, артрит может быть закодирован как артралгия, артрит, припухлость в суставе или боль в конечности. Это несоответствие в кодировании затрудняет понимание частоты конкретного события как побочного эффекта. Кроме того, большинство ревматических ИЗПЭ редко приводят к смерти или госпитализации пациентов и, следовательно, выходят из-под контроля специалистов. Наконец, ревматические ИЗПЭ могут быть отсроченными нежелательными явлениями, возникающими в течение двух лет после начала терапии ИИКТ [12], а иногда даже после прекращения лечения. Исходя из этого, данные клинических испытаний имеют ограниченную информативность для определения эпидемиологии ревматических ИЗПЭ.
Небольшое количество информации о заболеваемости ревматическими ИЗПЭ можно найти в отчетах обсервационных исследований. Одноцентровое исследование указало на 5,1% заболеваемость (10 из 195 пациентов) воспалительным артритом у пациентов, получавших ингибитор PD-1 с/без ипилимумаба при метастазирующих злокачественных новообразованиях кожи [7]. В этом исследовании исключены пациенты, у которых ранее был остеоартрит, а затем развился отек сустава или синовит, но при включении этих пациентов в группу воспалительного артрита заболеваемость повысилась до 7,7%. Другое ретроспективное одноцентровое исследование 400 пациентов с меланомой, получавших ИИКТ, представило частоту воспалительного артрита ≈3%. Французский регистр, напротив, выявил серонегативный воспалительный артрит только у 0,7% пациентов, получавших терапию анти-PD-1, и 2,5% у тех, кто получал комбинированную терапию анти-CTLA4 и анти-PD-1 [40]. Также выявлено, что частота миозита была ниже, чем воспалительного артрита. Так, в ретроспективном исследовании 654 пациентов, получавших ингибиторы PD-1, только у 5 (0,8%) пациентов развился подтвержденный биопсией миозит [41]. Необходимы дальнейшие проспективные исследования с активным и тщательным выявлением ревматических ИЗПЭ для лучшего понимания патогенетических построений и частоты развития ревматических заболеваний de novo.
КЛИНИЧЕСКИЕ СИНДРОМЫ
Воспалительный артрит. Воспалительный артрит, обусловленный терапией ИИКТ, был описан в нескольких различных сериях случаев и ретроспективных когортных исследованиях [3, 7, 9, 12, 35, 38, 62]. В патологический процесс были вовлечены как мелкие, так и крупные суставы, зарегистрированы случаи как олигоартрита, так и полиартрита. Кроме того, у небольшой части пациентов развивался реактивный артрит с характерной триадой уретрита, конъюнктивита и артрита [12]. Тяжесть артрита широко варьировала от легкой степени, требующей лечение только нестероидными противовоспалительными препаратами (НПВП) или преднизолоном в низких дозах, до тяжелой, требующей лечения ингибиторами ФНО [12] или ингибиторами рецептора ИЛ-6 [35].
Время манифестации артрита в исследованиях колебалось от немедленного начала после однократной терапевтической дозы до двух лет после старта терапии; среднее время от начала симптомов составило 100 дней после первого введения ИИКТ [7, 9, 12]. Хотя большинство пациентов с ИИКТ-индуцированным воспалительным артритом являются серонегативными по ревматоидному фактору или антителам к циклическому цитруллинированному пептиду (анти-ЦЦП), описана подгруппа пациентов, которая была серопозитивной по этим иммунологическим маркерам [12]. Также описаны несколько случаев артрита de novo у пациентов с псориазом, получавших терапию ИИКТ [38, 57]. При визуализации суставов с помощью магнитно-резонансной терапии (МРТ) или ультразвукового исследования (УЗИ) выявлены эрозии, теносиновит и синовит [12, 14].
Особенность ревматических ИЗПЭ состоит в стойкости и резистентности к лечению воспалительных явлений со стороны суставов даже после прекращения терапии ИИКТ, что отличается практически от всех других неревматических ИЗПЭ. Эта стойкость воспаления особенно характерна для воспалительного артрита, что, как правило, требует длительного лечения иммуномодулирующей терапией в течение месяцев или лет после прекращения терапии ИИКТ [62].
Ревматическая полимиалгия и ГКА. Сообщалось о развитии изолированной ревматической полимиалгии и ГКА с паттерном ревматической полимиалгии после лечения как анти-CTLA4, так и анти-PD-1. Следует отметить, что ИИКТ-индуцированная ревматическая полимиалгия отмечалась чаще, чем ГКА [9]. Симптомы этих состояний совпадали с характерными симптомами традиционной формы заболеваний: скованность и боль в мышцах и суставах плечевого и тазового пояса, головная боль в височных областях, перемежающаяся хромота нижней челюсти и преходящая слепота. В образцах, полученных при биопсии височной артерии, выявлены артериит с инфильтрацией мононуклеарными клетками, часто с наличием гигантских многоядерных клеток, и пролиферация интимы [49].
Воспалительная миопатия. Случаи впервые выявленного миозита, в основном полимиозита, наблюдались достаточно часто у пациентов, получавших терапию ИИКТ [36, 41], в то время как сообщений о возникновении дерматомиозита крайне мало [60]. Креатинфосфокиназа (КФК) имеет тенденцию к повышению в десять и более раз по сравнению с концентрацией в сыворотке крови у здоровых людей. В патологический процесс обычно вовлекаются проксимальные отделы мышц, хотя также имеются данные о случаях поражения дистальных и дыхательных мышц, последнее может привести к летальному исходу. Также на фоне терапии ИИКТ описано возникновение воспалительного фасцита в сочетании с тендинитом [16]. Подгруппа пациентов с ИИКТ-индуцированной воспалительной миопатией также часто имела проявления сопутствующей антителоположительной миастении гравис [60].
Сухой синдром. Сухой синдром, включающий сухость во рту (с/без синдрома сухого глаза), также может возникнуть у пациентов, получающих терапию ИИКТ [8, 13]. Эти проявления могут иметь острое начало и оказывать существенное негативное влияние на качество жизни пациента. В отличие от пациентов с классической формой сухого синдрома, большинство из них не имеют анти-Ro/SSa или анти-La/SSb антител в крови или сопутствующего паротита [12].
Разные ревматологические синдромы. Два случая развития системной склеродермии были зарегистрированы у пациентов с метастатической меланомой, получавших пембролизумаб (гуманизированное антитело против PD-1): один случай с диффузной и один с лимитированной формами [1]. Критическая дигитальная ишемия была зарегистрирована у пациента, получавшего комбинированную терапию ингибитором анти-PD-1 ниволумабом и ипилимумабом [22]. Зарегистрировано также развитие эозинофильного фасцита у пациента с метастатической меланомой на фоне лечения пембролизумабом [34]. Развитие саркоидоза с гранулематозным поражением с вовлечением легких, кожи и лимфатических узлов описано на фоне комбинированной терапии анти-PD-1 и анти-CTLA4 [55]. Также было зарегистрировано развитие различных типов васкулитов, включая васкулит с поражением одного органа — центральной нервной системы [39], матки [50] и сетчатки [44]. Кроме того, описаны два случая развития гранулематоза с полиангиитом с поражением легких и почек у пациента, получавшего ипилимумаб с последующим терапией пембролизумабом [18, 58]. Описан случай волчаночного нефрита у пациента с антителами к двухспиральной ДНК и почечной недостаточностью с исчезновением клинических симптомов после прекращения лечения ИИКТ и применением ГК [21]. В научной литературе также представлено сообщение о развитии изолированной кожной волчанки на фоне терапии ИИКТ [42].
Менеджмент ревматических ИЗПЭ
При развитии ревматических ИЗПЭ онкологи должны сотрудничать с ревматологами и как можно раньше направлять пациентов в ревматологические клиники при подозрении на развитие ревматических ИЗПЭ для обеспечения оптимальной терапии. Специфический менеджмент ревматических ИЗПЭ зависит от тяжести проявлений и вовлечения систем органов.
Для распознавания ИЗПЭ и ведении таких пациентов ведущими онкологическими обществами, в том числе Американским обществом клинической онкологии (ASCO), Европейским обществом медицинской онкологии (ESMO), Рабочей группой, изучающей онкологическую токсичность иммунотерапии, и Национальной комплексной онкологической сетью США, недавно были опубликованы всеобъемлющие руководящие принципы для улучшения соответствующей оценки и лечения ИЗПЭ [6, 25, 51, 54]. Эти согласованные руководства рекомендуют поэтапный диагностический и терапевтический подход к ИЗПЭ в зависимости от пораженной системы органов и степени выраженности ИЗПЭ. При развитии токсичности 1-й степени тяжести рекомендуется продолжить иммунотерапию рака, системные ГК обычно не назначают, а воспалительные симптомы купируют с применением НПВП. При 2-й степени токсичности или выше назначают ГК и другие иммуномодулирующие препараты в зависимости от типа ревматического ИЗПЭ, а от терапии ИИКТ воздерживаются. Для случаев 3–4-й степени токсичности иммунотерапия ИИКТ обычно прекращается, назначают ГК в более высоких дозах и иммуносупрессивные препараты. В рекомендациях ASCO были предложены конкретные указания только по лечению воспалительного артрита, миозита и полимиалгияподобного синдрома (табл. 3) [6]. Важные вопросы касательно подхода к терапии ревматологических ИЗПЭ обобщены в табл. 4.
| ВОСПАЛИТЕЛЬНЫЙ АРТРИТ | |||
|---|---|---|---|
| Определение: заболевание, характеризующееся воспалением суставов | |||
| Клинические симптомы: боль в суставах, сопровождающаяся их припухлостью; воспалительные симптомы, такие как скованность после пребывания в покое или по утрам, длящиеся >30 мин; улучшение симптомов на фоне приема НПВП или ГК | |||
| Диагностическое обследование | |||
| 1-я степень токсичности. Сбор полного ревматологического анамнеза и объективное обследование всех периферических суставов на предмет болезненности, припухлости и объема движений; осмотр позвоночника. Рентгенография для исключения метастатического поражения и оценки повреждения суставов (эрозии) — при необходимости. Рассмотреть необходимость назначения иммунологических лабораторных исследований, включая антиядерные антитела, ревматоидный фактор и анти-ЦЦП, и провоспалительных маркеров (СОЭ и СРБ) при сохранении симптомов; если симптомы наводят на мысль о реактивном артрите или вовлечении позвоночника, тестирование на HLA B27 | |||
| 2–4-я степень токсичности. Сбор полного ревматологического анамнеза и объективное обследование, как указано выше; лабораторные тесты, как указано выше.УЗИ±МРТ пораженных суставов при наличии показаний (например постоянный артрит, резистентный к лечению, подозрение на метастатические поражения или септический артрит).Раннее направление к ревматологу при наличии признаков синовита или при сохранении артралгии >4 нед | |||
| Мониторинг: пациенты с воспалительным артритом должны проходить регулярное ревматологическое исследование, включая маркеры воспаления, каждые 4–6 нед после начала лечения | |||
| Степень токсичности | Менеджмент | ||
| Все степени токсичности | Клиницисты должны следить за появлениями впервые выявленной у пациента боли и/или припухлости суставов, чтобы определить наличие воспалительного артрита; оценить, являются ли данные симптомы новыми с момента начала терапии ИИКТ | ||
| 1-я степень токсичности: незначительная боль с воспалением, эритемой или припуханием суставов | Продолжить терапию ИИКТ.
|
||
| 2-я степень токсичности: умеренная боль, признаки воспаления, эритемы или припухания суставов с ухудшением качества жизни по шкале оценки способности к самообслуживанию | Воздержаться от приема ИИКТ и возобновить их прием при контроле симптомов и дозе преднизолона ≤10 мг/сут.
|
||
| 3–4-я степень токсичности: сильная боль, связанная с признаками воспаления, эритемы или припухания суставов; необратимое повреждение суставов; инвалидизация; ухудшение качества жизни по шкале оценки способности к самообслуживанию | Временно прекратить прием ИИКТ, можно возобновить после консультации с ревматологом при разрешении симптомов до 1-й степени токсичности.
|
||
Дополнительные соображения
|
|||
| МИОЗИТ | |||
| Определение: заболевание, характеризующееся мышечным воспалением со слабостью и повышенной концентрацией мышечных ферментов (креатинкиназа). Мышечная боль может присутствовать в тяжелых случаях. Жизнеугрожающие состояния возникают при вовлечении дыхательных мышц или миокарда | |||
| Диагностическое обследование: сбор полного ревматологического и неврологического анамнеза, полное ревматологическое и неврологическое обследование, включая определение мышечной силы, обследование кожи на наличие признаков, свидетельствующих о дерматомиозите. Для миозита мышечная слабость более характерна, чем боль. Активный опрос по поводу предшествующих состояний, которые могут вызвать сходные симптомы.Анализы крови для оценки мышечного воспаления: КФК, трансаминазы (АсАТ, АлАТ), лактатдегидрогеназа и альдолаза могут быть повышены. Миозитные маркеры.Для оценки вовлечения миокарда необходимо исследовать уровень тропонина и провести инструментальные исследования сердца, такие как эхокардиограмма и электрокардиография, при необходимости.Оценить уровни маркеров воспаления (СОЭ и СРБ).При подозрении на миастению, при неврологической симптоматике, неясном диагнозе необходимо провести ЭМГ, визуализацию (МРТ) и/или биопсию мышечного лоскута.Мониторинг: КФК, СОЭ, СРБ | |||
| 1-я степень токсичности: полное объективное и лабораторное исследование, как указано выше | |||
| 2-я степень токсичности: полное объективное и лабораторное исследование, как указано выше; аутоиммунные маркеры миозита; ЭМГ, МРТ пораженных суставов. Раннее направление к ревматологу или неврологу | |||
| 3–4-я степень токсичности: см. 2-ю степень токсичности. Срочное направление к ревматологу или неврологу | |||
| Степень токсичности | Менеджмент | ||
| 1-я степень токсичности: незначительная мышечная слабость с/без боли | Продолжить прием ИИКТ.
|
||
| 2-я степень токсичности: умеренная мышечная слабость с/без боли, с ухудшением качества жизни по шкале оценки способности к самообслуживанию | Временно прекратить прием ИИКТ с возобновлением при контроле симптомов, при нормальном уровне КФК и дозе преднизолона <10 мг; при ухудшении симптомов — лечение согласно 3-й степени токсичности.
|
||
| 3–4-я степень токсичности: сильная слабость с/без боли, с ухудшением качества жизни по шкале оценки способности к самообслуживанию | Временно прекратить прием ИИКТ до разрешения симптомов до 1-й степени токсичности, окончательно прекратить в случае наличия симптомов/признаков поражения миокарда.
|
||
| ПОЛИМИАЛГИЯПОДОБНЫЙ СИНДРОМ | |||
| Определение: характеризуется выраженной болью, скованностью и ригидностью в проксимальных отделах верхних и/или нижних конечностей (шея, плечи и бедра) с отсутствием признаков истинного мышечного воспаления, такого как повышение КФK или миозитспецифические признаки на ЭМГ. Нет истинной мышечной слабости, трудности при активных движениях, связанных с болью | |||
| Диагностическое обследование | |||
| 1-я степень токсичности. Сбор полного ревматологического анамнеза для проведения дифференциальной диагностики и обследование всех групп суставов и кожи.Проверьте наличие симптомов височного артериита, таких как головная боль или нарушения зрения; консультация офтальмолога, рассмотрение необходимости биопсии височной артерии.Антиядерные антитела, ревматоидный фактор, анти-ЦЦП.КФK и миозитный профиль для дифференциальной диагностики миозита.Маркеры воспаления (СОЭ, СРБ).Мониторинг: СОЭ, СРБ | |||
| 2–4-я степень токсичности. Сбор анамнеза и объективное исследование, как указано выше; аутоиммунные тесты, необходимые для дифференциальной диагностики; раннее направление к ревматологу | |||
| Степень токсичности | Менеджмент | ||
| 1-я степень токсичности. Легкая скованность и боль | Продолжить терапию ИИКТ.
|
||
| 2-я степень токсичности: умеренная скованность и боль с ухудшением качества жизни по шкале оценки способности к самообслуживанию | Рассмотреть возможность временного прекращения приема ИИКТ и возобновление терапии после контроля симптомов, приеме преднизолона <10 мг; при ухудшении симптомов — лечение, как при 3-й степени токсичности.
|
||
| 3–4-я степень токсичности: выраженная ригидность и боль, ограничение активных движений, повышение температуры тела, ухудшение сна, снижение аппетита, значительное ухудшение качества жизни по шкале оценки способности к самообслуживанию | Временное прекращение приема ИИКТ, возобновление после консультации с ревматологом, уменьшение выраженности симптомов до 1-й степени токсичности; обратите внимание на высокую вероятность рецидивирования токсичности при возобновлении приема ИИКТ.
|
||
| Все рекомендации основаны на консенсусе экспертов, преимущества перевешивают вред, а сила рекомендаций — умеренная | |||
Тут и далее: БМАРП — болезнь-модифицирующие антиревматические препараты; СОЭ — скорость оседания эритроцитов, СРБ — С-реактивный белок; ЭМГ — электромиография.
| 1) Что ревматолог должен знать об ИЗПЭ? ИЗПЭ могут быть потенцированы современной терапией рака и свидетельствовать об ее эффективности. Лечение, назначенное ревматологом, может быть ограничено теоретическими соображениями о том, что иммунодепрессанты, показанные для лечения при ИЗПЭ, могут ингибировать противоопухолевый эффект ИИКТ. Это сложная клиническая ситуация, но понимание долгосрочного плана и целей лечения рака помогает ревматологу объяснить ограничения лечения пациенту |
| 2) Как тяжесть ИЗПЭ влияет на варианты лечения? Тяжесть проявлений ИЗПЭ может влиять на варианты лечения. Для пациентов с ИЗПЭ в виде легкого артрита или артрита с вовлечением одного сустава НПВП и внутрисуставные ГК являются вариантом лечения [54], тогда как для пациентов с тяжелым артритом и эрозиями высокие дозы преднизолона (>40 мг/сут) и раннее назначение БМАРП являются терапией выбора |
| 3) Какие существуют ограничения при приеме ИИКТ? Не допускается применение БМАРП или преднизолона >10 мг/сут одновременно с лечением ИИКТ |
| 4) Какие препараты выбора при лечении ИЗПЭ? Ингибиторы ФНО-α — препараты выбора при иммуноопосредованном колите или воспалительном артрите [63]. У пациентов с миозитом и иммуноопосредованной тромбоцитопенией препаратом выбора является внутривенный иммуноглобулин [61]. Поскольку в настоящее время имеются ограниченные данные о безопасности длительной иммуносупрессии для лечения при ИЗПЭ и их влиянии на опухолевый процесс, согласованное решение о лечении онколога и ревматолога считается разумным и крайне важным |
| 5) Доступны ли неиммуносупрессивные методы лечения для устранения симптомов ревматических ИЗПЭ? Симптомы сухого синдрома можно лечить с помощью местной терапии, все препараты данной группы не имеют никакого влияния на опухолевый ответ ИИКТ |
| 6) Как долго необходимо наблюдать пациентов? ИЗПЭ могут возникать спустя много времени после начала или даже после прекращения терапии ИИКТ. Длительный мониторинг ревматолога и онколога пациентов в отношении этой проблемы имеет важное значение |
Бессимптомные аутоиммунные нарушения в анамнезе
Каким образом ИИКТ опосредуют активацию иммунной системы у пациентов с бессимптомными или малосимптомными аутоиммунными нарушениями, детально не изучено. Хорошо известно, что ревматоидный артрит ассоциируется с наличием аутоантител к цитруллинированным белкам (АЦБ), которые можно выявить за несколько лет до дебюта клинического заболевания. Хотя ранние клинические наблюдения ИИКТ-ассоциированных воспалительных полиартритов были в основном у серонегативных пациентов [11], более недавние работы предполагают, что некоторые пациенты, будучи АЦБ-позитивными до начала терапии, более подвержены острому началу аутоиммунного заболевания после воздействия ИИКТ, особенно на фоне анти-PD-1-терапии [3]. Аналогичная ситуация описана для такого ИЗПЭ, как сахарный диабет I типа с острым кетоацидозом, при котором пациенты до лечения ИИКТ были положительны в отношении общепризнанных ассоциированных с этим заболеванием антител — антитела против островковых клеток [47]. Подобные примеры других органоспецифических ИЗПЭ, при которых до терапии ИИКТ выявлены ассоциированные с определенным заболеванием аутоантитела, без развития клинически значимых симптомов, включая миастению, аутоиммунную гемолитическую анемию и аутоиммунные заболевания щитовидной железы [37]. Однако следует отметить, что большинство пациентов с ИЗПЭ ревматического и неревматического происхождения имеют отрицательный тест на патогномоничные аутоантитела в сыворотке крови.
Ревматические заболевания в анамнезе
Десятки миллионов пациентов с иммуноопосредованными воспалительными заболеваниями, включая системные заболевания соединительной ткани, могут заболеть раком. В связи с этим актуальным и открытым остается вопрос: «Может ли это быть противопоказанием к иммунотерапии рака?» К сожалению, такие пациенты не были включены в клинические испытания, которые привели к одобрению FDA этих иммунотерапевтических процедур при онкологических заболеваниях. Результаты нескольких небольших ретроспективных исследований и метаанализа показывают, что до 50% пациентов с иммуноопосредованными воспалительными заболеваниями в анамнезе, получавших лечение ИИКТ, имели обострения заболевания, а еще у 20–30% развивались другие ревматические ИЗПЭ de novo во время терапии ИИКТ [30, 48, 49]. В небольшом французском проспективном исследовании пациенты, получавшие ИИКТ, с ранее существовавшими аутоиммунными заболеваниями с большей вероятностью имели новые случаи ИЗПЭ, и у них эти осложнения развивались намного раньше, чем у пациентов с неотягощенным анамнезом [15]. Тем не менее большинство из этих ИЗПЭ поддаются курации, и многие пациенты выигрывают от терапии ИИКТ. Еще одним вопросом без ответа остается: «Могут ли пациенты с хроническими ревматическими ИЗПЭ, после разрешения их с помощью БМАРП, затем эффективно лечиться от рака при помощи ИИКТ?»
Влияние развития ИЗПЭ на эффективность противоопухолевого лечения
Резонно спросить, свидетельствует ли развитие ИЗПЭ во время ИИКТ-терапии о достаточном ответе опухоли на лечение. Наличие ИЗПЭ свидетельствует о том, что произошло истощение иммунных клеток. Согласно данным некоторых работ, действительно, пациенты с развитием ИЗПЭ, по крайней мере в контексте некоторых видов рака (таких как меланома и почечно-клеточный рак), имеют противоопухолевый ответ лучше, чем пациенты без ИЗПЭ [45, 53, 61, 68]. В одном исследовании отмечалось, что специфическое ИЗПЭ, а именно гранулематозные/саркоидозподобные поражения (которые редко отмечаются, но количество сообщений увеличивается), могут быть в качестве маркера терапевтического ответа в подгруппе пациентов с меланомой [65].
Реакция опухоли на ревматическую терапию
Все еще неизвестно, будет ли сопутствующая иммуносупрессивная или иммуномодулирующая терапия БМАРП ранее существовавших ревматических заболеваний или развившихся ревматических ИЗПЭ нивелировать противоопухолевый ответ терапии ИИКТ. Ретроспективные исследования не дают свидетельств неблагоприятного влияния на кинетику опухоли терапии ГК или ингибиторов ФНО [59]. Некоторые данные также свидетельствуют о том, что синтетические БМАРП хорошо переносятся пациентами с воспалительным артритом, а также, что эти препараты могут сохранять противоопухолевую эффективность иммунотерапии [13]. Для пациентов с наиболее тяжелыми ИЗПЭ, особенно хроническими и резистентными, эффект длительной иммуносупрессии в высокой дозе или биологической терапии ингибиторами, не относящимися к ФНО, на сегодня остается неизвестным.
Биомаркеры для прогнозирования развития ИЗПЭ
Существует нарастающая необходимость в выявлении биомаркеров для прогнозирования риска развития ИЗПЭ и обеспечения профилактических мероприятий. Несколько исследований продемонстрировали, что нарушения в функционировании периферических В-клеток и общие профили аутоантител [17, 23, 43], могут предоставить приблизительные оценки риска развития ИЗПЭ. К сожалению, ни один предполагаемый биомаркер не является прогностическим для ревматических ИЗПЭ, кроме редких случаев бессимптомной позитивности по АЦБ [3]. Остается неясным, представляют ли ИЗПЭ развитие заболеваний de novo или отражают лежащие в основе иммуноопосредованные заболевания. На сегодняшний день не выявлено характерных аутоантител, классических HLA ассоциаций или других биомаркеров ревматических ИЗПЭ [13]. Необходимы дальнейшие исследования в этой области, поскольку иммунопатогенные механизмы для большинства ИЗПЭ неизвестны.
Выводы
1. Иммунотерапия рака с помощью ИИКТ произвела революцию в лечении рака, но обусловила риск развития аутоиммунных или аутовоспалительных осложнений, известных как ИЗПЭ.
2. ИЗПЭ могут проявляться с вовлечением любой системы органов во время и/или после лечения ИИКТ.
3. Лечение ИЗПЭ проводят с помощью иммуносупрессивных препаратов, в первую очередь ГК, и иногда с добавлением синтетических или биологических БМАРП.
4. Ревматические ИЗПЭ отмечаются не так часто, как некоторые другие ИЗПЭ, что, вероятно, связано с их недостаточной диагностикой.
5. Ревматические ИЗПЭ могут манифестировать как на ранних, так и на поздних стадиях терапии ИИКТ. Значительная часть из них является хроническими и сохраняются даже после прекращения терапии ИИКТ.
6. Ревматологи должны знать эту новую область ревматических заболеваний и стать центральными партнерами в межпрофессиональных командах, занимающихся менеджментом ИЗПЭ в процессе иммунотерапии пациентов с онкологическими заболеваниями.
Список использованной литературы
- 1. Barbosa N.S., Wetter D.A., Wieland C.N. et al. (2017) Scleroderma induced by pembrolizumab: a case series. Mayo Clin. Proc., 92: 1158–1163.
- 2. Bardhan K., Anagnostou T., Boussiotis V.A. (2016) The PD1:PD-L1/2 pathway from discovery to clinical implementation. Front. Immunol., 7: 550.
- 3. Belkhir R., Burel S.L., Dunogeant L. et al. (2017) Rheumatoid arthritis and polymyalgia rheumatica occurring after immune checkpoint inhibitor treatment. Ann. Rheum. Dis., 76: 1747–1750.
- 4. Bertrand A., Kostine M., Barnetche T. et al. (2015) Immune related adverse events associated with anti-CTLA-4 antibodies: systematic review and meta-analysis. BMC Med., 13: 211.
- 5. Boussiotis V.A. (2016) Molecular and biochemical aspects of the PD-1 checkpoint pathway. N. Engl. J. Med., 375: 1767–1778.
- 6. Brahmer J.R., Lacchetti C., Schneider B.J. et al. (2018) Management of immune-related adverse events in patients treated with immune checkpoint inhibitor therapy: American Society of Clinical Oncology Clinical Practice guideline. J. Clin. Oncol., 36: 1714–1768.
- 7. Buder-Bakhaya K., Benesova K., Schulz C. et al. (2018) Characterization of arthralgia induced by PD-1 antibody treatment in patients with metastasized cutaneous malignancies. Cancer Immunol. Immunother., 67: 175–182.
- 8. Calabrese L., Velcheti V. (2017) Checkpoint immunotherapy: good for cancer therapy, bad for rheumatic diseases. Ann. Rheum. Dis., 76: 1–3.
- 9. Calabrese C., Kirchner E., Kontzias K. et al. (2017) Rheumatic immune-related adverse events of checkpoint therapy for cancer: case series of a new nosological entity. RMD Open, 3: e000412.
- 10. Calabrese L.H. (2018) Sorting out the complexities of autoimmunity and checkpoint inhibitors: not so easy. Ann. Intern. Med., 168: 149–150.
- 11. Cappelli L.C., Shah A.A., Bingham C.O. 3rd (2017) Immune-related adverse effects of cancer immunotherapy — implications for rheumatology. Rheum. Dis. Clin. North Am., 43: 65–78.
- 12. Cappelli L.C., Gutierrez A.K., Baer A.N. et al. (2017) Inflammatory arthritis and sicca syndrome induced by nivolumab and ipilimumab. Ann. Rheum. Dis., 76: 43–50.
- 13. Cappelli L.C., Brahmer J.R., Forde P.M. et al. (2018) Clinical presentation of immune checkpoint inhibitor-induced inflammatory arthritis differs by immunotherapy regimen. Semin. Arthritis Rheum., 48(3): 553–557.
- 14. Chan M.M., Kefford R.F., Carlino M. et al. (2015) Arthritis and tenosynovitis associated with the anti-PD1 antibody pembrolizumab in metastatic melanoma. J. Immunother., 38: 37–39.
- 15. Danlos F.X., Voisin A.L., Dyevre V. et al. (2018) Safety and efficacy of anti-programmed death 1 antibodies in patients with cancer and pre-existing autoimmune or inflammatory disease. Eur. J. Cancer, 91: 21–29.
- 16. Daoussis D., Kraniotis P., Liossis S.N., Solomou A. (2017) Immune checkpoint inhibitor-induced myofasciitis. Rheumatology, 56: 2161.
- 17. Das R., Bar N., Ferreira M. et al. (2018) Early B cell changes predict autoimmunity following combnation immune checkpoint blockade. J. Clin. Invest., 128: 715–720.
- 18. Daxini A., Cronin K., Sreih A.G. (2018) Vasculitis associated with immune checkpoint inhibitors-a systematic review. Clin. Rheumatol., 37(9): 2579–2584.
- 19. Eggermont A.M., Chiarion-Sileni V., Grob J.J. et al. (2016) Prolonged survival in stage III melanoma with ipilimumab adjuvant therapy. N. Engl. J. Med., 375: 1845–1855.
- 20. Esfahani K., Miller W.H. (2017) Reversal of autoimmune toxicity and loss of tumor response by interleukin-17 blockade. N. Engl. J. Med., 376: 1989–1991.
- 21. Fadel F., El Karoui K., Knebelmann B. (2009) Anti-CTLA4 antibody-induced lupus nephritis. N. Engl. J. Med., 361: 211–212.
- 22. Gambichler T., Strutzmann S., Tannapfel A., Susok L. (2017) Paraneoplastic acral vascular syndrome in a patient with metastatic melanoma under immune checkpoint blockade. BMC Cancer, 17: 327.
- 23. Gowen M.F., Giles K.M., Simpson D. et al. (2018) Baseline antibody profiles predict toxicity in melanoma patients treated with immune checkpoint inhibitors. J. Transl. Med., 16: 82.
- 24. Guo Y., Walsh A.M., Canavan M. et al. (2018) Immune checkpoint inhibitor PD-1 pathway is down-regulated in synovium at various stages of rheumatoid arthritis disease progression. PLOS ONE, 13: e0192704.
- 25. Haanen J., Carbonnel F., Robert C. et al. (2018) Management of toxicities from immunotherapy: ESMO clinical practice guidelines for diagnosis, treatment and follow-up. Ann Oncol., 29: 264–266.
- 26. Hoos A. (2016) Development of immuno-oncology drugs —from CTLA4 to PD1 to the next generations. Nat. Rev. Drug Discov., 15: 235–247.
- 27. Hotchkiss R.S., Moldawer L.L. (2014) Parallels between cancer and infectious disease. N. Engl. J. Med., 371: 380–383.
- 28. Huang A.C., Postow M.A., Orlowski R.J. et al. (2017) T cell invigoration to tumour burden ratio associated with anti-PD-1 response. Nature, 545: 60–65.
- 29. June C.H., Warshauer J.T., Bluestone J.A. (2017) Is autoimmunity the Achilles’ heel of cancer immunotherapy? Nat. Med., 23: 540–547.
- 30. Johnson D.B., Sullivan R.J., Ott P.A. et al. (2016) Ipilimumab therapy in patients with advanced melanoma and preexisting autoimmune disorders. JAMA Oncol., 2: 234–240.
- 31. Johnson D.B., Sullivan R.J., Menzies A.M. (2017). Immune checkpoint inhibitors in challenging populations. Cancer, 123: 1904–1911.
- 32. Karunarathne D.S., Horne-Debets J.M., Huang J.X. et al. (2016) Programmed death-1 ligand 2-mediated regulation of the PD-L1 to PD-1 axis is essential for establishing CD4(+) T cell immunity. Immunity, 45: 333–345.
- 33. Khoja L., Day D., Wei-Wu Chen T. et al. (2017) Tumour- and class-specific patterns of immune-related adverse events of immune checkpoint inhibitors: a systematic review. Ann. Oncol., 28: 2377–2385.
- 34. Khoja L., Maurice C., Chappell M. et al. (2016) Eosinophilic fasciitis and acute encephalopathy toxicity from pembrolizumab treatment of a patient with metastatic melanoma. Cancer Immunol. Res., 4: 175–178.
- 35. Kim S.T., Tayar J., Trinh V.A. et al. (2017) Successful treatment of arthritis induced by checkpoint inhibitors with tocilizumab: a case series. Ann. Rheum. Dis., 76: 2061–2064.
- 36. Kimura T., Fukushima S., Miyashita A. et al. (2016) Myasthenic crisis and polymyositis induced by one dose of nivolumab. Cancer Sci., 107: 1055–1058.
- 37. Kobayashi T., Iwama S., Yasuda Y. et al. (2018) Patients with antithyroid antibodies are prone to develop destructive thyroiditis by nivolumab: a prospective study. J. Endocr. Soc., 2: 241–251.
- 38. Law-Ping-Man S., Martin A., Briens E. et al. (2016) Psoriasis and psoriatic arthritis induced by nivolumab in a patient with advanced lung cancer. Rheumatology, 55: 2087–2089.
- 39. Laubli H., Hench J., Stanczak M. et al. (2017) Cerebral vasculitis mimicking intracranial metastatic progression of lung cancer during PD-1 blockade. J. Immunother. Cancer, 5: 46.
- 40. Le Burel S., Champiat S., Mateus C. et al. (2017) Prevalence of immune-related systemic adverse events in patients treated with anti-programmed cell death 1/anti-programmed cell death-ligand 1 agents: a single-centre pharmacovigilance database analysis. Eur. J. Cancer, 82: 34–44.
- 41. Liewluck T., Kao J.C., Mauermann M.L. (2017) PD-1 inhibitor-associated myopathies: emerging immune-mediated myopathies. J. Immunother., 41: 208–211.
- 42. Liu R.C., Sebaratnam D.F., Jackett L. et al. (2018) Subacute cutaneous lupus erythematosus induced by nivolumab. Australas. J. Dermatol., 59: e152–e154.
- 43. Lo B., Fritz J.M., Su H.C. et al. (2016) CHAI and LATAIE: new genetic diseases of CTLA-4 checkpoint insufficiency. Blood, 128: 1037–1042.
- 44. Manusow J.S., Khoja L., Pesin N. et al. (2014) Retinal vasculitis and ocular vitreous metastasis following complete response to PD-1 inhibition in a patient with metastatic cutaneous melanoma. J. Immunother. Cancer, 2: 41.
- 45. Martini D.J., Hamieh L., McKay R.R. et al. (2018) Durable clinical benefit in metastatic renal cell carcinoma patients who discontinue PD-1/ PD-L1 therapy for immune-related adverse events. Cancer Immunol. Res., 6: 402–408.
- 46. McKinney E.F., Lee J.C., Jayne D.R. et al. (2015) T cell exhaustion, co-stimulation and clinical outcome in autoimmunity and infection. Nature, 523: 612–616.
- 47. Mehta H.B., Mehta V., Goodwin J.S. (2017) Association of hypoglycemia with subsequent dementia in older patients with type 2 diabetes mellitus. J. Gerontol. A Biol. Sci. Med. Sci., 72: 1110–1116.
- 48. Menzies A.M., Johnson D.B., Ramanujam S. et al. (2017) Anti-PD-1 therapy in patients with advanced melanoma and preexisting autoimmune disorders or major toxicity with ipilimumab. Ann. Oncol., 28: 368–376.
- 49. Micaily I., Chernoff M. (2017) An unknown reaction to pembrolizumab: giant cell arteritis. Ann. Oncol., 28: 2621–2622.
- 50. Minor D.R., Bunker S.R., Doyle J. (2013) Lymphocytic vasculitis of the uterus in a patient with melanoma receiving ipilimumab. J. Clin. Oncol., 31: e356.
- 51. Nccn.org. 2019. Available online at: https://www.nccn.org/professionals/physician_gls/pdf/immunotherapy.pdf (accessed February 25, 2019).
- 52. Olde Nordkamp M.J., Koeleman B.P., Meyaard L. (2014) Do inhibitory immune receptors play a role in the etiology of autoimmune disease? Clin. Immunol., 150: 31–42.
- 53. Postow M.A., Sidlow R., Hellmann M.D. (2018) Immune-related adverse events associated with immune checkpoint blockade. N. Engl. J. Med., 378: 158–168.
- 54. Puzanov I., Diab A., Abdallah K. et al. (2017) Managing toxicities associated with immune checkpoint inhibitors: consensus recommendations from the Society for Immunotherapy of Cancer (SITC) Toxicity Management Working Group. J Immunother Cancer, 5: 95.
- 55. Reddy S.B., Possick J.D., Kluger H.M. et al. (2017) Sarcoidosis following anti-PD-1 and anti-CTLA-4 therapy for metastatic melanoma. J. Immunother., 40: 307–311.
- 56. Ribas A. (2015) Releasing the brakes on cancer immunotherapy. N. Engl. J. Med., 373: 1490–1492.
- 57. Ruiz-Banobre J., Pérez-Pampín E., García-González J. et al. (2017) Development of psoriatic arthritis during nivolumab therapy for metastatic non-small cell lung cancer, clinical outcome analysis and review of the literature. Lung Cancer, 108: 217–221.
- 58. Rutgers A., van den Brom R.R., Hospers G.A. et al. (2018) Systemic vasculitis developed after immune checkpoint inhibition. Arthritis Care Res., 70(8): 1275–1276.
- 59. Schadendorf D., Wolchok J.D., Hodi F.S. et al. (2017) Efficacy and safety outcomes in patients with advanced melanoma who discontinued treatment with nivolumab and ipilimumab because of adverse events: a pooled analysis of randomized phase II and III trials. J. Clin. Oncol., 35: 3807–3814.
- 60. Sheik Ali S., Goddard A.L., Luke J.J. et al. (2015) Drug-associated dermatomyositis following ipilimumab therapy: a novel immune-mediated adverse event associated with cytotoxic T-lymphocyte antigen 4 blockade. JAMA Dermatol., 151: 195–199.
- 61. Shiuan E., Beckermann K.E., Ozgun A. et al. (2017) Thrombocytopenia in patients with melanoma receiving immune checkpoint inhibitor therapy. J. Immunother. Cancer, 5: 8.
- 62. Smith M.H., Bass A.R. (2019) Arthritis after cancer immunotherapy: symptom duration and treatment response. Arthritis Care. Res., 71(3): 362–366.
- 63. Spain L., Diem S., Larkin J. (2016) Management of toxicities of immune checkpoint inhibitors. Cancer Treat. Rev., 44: 51–60.
- 64. Suarez-Almazor M.E., Kim S.T., Abdel-Wahab N., Diab A. (2017) Review: immune-related adverse events with use of checkpoint inhibitors for immunotherapy of cancer. Arthritis Rheumatol., 69: 687–699.
- 65. Tetzlaff M.T., Nelson K.C., Diab A. et al. (2018) Granulomatous/sarcoid-like lesions associated with checkpoint inhibitors: a marker of therapy response in a subset of melanoma patients. J. Immunother. Cancer, 6: 14.
- 66. Tocheva A.S., Mor A. (2017) Checkpoint inhibitors: applications for autoimmunity. Curr. Allergy Asthma Rep., 17: 72.
- 67. van der Vlist M., Kuball J., Radstake T.R., Meyaard L. (2016) Immune checkpoints and rheumatic diseases: what can cancer immunotherapy teach us? Nat. Rev. Rheumatol., 12: 593–604.
- 68. Weber J.S., Hodi F.S., Wolchok J.D. et al. (2017) Safety profile of nivolumab monotherapy: a pooled analysis of patients with advanced melanoma. J. Clin. Oncol., 35: 785–792.
- 69. Woodworth T., Furst D.E., Alten R. et al. (2007) Standardizing assessment and reporting of adverse effects in rheumatology clinical trials II: the rheumatology common toxicity criteria v.2.0. J. Rheumatol., 34: 1401–1414.
- 70. Zhang H., Watanabe R., Berry G.J. et al. (2017) Immunoinhibitory checkpoint deficiency in medium and large vessel vasculitis. Proc. Natl Acad. Sci. USA, 114: e970–e979.
Адрес для переписки:
Головач Ирина Юрьевна
03142, Киев, ул. Заболотного, 21
Клиническая больница «Феофания» ГУД,
Центр ревматологии
Е-mail: golovachirina@gmail.com

Leave a comment