Місце глюкокортикоїдів у сучасній стратегії лікування пацієнтів із ревматоїдним артритом
Резюме. У статті представлений огляд рандомізованих клінічних досліджень, а також європейських та американських рекомендацій з клінічного застосування глюкокортикоїдів у лікуванні пацієнтів із ревматоїдним артритом. Розглянуто ефективність застосування різних препаратів, доз і шляхів введення глюкокортикоїдів у комбінації з синтетичними і біологічними хворобо-модифікуючими агентами в досягненні ремісії при ранньому ревматоїдному артриті. Ефективне і раціональне застосування глюкокортикоїдів в дебюті ревматоїдного артриту за даними представлених досліджень дозволило в більшості випадків уникнути їх «хронічного» застосування в подальшому, підвищити ефективність монотерапії метотрексатом і навіть відмінити біологічні агенти у зв’язку з розвитком стійкої ремісії при відсутності рентгенологічного прогресування і підвищення частоти побічних ефектів.
До настоящего времени продолжают дискутироваться вопросы применения глюкокортикоидов (ГК) при ревматоидном артрите (РА) ввиду наличия долгосрочных побочных эффектов (ПЭ) в виде сердечно-сосудистых заболеваний, инфекций, нарушений углеводного обмена, ожирения и переломов (Ethgen O. et al., 2013). Несмотря на широкий диапазон ПЭ, ГК широко применяют в клинической практике для лечения пациентов с РА в различных дозах как короткими курсами, так и десятилетиями, особенно при наличии высокой активности заболевания. Так, в Великобритании 50% пациентов применяют ГК в дебюте РА еще на этапе первичного звена оказания медицинской помощи, при этом более половины из них в дозе >10 мг/сут (Black R.J. et al., 2015). По данным немецкой когорты раннего артрита (CAPEA) ГК в дебюте болезни были назначены в 77% случаев, при этом 20% пациентов получали ГК в низких дозах (<7,5 мг/сут) и 35% — в высоких дозах (≥20 мг/сут) (Albrecht K. et al., 2015). В Латинской Америке большинство пациентов (64%) с ранним РА применяют ГК преимущественно (80%) в низких дозах (Cardiel M.H. et al., 2012). Обратную тенденцию отмечали на Североамериканском континенте (по данным канадской когорты CATCH), когда в дебюте РА 42% пациентов получали ГК преимущественно в низких дозах таблетировано (50%) или парентерально (38%) — в форме внутрисуставных (в/с) и внутримышечных (в/м) инъекций (McKeown E. et al., 2012).
На сегодняшний день наиболее эффективной лечебной стратегией раннего РА с учетом «окна возможностей» является комбинация медленнодействующих синтетических болезнь-модифицирующих препаратов (БМП) с ГК или биологическими агентами (БА), препаратами, которые могут обеспечить быструю индукцию ремиссии. ГК сейчас широко используют в качестве «мост»-терапии в низких и средних дозах с целью быстрого контроля воспаления и предотвращения рентгенологического прогрессирования до начала действия БМП. Уже в первые недели лечения ГК могут уменьшить выраженность клинических симптомов и функциональных ограничений, тем самым быстро возвращая пациента к его привычной социальной активности и, возможно, предотвращая формирование осложнений. Однако как со стороны пациентов, так и со стороны врачей сохраняется неоднозначное отношение к применению ГК с целью индукции ремиссии у пациентов с РА. Опасения относительно развития ПЭ и отсутствие определения оптимальных доз, длительности приема и пути введения ограничивает применение ГК в пределах «окна возможностей» (van Tuyl L.H. et al., 2007; Meyfroidt S. et al., 2014). В рутинной практике ревматологи в большинстве случаев используют сочетание ГК в низких дозах в таблетках с БМП для лечения РА, однако до настоящего времени сохраняется неоднозначное отношение к использованию более высоких доз и к парентеральному введению.
Эволюция роли ГК в стратегии «лечение до достижения цели» при РА последовательно представлена в европейских и американских рекомендациях и основана на результатах плодотворной работы групп экспертов и данных рандомизированных клинических исследований (РКИ).
Общепринятой является номенклатура доз ГК, разработанная и опубликованная экспертной группой EULAR в 2002 г. (Buttgereit F. et al., 2002). Она основана на дозозависимом соотношении геномных и негеномных эффектов при применении ГК в различных дозах.
Таким образом, в эквиваленте по преднизолону:
- низкие дозы ГК ≤7,5 мг/сут;
- средние дозы ГК >7,5–≤30 мг/сут;
- высокие дозы ГК >30–≤100 мг/сут;
- очень высокие дозы ГК >100 мг/сут;
- пуль-терапия ≥250 мг/сут внутривенно (в/в) в течение 1–5 дней.
Определение низких доз ГК в рекомендациях EULAR 2016 г. аналогично вышеописанному (Strehl C. et al., 2016). Тогда как в рекомендациях Американской коллегии ревматологов (АКР) 2015 г. низкие дозы в эквиваленте по преднизолону определены как ≤10 мг/сут, высокие — как >10 мг/сут, но <60 мг/сут с быстрой отменой и короткий курс как <3 мес терапии (Singh J.A. et al., 2016). В основу понятия быстрой отмены в рекомендациях АКР положен режим ГК-терапии из исследования COBRA, когда инициальная доза преднизолона была снижена с 60 до 7,5 мг/сут в течение 6 нед (Boers M. et al., 1997).
В рекомендациях EULAR по лечению пациентов с РА, начиная с 2010 г., ГК в комбинации с синтетическими и биологическими БМП рекомендованы к применению коротким курсом с использованием различных доз и путей введения как первично, так и при замене БМП или обострении. Однако отмена/снижение дозы должны осуществляться настолько быстро, насколько это клинически возможно (Smolen J.S. et al., 2010). Согласно рекомендациям EULAR 2014 г. «низкие дозы ГК следует рассматривать как часть первичной инициальной лечебной стратегии (в комбинации с одним или более БМП) длительностью до 6 мес, при этом снижение дозы/отмена необходимо производить так быстро, как это клинически возможно». Тогда как монотерапию ГК не рекомендовалось использовать, за исключением случая непереносимости всех БМП (Smolen J.S. et al., 2014).
В рекомендациях ACR (АКР) 2015 г. пациентам как с ранним (длительность болезни <6 мес), так и поздним РА ГК коротким курсом в наименьших дозах показаны в качестве «мост»-терапии при назначении БМП; при сохранении умеренной или высокой активности болезни, несмотря на применение БМП или БА; а также при обострении заболевания.
В последних, актуальных на сегодняшний день, рекомендациях EULAR 2016 г. по лечению при РА полномочия ГК были расширены: коротким курсом в низких, средних и высоких дозах их можно назначать как первично, так и при замене БМП; возможно использование различных доз и путей введения (в/м, в/в, per os); отмену/снижение дозы необходимо производить так быстро, как это клинически возможно. Кроме того, отмена/снижение дозы БА у пациентов в состоянии устойчивой ремиссии возможна только после снижения/отмены ГК, особенно в случае проведения комбинированной терапии синтетическими и биологическими БМП (Smolen J.S. et al., 2017).
В настоящее время системное применение ГК обосновано не только в лечении при РА, но и включено в обновленные (2016 г.) рекомендации по лечению раннего артрита, до верификации определенной нозологической формы. С учетом высокой терапевтической эффективности и наличия кумулятивных ПЭ при раннем артрите ГК рекомендуется применять в наименьших дозах в качестве временной (<6 мес) вспомогательной терапии, а также возможно применение внутрисуставно для уменьшения выраженности локальных симптомов воспаления (Combe B. et al., 2017).
Основой для всех рекомендаций по применению ГК послужили результаты крупных РКИ по сравнительной оценке эффективности разных режимов ГК-терапии (tREACH, CareRA, IDEA, ESPOIR). Общим для всех исследований является использование терапевтической стратегии «лечение до достижения цели» в когорте раннего РА. Целью лечения было достижение ремиссии/низкой активности болезни (НАБ), активность болезни оценивали каждые 3 мес, при недостижении цели проводили коррекцию терапии.
Ввиду широкого внедрения в клиническую практику новых диагностических критериев РА ACR/EULAR (Aletaha D. et al., 2010), особый интерес представляют данные РКИ по использованию различных режимов ГК-терапии именно у пациентов с ранним РА. Современные рекомендации по лечению РА сформированы на основе данных РКИ в когорте пациентов с диагнозом, установленным по критериям ACR 1987 г. (Arnett F.C. et al., 1988), одним из пунктов которых является наличие эрозий. По сути ранний и поздний РА — это две разные популяции пациентов, и если в первом случае речь идет в основном об остром неэрозивном артрите, то во втором случае пациенты имеют хронические необратимые изменения в клинико-морфологической картине заболевания и иммунологическом статусе. В первом случае, на дорентгенологической стадии, адекватная терапия может обеспечить длительную ремиссию болезни и даже выздоровление, во втором — имеет скорее симптоматический характер и позволяет только частично контролировать прогрессирование функциональных ограничений и клинико-рентгенологических проявлений.
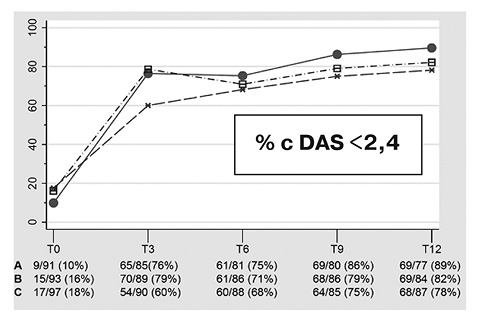
В Датском исследовании tREACH у пациентов с ранним РА (2007–2011) сравнивали эффективность тройной комбинации БМП (МТХ (метотрексат) 25 мг/нед + ССЗ (сульфасалазин) 2 г/сут + ГХ (гидроксихлорохин) 400 мг/сут) с монотерапией МТХ в сочетании с различными дозами ГК на протяжении 12 мес лечения (de Jong P.H. et al., 2014). В одной из групп тройной терапии ГК применяли парентерально в форме однократной в/м инъекции 120 мг метилпреднизолона (МП) или 80 мг триамцинолона ацетата, в другой использовали таблетированный прием ГК (тГК) в дозе 15 мг/сут (в эквиваленте по преднизолону) в первые 4 нед, с последующим снижением на 2,5 мг 1 раз в неделю и полной отменой через 10 нед лечения. В группе монотерапии МТХ применялся в дозе 25 мг/нед в сочетании с приемом ГК в таблетках по вышеописанной схеме. Все пациенты в группах тГК дополнительно, с целью профилактики остеопороза, получали в течение 3 мес ризедронат — 35 мг/нед, кальций — 500 мг/сут и витамин D — 400 мг/сут.
Статистически значимые различия в эффективности применяемых схем лечения определялись только в течение первых трех месяцев терапии с преобладанием эффекта в группах тройной терапии (рис. 1). Через 12 мес группы не различались по количеству пациентов в ремиссии и с НАБ. λDAS28 между двумя различными схемами «мост»-терапии ГК составила −0,20 (95% ДИ от −0,45 до 0,04), что свидетельствует о сопоставимой эффективности парентерального приема ГК и тГК коротким курсом в достижении ремиссии/низкой активности болезни при инициальной комбинированной терапии пациентов с ранним РА. Также не выявлено статистически значимых различий между группами в количестве обострений при отмене/снижении дозы. Показатели рентгенологического прогрессирования (индекс Шарпа) и функционального статуса (HAQ) были сопоставимы при всех вариантах терапии через 12 мес лечения. В группе монотерапии МТХ дополнительное назначение БА потребовалось в 2 раза чаще, чем в группах тройной терапии (27% vs 43%). Общее количество ПЭ было сопоставимо между группами, с меньшей потребностью в медикаментозном лечении при ПЭ в группе монотерапии МТХ (тГК — 65%, монотерапия МТХ — 45%, p=0,008). Не было разницы в ПЭ между парентеральным и пероральным (тГК) путями введения ГК.
Датское исследование OPERA представляет интерес своим необычным дизайном. В качестве «мост»-терапии у пациентов с ранним РА применяли триамцинолон гексацетонид 40 мг/мл, который вводили в/с в дозе, не превышающей 4 мл (в 4 сустава) на одно введение (Hørslev-Petersen K. et al., 2014). У 180 наивных пациентов параллельно с назначением ГК изучали сравнительную эффективность монотерапии МТХ в дозе 20 мг/нед с комбинированной терапией МТХ + адалимумаб (АДА). Оценку эффективности лечения проводили каждые 3 мес. Согласно дизайну исследования, при сохранении умеренной активности РА через 3 мес лечения (DAS28 СРБ ≥3, 2, ≥1 припухшего сустава) пациентам дополнительно вводили триамцинолона гексацетонид в/с ежемесячно, но не более 3 мес последовательно, в мелкие или крупные суставы. В случае отсутствия эффекта через 6 мес лечения пациента переводили в открытую фазу, где АДА заменяли на другой БА по решению врача. Отличительной особенностью данного исследования был полный запрет применения нестероидных противовоспалительных препаратов в течение 12 мес лечения.
Комбинация БМП с в/с введением триамцинолона гексацетонида была высокоэффективна в обеих группах. Через 12 мес лечения НАБ зарегистрирована соответственно у 80 и 76% пациентов в группах МТХ + АДА и монотерапии МТХ (p=0,65). Однако эффективность комбинированной терапии АДА + МТХ в достижении ремиссии РА существенно превышала эффективность монотерапии МТХ (74% vs 49%). Кумулятивная доза триамцинолона гексацетонида и количество суставов, куда были проведены инъекции, не различались между группами. Использование в данном исследовании ГК в/с в качестве «мост»-терапии позволило быстро достигнуть ремиссии/НАБ с применением ГК в низких дозах. При перерасчете на ежедневный прием (40 мг триамцинолона соответствует 50 мг преднизолона) среднесуточная доза ГК не превышала 1 мг/сут по преднизолону, при этом дозу выше 2 мг/сут получали не более 5% пациентов, что обеспечило отсутствие системных ПЭ.
В исследовании CareRA проводили сравнительную оценку эффективности таблетированного приема ГК в средних и высоких дозах (Бельгийская когорта раннего артрита, 2009–2013 гг.; Verschueren P. et al., 2015). Основным критерием включения был очень ранний РА, не более 3 нед от момента установления диагноза. Стратификация лечения проводилась в зависимости от наличия факторов неблагоприятного прогноза. В группу высокого риска (ВР) вошли 290 пациентов с умеренной/высокой активностью (DAS28 СРБ >3,2) вне зависимости от серопринадлежности, а также серопозитивные («РФ+») пациенты с эрозиями вне зависимости от активности болезни. Соответственно когорту низкого риска (НР) составили все пациенты с отсутствием активности РА (DAS28 СРБ ≤3,2) и серонегативные («РФ–») пациенты без эрозий (n=110).
Пациенты ВР были рандомизированы в одну из трех групп с разной терапевтической стратегией:
- COBRA Classic: МТХ + ССЗ + ГК 60–40–25–20–15–10–7,5 мг/сут/нед.
- COBRA Slim: МТХ + ГК 30–20–12,5–10–7,5–5 мг/сут/нед.
- COBRA Avant-Garde: МТХ + ЛФ (лефлуномид) + ГК 30–20–12,5–10–7,5–5 мг/сут/нед.
- Пациенты НР были рандомизированы следующим образом:
- COBRA Slim: МТХ + ГК 30–20–12,5–10–7,5–5 мг/сут/нед.
- МТХ: 15 мг/нед с повышением до 20 мг/нед. В группе монотерапии МТХ ГК были запрещены.
МТХ применяли в дозе 15 мг/нед, ССЗ — 2 г/сут, ЛФ — 10 мг/сут. Начальная доза ГК снижалась еженедельно до дозы 7,5/5 мг/сут. В этой дозе пациенты продолжили прием ГК до 28-й недели, затем дозу продолжали снижать еженедельно, пропуская прием одной суточной дозы до полной отмены через 6 нед. Целью лечения было достижение ремиссии. Оценку эффективности проводили каждые 8 нед, и при сохранении активности болезни (DAS28 СРБ >3,2) повышали дозы БМП до максимальных. Первые 16 нед данного исследования фактически отражают период, условно названный «окно возможностей» в лечении пациентов с РА.
Ремиссия на 16-й неделе была достигнута у 70,4% пациентов в группе COBRA Classic, у 73,5% — в группе COBRA Slim и у 68,1% — в группе COBRA Avant-Garde (p=0,713) (рис. 2). Повышение дозы БМП через 8 нед лечения потребовалось соответственно в 19,4; 22,4 и 14,9% случаев в группах Classic, Slim и Avant-Garde (p=0,407), из них НАБ на 16-й неделе достигло соответственно 50,0; 87,5 и 60,0% (p=0,086). Только незначительному количеству пациентов дополнительно потребовалось в/с введение ГК: 3,1% — в группе Classic, по 5,1% — в группах Slim и Avant-Garde (p=0,703). Сопоставимо с данными РКИ tREACH монотерапия МТХ отличалась лучшей переносимостью, ПЭ зарегистрированы у 46,9% пациентов, что достоверно меньше, чем в группах Classic (61,2%) и Avant-Garde (69,1%). Рентгенологическое прогрессирование было минимальным и не различалось между группами. Не отмечалось преимущества применения ГК в высоких дозах, группы с приемом ГК в дозах 60 и 30 мг/сут не различались по частоте достижения ремиссии, с тенденцией к увеличению выраженности системных ПЭ при приеме в высоких дозах.
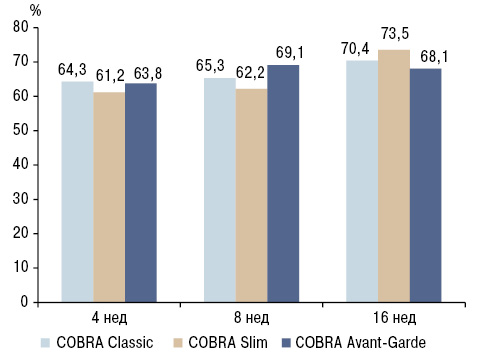
Согласно полученным данным, у пациентов с ранним РА в фазе индукции ремиссии монотерапия МТХ в сочетании со средними дозами ГК является наиболее оптимальным вариантом лечения, обеспечивая быстрый эффект и не уступая по эффективности комбинации БМП. Величина дозы ГК прямо пропорциональна скорости наступления терапевтического эффекта. Так, в исследовании tREACH комбинация МТХ с ГК значительно уступала по эффективности тройной терапии БМП в первые 12 нед лечения, тогда как, по данным CareRA, группы имели сопоставимую эффективность уже через 4 нед лечения (de Jong P. et al., 2014). Данный факт можно объяснить тем, что в исследовании tREACH стартовая доза ГК составляла 15 мг/сут с полной постепенной отменой в течение 10 нед, тогда как пациенты в исследовании CareRA принимали ГК в стартовой дозе 60–30 мг/сут со снижением до 7,5–5 мг/сут в течение 6 нед и продолжением приема ГК в низких дозах в целом до 34-й недели лечения.
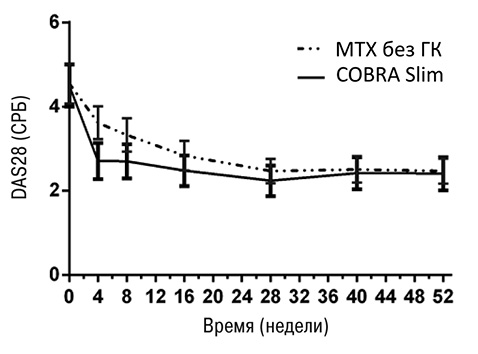
Через 1 год терапии ремиссия сохранялась соответственно у 64,3; 60,2 и 62,4% пациентов ВР в группах COBRA Classic, COBRA Slim и COBRA Avant-Garde (p=0,840). У пациентов НР комбинация МТХ с ГК не имела преимущества перед монотерапией МТХ (p=0,329) (рис. 3). Согласно последним рекомендациям EULAR (Smolen J.S. et al., 2017) после достижения устойчивой ремиссии заболевания необходимо снижать/отменять ГК и БМП. В исследовании CareRA через 52 нед лечения 76,0% пациентов получали монотерапию БМП, только 5,2% применяли ГК и 7,5% — БА, что иллюстрирует реальность уменьшения количества применяемых препаратов при быстром достижении и сохранении ремиссии у пациентов с ранним РА (Verschueren P. et al., 2017).
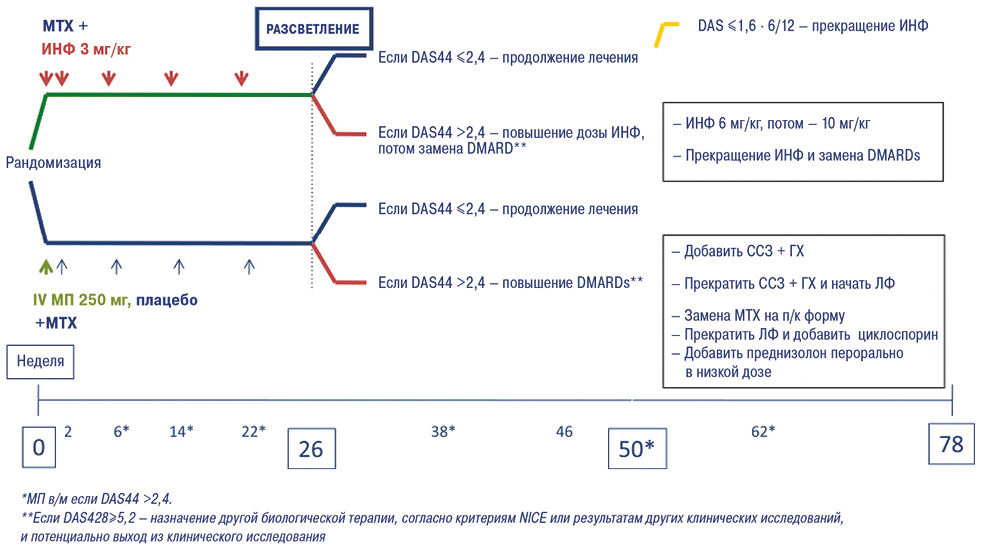
Британское исследование IDEA (n=112) также было посвящено поиску оптимальной схемы индукции ремиссии у терапевтически наивных пациентов с ранним РА. В данном случае сравнивали эффективность применения ГК в высоких дозах парентерально с инфликсимабом (ИНФ) (Nam J.L. et al., 2014). Пациенты получали ИНФ в дозе 3 мг/кг массы тела по стандартной схеме (0; 2; 6; 14; 22 нед) или МП 250 мг в виде однократной в/в инфузии (рис. 4). Все пациенты получали МТХ в дозе 20 мг/нед (эскалация — с 10 до 20 мг/нед в первые 6 нед) и при необходимости — в/м или в/с инъекции МП на 6-, 14-, 22-, 38-, 50- и 62-й неделях). ГК в таблетках не применяли.
Важно отметить, что эффективность терапии и скорость рентгенологического прогрессирования были сопоставимы для МП и ИНФ, с преобладанием скорости наступления терапевтического эффекта в группе ИНФ в первые 6 нед лечения (рис. 5). Устойчивая ремиссия (DAS44 <1,6) в течение 6 мес достигнута у 37,9% в группе ИНФ и у 30,8% — в группе МП в среднем через 59,27 и 60,98 нед лечения соответственно (p=0,251). Устойчивая ремиссия — это ремиссия, которая должна быть зарегистрирована врачом как минимум на трех последовательных визитах в клинику и сохраняться не менее 6 мес (Schett G. et al., 2016). У каждого пятого пациента ИНФ был отменен в связи с ремиссией, которая сохранялась после отмены у большинства (78,6%) пациентов до 78-й недели. В данном исследовании выявлена зависимость структурно-модифицирующего действия препаратов от серопринадлежности пациентов. В группе МП отсутствие рентгенологического прогрессирования зарегистрировано у большинства (96%) «РФ–» пациентов, тогда как в группе ИНФ — у большинства «РФ+» (74%).
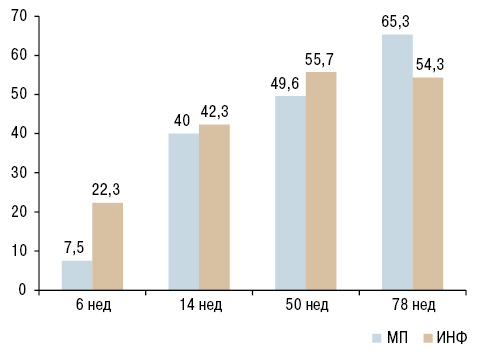
Коррекция терапии в обеих группах в связи с отсутствием ремиссии/НАБ потребовалась у более чем 60% случаев в течение всего периода исследования. С учетом дополнительного применения МП в/м в дозе 120 мг у пациентов с умеренной/высокой активностью болезни, средняя доза ГК в первые 26 нед лечения была достоверно выше в группе МП и в среднем составила МП 21,1 мг/мес (ИНФ — 16 мг/мес; p=0,069). Среднесуточная доза в перерасчете на весь период наблюдения была сопоставима в обеих группах и составила 0,89 мг/сут для группы МП и 0,67 мг/сут — для группы ИНФ.
Таким образом, однократное или последовательное применение ГК парентерально позволяет получить быстрый эффект при использовании препарата в низких дозах и предполагает отсутствие системных ПЭ. По данным исследования ESPOIR, в котором оценивали 7-летнюю безопасность ГК, нет достоверных данных в пользу негативного влияния ГК в низких дозах (3,1±2,9 мг/сут по преднизолону) на профиль безопасности у французской когорты пациентов с ранним РА (Roubille C. et al., 2017).
Таким образом, на сегодняшний день ГК, вводимые как парентерально, так и в таблетках, являются неотъемлемой частью стратегии «лечение до достижения цели». При этом выбор дозы и пути введения ГК следует проводить с учетом индивидуального клинического сценария. При наличии факторов неблагоприятного прогноза применение ГК в средних дозах в качестве «мост»-терапии (исследование COBRA) может иметь потенциальные преимущества перед использованием препарата в низких дозах у пациентов с ранним РА.
Применение ГК в низких дозах обеспечивает медленное развитие геномных эффектов и в случае высокой активности болезни может не удовлетворять определению «мост»-терапии и не обеспечивать быстрого развития ремиссии. Применение ГК в средних/высоких дозах коротким курсом (включая однократное введение 250 мг МП в/в) благодаря немедленному развитию негеномных эффектов оказывает более радикальный биологический эффект на иммунологические механизмы развития РА и обеспечивают «реальную» индукцию ремиссии (Buttgereit F. et al., 2002; Spies C.M. et al., 2011; Schett G. et al., 2016). Продолжение применения ГК в низких дозах до момента развития максимальной терапевтической активности БМП (до 6 мес) более эффективно для развития устойчивой ремиссии, чем использование коротких курсов (Bakker M.F. et al., 2012).
У пациентов с высоким риском развития системных ПЭ ГК обосновано первичное назначение как однократного в/в введения МП в дозе 250 мг, так и последующих в/м и в/с инъекций в рамках стратегии «лечение до достижения цели». Применение ГК парентерально, по данным РКИ OPERA (Hørslev-Petersen K. et al., 2014) и IDEA (Nam J.L. et al., 2014), позволило достичь высокой частоты ремиссии при использовании в среднем очень низких доз ГК. Кроме того, в/в введение ГК подобно блокаторам фактора некроза опухоли-альфа ингибирует активность остеокластов и может минимизировать повреждение костной ткани на ранних стадиях заболевания. Последующее эффективное использование стратегии «лечение до достижения цели» в этой группе больных может существенно снизить вероятность формирования эрозий.
Эффективное и рациональное применение ГК в сочетании с БМП в дебюте РА по данным представленных РКИ позволило в большинстве случаев избежать комбинированной болезнь-модифицирующей терапии, «хронического» применения ГК и даже отменить БА в связи с развитием устойчивой ремиссии при отсутствии рентгенологического прогрессирования и сопоставимой частоты ПЭ. Эти результаты согласуются с трансформацией концепции РА в последние годы от хронического пожизненного заболевания к острому/подострому воспалительному процессу, который может быть прерван при определенных обстоятельствах, наиболее важными из которых являются ранняя диагностика и немедленное адекватное лечение (Schett G. et al., 2016).
Определяющее значение при проведении ГК-терапии имеет выбор препарата с оптимальным соотношением силы противовоспалительного действия и спектра ПЭ. С момента открытия возможности получения синтетических ГК путем изменения химической структуры кортизона постоянно проводится поиск оптимального лекарственного средства с сильной противовоспалительной активностью и минимальным спектром ПЭ. Наибольшим научным достижением ХХ века стал синтез первого синтетического ГК — преднизолона — посредством внедрения двойной связи между первым и вторым атомами углерода в молекуле кортизона, что позволило достичь 4-кратного повышения противовоспалительной активности и некоторого снижения минералокортикоидного эффекта. Продолжением усовершенствования молекулы синтетических ГК было введение в молекулярную структуру фтора и выход на рынок дексаметазона, триамцинолона и бетаметазона. Данные препараты полностью лишены минералокортикоидной активности и по противовоспалительному действию в 30 раз превышают эффекты кортизона (таблица). Однако при систематическом применении этих препаратов сила противовоспалительного действия оказалась параллельна силе ПЭ (Siegel S.C., 1985). В результате постоянной стимуляции ГК рецепторов периферических тканей, а также значительно возросшего периода полувыведения и биологической активности новые аналоги ГК с большей силой и в более низких дозах вызывают подавление гипоталамо-гипофизарно-надпочечниковой оси и развитие вторичного синдрома Кушинга (Paragliola R.S. et al., 2017).
Таблица
Соотношение силы противовоспалительного действия, побочных эффектов,
периодов фармакологической и биологической активности эндогенных и синтетических ГК
| Препарат | Противовоспалительный потенциал* | Эквивалентная фармакологическая доза, мг | Минералокортикоидная активность | Повышение аппетита | Мышечная миопатия | Период полувыведения, ч | Угнетение ГГНО**, мг | |
|---|---|---|---|---|---|---|---|---|
| плазматический | биологический | |||||||
| Гидрокортизон | 1 | 20 | 2+ | 2+ | 1+ | 1,5 | 8–12 | 20–30 |
| Кортизон | 0,8 | 25 | 2+ | 2+ | 1+ | 1,5 | 8–12 | 25–35 |
| Преднизон | 2,7 | 5 | 1+ | 3+ | 1+ | 2,7 | 12–36 | 7,5 |
| Преднизолон | 4 | 5 | 1+ | 3+ | 1+ | 2,75 | 12–36 | 7,5 |
| Метилпреднизолон | 5 | 4 | 0 | 2+ | 1+ | 3,0 | 12–36 | 7,5 |
| Триамцинолон | 5 | 4 | 0 | 0 | 3+ | 4,2 | 24–48 | 5–7,5 |
| Параметазон | 10 | 2 | 0 | 3+ | 2+ | 5,0 | 36–54 | 2,5–5 |
| Дексаметазон | 30 | 0,75 | 0 | 4+ | 2+ | 5,0 | 36–54 | 1–1,5 |
| Бетаметазон | 30 | 0,6 | 0 | 4+ | 2+ | 5,0 | 36–54 | 1–1,5 |
Относительно гидрокортизона, принятого за единицу.
ГГНО — гипоталамо-гипофизарно-надпочечниковая ось.
Уровни 0–4+.
Суточная доза, которая обычно приводит к угнетению ГГНО.
С учетом соотношения эффективность/безопасность при проведении ГК-терапии длительностью более 3 нед (период, достаточный для супрессии гипоталамо-гипофизарно-надпочечниковой оси), и особенно при использовании в средних и высоких дозах, препаратом выбора является нефторированный синтетический ГК метилпреднизолон, оригинальными представителями которого являются Медрол, Солу-Медрол, Депо-Медрол («Pfizer H.C.P. Corporation», США). При более высоком, чем у преднизолона, противовоспалительном эффекте он является короткоживущим препаратом без минералокортикоидной активности и сопоставимым с эндогенным кортизоном спектром ПЭ. Метилпреднизолон — золотой стандарт для проведения пульс-терапии благодаря значительному потенциалу оказания негеномных эффектов (по силе действия в более чем 3 раза превышает преднизолон и уступает только дексаметазону) и минимальному спектру ПЭ.
Список использованной литературы
- Albrecht K., Callhoff J., Schneider M. et al. (2015) High variability in glucocorticoid starting doses in patients with rheumatoid arthritis: observational data from an early arthritis cohort. Rheumatol. Int., 35: 1377–1384.
- Aletaha D., Neogi T., Silman A.J. et al. (2010) 2010 Rheumatoid Arthritis Classification Criteria: an American College of Rheumatology/European League Against Rheumatism collaborative initiative. Arthritis Rheum., 62(9): 2569–2581. doi: 10.1002/art.27584.
- Arnett F.C., Edworthy S.M., Bloch D.A. et al. (1988) The American Rheumatism Association 1987 revised criteria for the classification of rheumatoid arthritis. Arthritis Rheum., 31: 315–324.
- Bakker M.F., Jacobs J.W., Welsing P.M. et al. (2012) Low-dose prednisone inclusion in a methotrexate-based, tight control strategy for early rheumatoid arthritis: a randomized trial. Ann. Int. Med., 156: 329–339.
- Black R.J., Joseph R.M., Brown B. et al. (2015) Half of U.K. patients with rheumatoid arthritis are prescribed oral glucocorticoid therapy in primary care: a retrospective drug utilization study. Arthritis Res. Ther., 17: 375.
- Boers M., Verhoeven A.C., Markusse H.M. et al. (1997) Randomised comparison of combined step-down prednisolone, methotrexate and sulphasalazine with sulphasalazine alone in early rheumatoid arthritis. Lancet, 350: 309–318.
- Buttgereit F., da Silva J.A., Boers M. et al. (2002) Standardised nomenclature for glucocorticoid dosages and glucocorticoid treatment regimens: current questions and tentative answers in rheumatology. Ann. Rheum. Dis., 61: 718–722.
- Cardiel M.H., Pons-Estel B.A., Sacnun M.P. et al. (2012) Treatment of early rheumatoid arthritis in a multinational inception cohort of Latin American patients: the GLADAR experience. J. Clin. Rheumatol., 18: 327–335.
- Combe B., Landewe R., Daien C.I. et al. (2017) 2016 update of the EULAR recommendations for the management of early arthritis. Ann. Rheum. Dis., 76: 948–959. doi:10.1136/annrheumdis-2016-210602.
- de Jong P.H., Hazes J.M., Han H.K. et al. (2014) Randomised comparison of initial triple DMARD therapy with methotrexate monotherapy in combination with low-dose glucocorticoid bridging therapy; 1-year data of the tREACH trial. Ann. Rheum. Dis., 73: 1331–1339.
- Ethgen O., de Lemos Esteves F., Bruyere O. et al. (2013) What do we know about the safety of corticosteroids in rheumatoid arthritis? Curr. Med. Res. Opin., 29: 1147–1160.
- Hørslev-Petersen K., Lund Hetland M., Junker P. et al. (2014) Adalimumab added to a treat-to-target strategy with methotrexate and intra-articular triamcinolone in early rheumatoid arthritis increased remission rates, function and quality of life. The OPERA Study: an investigator-initiated, randomised, double-blind, parallel-group, placebo-controlled trial. Ann. Rheum. Dis., 73: 654–661.
- McKeown E., Bykerk V.P., De Leon F. et al. (2012) Quality assurance study of the use of preventative therapies in glucocorticoid-induced osteoporosis in early inflammatory arthritis: results from the CATCH cohort. Rheumatology (Oxford), 51: 1662–1669.
- Meyfroidt S., van Hulst L.T., De Cock D. et al. (2014) Factors influencing the prescription of intensive combination treatment strategies for early rheumatoid arthritis. Scand. J. Rheumatol., 43: 265–272.
- Nam J.L., Villeneuve E., Hensor E.M.A. et al. (2014) Remission induction comparing infliximab and high-dose intravenous steroid, followed by treat-to-target: a double-blind, randomised, controlled trial in new-onset, treatment-naive, rheumatoid arthritis (the IDEA study). Ann. Rheum. Dis., 73: 75–85.
- Paragliola R.M., Papi G., Pontecorvi A., Corsello S.M. (2017) Treatment with Synthetic Glucocorticoids and the Hypothalamus-Pituitary-Adrenal Axis. Int. J. Mol. Sci., 18: 2201.
- Roubille C., Rincheval N., Dougados M. et al. (2017) Seven-year tolerability profile of glucocorticoids use in early rheumatoid arthritis: data from the ESPOIR cohort. Ann. Rheum. Dis., 76: 1797–1802. doi: 10.1136/annrheumdis-2016–210135.
- Schett G., Emery P., Tanaka Y. et al. (2016) Tapering biologic and conventional DMARD therapy in rheumatoid arthritis: current evidence and future directions. Ann. Rheum. Dis., 75: 1428–1437. doi: 10.1136/annrheumdis-2016-209201.
- Siegel S.C. (1985) Overview of corticosteroid therapy. J. Allergy Clin. Immunol., 76: 312–320.
- Singh J.A., Saag K.G., Bridges S.L.Jr. et al. (2016) 2015 American College of Rheumatology Guideline for the Treatment of Rheumatoid Arthr. Arthritis Care Res. (Hoboken), 68(1): 1–25. DOI 10.1002/acr.22783.
- Smolen J.S., Landewé R., Bijlsma J. et al. (2017) EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs: 2016 update. Ann. Rheum. Dis., 76: 960–977. doi: 10.1136/annrheumdis-2016–210715.
- Smolen J.S., Landewé R., Breedveld F.C. et al. (2010) EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs. Ann. Rheum. Dis., 69: 964–975.
- Smolen J.S., Landewé R., Breedveld F.C. et al. (2014) EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs: 2013 update. Ann. Rheum. Dis., 73(3): 492–509.
- Spies C.M., Strehl C., van der Goes M.C. et al. (2011) Glucocorticoids. Best Pract. Res. Clin. Rheumatol., 25: 891–900.
- Strehl C., Bijlsma J.W., de Wit M. et al. (2016) Defining conditions where long-term glucocorticoid treatment has an acceptably low level of harm to facilitate implementation of existing recommendations: viewpoints from an EULAR task force. Ann. Rheum. Dis., 75: 952–957.
- van Tuyl L.H., Plass A.M., Lems W.F. et al. (2007) Why are Dutch rheumatologists reluctant to use the COBRA treatment strategy in early rheumatoid arthritis? Ann. Rheum. Dis., 66: 974–976.
- Verschueren P., De Cock D., Corluy L. et al. (2015) Methotrexate in combination with other DMARDs is not superior to methotrexate alone for remission induction with moderate-to-high-dose glucocorticoid bridging in early rheumatoid arthritis after 16 weeks of treatment: the CareRA trial. Ann Rheum. Dis., 74: 27–34.
- Verschueren P., De Cock D., Corluy L. et al. (2017) Effectiveness of methotrexate with step-down glucocorticoid remission induction (COBRA Slim) versus other intensive treatment strategies for early rheumatoid arthritis in a treat-to-target approach: 1-year results of CareRA, a randomised pragmatic open-label superiority trial. Ann. Rheum. Dis., 76: 511–520.
Напечатано при поддержке
Представительства «Пфайзер Экспорт Би.Ви» в Украине
Адрес для переписки:
Гармиш Елена Алексеевна
03680, Киев, ул. Народного ополчения, 5
ГУ «ННЦ «Институт кардиологии
им. Н.Д. Стражеско» НАМН Украины»

Leave a comment