УРАЖЕННЯ НИРОК У ХВОРИХ НА СИСТЕМНИЙ ЧЕРВОНИЙ ВОВЧАК: ВАЖЛИВІСТЬ ГІСТОЛОГІЧНОГО ДІАГНОЗУ У ВИБОРІ РАЦІОНАЛЬНОЇ ТЕРАПІЇ. КЛІНІЧНИЙ ВИПАДОК
Триполка С.А.1, Головач И.Ю.2, Дядык Е.А.3
- 1Коммунальное некоммерческое предприятие Харьковского областного совета «Областная клиническая больница», Харьков
- 2Клінічна лікарня «Феофанія» Державного управління справами, Київ
- 3Национальная медицинская академия последипломного образования им. П.Л. Шупика, Киев
Резюме. У статті подано сучасні підходи до діагностики вовчакового нефриту. Описано патоморфологічні зміни при вовчаковому гломерулонефриті, наведено характеристику класів люпус-нефриту. На сьогодні жоден із сироваткових чи сечових біомаркерів активності недуги не перевищує за інформативністю гістопатологічне дослідження біоптатів нирки. Отже, класифікація вовчакового гломерулонефриту визначається результатами патоморфологічного дослідження. Стаття ілюстрована численними фотографіями патогістологічних змін нирок при різних класах нефриту. Наведено клінічний випадок спостереження за пацієнткою із системним червоним вовчаком і ураженням нирок. Проведення нефробіопсії з подальшим патогістологічним дослідженням дозволило встановити клас нефриту, а також змінити застосовувану імуносупресорну терапію. Представлений клінічний випадок підкреслює необхідність і доцільність проведення біопсії нирок і встановлення морфологічного класу нефриту якомога в більш ранні терміни захворювання, що уможливить більш цілеспрямований підбір терапії та досягнення успіху в лікуванні на більш ранніх стадіях.
Клинические признаки поражения почек развиваются у большинства пациентов с системной красной волчанкой (СКВ), как правило, это возникающие в какой-то момент болезни отклонения в анализе мочи [1]. Клинически очевидное поражение почек в конечном итоге развивается примерно у половины пациентов с СКВ [3, 14, 15, 23, 35, 52, 54]. В качестве иллюстрации этого хотелось бы привести три наиболее показательных когортных исследования [14, 15, 35]: среди 1000 пациентов из 12 клинических центров Европы у 16% была диагностирована нефропатия на фоне установленной СКВ, определяемая как экскреция белка >0,5 г/сут, повышение креатинина сыворотки по меньшей мере на 0,8 мг/дл (71 мкмоль/л) [15]. В течение 10 лет наблюдения нефропатия развилась у 28% пациентов [14]. В другом отчете, который охватывал 1378 пациентов с СКВ в Соединенных Штатах Америки (США), хроническая болезнь почек, определяемая как экскреция белка >0,5 г/сут, изменения мочевого осадка ≥5 эритроцитов в поле зрения, повышение креатинина сыворотки крови ≥1,5 мг/дл (133 мкмоль/л), присутствовала у 32% пациентов в течение одного года после установления диагноза [35]. При средней длительности заболевания 9 лет у 47% пациентов зафиксирована экскреция белка, которая составляла >0,5 г/сут; у 6% больных снижалась скорость клубочковой фильтрации (СКФ) и у 4% развилась терминальная стадия почечной недостаточности [8]. Еще в одном исследовании населения США с использованием базы данных Медикейд (Medicaid; в основном это этнические и расовые меньшинства, живущие в условиях нищеты) показано, что у 144 пациентов с СКВ на 100 000 человек в течение 5 лет были признаки поражения почек [24]. Диагноз гломерулонефрита (ГН) установлен у 21,5% этих пациентов (31 случай волчаночного нефрита на 100 000 человек в популяции). Истинная распространенность волчаночного нефрита в этой группе высокого риска, вероятно, будет больше, поскольку наблюдение охватило всего лишь пять лет, и у некоторых пациентов нефропатия могла быть не диагностирована. Более высокая заболеваемость волчаночным нефритом среди пациентов с СКВ в США по сравнению с Европой может частично отражать расовые и этнические различия: частота волчаночного нефрита выше у афроамериканцев (от 34 до 51%), латиноамериканцев (от 31 до 43%) и азиатов (от 33 до 55%) по сравнению с белыми (от 14 до 23%) [12, 24]. У афро- и латиноамериканцев также отмечаются более сложные (высоких градаций) данные гистопатологического исследования, более высокие сывороточные концентрации креатинина и более высокие значения протеинурии, чем у белокожих жителей США [17].
Большинство почечных аномалий появляются вскоре после установления диагноза СКВ (обычно в течение первых 6–36 мес) [10, 42, 52]. Хотя повышенная сывороточная концентрация креатинина в конечном итоге регистрируется примерно у 30% всех пациентов с СКВ, снижение функции почек в первые годы диагностики СКВ является необычным. Временной курс развития волчаночного нефрита варьируется в зависимости от пола, возраста и этнической принадлежности. Так, в ретроспективном исследовании в США мужчины, более молодые пациенты (например моложе 33 лет при установлении диагноза) и пациенты не европеоидной расы были подвержены более высокому риску развития люпус-нефрита и риску более раннего его возникновения [52].
КЛИНИЧЕСКИЕ ОСОБЕННОСТИ И ДИАГНОСТИКА
У пациентов с СКВ наличие нефрита подозревается на основании аномальных результатов анализа мочи и/или повышения сывороточного креатинина, а диагноз подтверждается гистопатологическими данными по результатам почечной биопсии [3]. При этом, как отмечалось выше, у некоторых пациентов признаки поражения почек могут присутствовать уже во время первичной диагностики СКВ. Пациенты с СКВ должны проходить тестирование на поражение почек через регулярные промежутки времени, в частности анализ мочи с изучением мочевого осадка (поиск гематурии и клеток), оценку экскреции белка с мочой за сутки и уровень креатинина сыворотки, также определяют СКФ. Повышенные титры антител к ДНК и низкие уровни комплемента (C3 и C4) часто указывают на активную волчанку, ассоциированы с волчаночным нефритом, хотя полезность серологической оценки среди пациентов может отличаться [26].
Биопсию почек следует проводить у большинства пациентов с СКВ, имеющих признаки поражения почек, с целью не только установления диагноза, но и определения класса волчаночного нефрита. Установление класса волчаночного нефрита важно по следующей причине: лечение должно базироваться на гистологическом подтипе (по классификации Международного общества нефрологии [International Society of Nephrology — ISN]/Общества патологии почек [Renal Pathology Society — RPS]), степени активности и осложнений, таких как интерстициальный нефрит и тромботическая микроангиопатия [2, 5].
Клиническая картина может не точно отражать тяжесть гистологических результатов. Например, при минимальной протеинурии и нормальном креатинине сыворотки крови у пациента может определяться пролиферативный тип люпус-нефрита по данным гистологического исследования, что требует незамедлительной медикаментозной коррекции.
Тем не менее пациенты с протеинурией <500 мг/сут и незначительными изменениями осадка мочи не нуждаются в биопсии почек. У таких пациентов вряд ли будет класс нефрита, при котором требуется проведение иммунодепрессивной терапии, если во время последующих обследований ухудшения функции почек не отмечается.
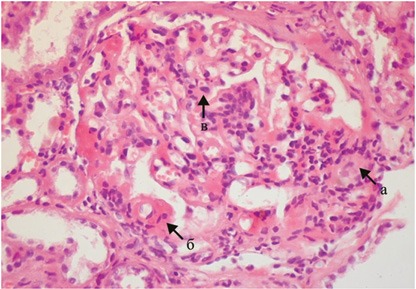
Патоморфологические изменения при волчаночном гломерулонефрите (ВГН) могут быть весьма разнообразными [2, 4, 6, 16]. В отдельных случаях ВГН может сочетаться с другими иммунокомплексными ГН. Наряду с этим существуют патоморфологические особенности, характерные для любого класса ВГН. К ним относятся: мезангиальная, эндокапиллярная пролиферация (гиперклеточность), кариорексис, фибриноидный некроз, гиалиновые тромбы, гематоксилиновые тельца, утолщение базальной мембраны капилляров в виде «проволочных петель» (рис. 1).
При иммунофлюоресцентной микроскопии (ИФМ) или иммуногистохимическом исследовании (ИГХИ) в клубочках характерны субэндотелиальные вдоль гломерулярной базальной мембраны (ГБМ) диффузные или очаговые депозиты IgG, С3, С1q, а в части наблюдений — IgM и IgA; в зоне мезангиума в различных сочетаниях и степени интенсивности — депозиции IgG, IgM, IgA, С3 и С1q, так называемый фуллеровый рисунок. Именно наличие депозитов иммунных комплексов в трех пространствах клубочков (мезангиальном, субэндотелиальном, субэпителиальном) являются отличительной чертой ВГН. В составе депонирующих иммунных комплексов определяется весь набор иммуноглобулинов (IgG, IgA, IgM) и компонентов комплемента (С3, С4 и С1q) — так называемый full house [2, 5, 6].
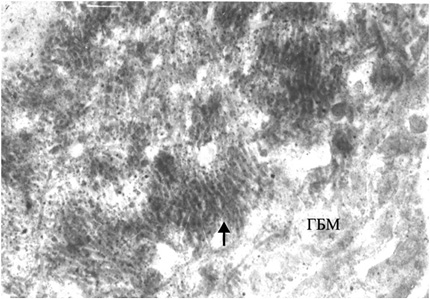
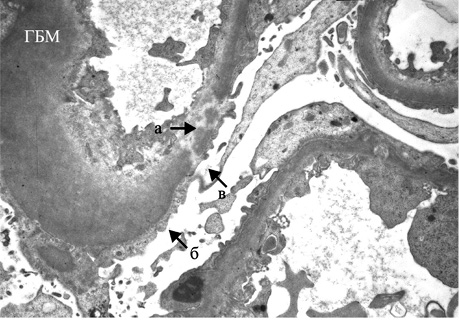
При электронной микроскопии (ЭМ) характерны наличие неравномерной пролиферации, набухание МК и ЭК, инфильтрация капилляров ПЯЛ, расширение мезангиальной зоны и увеличение мезангиального матрикса (ММ), наличие крупных электронно-плотных субэндотелиальных депозитов, реже — мезангиальных. Отличительной чертой является вовлечение в патологический процесс подоцитов — слияние малых отростков подоцитов (МОП), оголение ГБМ, активация подоцитов, повреждение их с появлением жировых, белковых вакуолей, вторичных лизосом и с микровиллезной трансформацией цитоплазмы [2]. В части наблюдений выявляются субэпителиальные депозиты (тубулоретикулярные включения) в виде негомогенных отложений электронно-плотного материала с чередующимися темными и светлыми линиями — «пальцеподобные» («fingerprint») депозиты II типа (рис. 2). Эти включения состоят из рибонуклеопротеина и мембраны, их синтез стимулируется α-интерфероном [45]. Единственными другими обстоятельствами, в которых эти образования могут также встречаться, являются ВИЧ-нефропатия (связанная с хронически высокими уровнями циркулирующего α-интерферона) и лечение α-интерфероном. Тем не менее пациенты с ВИЧ-нефропатией обычно имеют коллабирующий фокальный сегментарный гломерулосклероз, а не пролиферативный ГН с иммунокомплексными депозитами.
КЛАССИФИКАЦИЯ
За последние два десятилетия предпринято несколько попыток разных профессиональных сообществ классифицировать гломерулопатии, связанные с СКВ. Морфологический диагноз ВГН должен базироваться на критериях, предложенных экспертами ВОЗ в 1995 г. [16] и пересмотренных в 2003 г. экспертами ISN и Международной ассоциации морфологов (International Morphological Association — IMA). Согласно этим рекомендациям и определениям различают 4 морфологических класса ВГН [25, 55]. С учетом этих определений и рекомендаций изменения с вовлечением в патологический процесс 50% клубочков и более обозначались как диффузные, а менее 50% клубочков — как фокальные; глобальными считают изменения, охватывающие более чем половину капилляров клубочка, а сегментарными — менее чем половину. Хотя разные классы имеют различные гистологические, клинические и прогностические характеристики, часто они могут перекрываться. Большую роль в патоморфологической интерпретации играет техника проведения биопсии. В идеальном случае образец биопсии должен содержать до 25, но не менее 8 клубочков. Кроме того, значительный процент пациентов переходит из одного класса ВГН в другой, иногда после терапии, а иногда и спонтанно со временем течения заболевания [2, 11, 29, 36, 38, 40]. Эволюция от одного класса нефрита к другому не вызывает удивления, поскольку различные типы гистологий представляют собой неспецифические ответы на иммунные комплексные осадки.
Учитывая инвазивность методики для градации классов нефрита, ученые попытались сопоставить различные серологические показатели и параметры мочи как потенциальные неинвазивные детерминанты гистологического класса [46]. Они включали комбинацию уровня антител к ДНК и низких уровней комплемента, анти-C1q-антител [18], индуктора опухолевого некроза апоптоза (TWEAK) [51] и липокалина (NGAL) [47]. Тем не менее ни один из сывороточных или мочевых биомаркеров активности болезни не превышает по информативности гистопатологическое исследование биоптатов почки. Таким образом, классификация ВГН определяется результатами патоморфологического исследования.
Минимальный мезангиальный люпус-нефрит (класс I). Этот класс волчаночного нефрита редко диагностируется, поскольку у таких пациентов, как правило, нормальный анализ мочи или минимальная протеинурия и нормальный уровень креатинина в сыворотке крови. В результате биопсия обычно не выполняется. Как правило, I класс «резервируется» за случаями ВГН с наличием иммунных депозитов в мезангиуме, выявляемых при ИФМ и ЭМ, и отсутствием поражений, определяемых при световой микроскопии (СМ). Минимальный мезангиальный волчаночный нефрит (класс I) представляет собой самую раннюю и мягкую форму гломерулярного поражения при СКВ [2, 3].
Мезангиальный пролиферативный волчаночный нефрит (класс II). Гистологические изменения II класса ВГН клинически проявляются микроскопической гематурией и/или протеинурией. Гипертензия обычно не характерна, а нефротический синдром и почечная недостаточность практически никогда не выявляются. При СМ характерны «чистые» мезангиальные изменения, неравномерные в пределах одного клубочка и различной выраженности в разных клубочках, умеренное расширение мезангиальной зоны, незначительное увеличение ММ. При этом в очагах пролиферации МК выявляются мелкие депозиты (рис. 3). Периферические капиллярные петли клубочков тонкие.
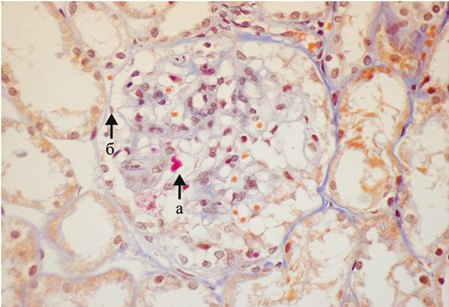
При ИФМ/ИГХИ в зоне мезангиума отмечаются незначительные гранулярные депозиты IgG, фракции комплемента (С3). При ЭМ встречаются мелкие электронно-плотные депозиты в мезангиуме, пролиферация МК, умеренная активация подоцитов.
Наличие субэндотелиальных депозитов при СМ, а также глобального или сегментарного гломерулосклероза (как результата предшествующей пролиферации, фибриноидного некроза или экстракапиллярной пролиферации в виде полулуний), исключает диагноз ВГН II класса. Данная картина указывает на более тяжелые формы заболевания — III или IV класса ВГН. Почечный прогноз при мезангиальном пролиферативном ВГН является хорошим и не требует базисной терапии, если у пациента не наблюдается прогрессирующее течение болезни или нет подтверждения почечной недостаточности [5].
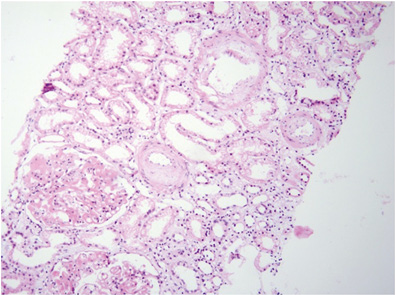
Фокальный волчаночный нефрит (класс III). Данный класс поражения почек обычно клинически ассоциируется с гематурией и протеинурией, некоторые пациенты имеют гипертонию, сниженную СКФ и/или нефротический синдром. При СМ характерно наличие в вовлеченных (то есть <50%) в патологический процесс клубочках сегментарной пролиферации МК, ЭК, «активных» изменений в виде сегментарного отложения фибрина в клубочках, кариорексиса, ПЯЛ, гиалиновых и фибриновых тромбов, гематоксилиновых телец, утолщения части капиллярных стенок в виде «проволочных петель», эпителиальных микрополулуний и/или полулуний (рис. 4). Кроме того, могут иметь место «неактивные» изменения: сегментарные и/или диффузные склеротические изменения в клубочках, выраженное увеличение ММ [2, 4, 5].
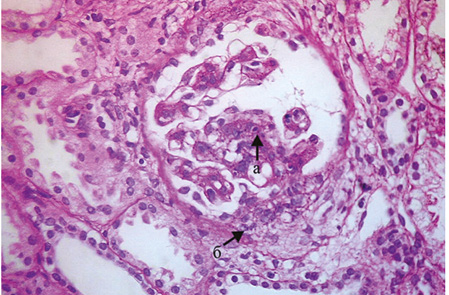
При ИФМ/ИГХИ в мезангиальной зоне определяются гранулярные депозиты IgG, возможна депозиция IgA и IgM, субэндотелиально вдоль ГБМ выявляются депозиты IgG, С1q и С3 фракций комплемента. При ЭМ характерна пролиферация МК, расширение мезангиальной зоны, увеличение ММ, электронно-плотные депозиты в мезангиуме, в части наблюдений слияние МОП, дегенеративные изменения в них — набухание цитоплазмы, расширенные цистерны комплекса Гольджи, электоронно-плотные тельца (лизосомы), гипертрофия ядра и появление пространства между базальной мембраной и подоцитами.
Существуют также подклассы III класса ВГН, которые определяются воспалительной активностью (или длительностью) поражений [48, 55]:
- Класс III (А), фокальный пролиферативный волчаночный нефрит, который является заболеванием класса III с активными поражениями.
- Класс III (A/C), фокальный пролиферативный и склерозирующий волчаночный нефрит, который связан с активными и хроническими поражениями.
- Класс III (C), фокальный склерозирующий волчаночный нефрит, при котором наблюдаются хронические неактивные поражения с рубцами.
Прогнозирование при III классе ВГН может быть затруднено вследствие определенной объективной сложности при точном установлении процента вовлеченных в патологический процесс клубочков. Эта последняя особенность обусловлена возможностью ошибки выборки, вызванной относительно небольшим количеством клубочков, которые получены при типичной чрескожной биопсии почек [2, 4].
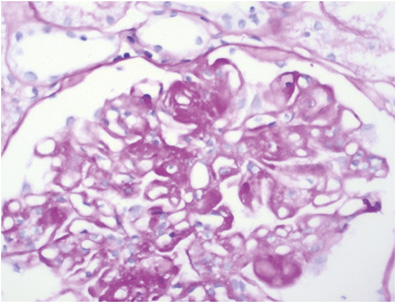
Диффузный волчаночный нефрит (класс IV) является наиболее распространенным гистологическим классом и самой тяжелой формой ВГН [1, 50]. Гематурия и протеинурия присутствуют практически у всех пациентов с активным заболеванием IV класса, часто развивается нефротический синдром, гипертония и снижение СКФ. У таких пациентов обычно отмечается значительная гипокомплементемия (особенно С3) и повышенные уровни анти-ДНК, особенно во время активной фазы болезни [37]. Данный класс ВГН характеризуется вовлечением в патологический процесс >50% клубочков. В них отмечается диффузная сегментарная и/или глобальная пролиферация МК и ЭК (класс IV-S, включающий <50% капилляров клубочка, класс IV-G, включающий >50% капилляров клубочка), увеличение ММ, утолщение и расщепление базальной мембраны капилляров клубочков по типу «проволочных петель» (рис. 5).
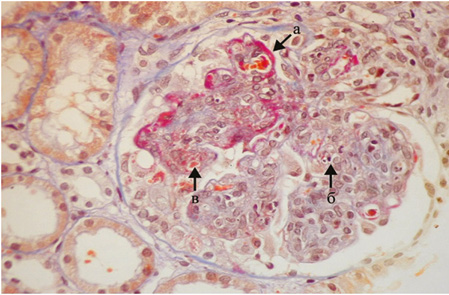
При ИМФ/ИГХИ в зоне мезангиума определяются в различных сочетаниях депозиты IgG, IgM, IgA, С3 и С1q, в очагах некроза, клеточных полулуниях, зонах гломерулосклероза имеет место депозиция фибриногена — так называемый full house, характерный для СКВ. При ЭМ в клубочках характерна неравномерная пролиферация, набухание МК и ЭК, инфильтрация капилляров ПЯЛ, расширение мезангиальной зоны с увеличением ММ, крупные электронно-плотные субэндотелиальные, мезангиальные и субэпителиальные депозиты. Часть субэндотелиальных депозитов в виде негомогенных отложений электронно-плотного материала с чередующимися темными и светлыми участками — «пальцеподобные» («fingerprint») депозиты II типа (см. рис. 2).
Существуют также подклассы IV класса ВГН, которые указывают на особенности морфологических изменений в клубочках, — сегментарные (S) или глобальные (G), а также распределяются по выраженности активности или хроничности поражений [55]:
- Класс IV-S (A), который является классом IV-S с активными повреждениями. Этот класс также называют диффузным сегментарным пролиферативным нефритом.
- Класс IV-G (A), который является подклассом IV-G, связан с активными повреждениями. Этот подтип также называют диффузным глобальным пролиферативным нефритом. Подгруппа пациентов с нефритом класса IV-G (A) имеет тяжелые сегментарные, а не глобальные гломерулярные поражения. Однако, поскольку сегментарные поражения у таких пациентов включают >50% пораженных капиллярных петель, они классифицируются как глобальные (класс IV-G), а не сегментарные (класс IV-S). Некоторые исследователи относят к этой подгруппе ВГН категории IV-Q болезни [49].
По сравнению с пациентами с классом IV-S и истинным глобальным поражением IV-G класса у пациентов с нефритом класса IV-Q значительно снижается частота ремиссии и наблюдается существенно более высокая заболеваемость почечной недостаточностью в терминальной стадии [48, 49].
- Класс IV-S (A/C), который связан с активными и хроническими поражениями. Его также классифицируют как диффузный сегментарный пролиферативный и склерозирующий нефрит.
- Класс IV-G (A/C), который является классом IV-G с активными и хроническими поражениями. Его также называют диффузным глобальным пролиферативным и склерозирующим нефритом.
- Класс IV-S (C) связан с хроническими неактивными поражениями со шрамами. Это диффузный сегментарный склерозирующий ВГН.
- Класс IV-G (C), который является классом IV-G с хроническими неактивными поражениями со склерозом. Это также называют диффузным глобальным склерозирующим волчаночным нефритом.
При активном заболевании могут присутствовать пролиферативные и некротизирующие изменения, образование полулуний, которые определяются в более чем 50% клубочков при СМ [48, 49]. Выраженная депозиция разных классов иммуноглобулинов (особенно IgG) и комплемента (особенно С3) (рис. 6) приводит к утолщению ГБМ при СМ (см. рис. 1), аналогичному таковому при мембранопролиферативном ГН. Эти поражения могут характеризоваться повышенной проницаемостью ГБМ, появлением провоспалительных клеток (моноциты, супрессорные/цитотоксические Т-клетки) в просвете капсулы Боумена, в ответ на это возможно формирование полулуний [7, 19].
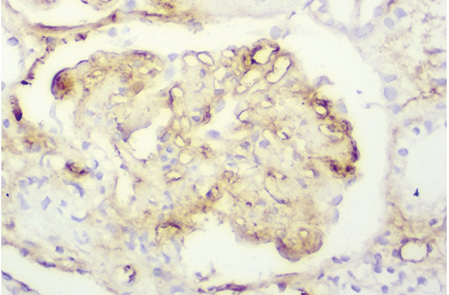
Следует отметить, что практически во всех наблюдениях при этом классе ВГН выявляют наличие тубулоинтерстициальных и/или сосудистых изменений в виде преимущественно умеренного и выраженного тубулоинтерстициального компонента.
Волчаночная мембранозная нефропатия (класс V). У пациентов с волчаночным нефритом V класса обычно клинически выявляют признаки нефротического синдрома, как при идиопатической мембранозной нефропатии [11, 21, 34]. Гематурия и гипертония также часто отмечаются, а концентрация креатинина обычно нормальная или слегка повышенная. Микроскопически этот класс характеризуется неравномерным диффузным утолщением ГБМ, наличием субэпителиальных (глобальных и/или сегментарных) депозитов в виде «шипиков» (рис. 7), в части наблюдений отмечается слабая сегментарная пролиферация МК [30].
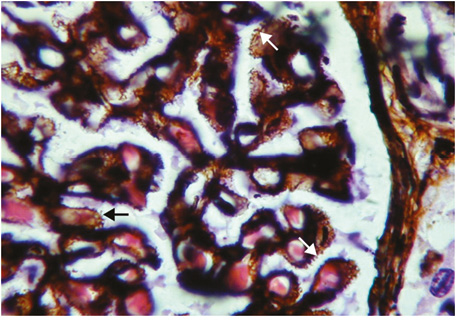
При ИФМ/ИГХИ характерны субэпителиальные (эпимембранозные) интенсивные гранулярные и линейные депозиты IgG в различных сочетаниях с С1q и С3, а также IgM, IgA, возможна неинтенсивная гранулярная депозиция в мезангиуме IgG, С3 и С1q. При ЭМ характерно диффузное неравномерное утолщение ГБМ с крупными электронно-плотными субэпителиальными депозитами, могут встречаться также мелкие мезангиальные депозиты (рис. 8).
Что интересно, по данным литературы [2–4, 6], мембранозная нефропатия может не иметь других клинических или серологических проявлений СКВ (например, уровни комплемента могут быть нормальными, а антитела против ДНК могут не выявляться). Тем не менее имеется несколько дифференциальных признаков, выявляемых при ЭМ, ИФМ/ИГХИ (особенно депозиция С1q фракции комплемента), которые при определении достоверно указывают на волчаночный генез поражения почек, а не на идиопатическую мембранозную нефропатию.
Расширенный склерозирующий волчаночный нефрит — end stage (класс VI). У пациентов с прогрессирующим склерозирующим ГН обычно выявляют медленно прогрессирующую почечную дисфункцию в сочетании с протеинурией и относительно небольшими изменениями осадка мочи. Морфологически VI класс характеризуется глобальным склерозом >90% клубочков вследствие предшествующего воспалительного повреждения, а также «продвинутой» стадией хронического III–IV или V класса волчаночного нефрита. Активный ГН обычно не наблюдается. В ретроспективном исследовании установлено, что 4% из 169 биопсий почек у пациентов с волчаночным нефритом были классифицированы по типу VI [20]. Идентификация этого поражения с помощью биопсии почек чрезвычайно важна, поскольку иммунодепрессанты вряд ли будут полезны при данном гистологическом классе.
Сочетание СКВ и ANCA-ассоциированного ГН. Антинейтрофильные цитоплазматические антитела (ANCA) определяются с помощью косвенной иммунофлюоресценции у примерно 20% пациентов с СКВ [13]. Кроме того, у некоторых пациентов с волчаночным нефритом имеются гистологические симптомы сопутствующего ANCA-ассоциированного ГН, включая заметные признаки некроза и полулуний с минимальной или отсутствующей эндокапиллярной пролиферацией или субэндотелиальными отложениями [28, 41, 57].
Мы столь подробно остановились на типах почечной гистологии, поскольку именно они определяют оптимальное лечение ВГН. Иммуносупрессивная терапия показана пациентам с активным диффузным или очаговым пролиферативным люпус-нефритом (класс III или IV) [10, 43, 44]. Иммуносупрессивная терапия обычно не показана для минимального мезангиального и мезангиального пролиферативного люпус-нефрита (класс I–II).
ПРИНЦИПЫ ИММУНОСУПРЕССИВНОЙ ТЕРАПИИ ПРИ ВОЛЧАНОЧНОМ НЕФРИТЕ
Иммуносупрессивная терапия пациентов с пролиферативным волчаночным нефритом состоит из индукционной и поддерживающей фазы: начальная (индукционная) терапия включает введение сильных противовоспалительных препаратов и иммунодепрессантов для достижения почечного ответа [1]. Продолжительность начального периода терапии варьируется; он может быть коротким — три месяца или длиться до одного года, но в среднем составляет примерно шесть месяцев. Как только достигается стабилизация функции почек, проводится менее агрессивная (поддерживающая) иммуносупрессивная терапия в течение длительного времени для предотвращения рецидива.
В настоящее время нет единого мнения по определению понятия «полного почечного ответа» у пациентов с пролиферативным люпус-нефритом, которые получают иммуносупрессивную терапию. Под полным ответом подразумевают прекращение воспаления, характеризующееся снижением экскреции белка, снижением или стабилизацией уровня креатинина в сыворотке крови и уменьшением гематурии, пиурии и количества клеток.
Таким образом, большинство определений полного ответа включают следующие элементы:
1. Существенное сокращение экскреции белка в моче. В клинических исследованиях были использованы различные определения протеинурии. Например, совместная исследовательская группа по волчаночным нефритам определила полный ответ как экскрецию белка ≤0,33 г/сут [56].
2. Улучшение или стабилизация уровня креатинина в сыворотке крови. Почечная функция у пациентов с полным клиническим ответом также была определена по-разному в различных исследованиях, включая нормальный уровень креатинина в сыворотке крови [31], уровень креатинина в сыворотке крови <1,2 мг/дл (106 мкмоль/л) [32], ≤1,4 мг/дл (124 мкмоль/л) [56] или в пределах 15–25% от исходного значения [6].
3. Улучшение характеристик мочевого осадка. Многие, но не все определения полного ответа в клинических исследованиях подразумевают улучшение характеристик мочевого осадка. В нескольких исследованиях отмечено уменьшение количества эритроцитов до ≤10 в поле зрения или ≤5 эритроцитов в поле зрения [31, 32].
Однако не все успешно леченные пациенты с гистологической ремиссией имеют полный клинический ответ. Причины этого феномена следующие:
- протеинурическое хроническое заболевание почек может быть результатом необратимых изменений (рубцов), несмотря на разрешение воспаления;
- гематурия может сохраняться по разным причинам (например воспаление мочевого пузыря, вызванное циклофосфамидом);
- сывороточный креатинин и экскреция белка не могут вернуться в норму из-за необратимого поражения во время активной фазы заболевания. В связи с этим прогрессия гломерулосклероза с высокой протеинурией может возникать со временем в отсутствие воспаления [39];
- несмотря на то что уменьшение протеинурии является важным маркером успешного ответа на иммуносупрессивную терапию, максимальное снижение экскреции белка обычно наблюдается гораздо позже (на несколько месяцев), чем разрешение изменений осадка мочи.
Считается, что достижение неактивного мочевого осадка (наличие измененных эритроцитов) является существенным компонентом полного почечного ответа. Тем не менее наличие неизмененных эритроцитов в небольшом количестве может сохраняться у пациентов с неактивным заболеванием, например вследствие воспаления мочевого пузыря, вызванного циклофосфамидом, и таким пациентам может потребоваться цистоскопия, чтобы исключить рак мочевого пузыря, спровоцированный циклофосфамидом. Оценка осадка мочи путем микроскопического обследования должна проводиться нефрологом или другим клиницистом, квалифицированным в этой процедуре.
Таким образом, согласно широко распространенной системе классификации ВГН гломерулярные расстройства распределяются на шесть различных моделей, или классов, основанных на результатах биопсии почек, в зависимости от которых происходит выбор иммуносупрессивной терапии.
Клинический случай
Приводим собственное наблюдение течения волчаночного нефрита с тяжелой гипопротеинемией, трудно поддающейся терапии, выраженной протеинурией и нефротическим синдромом.
Больная Л., 39 лет, обратилась за консультацией в поликлиническое отделение Коммунального учреждения охраны здоровья «Областная клиническая больница — Центр экстренной медицинской помощи и медицины катастроф» Харькова в июле 2018 г. с жалобами на постоянную диффузную отечность конечностей, туловища, утреннюю отечность лица, общую слабость, одышку при движении, разговоре, периодический субфебрилитет, увеличение живота в объеме, боль в суставах кистей, лучезапястных, голеностопных, коленных суставах, усиливающуюся при движениях, уменьшающуюся в покое, периодическое покраснение кожи лица, зоны декольте, утомляемость, сонливость.
Из анамнеза известно, что считает себя больной с 2007 г., когда впервые без видимой причины отмечала выпадение волос, дерматит в области лица, зоны декольте, позже — высыпания в области верхних конечностей в виде эритематозно-папулезной сыпи, отечность голеней, стоп. В то время была госпитализирована в ревматологическое отделение Областной клинической больницы, где был установлен диагноз СКВ, подострое течение, дерматит, тотальная алопеция, эндомиокардит, недостаточность митрального клапана, люпус-нефрит в сочетании с пиелонефритом. Симптоматическая артериальная гипертензия. Анемия. На фоне лечения метилпреднизолоном 40 мг/сут, пефлоксацином, дипиридамолом, лизиноприлом отмечалась положительная динамика, после купирования явлений пиелонефрита проводилась терапия циклофосфамидом 200 мг внутримышечно через день, в последующем получала азатиоприн в дозе 150 мг/сут. В течение последующих лет доза метилпреднизолона была снижена до 4 мг/сут, постоянно принимала азатиоприн в дозе 100–150 мг/сут. Чувствовала себя удовлетворительно. В связи с беременностью в 2010 г. прием азатиоприна самостоятельно прекратила. В 2011 г. — физиологические роды без ухудшения состояния. Ухудшение состояния отметила в 2013 г., когда во время повторной беременности появилась протеинурия и увеличилась ее выраженность, стабильно повышалось артериальное давление. Проведено прерывание беременности на сроке 17–18 нед. В дальнейшем возобновила прием азатиоприна в дозе 150 мг/сут, метилпреднизолона 16 мг/сут. Ежемесячно контролировала уровень протеинурии, который колебался в диапазоне 0,30–3,0 г/л. Ухудшение состояния стала отмечать в течение последнего года после отдыха на морском побережье и инсоляции: появился и прогрессивно усиливался отечный синдром, особенно после употребления белковой пищи. При обследовании диагностирована гипопротеинемия, прогрессирующая в динамике (общий белок 30–29 г/л), суточная протеинурия составила 11 г/л.
Ретроспективно выяснено, что в 2015 г. у пациентки были тромбозы поверхностных вен левой верхней конечности, правой нижней конечности, в связи с чем принимала ривароксабан. В остальном анамнез без особенностей.
С 13.06.2018 г. по 29.06.2018 г. находилась на стационарном лечении в ревматологическом отделении, на момент госпитализации состояние больной средней тяжести, сознание ясное, удовлетворительного питания. Индекс массы тела 33,9 кг/м2. Ограниченно активна из-за общей слабости. «Лунообразность» и одутловатость лица. Кожа бледная. Гипотермия кистей, стоп. Единичные мелкие гематомы в области голеней. Диффузная отечность туловища, конечностей. Стрии в области бедер. Периферические лимфоузлы не пальпируются. Визуально суставы не изменены, пальпация суставов кистей, лучезапястных, коленных, голеностопных суставов болезненная, движения сохранены в полном объеме. В легких над всей поверхностью перкуторно ясный легочный звук, аускультативно — везикулярное дыхание, в подлопаточных областях ослабленное дыхание, частота дыхания 16 в минуту. Сердце: границы относительной сердечной тупости: правая: IV м/р по правому краю грудины; верхняя: IІІ м/р по левому краю грудины; левая: V м/р по левой среднеключичной линии. Аускультация: тоны приглушены, деятельность ритмичная, систолический шум на верхушке, в точке Боткина — Эрба, артериальное давление 120/70 мм рт. ст. Пульс 96 уд./мин, удовлетворительного качества, ритмичный. Язык влажный, чистый. Живот увеличен за счет асцита, при пальпации мягкий, безболезненный. Печень пальпируется у края реберной дуги, селезенка не пальпируется. Симптом Пастернацкого отрицательный с обеих сторон. Физиологические оправления без особенностей. Диурез соответствует объему выпитой жидкости — около 1,5 л.
Клинический анализ крови представлен в табл. 1. Клинический анализ мочи представлен в табл. 2. Биохимический анализ крови — в табл. 3.
| Даты | Эритроциты, •10/л | Hb, г/л | Лейкоциты, •10/л | Тромбоциты, •10/л | Палочкоядерные, % | Сегментоядерные, % | Эозинофилы, % | Базофилы, % | Лимфоциты, % | Моноциты, % | СОЭ, мм/ч |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 23.05.2018 | 3,82 | 119 | 6,2 | 358 | 1 | 36 | 1 | 1 | 50 | 11 | 28 |
| 25.06.2018 | 3,24 | 102 | 8,1 | 256 | 1 | 64 | 1 | 0 | 23 | 11 | 12 |
| 18.09.2018 | 4,11 | 119 | 7,4 | 237 | 1 | 73 | 1 | 0 | 24 | 1 | 13 |
| Даты | Удельный вес | Сахар | Белок, г/л | Уробилиноген, мкмоль/л |
Эритроциты неизмененные в поле зрения |
Эритроциты выщелоченные в поле зрения |
Лейкоциты в поле зрения | Цилиндры в поле зрения | Эпителий плоский | Эпителий переходный | Эпителий почечный |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 01.06.2018 | 1011 | – | 3,2 | 13,4 | 40–50 | 7–10 | 3–5 | 1–2 | Умер | 3–5 | – |
| 29.06.2018 | 1010 | – | 9,2 | – | 3–4 | – | 3–4 | 3–4 | – | 1–3 | – |
| 30.08.2018 | 1015 | – | 2,2 | – | 1–3 | – | 1–3 | 1–3 | – | 1–3 | – |
| 12.10.2018 | 1018 | – | 1,9 | – | 3–4 | – | 1–2 | 1–3 | – | 1–3 | – |
| Даты | Общий белок, г/л | Мочевина, моль/л | Креатинин, мкмоль/л | Холестерин общий, ммоль/л | Холестерин ЛПНП, ммоль/л | Холестерин ЛПВП, моль/л | Холестерин ЛПОНП, моль/л | Триглицериды, ммоль/л | АлАТ, ед/л | АсАТ, ед/л | Калий, ммоль/л | Натрий, ммоль/л |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 23.05.2018 | 33,7 | 5,5 | 48,2 | 6,39 | 4,1 | 1,74 | 0,54 | 1,19 | 27,9 | 44 | 3,64 | 135 |
| 25.06.2018 | 32,1 | 7,3 | 59,4 | 6,48 | 4,3 | 1,9 | 0,57 | 1,16 | 28,4 | 31,6 | 4,31 | 147 |
| 14.08.2018 | 37 | 5,8 | 80 | – | – | – | – | – | 35 | 40 | 4,5 | 140 |
| 30.08.2018 | 42 | 4,7 | 83 | – | – | – | – | – | – | – | – | – |
| 12.10.2018 | 46 | 5,3 | 88 | – | – | – | – | – | – | – | – | – |
ЛПВП — липопротеины высокой плотности; ЛПНП — липопротеины низкой плотности; ЛПОНП — липопротеины очень низкой плотности.
Также были проведены дополнительные лабораторные исследования с дифференциально-диагностической целью: ферритин — 109 нг/мл, трансферрин 0,8 г/л, тиреотропный гормон — 9,0 мМЕ/л, Т4 — 55,04 нмоль/л, Т3 — 1,16 нмоль/л.
01.06.2018. Т3 свободный — 2,3 пг/мл, Т4 свободный — 9,16 пмоль/л, антитела к тиреопероксидазе — 1,0 МЕд/мл, тиреотропный гормон — 5,2 мкЕд/мл. Антинуклеарные антитела — 1,8 ед, ANA-профиль — иммунологических феноменов не выявлено, антитела к нативной ДНК — слабоположительные, антитела к денатурированной ДНК — отрицательные, антитела к фосфолипидам IgG — 2,34 ед/мл, антитела к фосфолипидам IgM — 0,85 ед/мл, антитела класса IgM к β2-гликопротеину I — 5 ед/мл, антитела класса IgG к β2-гликопротеину I — 0,67 ед/мл, антифосфолипиды — IgG — 0,804 ед/мл (отрицательные), ANCA не выявлены, волчаночный антикоагулянт — отрицательный, С-реактивный белок — 1,9 мг/л, РФ — <2, серомукоиды — 9,0 ед, сиаловая кислота — 2,5 ммоль/л, мочевая кислота — 321 мкмоль/л. Антитела класса IgM к β2-гликопротеину I — 2,21 ед/мл, антитела класса IgG к β2-гликопротеину I — 1,8 ед/мл, антитела M к кардиолипину — 0,66 ед/мл, антитела к кардиолипину IgG — 0,42 ед/мл.
Суточное исследование мочи на белок: суточное количество белка — 4,59 г/л.
Проба Реберга: суточный объем мочи — 700 мл, креатинин в крови — 0,0531 ммоль/л, креатинин в моче — 1,9 ммоль/л, СКФ — 15 мл/мин, минутный диурез — 0,42.
Моча по Зимницкому: удельный вес в диапазоне от 1,005 до 1,017, дневной диурез — 0,77 л.
Инструментальные методы обследования:
23.05.2018. Мультиспиральная компьютерная томография органов грудной полости, брюшной полости — признаки умеренного левостороннего гидроторакса. Асцит.
21.06.2018. Рентгенологическое исследование органов грудной полости № 745 — легкие без очаговых и инфильтративных изменений, с обеих сторон тени дисковидных ателектазов. Корни структурные. Купола диафрагмы приподняты, ограничены в подвижности, в синусах с обеих сторон (больше слева) свободная жидкость. Сердце, аорта без особенностей. Двусторонний гидроторакс.
23.05.2018. Ультразвуковое исследование: признаки диффузной патологии паренхимы печени. Признаки хронического холецистита, хронического панкреатита, признаки диффузной патологии паренхимы почек с явлениями хронического двустороннего пиелонефрита; киста правой почки. Значительный асцит. Двусторонний гидроторакс. Лейомиома матки минимальных размеров. Фолликулярная киста правого яичника. Признаки диффузной патологии щитовидной железы.
22.06.2018. Ультразвуковое исследование: уплотнение створок аортального клапана и митрального клапана с митральной регургитацией I степени, трикуспидальная регургитация 0–I степени, минимальный гидроперикард. Признаки диффузной патологии паренхимы печени; гемангиома печени, признаки хронического холецистита; хронического панкреатита, признаки диффузной патологии паренхимы почек с явлениями хронического двустороннего пиелонефрита; киста правой почки. Асцит. Двусторонний гидроторакс.
20.09.2018. В динамике гидроперикард и гидроторакс не определяются. Минимальный асцит.
03.05.2018. Ультразвуковое исследование вен нижних конечностей: данных о тромбозе вен нижних и верхних конечностей нет. Реканализация тромбированных сегментов (тромбоз 2015 г.). Лимфедема на уровне бедра и голени ассоциирована с гипоальбуминемией.
14.06.18. Электрокардиография: синусовый ритм с частотой сердечных сокращений 76 уд./мин. Снижен вольтаж электрокардиограммы.
Учитывая клинико-лабораторный симптомокомплекс, у пациентки установлен следующий диагноз:
Основной диагноз: системная красная волчанка, хроническое течение, а/ф, активной IІ степени, с поражением кожи — в виде «бабочки» (рецидивирующий дерматит области декольте), придатков кожи (алопеция), сосудов (периферический нейрососудистый синдром верхних и нижних конечностей), суставов (полиартралгия, неэрозивный артрит, ФНС 0–І), почек (хроническая болезнь почек IV–V стадии, люпус-нефрит, нефротический синдром, по данным биопсии почек от 11.07.2017 — VI класс нефрита), полисерозит (гидроперикардит, асцит, двусторонний гидроторакс), ретикулоэндотелиальной системы (анемия легкой степени), аутоиммунный тиреоидит со снижением функции щитовидной железы.
Сопутствующие заболевания: киста правой почки. Дислипидемия. Анасарка. Стероидная васкулопатия. Гемангиома печени. Лейомиома матки минимальных размеров.
Во время нахождения в стационаре пациентка получила пульс-терапию метилпреднизолоном в дозах 500–500–500 мг внутривенно капельно, циклофосфамид 600 мг внутривенно капельно 1 раз в 2 нед № 2, инфузии раствора 20% альбумина № 6, нефротект 500 мл внутривенно капельно. Клинический эффект отсутствовал: продолжалось прогрессирование нефротического синдрома, нарастала протеинурия и гипопротеинемия, сохранялась почечная недостаточность; почечного ответа, хотя бы частичного, на данной терапии достичь не удалось.
Пациентка была выписана с рекомендациями продолжить прием метилпреднизолона 40 мг/сут, продолжить внутривенные инфузии циклофосфамида 600 мг внутривенно капельно 1 раз в 2 нед, спиронолактон 50 мг утром, пантопразол 20 мг утром натощак 2 нед, розувастатин 20 мг/сут под контролем липидограммы, кетостерил 5 таблеток 3 раза в сутки во время еды; по рекомендации эндокринолога — левотироксин 25 мкг за полчаса до завтрака.
Несмотря на продолжающуюся индукционную иммуносупрессивную терапию циклофосфамидом у больной сохранялись признаки почечной недостаточности и нефротического синдрома. В связи с чем ей настоятельно было рекомендовано проведение биопсии почки для морфологической верификации стадии поражения почек и подбора оптимальной иммуносупрессивной терапии.
В июле 2018 г. больной проведена биопсия и патоморфологическое исследование почек.
Патоморфологическое исследование: в биоптате до 16 клубочков, один полностью склерозирован, в клубочках неравномерно выраженная пролиферация МК, ЭК, гипертрофия отдельных подоцитов, очаги фибриноидного некроза, кариорексис, в просвете части капилляров — моноциты; резкое, неравномерно выраженное утолщение базальных мембран капилляров по типу «проволочных петель» (за счет фибриноидного некроза, в части клубочков и склероза) (рис. 9), очаговое расщепление базальных мембран капилляров, очаговое увеличение ММ; точечные и линейные сращения (синехии) периферических капиллярных петель с капсулой Боумена; неравномерно выраженное утолщение и расщепление базальной мембраны капсулы Боумена (рис. 10). В канальцах — выраженные дегенеративные изменения, некроз групп клеток, очаговая субатрофия, небольшие очаги атрофии эпителия (до 10% объема биоптата) с утолщением тубулярной базальной мембраны, в части канальцев гипертрофия (компенсаторная) клеток эпителия (рис. 11). В просвете канальцев — белковые массы, слущенный эпителий, гиалиновые, одиночные геминовые цилиндры, часть канальцев с резко уменьшенным простором за счет выраженных дегенеративных изменений эпителия, часть канальцев расширены; в отдельных канальцах в просвете — петрификаты (см. рис. 8). В строме — отек, очаговое разрастание молодой соединительной ткани, явления дисмукоидоза, очаговые лимфогистиоплазмоцитарные с признаками кариорексиса клеточные инфильтраты. В сосудах мелкого калибра — выраженное утолщение стенки за счет дисмукоидоза, фибриноидного некроза, признаки спазма; в сосудах среднего калибра — спазм, дисмукоидоз, неравномерное утолщение стенки (рис. 12), в отдельных сосудах уменьшение просвета до ½–⅔ за счет выраженного дисмукоидоза и атероматоза (рис. 13).
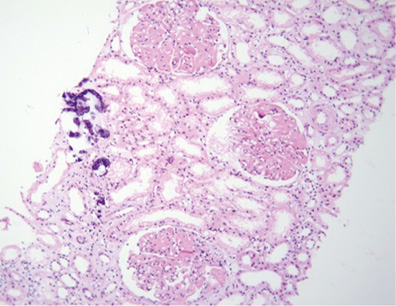
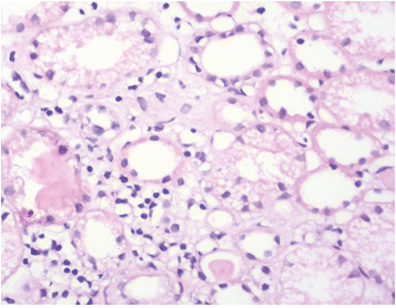
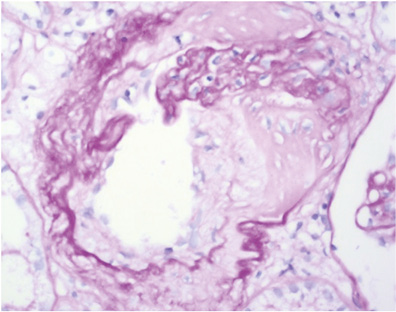
Окраска по конго-рот — отрицательная.
ИГХИ
IgA: в клубочках очаговые гранулярные субэндотелиальные депозиты от + до ++, вдоль эндотелия капилляров депозиты до +, в отдельных подоцитах депозитов до +; в строме между канальцами, в перитубулярных капиллярах, в клеточных инфильтратах депозитов до ++, в эпителии канальцев в виде зернистости депозитов от ++ до +++.
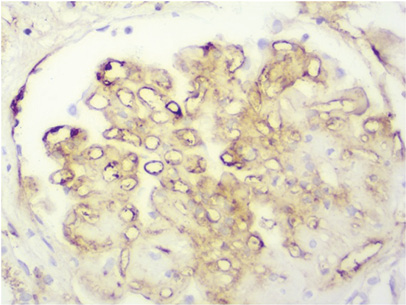
IgG: в клубочках очаговые гранулярные субэндотелиальные, мезангиальные депозиты от ++ до +++, в отдельных подоцитах депозитов до +, вдоль эндотелия капилляров депозитов до +; в строме между канальцами, в перитубулярных капиллярах, в клеточных инфильтратах депозитов до ++, в эпителии канальцев в виде зернистости депозитов от ++ до +++ (рис. 14).
IgM: в клубочках очаговые гранулярные мезангиальные, субэндотелиальные, вдоль эндотелия части капилляров депозитов до ++, в отдельных подоцитах депозитов до ++, в перитубулярных капиллярах, в клеточных инфильтратах депозитов до ++, очагово в эпителии канальцев в виде зернистости депозитов от ++ до +++.
С3: в клубочках очаговые гранулярные субэндотелиальные депозиты до +, в отдельных канальцах депозиты в виде зернистости до +.
С1q: депозиты отсутствуют.
CD20: в отдельных клубочках В-лимфоциты, в клеточных инфильтратах, между канальцами скопление В-лимфоцитов (рис. 15).
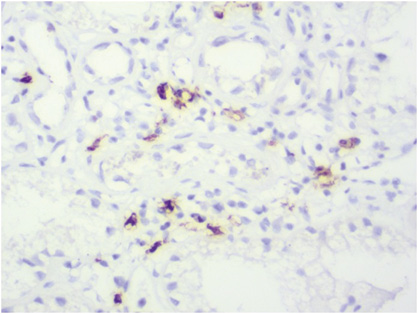
Патоморфологический диагноз: данные патоморфологического, гистохимического, иммуногистохимического исследований свидетельствуют о ВГН (IV A/С, (диффузный) морфологический класс ISN/RPS, 2002 г., 2017 г.) с выраженным тубулярным, умеренным интерстициальным компонентом, наличием В-лимфоцитов в клеточных инфильтратах, между канальцами, признаками волчаночной васкулопатии (lupus vasculopathy).
Несмотря на 3-месячный курс индукционной терапии циклофосфамидом, мы не смогли добиться какого-либо почечного ответа, уменьшения протеинурии и гипопротеинемии. Ограниченные данные из небольших серий случаев позволяют предположить, что в этой ситуации микофенолата мофетил (ММФ) может быть эффективен при лечении пациентов с устойчивостью к циклофосфамиду [22, 27, 33].
Устойчивость к первичной иммуносупрессивной терапии чаще всего определяется как неспособность достичь полного или частичного ответа и связана с худшим долгосрочным прогнозом по сравнению с пациентами, которые достигают полного ответа. Оценка развития полного ответа обычно требует как минимум 3–6 мес, а у многих пациентов — периода до 12 мес или более после начала индукционной терапии.
В Руководстве по клинической практике Kidney Disease Improving Global Outcomes (KDIGO) для ГН, Объединенной европейской антиревматической лиги, Европейской ассоциации почек — Европейской ассоциации диализа и трансплантации (European League Against Rheumatism/European Renal Association — European Dialysis and Transplant Association — EULAR/ERA-EDTA) [13] в целом рекомендовано лечить пациентов с резистентностью к циклофосфамиду ММФ и ММФ-резистентных — циклофосфамидом. Схемы индукции и поддержания, используемые при резистентных люпус-нефритах, такие же, как и для первичной терапии. Пациенты, которые не отвечают на лечение как циклофосфамидом, так и ММФ, могут быть переведены на ритуксимаб.
Для пациентов с пролиферативным люпус-нефритом с устойчивостью к ММФ плюс глюкокортикоиды (ГК) в качестве терапии первой линии рекомендуется внутривенный циклофосфамид плюс ГК (1B). Режим такой же, как и для индукционной терапии.
Для пациентов с пролиферативным люпус-нефритом с устойчивостью к циклофосфамиду плюс ГК в качестве терапии первой линии рекомендуется лечение ММФ плюс ГК (класс 1B). Режим такой же, как и для индукционной терапии.
Для пациентов, у которых не эффективен ни циклофосфамид, ни ММФ, рекомендуется ритуксимаб, хотя рандомизированные исследования не проводились и данные долгосрочного наблюдения недоступны (класс 2С) [13].
В связи с наличием у описываемой пациентки VI класса нефрита, отсутствием клинического эффекта и почечного ответа на фоне трехмесячного приема циклофосфамида было принято решение о замене базисного препарата на ММФ в стартовой дозе 1 г/сут с последующим повышением дозы до 2–3 г. В динамике на фоне приема ММФ отмечено регресс симптомов нефротического синдрома, уменьшение явлений полисерозита (исчезновение гидроперикарда, гидроторакса, уменьшение асцита), также уменьшились периферические отеки, несколько повысился уровень общего белка крови: при обращении пациентки он составлял 33 г/л, на фоне терапии увеличился до 41,0 г/л; суточная протеинурия снизилась с 9,2 до 1,9 г/л.
Анализируя данный клинический случай, необходимо акцентировать внимание на следующих аспектах.
Во-первых, мы в своей клинической практике столкнулись с резистентным волчаночным нефритом с развитием хронической почечной недостаточности.
Во-вторых, мы смогли верифицировать и сопоставить клиническую и патоморфологическую стадию волчаночного нефрита и подобрать адекватную морфологическому классу нефрита патогенетическую терапию. Проведена комбинированная иммуносупрессивная терапия (пульс-терапия ГК, циклофосфамид и ММФ). В литературе отмечено, что некоторые пациенты остаются устойчивыми к первоначальному иммуносупрессивному лечению, несмотря на полное соблюдение предписанного режима. Невзирая на длительную эффективность азатиоприна как базисного препарата для лечения люпус-нефрита, у пациентки развился рецидив (renal flare) после инсоляции.
В-третьих, у пациентки отмечена устойчивость к первичной иммуносупрессивной терапии, которая чаще всего определяется как неспособность достичь полного или частичного почечного ответа и связана с худшим долгосрочным прогнозом. На основании полученных гистопатологических данных биопсии почки целенаправленно была проведена замена циклофосфамида на ММФ. Согласно рекомендациям EULAR/ERA-EDTA, если для индукции использовался циклофосфамид и пациент принимал азатиоприн для поддерживающей терапии, многие эксперты выбирают ММФ, а не повторяют циклы циклофосфамида, чтобы избежать кумулятивной токсичности данного препарата. Данный клинический случай подчеркивает необходимость и целесообразность проведения биопсии почек и установление морфологического класса нефрита как можно в более ранние сроки заболевания, что позволит более целенаправленно подбирать терапию и добиваться успеха в лечении на более ранних стадиях. Так, более раннее проведение нефробиопсии у описываемой пациентки позволило бы избежать длительного периода подбора терапии, которая при ретроспективной оценке оказалась неэффективной, неуклонного прогрессирования заболевания, почечной недостаточности и нефротического синдрома; правильные данные патогистологического исследования обусловили бы раннее применение целевой терапии на более раннем этапе заболевания, что позволило бы достичь почечного ответа и ремиссии заболевания гораздо раньше.
Мы, следуя этой тактике, добились стабилизации состояния с тенденцией к улучшению почечной функции в виде уменьшения протеинурии и гипопротеинемии, уменьшения отечного синдрома, уменьшения проявлений нефротического синдрома как основного клинического симптома поражения почек у пациентки.
Обсуждение подобных редких клинических случаев необходимо для поиска путей преодоления трудностей курации таких больных, часто резистентных к общепринятой терапии волчаночного нефрита.
Список использованной литературы
- Головач И.Ю. (2018) Люпус-нефрит: современная парадигма лечения. Почки, 7(2): 122–131.
- Дядик О.О. (2003) Характеристика морфогенезу вовчакового гломерулонефриту. Галиц. лікар. вісник, 10(4): 40–41.
- Дядык А.И., Колесник Н.А., Василенко И.В. др. (2003) Поражение органов и систем при СКВ. Монография. Донецк: Регион, 267 с.
- Дядык Е.А. (2004) Характер гломерулярных поражений при различных морфологических формах волчаночного гломерулонефрита. Вестн. неотлож. восстанов. медицины, 5(1): 116–119.
- Дядык Е.А. (2004) Интерпретация почечных биоптатов у больных системной красной волчанкой с клиническими проявлениями волчаночного гломерулонефрита. Укр. журн. нефрології та діалізу, 2: 10–13.
- Дядык Е.А. (2004) Особенности тубулоинтерстициального аппарата при различных морфологических классах волчаночного гломерулонефрита. Вестн. неотлож. восстанов. медицины, 5(2): 318–321.
- Aitman T.J., Dong R., Vyse T.J. et al. (2006) Copy number polymorphism in Fcgr3 predisposes to glomerulonephritis in rats and humans. Nature, 439: 851.
- Akashi Y., Oshima S., Takeuchi A. et al. (1995) Identification and analysis of immune cells infiltrating into the glomerulus and interstitium in lupus nephritis. Nihon Rinsho Meneki Gakkai Kaishi, 18: 545.
- Alarcón G.S., McGwin G. Jr., Petri M. et al. (2002) Baseline characteristics of a multiethnic lupus cohort: PROFILE. Lupus, 11: 95.
- Almaani S., Meara A., Rovin B.H. (2017) Update on Lupus Nephritis. Clin. J. Am. Soc. Nephrol., 12: 825.
- Appel G.B., Silva F.G., Pirani C.L. et al. (1978) Renal involvement in systemic lupud erythematosus (SLE): a study of 56 patients emphasizing histologic classification. Medicine (Baltimore), 57: 371.
- Bastian H.M., Roseman J.M., McGwin G. Jr. et al. (2002) Systemic lupus erythematosus in three ethnic groups. XII. Risk factors for lupus nephritis after diagnosis. Lupus, 11: 152.
- Bertsias G.K., Tektonidou M., Amoura Z. et al. (2012) Joint European League Against Rheumatism and European Renal Association-European Dialysis and Transplant Association (EULAR/ERA-EDTA) recommendations for the management of adult and paediatric lupus nephritis. Ann. Rheum. Dis., 71: 1771.
- Cervera R., Khamashta M.A., Font J. et al. (1993) Systemic lupus erythematosus: clinical and immunologic patterns of disease expression in a cohort of 1,000 patients. The European Working Party on Systemic Lupus Erythematosus. Medicine (Baltimore), 72: 113.
- Cervera R., Khamashta M.A., Font J. et al. (2003) Morbidity and mortality in systemic lupus erythematosus during a 10-year period: a comparison of early and late manifestations in a cohort of 1,000 patients. Medicine (Baltimore), 82: 299.
- Chung J., Bernstein J., Glassock R.J. (1995) Renal Disease: Classification and Atlas of Glomerular Disease, 2nd ed. Tokyo, New York, Igaku-Shoin: 151.
- Contreras G., Lenz O., Pardo V. et al. (2006) Outcomes in African Americans and Hispanics with lupus nephritis. Kidney Int., 69: 1846.
- Coremans I.E., Spronk P.E., Bootsma H. et al. (1995) Changes in antibodies to C1q predict renal relapses in systemic lupus erythematosus. Am. J. Kidney Dis., 26: 595.
- Davis J.C., Tassiulas I.O., Boumpas D.T. (1996) Lupus nephritis. Curr. Opin. Rheumatol., 8: 415.
- Descombes E., Droz D., Drouet L. et al. (1997) Renal vascular lesions in lupus nephritis. Medicine (Baltimore), 76: 355.
- Donadio J.V. Jr., Burgess J.H., Holley K.E. (1977) Membranous lupus nephropathy: a clinicopathologic study. Medicine (Baltimore), 56: 527.
- Dooley M.A., Cosio F.G., Nachman P.H. et al. (1999) Mycophenolate mofetil therapy in lupus nephritis: clinical observations. J. Am. Soc. Nephrol., 10: 833.
- European Working Party on Systemic Lupus Erythematosus (1993) Medicine (Baltimore), 72: 113.
- Feldman C.H., Hiraki L.T., Liu J. et al. (2013) Epidemiology and sociodemographics of systemic lupus erythematosus and lupus nephritis among US adults with Medicaid coverage, 2000–2004. Arthritis Rheum., 65: 753.
- Furness P.N., Taub N. (2006) Interobserver reproducibility and application of the ISN/RPS classification of lupus nephritis-a UK-wide study. Am. J. Surg. Pathol., 30: 1030.
- Gelmetti A.P., Freitas A.C., Woronik V. et al. (2006) Polymorphism of the FcgammaRIIalpha IgG receptor in patients with lupus nephritis and glomerulopathy. J. Rheumatol., 33: 523.
- Glicklich D., Acharya A. (1998) Mycophenolate mofetil therapy for lupus nephritis refractory to intravenous cyclophosphamide. Am. J. Kidney Dis., 32: 318.
- Hervier B., Hamidou M., Haroche J. et al. (2012) Systemic lupus erythematosus associated with ANCA-associated vasculitis: an overlapping syndrome? Rheumatol. Int., 32: 3285.
- Huong D.L., Papo T., Beaufils H. et al. (1999) Renal involvement in systemic lupus erythematosus. A study of 180 patients from a single center. Medicine (Baltimore), 78: 148.
- Jennette J.C., Iskandar S.S., Dalldorf F.G. (1983) Pathologic differentiation between lupus and nonlupus membranous glomerulopathy. Kidney Int., 24: 377.
- Karassa F.B., Trikalinos T.A., Ioannidis J.P., FcgammaRIIa-SLE Meta-Analysis Investigators (2002) Role of the Fc gamma receptor IIa polymorphism in susceptibility to systemic lupus erythematosus and lupus nephritis: a meta-analysis. Arthritis Rheum., 46: 1563.
- Karassa F.B., Trikalinos T.A., Ioannidis J.P., Fcgamma RIIIA-SLE Meta-Analysis Investigators (2003) The Fc gamma RIIIA-F158 allele is a risk factor for the development of lupus nephritis: a meta-analysis. Kidney Int., 63: 1475.
- Karim M.Y., Pisoni C.N., Ferro L. et al. (2005) Reduction of proteinuria with mycophenolate mofetil in predominantly membranous lupus nephropathy. Rheumatology (Oxford), 44: 1317.
- Kashgarian M. (1994) Lupus nephritis: lessons from the path lab. Kidney Int., 45: 928.
- Kasitanon N., Magder L.S., Petri M. (2006) Predictors of survival in systemic lupus erythematosus. Medicine (Baltimore), 85: 147.
- Lee H.S., Mujais S.K., Kasinath B.S. et al. (1984) Course of renal pathology in patients with systemic lupus erythematosus. Am. J. Med., 77: 612.
- Lloyd W., Schur P.H. (1981) Immune complexes, complement, and anti-DNA in exacerbations of systemic lupus erythematosus (SLE). Medicine (Baltimore), 60: 208.
- Lu J., Tam L.S., Lai F.M. et al. (2011) Repeat renal biopsy in lupus nephritis: a change in histological pattern is common. Am. J. Nephrol., 34: 220.
- Mannik M., Merrill C.E., Stamps L.D., Wener M.H. (2003) Multiple autoantibodies form the glomerular immune deposits in patients with systemic lupus erythematosus. J. Rheumatol., 30: 1495.
- Najafi C.C., Korbet S.M., Lewis E.J. et al. (2001) Significance of histologic patterns of glomerular injury upon long-term prognosis in severe lupus glomerulonephritis. Kidney Int., 59: 2156.
- Nasr S.H., D’Agati V.D., Park H.R. et al. (2008) Necrotizing and crescentic lupus nephritis with antineutrophil cytoplasmic antibody seropositivity. Clin. J. Am. Soc. Nephrol., 3: 682.
- Nossent H.C., Henzen-Logmans S.C., Vroom T.M. et al. (1990) Contribution of renal biopsy data in predicting outcome in lupus nephritis. Analysis of 116 patients. Arthritis Rheum., 33: 970.
- Ortega L.M., Schultz D.R., Lenz O. et al. (2010) Review: Lupus nephritis: pathologic features, epidemiology and a guide to therapeutic decisions. Lupus, 19: 557.
- Parikh S.V., Rovin B.H. (2016) Current and emerging therapies for lupus nephritis. J. Am. Soc. Nephrol., 27: 2929.
- Rich SA. (1995) De novo synthesis and secretion of a 36-kD protein by cells that form lupus inclusions in response to alpha-interferon. J. Clin. Invest., 95: 219.
- Rovin B.H., Zhang X. (2009) Biomarkers for lupus nephritis: the quest continues. Clin. J. Am. Soc. Nephrol., 4: 1858.
- Rubinstein T., Pitashny M., Levine B. et al. (2010) Urinary neutrophil gelatinase-associated lipocalin as a novel biomarker for disease activity in lupus nephritis. Rheumatology (Oxford), 49: 960.
- Schwartz M.M., Kawala K.S., Corwin H.L., Lewis E.J. (1987) The prognosis of segmental glomerulonephritis in systemic lupus erythematosus. Kidney Int., 32: 274.
- Schwartz M.M., Korbet S.M., Lewis E.J.; Collaborative Study Group (2008) The prognosis and pathogenesis of severe lupus glomerulonephritis. Nephrol. Dial. Transplant., 23: 1298.
- Schwartz M.M., Lan S.P., Bonsib S.M. et al. (1989) Clinical outcome of three discrete histologic patterns of injury in severe lupus glomerulonephritis. Am. J. Kidney Dis., 13: 273.
- Schwartz N., Rubinstein T., Burkly L.C. et al. (2009) Urinary TWEAK as a biomarker of lupus nephritis: a multicenter cohort study. Arthritis Res. Ther., 11: R143.
- Seligman V.A., Lum R.F., Olson J.L. et al. (2002) Demographic differences in the development of lupus nephritis: a retrospective analysis. Am. J. Med., 112: 726.
- Sen D., Isenberg D.A. (2003) Antineutrophil cytoplasmic autoantibodies in systemic lupus erythematosus. Lupus, 12: 651.
- Wang F., Wang C.L., Tan C.T., Manivasagar M. (1997) Systemic lupus erythematosus in Malaysia: a study of 539 patients and comparison of prevalence and disease expression in different racial and gender groups. Lupus, 6: 248.
- Weening J.J., D’Agati V.D., Schwartz M.M. et al. (2004) The classification of glomerulonephritis in systemic lupus erythematosus revisited. Kidney Int., 65: 521.
- Yin Y., Wu X., Shan G., Zhang X. (2012) Diagnostic value of serum anti-C1q antibodies in patients with lupus nephritis: a meta-analysis. Lupus, 21: 1088.
- Yu F., Tan Y., Liu G. et al. (2009) Clinicopathological characteristics and outcomes of patients with crescentic lupus nephritis. Kidney Int., 76: 307.
Адрес для переписки:
Триполка Светлана Анатольевна
61058, Харьков, просп. Независимости, 13
Коммунальное некоммерческое предприятие
Харьковского областного совета
«Областная клиническая больница»
E-mail: svtripolka@gmail.com

Leave a comment