Обоснование назначения альфакальцидола (альфа д3-тева) для терапии инволютивного остеопороза у женщин, а также профилактики и терапии глюкокортикоид-индуци рованного остеопороза*
Повышенная продукция цитокинов и повышенная активность остеокластов (ослабление естественной активности апоптоза остеокластов) вследствие снижения продукции эстрогенов обуславливают как потерю костной массы у женщин в период менопаузы, так и нарушение активации витамина D и мальаб-сорбцию кальция (Ca). Альфакальцидол (в Украине зарегистрирован под названием Альфа Д3-Тева) препятствует быстрой постменопазуальной потере костной массы, устраняет мальабсорбцию кальция и блокирует провоспалительные цитокины, обеспечивающие резорбцию кости.
Остеопороз при установленном диагнозе у пациентов пожилого возраста обоих полов характеризуется разобщением (дисбалансом) исходно тесно связанных процессов ремоделирования кости, обусловленным не только дефицитом половых гормонов и так называемой соматопаузой (дефицитом инсулиноподобного фактора роста [IGF/ИПФР]), но также недостаточностью витамина D, и, что очень важно, ослаблением синтеза D-гормона (кальцитриола) в почках и костях, равно, как и дефицитом рецепторов или снижением аффинности этих рецепторов к D-гормону в органах-мишенях. В результате этих явлений часто происходит повышение уровня паратиреоидного гормона (PTH/ПТГ). Недостаточность D-гормона и IGF-1 (ИПФР-1), очевидно, приводит к снижению мышечной силы, а также повышает риск падения и, следовательно, риск переломов.
Альфакальцидол (Альфа Д3-Тева), проD-гормон, является специфической антиостеопоротической терапией. При терапии альфакальцидолом (Альфа Д3-Тева) D-гормон поступает в организм в обход своей собственной регуляции, вследствие чего могут достигаться намного более высокие концентрации гормона в тканях-мишенях, чем при приеме обычного витамина D.
*По материалам публикации: E. Schacht «Rationale for Treatment of Involutional Osteoporosis in Women and for Prevention and Treatment of Corticosteroid-Induced Osteoporosis with Alfacalcidol» в «Calcif Tissue Int» (1999) 65: 317-327.
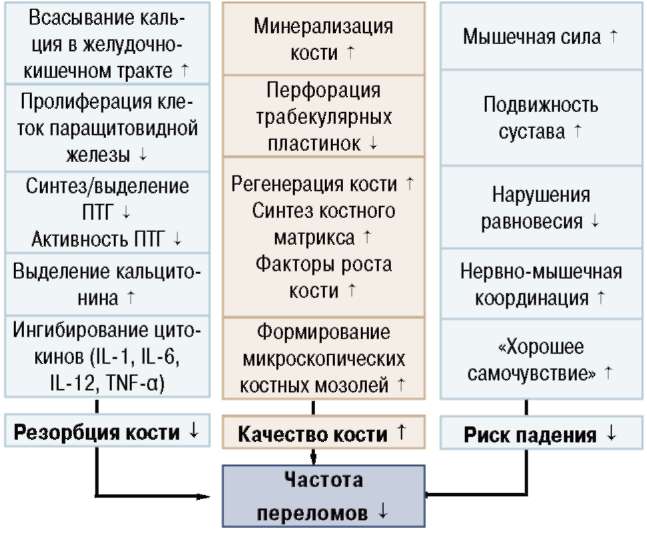
На фоне приема альфакальцидола (Альфа Д3-Тева) значительно возрастает возможность снижения, а часто и предупреждения осложнений остео-пороза в виде переломов костей у пациентов пожилого возраста. Необходимо четко разграничивать применение добавок обычного витамина й в низких дозах и кальция для обеспечения базового их поступления в организм пациентов пожилого возраста, привязанных к дому из-за болезни, и их применение в качестве вспомогательной терапии к ан-тиостеопоротическим лекарственным средствам и специфической антиостеопоротической терапии альфакальцидолом (Альфа Д3-Тева) у пациентов с остеопорозом (схема 1).
Схема 1. Механизм действия альфакальцидола
Улучшение понимания патогенеза остеопоро-за, индуцированного применением кортикостеро-идов, с нарушением гомеостаза кальция, и фармакологических эффектов альфакальцидола (Альфа Д3-Тева), препятствующего такой ятрогенной потере костной массы, позволяет объяснить особенно высокую его клиническую эффективность в терапии этой наиболее часто распространенной формы вторичного остеопороза.
Нормализация дисбаланса процессов ремо-делирования кости с помощью модуляции цито-кинов и потенциальное влияние на ухудшенное качество кости у пациентов с ревматоидным артритом (РА) и болезнью Крона, свидетельствуют о возможности применения альфакальцидола для профилактики и лечения остеопороза, развившегося в результате хронических воспалительных заболеваний, равно как и случаев остеопоро-за, развившегося, в частности, после трансплантации органов.
GCТEGПGPGЗ,ИHДУЦИPGBAHHЫЙ ПРИМЕНЕНИЕМ MIOKGKGP^KG-CТEPGИДGB
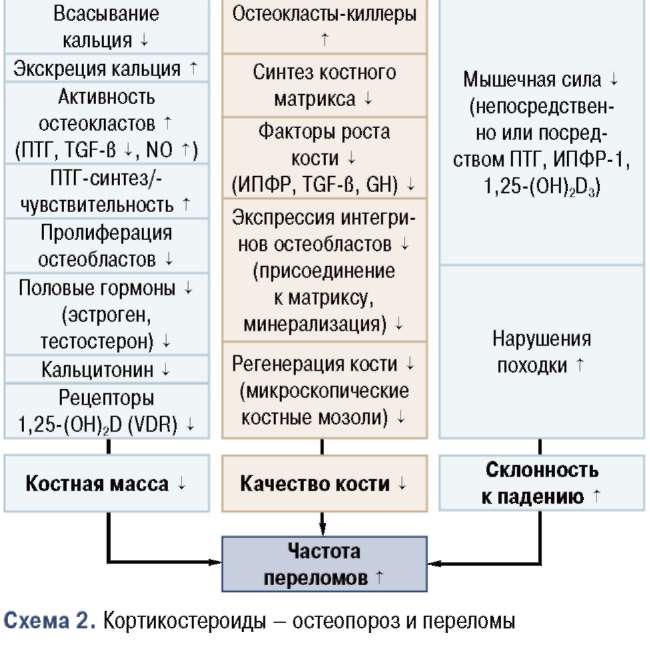
Остеопороз, индуцированный применением глюкортикостероидов, является наиболее распространенной формой вторичного остеопороза и одной из основных причин развития остеопоро-за у мужчин. Он характеризуется повышением резорбции кости и одновременно снижением косте-образования[97-99].
Глюкокортикостероиды уменьшают всасывание кальция в кишечнике и повышают экскрецию кальция с мочой, результатом чего является компенсаторное повышенное продукции ПТГ или повышенная чувствительность кости к ПТГ [1QQ]. Кроме того, кортикостероиды ингибируют функцию остеобластов, как и благоприятное воздействие гормонов роста и половых гормонов на костные ткани [1Q1, 1Q2]. Недавно установлено, что эти лекарственные средства подавляют экспрессию VDRs (рецепторы к D-гормону) [1Q3], и что они, вероятно, индуцируют нарушения, связанные с VDR [1Q4]. Ранее недооценивалось отрицательное влияние кортикостероидов на мышечную силу (опосредствованно, через повышенные уровни ПТГ или сниженные уровни ИПФР-1 и/или дефициты VDR на мышечные клетки) (схема 2) [1Q5, 1Q6].
GBGCHGBAHИE НАЗНАЧЕНИЯ AЛЬФAKAЛЬЦИДGЛA (АЛЬФА Д3-ТЕВА) ДЛЯ ПPGФИЛAKТИKИ И ТЕРАПИИ ГЛЮKGKGPТИKGCТEPGИД-ИHДУЦИPGBAHHGГG GCТEGПGPGЗA
Альфакальцидол (Альфа Дз-Тева), проходя единственную ракцию метаболизма в печени и костной ткани, превращается в кальцитриол, восполняя дефицит последнего, и обеспечивает предотвращение развития негативных эффектов глюкокортикои-дов на костную ткань. Более детально все эффекты представлены на схеме 3 [97, 1Q7-1Q9]. Теоретически допускаемые механизмы действия полностью подтверждаются практическим применением. Например, ингибирование потери костной массы при применении альфакальцидола (Альфа Д3-Тева) [11Q] продемонстрировано даже при терапии кортикосте-роидами в очень высоких дозах, тогда как этот эффект не наблюдался при лечении обычным витамином D, даже при его применении в высоких дозах [111].
+ = стимуляция – = подавление
Схема 3. Остеопороз, индуцированный кортикостероидами, и аль-факальцидол
ОСТЕОПОРОЗ ПРИ РА
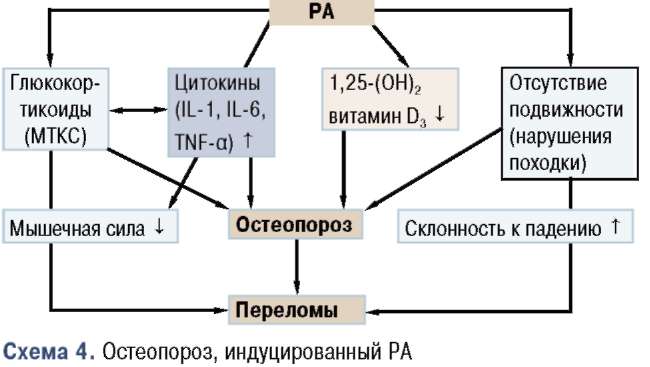
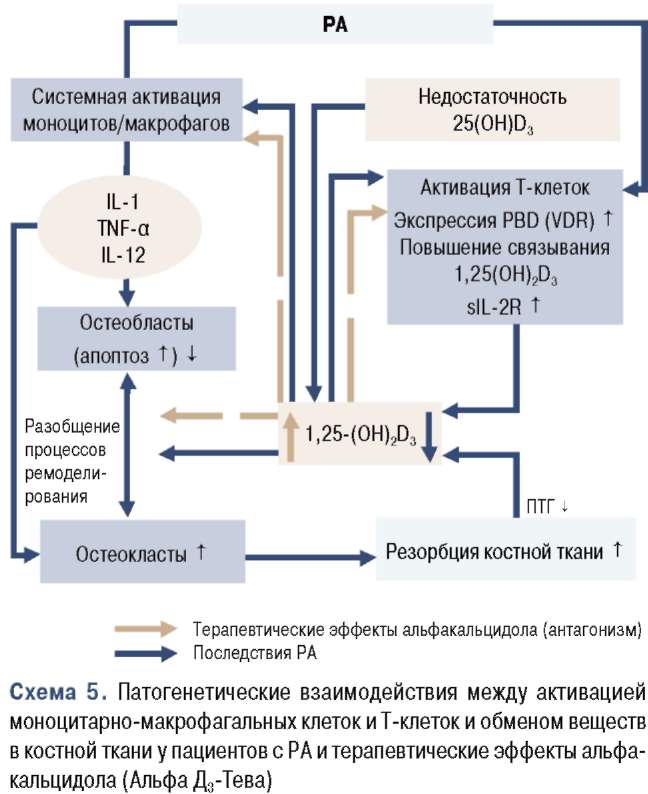
Кроме локальной остеопении, у пациентов с РА развивается остеопороз и, следовательно, они подвержены более высокому риску переломов. Потеря костной массы происходит очень рано и коррелирует непосредственно с активностью заболевания, а позже также с отрицательными эффектами ограниченной подвижности (схема 4) [97, 112].
Недавно продемонстрированная в исследовании корреляция между снижением уровня 1,25(ОН)й3 и повышением уровня С-реактивного белка имеет важное значение в понимании особенностей патогенеза при РА и противовоспалительной роли й-гормона [112]. Серьезный дефицит й-гормона у ВИЧ-инфицированных пациентов недавно объяснен ингибиторным эффектом ТМР-а на синтез й-гормона
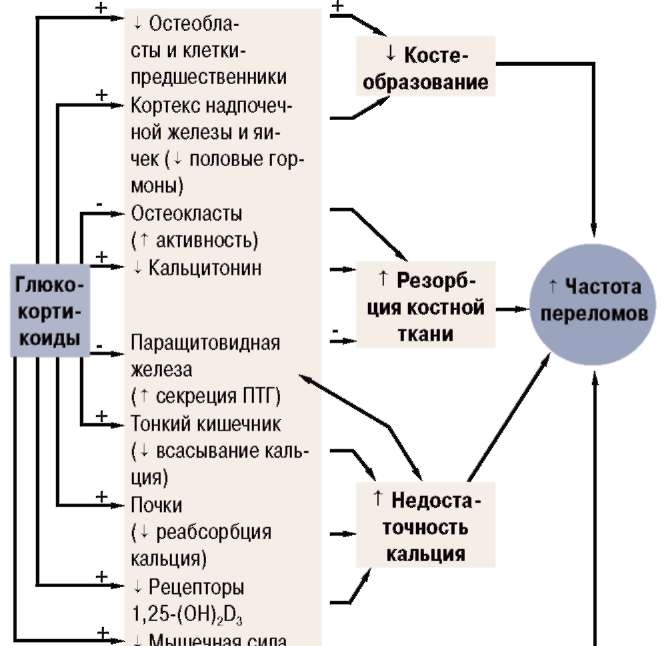
(1а-гидроксилирование) в почках [118]. Существует общее мнение о том, что цитокины (например 11_-6, !1_-12, ТМР-а) индуцируют резорбцию костной ткани не только при ревматических заболеваниях воспалительного генеза, но и при воспалительных заболеваниях кишечника (ВЗК: болезнь Крона, язвенный колит) [97]. Существуют, однако, новые наблюдения, свидетельствующие о том, что цитокины, подобно ТМР-а, также препятствуют костеобразованию, способствуя апоптозу остеобластов [5].
ОБОСНОВАНИЕ НАЗНАЧЕНИЯ АЛЬФАКАЛЬЦИДОЛА (АЛЬФА Д3-ТЕВА) ДЛЯ ИНГИБИРОВАНИЯ ПОТЕРИ КОСТНОЙ МАССЫ И МОДИФИЦИРОВАНИЯ ЗАБОЛЕВАНИЯ ПРИ РА И ВЗК
Активные метаболиты витамина D обладают имму-норегуляторными эффектами in vitro и in vivo [23, 24, 32], особенно посредством ингибирования IL-12 [13]. На клеточном уровне 1,25(OH)2D3 снижает экспрессию клеток Т-хелперов 1 (Th-1) непосредственно или опосредствованно, ингибируя IL-12 из моноцитов [13, 113]. В результате терапии альфакальцидолом или кальци-триолом увеличивается продукция клеток Т-хелперов 2 (Th-2), продуцирующих цитокины, обладающие остео-протекторным действием, подобно IL-4 и IL-10 [26, 113, 114]. Важно знать, что D-гормон обладает протекторными свойствами по отношению к остеобластам против гибели клеток, индуцированной TNF-a [5]. Этим объясняется то, почему активные метаболиты витамина D могут повторно нормализовать сниженное образование новой костной ткани. Этот механизм продемонстрирован in vivo на модели остеопении, опосредствованной воспалением (IMO), экспериментальной модели на животных с имитацией потери костной массы при РА [115], и в которой повышенные уровни ци-токинов в сыворотке крови имеют ключевое значение.
Таким образом, факторы, благодаря которым альфакальцидол (Альфа Д3-Тева) становится предпочтительней, чем витамин D, для профилактики и лечения остеопороза, ассоциированного с хроническими воспалительными заболеваниями (РА и ВЗК) [14, 97], включают модуляцию ци-токинов, результатом чего является нормализация разобщенных процессов ремоделирования костной ткани (процесса обновления костной ткани) и потенциальное влияние на качество костей (которое особенно ухудшается у пациентов с РА), и повышенный риск падения (вследствие мышечной слабости и нарушений походки).
Однако остается еще ряд вопросов, касающихся им-муномодулирующих свойств альфакальцидола. Прежде всего, до какой меры незначительно ослабленная иммунная система (с повышенными уровнями ре-зорбтивных цитокинов кости, как и повышенного уровня ПТГ) у пациентов с возрастным остеопорозом, особенно у лиц, «быстро теряющих костную массу», приводит к потере костной массы. Во-вторых, до какой степени это нарушение поддается коррекции с помощью применения альфакальцидола [6, У], с помощью активации клеток-супрессоров или протекторных цитокинов и их рецепторов [116]. Даже in vitro при изъятии клеток-супрессоров CDS повышается число остеокластов на 40%, и компенсация клеток CDS приводит к тому, что повышенная дифференцировка остеокластов исчезает [У]. Следует внести ясность в вопрос «эндогенного» воздействия альфакальцидола, модифицирующего заболевание, у пациентов с РА, хотя это воздействие — очевидно в теории (схема Б) [112], и в первом пилотном исследовании были предварительные доказательства, свидетельствующие в его пользу [11У].
Ранее не известный иммунообусловленный механизм индукции дефицита й-гормона при заболеваниях человека, отражает большое значение соответствующих, даже более высоких уровней й-гормона для удовлетворительного функционирования иммунной системы человека [112, 118].
ПОСТМЕНОПАУЗАЛЬНЫЙ ОСТЕОПОРОЗ
Постменопаузальный остеопороз является результатом низкой пиковой массы костной ткани, и/или усиления пери- и постменопаузального уменьшения костной массы. Последнее преимущественно вызвано эстрогенным дефицитом. Уменьшение костной массы приводит к нарушению микроархитектоники костной ткани и, следовательно, к ухудше-
нию качества кости. Механизмы патогенеза, задействованные в этом процессе, приведены на схеме 6.
Рис. 6. Костная масса и качество кости при постменопаузальном остеопорозе
Снижение синтеза й-гормона [1,25(0^^] в почках, вследствие сниженной активности фермента 1-а-гидроксилазы, является патогенетическим кофактором в развитии постменопаузального остеопо-роза (схема 7). Главную роль здесь играют повышение выделения кальция (Са) из костной ткани и сопутствующая супрессия ПТГ или продукция цитокинов [10, 118]. Кроме того, эстроген также является важным кофактором в активации 1а-гидроксилазы [11]. Два важных фактора в активации витамина о в почках, а именно уровни ПТГ и эстрогенов, снижаются после наступления менопаузы и, следовательно, частично объясняют мальабсорбцию кальция и подавление других эффектов й-гормона [10] (см. схему 7). Дефицит рецепторов витамина о (РВО/ЮГ)з) в кишечнике и в костной ткани очевиден; этот дефицит, с учетом количества и активности рецепторов, зависит от эстрогенной недостаточности [12] и также играет определенную роль в мальабсорбции кальция [12].
Схема 7. Недостаточность Э-гормона, индуцированная кофакторами 1а-гидроксилазы
Однако в этом случае эстрогенный дефицит также рассматривается как основная причина, по отношению к которой низкие уровни и/или снижение активности й-гормона являются вторичными. Это также объясняет ослабленную эндогенную регуляцию продукции цитокинов и цитокиновых эффектов й-гормоном [13-14].
ОБОСНОВАНИЕ НАЗНАЧЕНИЯ АЛЬФАКАЛЬЦИДОЛА (АЛЬФА Д3-ТЕВА) ДЛЯ ЛЕЧЕНИЯ ПОСТМЕНОПАУЗАЛЬНОГО ОСТЕОПОРОЗА
Активные метаболиты витамина й, такие как пролекарственная форма альфакальцидол (Альфа
Д3-Тева), который трансформируется в организме непосредственно в D-гормон, не образовывая других метаболитов, проявляет высокую активность в уменьшении быстрого постменопазуального снижения костной массы [15-19, 21] по сравнению с применением рекомендованных доз витамина D в сочетании с препаратами кальция. Нормализацию вышеуказанного сниженного синтеза и эффективности D-гормона, а также коррекцию мальабсорб-ции кальция можно рассматривать как механизм действия D-гормона. В этом контексте представляет интерес экспрессия рецепторов эстрогенов в костных клетках, опосредствованная 1,25(OH)2D3 [20]. Также принимаются во внимание повышение секреции кальцитонина [21] и нормализация разобщенных процессов ремоделирования костной ткани посредством увеличения TGF-I3 и остеопро-тегерина (ОПГ/OPG) [75] как вероятный механизм действия [22]. Этот механизм действия включает ингибирование постменопаузальной продукции цитокинов, резорбирующих костную ткань [23, 24], особенно TNF-a (или ингибирование его эффекта на обмен веществ в костной ткани, например инги-бирование апоптоза остеобластов [5], и увеличение выделения TGF-I3, что связано с восстановлением ослабленного апоптоза остеокластов в процессе ремоделирования костной ткани [25, 26]. Также, по-видимому, задействована коррекция повышенного соотношения CD4 : CD8 у пациентов, быстро теряющих костную массу, вследствие повышения CD8 [6,7] (схема 8).
4 Эстрогены
Мальабсорбция кальция
(недостаточность D-гормона/устойчивость) Альфакальцидол Апоптоз остеокластов i (TGF-p 4) Альфа Д,-Тева Цитокины Т (IL-1, IL-6, TNF-a) ■_,
i
—t Резорбция кости-
t OPG, TGF^B. f . ; Кальцитщин |
Масса костной ткани i
^^^^^^^^^^ -*• Т Риск перелома “-
Схема 8. Постменопаузальная потеря массы костной ткани и альфакальцидол
ИНВОЛЮТИВНЫЙ ОСТЕОПОРОЗ
Остеопороз у пациентов пожилого возраста обоих полов характеризуется разобщением процессов ремоделирования костной ткани (снижение костеобразования на фоне повышения, до некоторой степени, резорбции костной ткани). Этот дисбаланс процесса ремоделирования обусловлен дефицитом половых гормонов (эстрогена или тестостерона), так называемой соматопау-зой (недостаточностью гормона роста или инсу-линоподобного фактора роста (IGF), недостаточностью витамина D, и, что важно, снижением синтеза D-гормона в почках [27-29] и костях (дефицит 1а-гидроксилазы) [30]. Этому также способствуют дефицит рецепторов или снижение аффинности
|
Патогенетические механизмы |
|
|
■ Абсорбция кальция 1 (50%) |
|
|
(дефицит рецепторов витамина 0, дефицит Р-гормона; |
|
|
мальабсорбция кальция с неустановленными механизмами) |
|
|
■ Апоптоз остеокластов 1 (ТЄР-р I) |
|
|
■ Остеокласты-киллеры Т |
|
|
Цитокины (И-1, ІІ.-6, Т^-а) т |
|
|
Последствия: |
|
|
■ Нарушение минерализации костной ткани |
|
|
■ Разобщение процессов ремоделирования (обновления) |
|
|
костной ткани |
|
|
Перфорация пластинок губчатой ткани |
|
|
■ Разъединение трабекул |
|
|
■ Раннее нарушение качества костной ткани и повышение |
|
|
частоты переломов |
|
Витамин D: –
Потменопаузальная потеря костной массы
Кофакторы 1а-гидроксилазы: Эстроген i; ПТГ і; цитокины Т
э%~сть: Альфакальцидол: +
Возрастной остеопороз
Кофакторы 1а-гидроксилазы:
Эстроген i; Тестостерон і ; ЮМ і; ЮРВР-З + 54;
ЮРВР-4 Т; Масса почек 4
Клиническая дпкЖякяпмімппп- 4-і Витамин 0: + эффективность: Альфакальцидол. ++ (недостаточно)
рецепторов к й-гормону в органах-мишенях [12, 31] (желудочно-кишечный тракт, кости и паращи-товидная железа) [10, 32, 33-35].
Несоответствующие уровни 1,25(ОН)2й3 приведут к ухудшению всасывания кальция в кишечнике, таким образом, больше кальция будет мобилизоваться из костной системы, что в результате приведет к большей резорбции костной ткани.
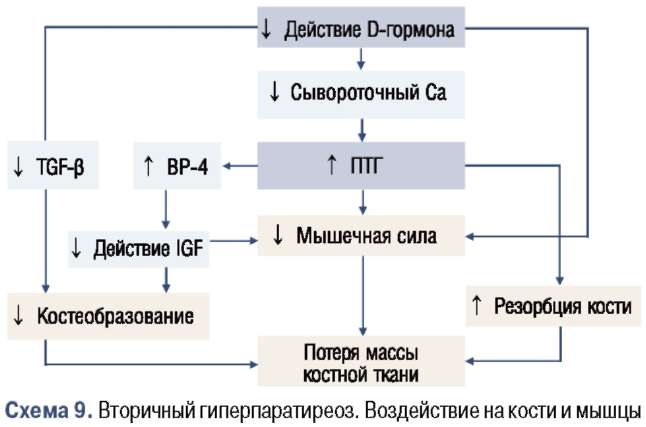
Кроме того, недостаточные уровни й-гормона приводят к ограниченному синтезу белков костного матрикса, продуцируемых остеобластами. Этот ограниченный синтез белков костного ма-трикса и ограниченная регуляция цитокинов, играющих важную роль в ремоделировании кости, оказывают неблагоприятное воздействие на массу и качество костной ткани. Предполагается, что одной из причин этого является уменьшение массы почек в пожилом возрасте. Другая причина заключается в уменьшении наличия кофакторов 1а-гидроксилазы, а именно эстрогена/тестостерона, инсулиноподобных факторов роста (ЮРб) и их связывающих белков (ИФРСВ-4/ЮРВР-4 т, ИФРСВ-3/5/ЮРВР-3/5 +) (см. схему 7).
Это часто приводит к повышению уровней ПТГ [36-37], поскольку организму необходимо больше ПТГ для поддержания нормальной активности й-гормона [33].
При возрастном остеопорозе повышение резорбции костной ткани не сопровождается повышением костеобразования. Напротив, повышенные уровни ПТГ стимулируют секрецию связывающих белков (ЮРВР-4) [47, 48], ингибирующих ЮР-1 и 2. Кроме того, недостаточность 1,25(ОН)2й3 приводит к снижению секреции ТСР-З [25]. Эти факторы приводят к ингибированию продукции, дифферен-цировки и метаболизма остеобластов, и, следовательно, к снижению костеобразования.
Различные исследовательские группы сделали заключение о том, что, как у мужчин, так и у женщин, снижение ЮР-1 и ЮР-З в кортикальной и тра-бекулярной костной ткани бедренной кости, связанное с возрастом, связано с повышением риска переломов [49, 50].
Связывающие белки ЮРВР-3 и ЮРВР-5 усиливают костный митогенный потенциал ЮР-1 и -2, и их содержание уменьшается в пожилом возрасте [51, 52], тогда как уровень ЮР-ингибирующего ЮРВР-4, как указано выше, повышается [47, 48]. Также особое значение имеет тот факт, что остеобласты у пациентов пожилого возраста менее восприимчивы к системным и местным остеотропным факторам [53]; в этом снижении восприимчивости может играть роль индукция ЮРВР-4 посредством ПТГ. Представляется важным наблюдение, что ЮР-1 является важным кофактором, подобно эстрогену, в активировании й-гормона в почках, с помощью ферментной системы 1а-гидроксилазы. Кроме того, ЮР-1 контролирует экспрессию гена ЮР1 Иными словами, дефицит ЮР-1 приведет к недостаточности й-гормона [54, 55]. Дефицит ЮР-1, ЮРВР-3 и й-гормона, очевидно, также вызывает снижение мышечной силы, впоследствии повышая
Это объясняет связь между вторичным гипер-паратиреозом и повышением частоты переломов шейки бедра, ребер и лучевой кости, а также тел позвонков. Четкая зависимость между снижением концентрации й-гормона в сыворотке крови и повышением потери костной массы тел позвонков недавно продемонстрирована у пациентов с переломами шейки бедра в течение 1-го года после события [43], после того, как было установлено разобщение процессов ремоделирования кости в этой же выборке пациентов [62]. Также недавно продемонстрировано, что риск переломов бедра коррелирует с низким содержанием Э-гормона в сыворотке крови, но не с уровнями 250НЭ3 [63]. Важно то, что в случае уже существующей потери костной массы на единицу ре-моделирования, новые циклы ремоделирования индуцируются посредством ПТГ, таким образом, усиливая дисбаланс процессов ремоделирования костной ткани (процесса обновления костной ткани). Эти повторно подтверждавшиеся изменения уровней и активности й-гормона, и, безусловно имеющие к этому отношение факторы мальабсорб-ции кальция, вторичный гиперпаратиреоз, снижение мышечной силы и повышение риска падений [10, 32, 33], представляют собой важные первичные патогенетические факторы в развитии остео-пороза и повышении частоты переломов у людей пожилого возраста (схема 10).
Недостаточность кальция Первичная недостаточность витамина 0 Первичная недостаточность/ устойчивость 1,25(0Н)2РЗ Паратиреоидная гиперплазия
Сниженная минерализация Остеомаляция
Мышечная сила 4 Ощущение равновесия 4 ‘ Психический статус 4
гормон роста, —. Рефлексы 4 _^ | Подвижность 4
Гормональная недостаточность (эстроген, тестостерон, 1,25(ОН)203,
Вторичный гиперпаратиреоз
4
Низкая масса костной ткани
Л
Защитные механизмы 4
4
Склонность к падению
I
Распределение энергии к мягким тканям 4
Схема 10. Факторы, задействованные в патогенезе возрастного остеопороза

ОБОСНОВАНИЕ НАЗНАЧЕНИЯ АЛЬФАКАЛЬЦИДОЛА (АЛЬФА Д3-ТЕВА) ДЛЯ ТЕРАПИИ ИНВОЛЮТИВНОГО ОСТЕОПОРОЗА
У пациентов с недостаточностью природного витамина й и сопутствующими низкими уровнями субстрата 2501-Ю3 в большинстве случаев будет достаточным прием добавок обычного витамина й для преодоления клинической или субклинической остеомаляции. Что касается многих специфических лекарственных средств для лечения остео-пороза (бисфосфонаты, кальцитонины или фториды), существует обоснование в пользу применения вспомогательной терапии, заключающейся в приеме кальция и витамина й в низких дозах. Однако применение обычного витамина й в физиологических суточных дозах 400-3000 МЕ или 15 мкг 250Нй3 не оказалось в достаточной мере эффективным в лечении остеопороза [16, 64-66].
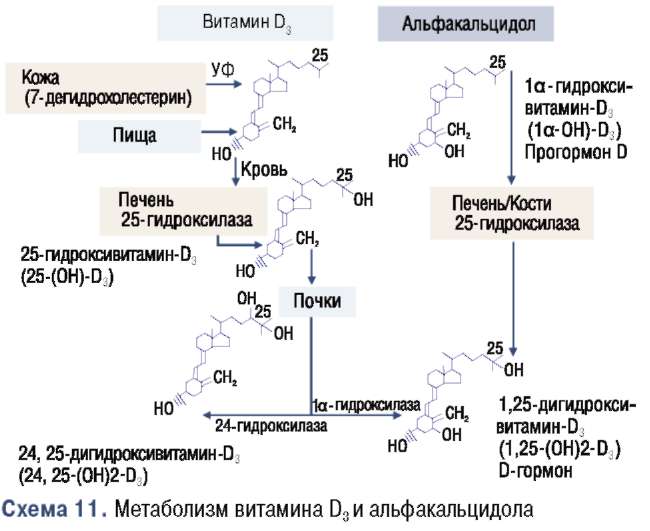
Как уже было продемонстрировано в ранее проводившихся исследованиях [67] и также повторно подтверждено в ходе недавно проводившихся исследований [68], при приеме добавок витамина й значительно повышаются уровни субстрата 250Нй3. Даже прием витамина й в более высоких дозах до 50 000 МЕ/нед не оказывает значительного воздействия в присутствии резервов насыщенного 250Нй3, поскольку синтез й-гормона в почках строго контролируется эндогенными регуля-торными механизмами (схема 11) [10, 33]. Только прием витамина й в чрезвычайно высоких суточных дозах 50 000 МЕ позволяет обойти эту эндогенную регуляцию [69].
Альфакальцидол (Альфа Д3-Тева), про й-гормон, с другой стороны, является специфической терапией остеопороза, благодаря чему нет необходимости в дополнительном приеме добавок кальция и/или обычного витамина й в связи с оптимальной абсорбцией кальция, поступающего с пищей.
При терапии альфакальцидолом (Альфа Д3-Тева) й-гормон поступает в организм, обходя эндогенную регуляцию (см. схему 11). В результате можно достичь намного более высоких концентраций гормона, чем при приеме добавок обычного витамина й в обычной дозировке [10, 69, 70],
и это необходимо для того, чтобы оказывать уравновешивающее воздействие на мальабсорбцию Ca, основывающуюся на дефиците VDR или снижении сродства VDR к D-гормону. Таким образом, с одной стороны, эта разновидность терапии включает прием активного D-гормона, (заместительная терапия D-гормоном), что также эффективно в случае сниженной продукции D-гормона в почках (см. схему 7). С другой стороны, она представляет собой фармакологически активную гормональную терапию для лечения остеопороза, при этом фармакологические эффекты, оказываемые на обменные процессы в паращитовидной железе, мышечной и нервной системе, а также на иммунную систему, могут способствовать снижению риска переломов [71].
Альфакальцидол (Альфа Д3-Тева) способствует активному всасыванию кальция и фосфата в тонком кишечнике, при этом D-гормон может стимулировать транспорт обоих ионов независимо друг от друга. При необходимости D-гормон будет мобилизовать кальций из костной системы в согласованном взаимодействии с ПТГ. Оба гормона также регулируют реабсорбцию кальция в почках. Это воздействие D-гормона в трех локализациях повышает концентрацию кальция и фосфата в сыворотке крови, способствует нормальной минерализации скелета и нормальной нервно-мышечной проводимости. ПТГ является важным стимулятором активации 25OHD3 в 1,25(OH)2D3 с помощью 1а-гидроксилазы в почках (см. схему 11). 1,25(OH)2D3 оказывает супрессивное воздействие на 1а-гидроксилазу и стимулирующее воздействие на 24-гидроксилазу, что приводит, с одной стороны, к расщеплению D-гормона и, с другой стороны — к повышенному образованию 24, 25(OH)2D3. Последний является метаболитом, который, очевидно, имеет особенно важное значение для заживления микропереломов и формирования микроскопических костных мозолей, следовательно, способствуя улучшению качества костной ткани (см. схему 11).
Наиболее важным эндокринным регулятором ПТГ является D-гормон. Кальцитриол и пролекар-ственное средство альфакальцидол (Альфа Д3-Тева) опосредствованно подавляют ПТГ, уровень которого особенно высокий у пациентов пожилого возраста, через улучшение всасывания кальция, но также и непосредственно путем ингибирования пролиферации клеток паращитовидной железы, индуцируя апоптоз [36, 72], а также синтеза и выделения ПТГ, и эффектов ПТГ на костную ткань [73, 74].
In vitro 1,25(OH)2D3 в высоких дозах стимулирует дифференцировку остеокластов, но также и остеопротегерина (ОПГ), сильнейшего ингибитора остеокластогенеза, таким образом, регулируя «ремоделирование кости», что чрезвычайно важно для процесса обновления костной массы, непрерывных репаративных процессов при микропереломах, и, следовательно, для стабильности костной системы [74, 75]. In vivo D-гормон ингибирует повышенную резорбцию костной ткани у пациентов, быстро теряющих костную массу.
Хотя D-гормон не участвует в регуляции минерализации непосредственно, а скорее повышает уровень кальция и фосфата, это не исключает воздействия на органический матрикс кости или на факторы роста кости. Напротив, существуют убедительные доказательства наличия анаболического эффекта на костную систему. D-гормон повышает синтез TGF-В и IGF-2 (TGF-В и IGF-2 стимулируют пролиферацию и дифференциров-ку остеобластов), увеличивает число рецепторов к IGF-1 и улучшает связывание IGF-1 с рецепторами (IGF-1 стимулирует активность остеобластов и синтез матрикса кости)и модулирует активность костных морфогенетических белков (КМБ/BMPs стимулируют остеоиндукцию) [25, 26, 33, 47, 76-78, 91].
Заслуживает внимания наблюдение, что 1,25(OH)2D3 in vitro повышает продукцию
IGFBP-3 [79]. Значение IGF-1 и IGFBPs как кофакторов 1а-гидроксилазы и в синтезе D-гормона в почках и костях — см. схему 7. Кроме того, синтез in vivo и in vitro коллагена I типа и белков матрикса, таких как остеокальцин и остеопонтин, имеющих чрезвычайно важное значение для минерализации, функционирования и процессов метаболизма костной ткани, усиливается посредством стимулирующего воздействия и транскрипции соответствующих генов [80-82]. Недавно было продемонстрировано, что D-гормон стимулирует транспорт фосфата не только в желудочно-кишечном тракте, но также в остеобластах[83].
Итак, эти результаты свидетельствуют о том, что вследствие терапии альфакальцидолом (Альфа Д3-Тева) можно ожидать ингибирования повышенной резорбции костной ткани, индуцированной ПТГ, и наличия анаболических эффектов на косте-образование. Кроме того, альфакальцидол (Альфа Д3-Тева) оказывает воздействие на качество кости, не только вследствие оптимизации минерализации костной ткани (например при субклинической остеомаляции, гетерогенной минерализации) и ингибирования резорбции костной ткани, но также способствуя другим важным процессам, таким как формирование микроскопических костных мозолей, путем регуляции ремоделирования костной ткани. Это, в свою очередь, улучшает ухудшившееся качество костной ткани, как было продемонстрировано в экспериментальных исследованиях на животных, в которых улучшились механические свойства кости [15, 16, 84-86]. Положительные эффекты альфакальцидола (Альфа Д3-Тева) с учетом оптимизации минерализации кости, увеличения массы кортикальной костной ткани, нормализации процессов ремоделирования кости и улучшения заживления микропереломов, являются одним из вариантов объяснения резкого снижения частоты переломов во всех частях костей (см. схему 1).
Повышенная склонность к падениям, в сочетании с меньшим количеством защитных механизмов и сниженным распределением энергии к мягким тканям (снижение индекса массы тела — ИМТ), до настоящего времени недооценивались как источники опасности, играющие роль в повышении
частоты переломов лучевой кости, и особенно бедра и ребер, но также и переломов тел позвонков. Mнoгие падения не являются результатом одной причины, а результатом взаимодействия множества нарушений, связанных с возрастом и состоянием здоровья, особенно снижения мышечной силы и подвижности [8У, 88]. Уже длительное время было известно, что костно-мышечная система является «органом-мишенью» для D-гормона [89]. но только недавно стало ясно, что D-гормон также регулирует экспрессию фактора роста нервов (ФРН/NGF) [90]. Taкже недавно было продемонстрировано, что IGFBP-3 выступает в качестве прогностического маркера повышенного риска переломов, а также в значительной мере коррелирует с безжировой массой тела и мышечной силой [54, 61]. D-гормон способствует повышению продукции IGFBP-3 [У9] in vitro и увеличивает период полувыведения, и, следовательно, эффект IGF-1, одного из наиболее сильных факторов активации мышц. Однако только недавно можно было наблюдать повышение концентрации IGF-1 в плазме крови in vivo всего лишь через 14 дней терапии D-гормоном в высоких дозах [91]. Mышечнaя слабость, нарушения походки и постуральные нарушения у пациентов пожилого возраста можно отнести на счет дефицита D-гормона [58]. Tеpaпия альфакальци-долом (Альфа Д^ева) позволит в значительной мере провести коррекцию этих состояний, и, следовательно, улучшить качество жизни. Более того, вследствие этого уменьшится склонность к падениям, а, значит, и риск переломов в этой группе пациентов (см. схему 1).
Клинические исследования по изучению аль-факальцидола продемонстрировали как увеличение мышечной силы [89, 92], так и снижение частоты переломов позвонков и шейки бедра на 50-У0% по сравнению с контрольными группами [93-95]. Это было особенно очевидным в группе пациентов высокого риска с инсультом [96]. Tеpaпия альфа-кальцидолом привела к снижению частоты переломов на более ранней стадии, чем при других видах терапии остеопороза, хотя могут быть установлены только умеренные одновременные увеличения костной массы. Правдоподобным объяснением этого наблюдения может быть уменьшение числа падений в результате терапии альфакальцидолом с двойным действием на кости и мышцы. Физиологическая терапия альфакальцидолом значительно снижает частоту клинически значимых осложнений остеопороза у пациентов пожилого возраста, мужчин и женщин, а именно переломов. Кроме того, альфакальцидол снижает интенсивность боли в спине. Этот факт, наряду с простым, удобным для пациентов, способом применения препарата и низкой частотой побочных эффектов, способствует долговременному соблюдению пациентом режима и схемы лечения.
ЗАКЛЮЧЕНИЕ
С одной стороны, альфакальцидол (Альфа Д3-Tевa) оказался очень эффективным средством
в снижении быстрой постменопаузальной потери костной массы посредством модуляции Са-регулирующих гормонов, такой как повышение 1,25(0Н)2й3 и фосфата и, следовательно, сывороточного соотношения Са/Р04, в результате чего повышается остеоидная минерализация и каль-цитонин. С другой стороны, он ингибирует костно-резорбтивные цитокины, продукция которых повышается в период постменопаузы, и повышает ЮР-Р, таким образом, восстанавливая сниженный апоптоз остеокластов, равно, как и улучшая свойства остеобластов.
При изучении результатов экспериментальных исследований на животных и клинико-фармакологических исследований, становятся понятными наблюдения, когда применение аль-факальцидола приводит к заметному снижению частоты переломов, в то же время только умеренно увеличивая массу костной ткани.
При коррекции вторичного гиперпаратиреоза у пациентов с возрастным остеопорозом снижается сопутствующая эндостальная резорбция костной ткани и интракортикальная пористость, обоих факторов, предрасполагающих к переломам. В результате проведения биомеханических испытаний выявлено улучшение механических свойств кости, что свидетельствует об улучшении качества костной ткани. Играет ли роль сниженная тенденция к падениям или нет как резул

Leave a comment