Огляд застосування глюкозаміну при остеоартрозі колінного суглоба: чому патентований кристалічний глюкозаміну сульфат має бути диференційований від інших глюкозамінів з метою максимізації клінічного результату
Кухарц Е.Дж.1, Коваленко В.2, Сзанто С.3, Брюйер О.4, Купер С.5, Реджинстер Ж.-И.4
- 1Отдел внутренней медицины и ревматологии Медицинского университета Силезии, Катовице, Польша
- 2Отдел некоронарогенных болезней сердца и клинической ревматологии ГУ «Национальный научный центр «Институт кардиологии имени Н.Д. Стражеско» НАМН Украины», Киев, Украина
- 3Институт внутренней медицины, факультет ревматологии Университета Дебрецена, Дебрецен, Венгрия
- 4Департамент общественного здравоохранения, эпидемиологии и экономики здравоохранения, Университет Льежа, Льеж, Бельгия
- 5Эпидемиологическое подразделение жизненного цикла MRC Университета Саутгемптона, Саутгемптон, Великобритания
Резюме. Алгоритм лікування остеоартрозу (ОА) колінного суглоба, розроблений Європейським товариством з клінічних і економічних аспектів остеопорозу і остеоартрозу (European Society for Clinical and Economic Aspects of Osteoporosis and Osteoarthritis — ESCEO), рекомендує симптоматичні повільнодіючі препарати для лікування ОА (symptomatic slow-acting drugs in osteoarthritis — SYSADOA) як першу лінію для середньо- і довгострокової терапії ОА через їхню здатність контролювати біль, покращувати функцію і уповільнювати розвиток структурних змін суглобів. Серед SYSADOA глюкозамін, ймовірно, є найбільш широко застосовуваним засобом. У цьому огляді, присвяченому застосуванню глюкозаміну при ОА колінного суглоба, ми досліджували, чи є докази ефективності патентованого кристалічного глюкозаміну сульфату (patented crystalline glucosamine sulfate — pCGS) («Rottapharm»/«MEDA») більш переконливими, ніж інших форм глюкозаміну. Тільки pCGS, який призначається 1 раз на добу в дозі 1500 мг, володіє високою біодоступністю і фармакологічним ефектом. При прийомі pCGS його рівень у плазмі крові досягає близько 10 мкМ, що необхідно для пригнічення інтерлейкін-1-індукованої експресії генів, задіяних у патофізіології процесу запалення суглобів і руйнування тканини. При цьому при застосуванні глюкозаміну хлориду досягають лише субтерапевтичних рівнів діючої речовини в зоні запалення. Як видно з ретельного вивчення доказової бази, тільки глюкозамін у формі pCGS надійно забезпечує вищу ефективність щодо усунення болю порівняно з парацетамолом, а також ефект, еквівалентний тому, який досягається при застосуванні нестероїдних протизапальних препаратів. Для порівняння, у ході рандомізованих контрольованих досліджень неодноразово показано, що ефект щодо купірування болю для некристалічних препаратів глюкозаміну сульфату і глюкозаміну хлориду дорівнює нулю. Крім того, існують докази, що тривале застосування pCGS модифікує перебіг захворювання зі зменшенням потреби в проведенні хірургічного втручання з метою повної заміни суглоба протягом принаймні 5 років після припинення лікування. Отже, препарат pCGS («Rottapharm»/«MEDA») є логічним вибором, який дозволяє забезпечити контроль болю в середньостроковій перспективі та тривалий вплив на прогресування захворювання.
Введение
Традиционно медикаментозная терапия при остеоартрозе (ОА) фокусировалась на методах лечения, которые могут уменьшить выраженность или помочь контролировать симптомы либо по крайней мере обеспечить обезболивание. В последнее время применение симптоматических медленнодействующих препаратов для лечения пациентов с ОА (symptomatic slow acting drugs for osteoarthritis — SYSADOA), в частности рецептурного глюкозамина сульфата (glucosamine sulfate —GS) и хондроитин сульфата (chondroitin sulfate — CS), предложено в качестве первой линии медикаментозной терапии больных прогрессирующим ОА для контроля симптомов в средне- и долгосрочной перспективе [1]. SYSADOA демонстрируют эффективность в качестве симптоматического лечения, а также обладают потенциалом в обеспечении болезнь-модифицирующего эффекта. Об этом свидетельствуют результаты исследований, в ходе которых выявлено снижение экспрессии некоторых медиаторов воспаления и деградации, что в свою очередь оказывало влияние на выраженность боли и других симптомов, а также способствовало более медленной деградации хряща, таким образом предотвращая прогрессирование заболевания [2]. Клиническое влияние этого молекулярного механизма проявлялось как в уменьшении выраженности боли и повышении функции, так и в результатах радиологического измерения восстановления сужения суставной щели (joint space narrowing — JSN) [3, 4].
Несмотря на то что в настоящее время существует несколько международных руководств по управлению ОА на основе данных доказательной медицины, недостает согласованности подходов к применению различных методов лечения [5–9]. Ключевой источник разногласий в отношении применения SYSADOA основывается на том факте, что регуляторный статус и, соответственно, наличие и маркировка этих препаратов существенно различаются в отдельных странах и регионах мира [10]. В частности, глюкозамин доступен как рецептурный патентованный кристаллический GS (patented crystalline glucosamine sulfate — pCGS) («Rottapharm»/«Meda») с соответствующими требованиями к его качеству [11], а также в виде генерических лекарственных средств, безрецептурных препаратов GS и диетических добавок, содержащих в основном соль глюкозамина гидрохлорида (GH). Генерические препараты глюкозамина, безрецептурные лекарственные средства и диетические добавки существенно отличаются от pCGS своей молекулярной структурой, фармацевтической формой и схемами дозирования. Только pCGS обладает высокой биодоступностью, применяется 1 раз в сутки в дозе 1500 мг и характеризуется проверенным фармакологическим эффектом [12].
Европейское общество по клиническим и экономическим аспектам остеопороза и остеоартроза (European Society for Clinical and Economic Aspects of Osteoporosis and Osteoarthritis — ESCEO) [13, 14] недавно разработало алгоритм рекомендаций по лечению, который призван помочь лечащему врачу в приоритезации методов вмешательства при терапии больных ОА коленного сустава, на основании имеющихся доказательств, применяемых в Европе и на международном уровне [1]. Рабочая группа ESCEO признала наличие различий в эффективности продемонстрированных форм глюкозамина в ходе клинических исследований и рекомендует: «Среди SYSADOA, рецептурный [кристаллический] GS отличать от других препаратов глюкозамина» [1]. В этом обзоре применения глюкозамина в лечении ОА мы исследуем причины, лежащие в основе упомянутого отличия между формами глюкозамина путем изучения доказательной базы.
Механизм действия
Глюкозамин является естественным строительным блоком для сложных длинноцепочечных гликозаминогликанов, которые связываются с белком в молекулах протеогликанов (аггрекан), являясь структурной частью хрящевого матрикса. При введении экзогенный глюкозамин оказывает специфическое фармакологическое действие при ОА в отношении хряща и хондроцитов [15, 16]. Глюкозамин влияет на экспрессию генов хряща при ОА, а антикатаболическая активность глюкозамина ответственна за его терапевтический эффект [17]. Показано, что глюкозамин in vitro снижает продукцию простагландина Е2 (PGЕ2) и ингибирует активацию сигнального пути, опосредованного ядерным фактором каппа В (NF-κB), ингибируя таким образом внутриклеточный цитокиновый сигнальный каскад в хондроцитах и синовиальных клетках (рис. 1) [2, 16–19]. При ОА глюкозамин индуцирует эффекты, противоположные провоспалительному и сустав-дегенерирующему эффектам, вызываемым интерлейкином (IL)-1 [16]. IL-1β является мощным провоспалительным цитокином, продуцируемым в больших количествах в суставе при ОА, где он запускает экспрессию воспалительных факторов, таких как циклооксигеназа (ЦОГ)-2, индуцибельная синтаза оксида азота (iNOS), IL-6 и фактор некроза опухоли (TNF)-α. IL-1β индуцирует клетки продуцировать больше IL-1 так же, как и факторы деградации матрикса, такие как матриксные металлопротеиназы (ММР) и протеазы семейства дизинтегрин и металлопротеиназа с тромбоспондиновым мотивом типа 1 (disintegrin and metalloproteinase with a thrombospondin type 1 motif, member TSs, ADAM-TSs). Большинство генов, кодирующих упомянутые белки, находятся под транскрипционным контролем NF-κB. Глюкозамин в клинически значимых концентрациях снижает экспрессию генов ЦОГ-2, iNOS и синтазы-1 микросомального простагландина Е (microsomal prostaglandin E synthase-1 — mPGEs1) и синтез PGE2 под действием IL-1, что позволяет предполагать, что глюкозамин может контролировать каскад, запускаемый воспалительными стимулами [20].
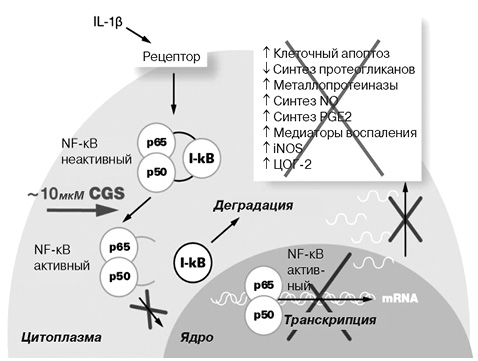
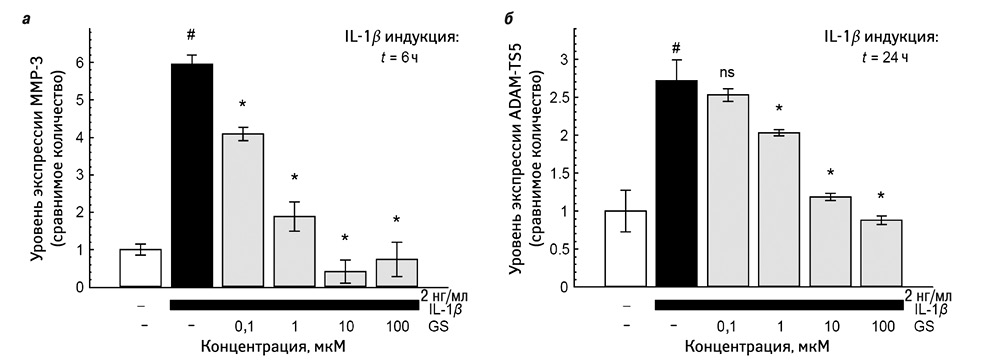
Упомянутые эффекты могут быть продемонстрированы in vitro с большинством солей глюкозамина или его форм, pCGS является единственной формой глюкозамина, для которой такие эффекты могут быть подтверждены для концентраций, в действительности достигнутых в биологических жидкостях после введения в терапевтических дозах в организм человека. Однако неизвестно, имеют ли упомянутые эффекты глюкозамина, отмечающиеся in vitro, значение для его терапевтического действия в рамках клинических исследований. pCGS ингибирует IL-1-стимулированную экспрессию генов — медиаторов дегенерации сустава в клетках хондроцитов человека в концентрациях 10 мкМ. Такая же концентрация определяется в плазме крови или синовиальной жидкости пациентов с ОА коленного сустава после приема pCGS в терапевтической дозе 1500 мг 1 раз в сутки [2]. Показан дозозависимый эффект pCGS на IL-1-индуцированную экспрессию генов — факторов деградации матрикса ММР-3 (стромелизин-1) и ADAM-TS5 (аггреканаза 2) (рис. 2) [2]. Долгосрочное пероральное введение GS уменьшает разрушение хряща и повышает уровень мРНК ММР-3 на моделях in vitro [21]. Более того, исследования на модели экспланта, взятого у человека с ОА, показывают, что GS является более сильным ингибитором экспрессии генов, чем GH, когда обоих вводят в дозах от 5 мМ [22].
Различия между GS- и GH-формами могут быть важны как на фармакокинетическом, так и фармакологическом уровне и могут помочь объяснить отличающиеся результаты, отмеченные в клинических исследованиях с различными солями глюкозамина и его форм. Концентрации сульфата возрастают после введения GS, что может восполнить дефицит в неорганической сере, вызванный низким уровнем потребления белков, необходимых для синтеза протеогликанов, которые имеют большое значение для метаболизма хондроцитов [23, 24]. GS является эффективным относительно животных моделей хирургически индуцированного ОА [25] и приводит к улучшению в отношении гистологических изменений при ОА с уменьшением выраженности синовита на 60% по сравнению с контрольной группой [26]. Однако хирургически индуцированный экспериментальный ОА не может отражать все аспекты спонтанного идиопатического ОА в организме человека. При постоянном приеме у STR/ort мышей, у которых с возрастом развивается спонтанный ОА, при котором весь сустав претерпевает дегенеративные изменения, аналогичные описанным при ОА у человека [27], pCGS уменьшает повреждение тканей, снижает степень поражения и улучшает показатели гистоморфометрии в эксперименте на этой животной модели [2].
Фармакокинетика
Фармакокинетические исследования демонстрируют, что прием pCGS в дозе 1500 мг 1 раз в сутки позволяет достичь устойчивой средней концентрации в плазме крови примерно 9 мкМ глюкозамина у здоровых добровольцев [28], то есть для которых на уровне 10 мкМ была показана эффективность в ингибировании IL-1-индуцированной экспрессии генов, в то время как введение GH (500 мг 3 раза в сутки) позволяло достичь устойчивого уровня только 1,2 мкМ [29]. Пиковые концентрации глюкозамина в плазме крови после однократного приема GH (1500 мг) составляют примерно ⅓ таковых после приема pCGS в той же дозе (1500 мг), в то время как обычно используемое на практике дозирование GH 500 мг 3 раза в сутки дополнительно снижает пиковые уровни на 50% даже в стационарном состоянии (табл. 1) [29]. В перекрестном исследовании показано, что переход с pCGS на GH приводит к снижению на 50% пиковой концентрации в плазме крови и сокращению на 75% общей биодоступности [12], что можно объяснить различиями в режиме дозирования и фармацевтической форме. Следует отметить, что низкая биодоступность, продемонстрированная для GH, может некоторым образом объяснить низкие результаты, полученные с помощью этой формы в исследовании Glucosamine/chondroitin Arthritis Intervention Trial (GAIT), проведенном при поддержке NIH, в котором не удалось выявить эффективность GH в сравнении с плацебо [30]. Важно, что у пациентов с ОА после одноразового приема pCGS (1500 мг) пиковые концентрации глюкозамина составили 7,17 мкМ (диапазон от 3,35 до 22,7 мкМ) в плазме крови и 4,34 мкМ (диапазон 3,22 до 18,1 мкМ) — в синовиальной жидкости [28, 31].
и GH в дозе 1500 мг ежедневно или 500 мг 3 раза в сутки
(адаптировано из: Persiani S. et al., 2005 [28] и Jackson C.G. et al., 2010 [29])
| Показатель | pCGS 1500 мг 1 раз в сутки | GH 1500 мг 1 раз в сутки | GH 500 мг 3 раза в сутки |
|---|---|---|---|
| Устойчивое состояние | Одна доза | Устойчивое состояние | |
| Cmax (среднее): нг/мл мкМ |
1602±425 8,9±2,4 |
492±161 2,7±0,9 |
211±93 1,2±0,5 |
| T½, ч | 15 | 2,51±1,84 | 3,94±2,41 |
Как выявлено, отсутствие соответствующей стабилизации GS влияет на доступность активного вещества. Более того, качество препаратов глюкозамина, не производимых «Rottapharm»/«Meda», может быть неоптимальным [32]. Исследование 14 диетических добавок и безрецептурных препаратов глюкозамина показало, что только 1 содержала заявленное количество активного вещества, в то время как другие содержали различные количества в диапазоне от 59 до 138% от указанной на упаковке дозы [32]. Таким образом, только форма pCGS остается стабильной и надежно обеспечивает достаточную концентрацию в плазме крови глюкозамина на уровне, определенном как фармакологически эффективный в снижении IL-1-индуцированной экспрессии ферментов, принимающих участие в деградации хряща в культуре клеток хондроцитов человека [2].
Эффективность
Современное лечение пациентов с ОА основано на контроле первичной боли и потери функции. Множество исследований различного качества были проведены, чтобы определить влияние глюкозамина на боль. В Кокрановском обзоре 25 рандомизированных контролируемых исследований всех форм глюкозамина у 4963 пациентов с OA, ограниченном исследованиями с адекватным сокрытием информации, не удалось показать преимуществ применения глюкозамина в отношении купирования боли [33]. Однако, когда исследования с применением формы pCGS компании «Rottapharm»/«Meda» были проанализированы отдельно, pCGS продемонстрировал лучшие результаты в отношении купирования боли (стандартное среднее отклонение — standardized mean difference [SMD] −1,11; 95% доверительный интервал [ДИ] −1,66… −0,57) и функции (индекс Лекена (Lequesne) SMD −0,47; 95% ДИ −0,82… −0,12) по сравнению с плацебо. С другой стороны, в ходе анализа тех исследований, в которых применяли формы глюкозамина других производителей, кроме компании «Rottapharm», не был показан статистически достоверный эффект в отношении боли или функции [33].
Возможным объяснением отличий в эффективности, выявленных между различными формами глюкозамина, могут быть плохое качество некоторых исследований, включенных в метаанализы, и потенциальный риск необъективности, которые могли исказить результаты. Кокрановский обзор показал превосходство формы pCGS производства «Rottapharm»/«Meda» в отношении купирования боли при ОА, но с высокой гетерогенностью между исследованиями (I=92%) [33]. Одним из решений в этом случае является фокусирование только на высококачественных исследованиях эффективности применения глюкозамина. Анализ подгрупп 3 основных исследований в Кокрановском обзоре показал, что pCGS статистически достоверно превосходит плацебо в аспекте купирования боли по шкале Western Ontario and McMaster Universities Osteoarthritis Index (WOMAC) (SMD −0,17; 95% ДИ −0,32… −0,01; р=0,037) с нулевой гетерогенностью между исследованиями [33].
P. Eriksen и коллеги провели стратифицированный метаанализ с целью рассмотреть потенциальный риск необъективности, связанной с неудовлетворительной обработкой данных, то есть во время рандомизации, сокрытия порядка распределения и статистического анализа [34]. Они выявили, что только 8 исследований соответствуют стандарту для «низкого риска необъективности». Этот анализ подтвердил, что 5 исследований, в которых изучали бренды, не принадлежащие «Rottapharm»/«Meda», даже с «низким риском необъективности» показали статистически не достоверный эффект в отношении снижения выраженности боли (0,02; 95% ДИ от −0,08…0,12). В противоположность этому анализ 3 исследований с «низким риском необъективности», в которых изучался pCGS компании «Rottapharm»/«Meda», подтвердил уменьшение выраженности боли с размером эффекта (effect size) 0,27 (95% ДИ −0,43…−0,12) [3, 4, 34, 35]. Этот недавний вывод находится в полном согласии с более ранним анализом тех же 3 исследований pCGS, оцененный как самый высококачественный по показателю шкалы качества Ядада (Jadad quality score) для клинических исследований [36, 37]. При отсутствии необъективности под воздействием промышленности некоторые другие факторы могут объяснить разницу в эффективности, наблюдаемой между качеством клинических исследований форм глюкозамина. Превосходство pCGS может быть объяснено уникальной стабилизированной формой глюкозамина, режимом дозирования 1500 мг 1 раз в сутки и высокой биодоступностью, что позволяет достигать более высокой концентрации глюкозамина в плазме крови по сравнению с другими формами [12].
Влияние применения pCGS на другие симптомы продемонстрировано в дальнейшем анализе результатов 3 основных исследований со статистически достоверным эффектом по шкале WOMAC в целом, относительно боли и функции в частности, а также индекса Лекена, с полным отсутствием неоднородности (рис. 3) [36].
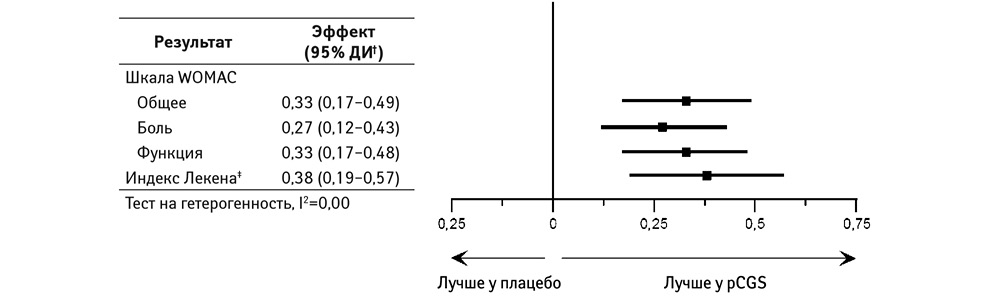
Эффект при применении pCGS в отношении уменьшения выраженности боли можно рассматривать как умеренный при 0,27. Тем не менее следует отметить, что pCGS имеет больший эффект в отношении уменьшения боли, чем парацетамол (с размером эффекта 0,14; 95% ДИ 0,05–0,22) [38], который по-прежнему может быть использован в качестве первой линии спасательной анальгезии при ОА [1]. Кроме того, эффект при приеме pCGS на выраженность боли при применении в течение от 6 мес до 3 лет эквивалентен таковому при применении пероральных неселективных или ЦОГ-2-селективных нестероидных противовоспалительных препаратов (НПВП), который составляет 0,29 (95% ДИ 0,22–0,35) для более коротких курсов лечения [39], рекомендуемых в качестве второго шага при назначении лечения у пациентов с ОА, постоянно испытывающих симптомы заболевания [1]. Было бы желательным иметь в своем распоряжении методы лечения ОА, обеспечивающие более чем умеренный эффект. Тем не менее некоторые меры могут действительно обеспечить такую надежную и последовательную эффективность.
Безопасность
Для всех видов лечения соотношение риска и пользы должно быть рассмотрено до назначения. Системные НПВП рекомендуются для периодического или циклического применения из-за опасений по поводу их возможных побочных эффектов в отношении желудочно-кишечного тракта и сердечно-сосудистой системы [1]. Существуют также накопившиеся данные о повышенном риске желудочно-кишечных побочных эффектов при применении парацетамола с повышением уровня печеночных ферментов [38]. С другой стороны, pCGS можно применять безопасно в долгосрочной перспективе с частотой нежелательных явлений, сопоставимой с плацебо [3, 4, 33, 35].
Болезнь-модифицирующие эффекты
Доказательства того, что длительное введение pCGS в течение 3 лет приводит к задержке развития изменений структуры сустава, представлены в 2 исследованиях, что предполагает потенциальную пользу от применения pCGS не только в отношении контроля симптомов, когда его назначают в начале алгоритма лечения. Измерение ширины межсуставного пространства (joint space width — JSW) в начале исследования и после 3 лет лечения в 2 исследованиях применения pCGS по сравнению с плацебо демонстрирует уменьшение сужения суставной щели (JSN) при приеме pCGS. В одном исследовании показана статистически достоверная разница по показателю JSN — 0,33 мм (95% ДИ 0,12–0,54) при приеме pCGS по сравнению с плацебо через 3 года приема (р=0,003) [3]. Во втором исследовании продемонстрировано, что лечение pCGS в течение 3 лет позволяет полностью предотвратить сужение межсуставной щели (JSN +0,04 мм; 95% ДИ −0,06…0,14; р=0,001) (табл. 2) [4]. Следует отметить, что в этих исследованиях использовали радиологическую технику, которая сегодня больше не рассматривается как ультрасовременная (хотя такой она была в то время, когда проводились эти исследования). Тем не менее после специального анализа этих результатов показано, что не было никакой необъективности, связанной с положением пациента или радиологического угла обзора, таким образом подтверждая обоснованность этих результатов [40].
в течение 3 лет лечения (адаптировано из: Reginster J.Y. et al., 2001 [3] и Pavelka K. et al., 2002 [4])
| Reginster J.Y. et al., 2001 [3] | Плацебо (n=106) | pCGS (n=106) | Разница | Значение p |
|---|---|---|---|---|
| Размер межсуставной щели при включении, мм (среднее ±SD) | 3,95±1,24 | 3,82±1,32 | − | − |
| Размер межсуставной щели через 3 года, мм (среднее и 95% ДИ) | −0,40 (−0,56… −0,24) |
−0,07 (−0,22… 0,07) |
0,33 (0,12–0,54) |
0,003 |
| Pavelka K. et al., 2002 [4] | Плацебо (n=101) | pCGS (n=101) |
Разница | Значение p |
| Размер межсуставной щели при включении, мм (среднее ±SD) | 3,63±1,57 | 3,89±1,48 | − | − |
| Размер межсуставной щели через 3 года, мм (среднее и 95% ДИ) | −0,19 (−0,29… −0,09) |
+0,04 (−0,06… 0,14) |
0,23 (0,09–0,37) |
0,001 |
SD — стандартное отклонение.
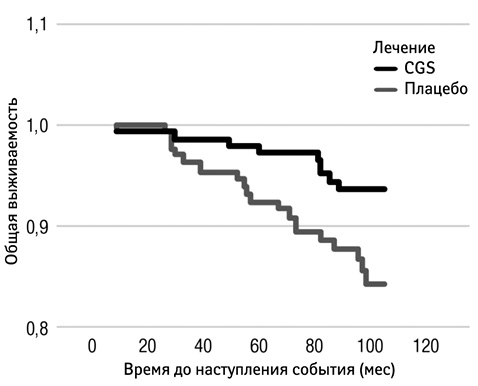
Отсутствие прогрессии JSN (определяется при пороге 0,5 мм [>0,3–0,7 мм]) показало прогностическое значение >90% относительно отсутствия необходимости в проведении хирургической замены сустава [41]. В обоих исследованиях у меньшего количества пациентов, применявших pCGS, отмечали пороговое тяжелое JSN (>0,5 мм) по сравнению с пациентами, получавшими плацебо: 15% против 30% (р=0,013) [3] и 5% против 14% (р=0,05) [4]. При длительном наблюдении за пациентами с ОА коленного сустава, которые принимали участие в двух 3-летних исследованиях применения pCGS и получали лечение в течение по крайней мере 12 мес, продемонстрировано, что согласно результатам ретроспективного анализа, полное эндопротезирование проводили в 2 раза чаще у пациентов из группы плацебо (14,5%) за 5 лет наблюдения по сравнению с теми пациентами, которые ранее применяли pCGS (6,3%; р=0,024), что демонстрирует снижение риска проведения полного эндопротезирования при приеме pCGS на 57% (относительный риск 0,43; 95% ДИ 0,20–0,92) [42]. Лечение pCGS статистически достоверно отсрочивает необходимость проведения операции полного эндопротезирования (р=0,026) (рис. 4) [42].
Фармакоэкономика
Оценка экономической эффективности лечения и влияния на бюджеты здравоохранения приобретает все большее значение. Экономическая оценка позволяет проводить сравнение различных стратегий с точки зрения затрат (затраты на вмешательство и расходы, связанные с заболеванием) и последствий, например количества качественных лет жизни, которые получил пациент в результате лечения (quality-adjusted life years — QALYs). Показано, что лечение pCGS в течение 6 мес является экономически эффективной терапией по сравнению с парацетамолом и плацебо при лечении ОА коленного сустава по показателю коэффициента эффективности дополнительных затрат (incremental cost-effectiveness ratio — ICER) [35, 43]. Кроме того, системный обзор и экономическая оценка определили, что добавочная стоимость из расчета на QALY при добавлении GS к текущему лечению в течение всей жизни пациента составляет около 21 335 фунтов стерлингов [44]. Анализ чувствительности позволил определить, что экономическая эффективность терапии с применением GS частично зависит от прироста качества жизни, изменения вероятности полного эндопротезирования коленного сустава и ставки дисконтирования.
Продолжительная терапия с применением pCGS способствует сокращению приема других сопутствующих лекарственных средств, применяющихся при ОА, а также уменьшению количества консультаций у специалистов здравоохранения и обследований, что отмечено при длительном наблюдении за пациентами с ОА [42]. Подгруппа пациентов, которые ранее принимали участие в рандомизированном исследовании, продолжили дальнейшее наблюдение в клинике, в ходе которого была рассчитана общая средняя стоимость ОА-связанных ресурсов в год, которая была примерно в 2 раза ниже для тех пациентов, которые получали pCGS, по сравнению с получавшими плацебо (292 евро по сравнению с 605 евро; p=0,024) (табл. 3). Общая стоимость препаратов для лечения ОА, принятых в группе плацебо (включая анальгетики и НПВП), была почти вдвое выше, чем в группе, получавшей pCGS (204 евро для группы плацебо по сравнению 108 евро для группы pCGS). Кроме того, количество визитов к специалистам, врачам общей практики и парамедикам, а также количество обследований (рентгенограммы, гастроскопии и не связанные с ОА обследования) было больше в группе плацебо по сравнению с пациентами, получавшими pCGS [42].
которые получали pCGS («Rottapharm»/«Meda») в течение 5 лет, по сравнению с плацебо
(адаптировано из: Bruyère O. et al., 2008 [42])
| Средние расходы, евро (доллары США)* | Плацебо (n=43) | pCGS (n=58) |
|---|---|---|
| Стоимость анальгетиков | 59 (77) | 19 (25) |
| Стоимость НПВП | 116 (151) | 63 (82) |
| Общая стоимость препаратов для лечения ОА (включая анальгетики, НПВП и т.д.) | 204 (265) | 108 (140) |
| Количество визитов к специалисту, среднее (SE) | 2,1 (0,5) | 1,8 (0,3) |
| Количество визитов к парамедику по поводу ОА | 17,4 (6,3) | 6,6 (2,0) |
| Количество рентгенограмм по поводу ОА | 0,60 (0,14) | 0,44 (0,09) |
| Количество гастроскопий | 0,30 (0,07) | 0,10 (0,04) |
| Общие затраты, рассчитанные для ОА-связанных ресурсов | 605 (786) | 292 (380) |
*1 евро = примерно 1,3 долл. США (2007). Общий расчет стоимости включает в себя расходы на посещение парамедиков, обследования (рентгенограммы, гастроскопии) и на лечение (анальгетики, НПВП и т.д.); р=0,024 по сравнению с плацебо.
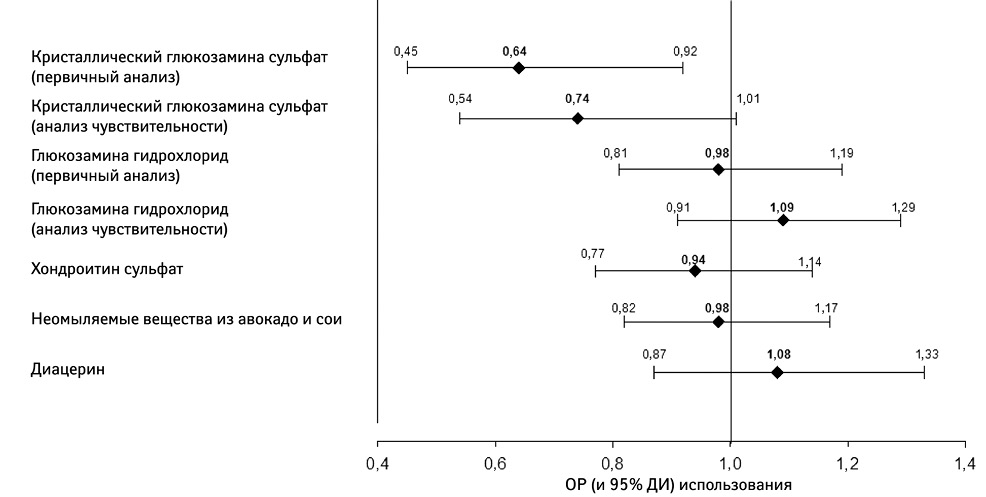
Дальнейшие доказательства снижения потребности в обезболивании при непрерывном приеме pCGS получены в ходе недавнего исследования, которое является репрезентативным для всех пациентов с ОА в повседневной жизни. Исследование Pharmaco-Epidemiology of GonArthroSis (PEGASus) проведено французскими органами здравоохранения в сотрудничестве с группой французских ревматологов и эпидемиологов; основная цель исследования состояла в том, чтобы оценить влияние SYSADOA на применение НПВП [45]. В исследовании PEGASus принимали участие взрослые пациенты с ОА коленного и/или тазобедренного сустава, обратившиеся за консультацией к ревматологу или врачу общей практики по поводу обострения симптоматики заболевания. Они получали лечение SYSADOA в соответствии с выбором врача или пациента. В период до 24 мес наблюдения разрешено переключение, продолжение или прекращение лечения с помощью SYSADOA. Среди всех SYSADOA, в том числе GH, CS, неомыляемых веществ из авокадо и сои, диацереина, при первичном анализе только прием pCGS позволял достичь статистически достоверного снижения применения НПВП на 36% (отношение рисков [ОР] 0,64; 95% ДИ 0,45–0,92) (рис. 5). Сокращение применения НПВП было еще больше с приближением к 50% в контексте рассмотрения пациентов, получавших лечение pCGS >4 мес (ОР 0,52; 95% ДИ 0,28–0,95) [45]. Можно ожидать, что аналогичные результаты в поддержку экономической эффективности pCGS будут показаны и в других странах, несмотря на различия финансирования систем здравоохранения.
Обсуждение
Алгоритм лечения, разработанный ESCEO для пациентов с ОА коленного сустава, рекомендует лечение с постоянным приемом SYSADOA, в частности pCGS («Rottapharm»/«Meda») и рецептурного CS в качестве первой линии терапии для средне- и долгосрочного контроля медленно прогрессирующих симптомов ОА [1]. Руководство ESCEO признает, что глюкозамин доступен во многих формах, но еще не все формы глюкозамина обеспечивают эквивалентный эффект. Таким образом, рабочая группа ESCEO рекомендует отличать форму pCGS («Rottapharm»/«Meda») от других препаратов глюкозамина из-за отчетливых различий в доказательной базе [1].
В этой статье мы изложили доказательства различий между pCGS и другими формами глюкозамина. Публикация данного обзора служит для обучения и информирования врачей о наличии такой разницы; тем не менее мы понимаем, что обучение пациентов является одним из важнейших элементов успешного управления заболеванием. Алгоритм ESCEO наряду с другими руководствами рекомендует основной набор первоначальных мер, которые должны быть предприняты в отношении каждого пациента с ОА, в том числе доступ к информации и образованию, уменьшение массы тела (в случае ее избыточности) и соответствующая программа упражнений [1]. Пациент должен быть проинформирован о том, что в то время как ОА еще не может быть вылечен, с помощью правильного применения соответствующих препаратов может быть достигнуто уменьшение выраженности симптомов и контроль прогрессирования заболевания. Информирование пациента о наличии разницы между pCGS и многими другими широко доступными формами глюкозамина поможет обеспечить приверженность лечению с целью правильной подготовки и максимизации результатов лечения.
Механистические исследования подтверждают роль pCGS как симптом- и структурно-модифицирующего агента при ОА, которая осуществляется посредством глюкозамин-индуцированного обратного эффекта в отношении провоспалительных и сустав-дегенеративных эффектов IL-1. В частности, pCGS ингибирует IL-1-индуцированную экспрессию генов белков, участвующих в патофизиологии воспаления суставов и разрушения ткани при концентрации в плазме 10 мкМ. Только форма pCGS («Rottapharm»/«Meda»), обладая высокой биодоступностью при приеме 1 раз в сутки в дозе 1500 мг, позволяет достичь уровня около 10 мкМ в плазме крови, необходимого для получения терапевтического эффекта.
Рандомизированные контролируемые исследования и метаанализы последовательно показывают умеренный эффект в отношении выраженности боли при применении pCGS, который составляет 0,27, что выше, чем у парацетамола (0,14) (его рассматривают как золотой стандарт обезболивающего препарата первой линии терапии), и сравним с эффектом системных НПВП — 0,29. Для сравнения в ходе рандомизированных исследований и метаанализов неоднократно продемонстрировано, что выраженность эффекта по отношению к выраженности боли при применении некристаллической формы GS и GH равна нулю [33].
Выводы
Целями при лечении ОА являются уменьшение выраженности симптомов и замедление прогрессирования для замедления в конечном итоге развития болезни, что может в свою очередь снизить влияние ОА на свободу передвижения и качество жизни пациента, а также привести к сокращению потребности в применении анальгетиков и проведении хирургического вмешательства в связи с эндопротезированием сустава в долгосрочной перспективе с последующим сокращением потребности в ресурсах здравоохранения [46]. Наряду с умеренным влиянием на выраженность боли существуют доказательства того, что длительное применение pCGS может иметь болезнь-модифицирующие эффекты, позволяя отсрочить развитие изменений сустава и снижая потребность в хирургическом вмешательстве по замене коленного сустава.
Кроме того, фармакоэкономические исследования в реальной жизни демонстрируют долгосрочное снижение необходимости в обезболивающих средствах и НПВП при применении pCGS в течение 12 мес со статистически достоверным сокращением расходов, связанных с приемом лекарств, консультациями медицинских специалистов и обследованиями. Следовательно, назначение пациентам форм глюкозамина (сульфата или гидрохлорида), не производимых компанией «Rottapharm»/«Meda», от которых не ожидается какой-либо клинической пользы, может рассматриваться как неэтичное, а с социально-экономической точки зрения — как напрасная трата экономических ресурсов в отношении и прямых расходов на лекарства, и более широкого использования ресурсов систем здравоохранения. Таким образом, форма pCGS («Rottapharm»/«Meda») в дозе 1500 мг 1 раз в сутки является логичным выбором с целью максимизировать положительные клинические результаты у пациентов с ОА и продемонстрировать среднесрочный контроль боли и длительное воздействие на прогрессирование заболевания.
Список использованной литературы
- 1. Bruyere O., Cooper C., Pelletier J.P. et al. (2014) An algorithm recommendation for the management of knee osteoarthritis in Europe and internationally: a report from a task force of the European Society for Clinical and Economic Aspects of Osteoporosis and Osteoarthritis (ESCEO). Semin. Arthritis Rheum., 44: 253–263.
- 2. Chiusaroli R., Piepoli T., Zanelli T. et al. (2011) Experimental pharmacology of glucosamine sulfate. Int. J. Rheumatol., 2011: 939265.
- 3. Reginster J.Y., Deroisy R., Rovati L.C. et al. (2001) Long-term effects of glucosamine sulphate on osteoarthritis progression: a randomised, placebo-controlled clinical trial. Lancet, 357: 251–256.
- 4. Pavelka K., Gatterova J., Olejarova M. et al. (2002) Glucosamine sulfate use and delay of progression of knee osteoarthritis: a 3-year, randomized, placebo-controlled, double-blind study. Arch. Intern. Med., 162: 2113–2123.
- 5. Jordan K.M., Arden N.K., Doherty M. et al. (2003) EULAR Recommendations 2003: an evidence based approach to the management of knee osteoarthritis: Report of a Task Force of the Standing Committee for International Clinical Studies Including Therapeutic Trials (ESCISIT). Ann. Rheum. Dis., 62: 1145–1155.
- 6. Hochberg M.C., Altman R.D., April K.T. et al. (2012)American College of Rheumatology 2012 recommendations for the use of nonpharmacologic and pharmacologic therapies in osteoarthritis of the hand, hip, and knee. Arthritis Care Res., 64: 465–744.
- 7. Jevsevar D.S. (2013) Treatment of osteoarthritis of the knee: evidence-based guideline, 2 edition. J. Am. Acad. Orthop. Surg., 21: 571–576.
- 8. McAlindon T.E., Bannuru R.R., Sullivan M.C. et al. (2014)OARSI guidelines for the non-surgical management of knee osteoarthritis. Osteoarthritis Cartilage, 22: 363–388.
- 9. Reginster J.Y., Cooper C., Hochberg M. et al. (2015) Comments on the discordant recommendations for the use of symptomatic slow-acting drugs in knee osteoarthritis. Curr. Med. Res. Opin., 31: 1041–1045.
- 10. Cutolo M., Berenbaum F., Hochberg M. et al. (2014) Commentary on recent therapeutic guidelines for osteoarthritis. Semin. Arthritis Rheum., 44: 611–617.
- 11. De Wan M., Volpi G., inventors; Rottapharm, assignee (1998) Method of preparing mixed glucosamine salts. USA patent 5, 847: 107.
- 12. Altman R.D. (2009) Glucosamine therapy for knee osteoarthritis: pharmacokinetic considerations. Expert. Rev. Clin. Pharmacol., 2: 359–371.
- 13. Marcucci G., Zimran A., Bembi B. et al. (2014) Gaucher disease and bone manifestations. Calcif. Tissue Int., 95: 477–494.
- 14. Kanis J.A., Rizzoli R., Cooper C., Reginster J.Y. (2014) Challenges for the development of bone-forming agents in Europe. Calcif. Tissue Int., 94: 469–473.
- 15. Hamerman D. (1989) The biology of osteoarthritis. N. Engl. J. Med., 320: 1322–1330.
- 16. Rovati L.C., Girolami F., Persiani S. (2012) Crystalline glucosamine sulfate in the management of knee osteoarthritis: efficacy, safety, and pharmacokinetic properties. Ther. Adv. Musculoskelet. Dis., 4: 167–180.
- 17. Reginster J.Y., Neuprez A., Lecart M.P. et al. (2012) Role of glucosamine in the treatment for osteoarthritis. Rheumatol. Int., 32: 2959–2967.
- 18. Largo R., Alvarez-Soria M.A., Diez-Ortego I. et al. (2003) Glucosamine inhibits IL-1beta-induced NFkappaB activation in human osteoarthritic chondrocytes. Osteoarthritis Cartilage, 11: 29–28.
- 19. Gouze J.N., Bianchi A., Becuwe P. et al. (2002) Glucosamine modulates IL-1-induced activation of rat chondrocytes at a receptor level, and by inhibiting the NF-kappa B pathway. FEBS Lett., 510: 166–170.
- 20. Chan P.S., Caron J.P., Rosa G.J., Orth M.W. (2005) Glucosamine and chondroitin sulfate regulate gene expression and synthesis of nitric oxide and prostaglandin E(2) in articular cartilage explants. Osteoarthritis Cartilage, 13: 387–394.
- 21. Taniguchi S., Ryu J., Seki M. et al. (2012) Long-term oral administration of glucosamine or chondroitin sulfate reduces destruction of cartilage and up-regulation of MMP-3 mRNA in a model of spontaneous osteoarthritis in Hartley guinea pigs. J. Orthop. Res., 30: 673–678.
- 22. Uitterlinden E.J., Jahr H., Koevoet J.L. et al. (2006) Glucosamine decreases expression of anabolic and catabolic genes in human osteoarthritic cartilage explants. Osteoarthritis Cartilage, 14: 250–257.
- 23. Hoffer L.J., Kaplan L.N., Hamadeh M.J. et al. (2001) Sulfate could mediate the therapeutic effect of glucosamine sulfate. Metabolism, 50: 767–770.
- 24. Cordoba F., Nimni M.E. (2003) Chondroitin sulfate and other sulfate containing chondroprotective agents may exhibit their effects by overcoming a deficiency of sulfur amino acids. Osteoarthritis Cartilage, 11: 228–230.
- 25. Altman R.D., Cheung H. (2001) Glucosamine sulfate on cartilage: lapine study. Arthritis Rheumat., 44: 1535.
- 26. Wen Z.H., Tang C.C., Chang Y.C. et al. (2010) Glucosamine sulfate reduces experimental osteoarthritis and nociception in rats: association with changes of mitogen-activated protein kinase in chondrocytes. Osteoarthritis Cartilage, 18: 1192–1202.
- 27. Mason R.M., Chambers M.G., Flannelly J. et al. (2001) The STR/ort mouse and its use as a model of osteoarthritis. Osteoarthritis Cartilage, 9: 85–91.
- 28. Persiani S., Roda E., Rovati L.C. et al. (2005) Glucosamine oral bioavailability and plasma pharmacokinetics after increasing doses of crystalline glucosamine sulfate in man. Osteoarthritis Cartilage, 13: 1041–1049.
- 29. Jackson C.G., Plaas A.H., Sandy J.D. et al. (2010) The human pharmacokinetics of oral ingestion of glucosamine and chondroitin sulfate taken separately or in combination. Osteoarthritis Cartilage, 18: 297–302.
- 30. Clegg D.O., Reda D.J., Harris C.L. et al. (2006) Glucosamine, chondroitin sulfate, and the two in combination for painful knee osteoarthritis. N. Engl. J. Med., 354: 795–808.
- 31. Persiani S., Rotini R., Trisolino G. et al. (2007) Synovial and plasma glucosamine concentrations in osteoarthritic patients following oral crystalline glucosamine sulphate at therapeutic dose. Osteoarthritis Cartilage, 15: 764–772.
- 32. Russell A.S., Aghazadeh-Habashi A., Jamali F. (2002) Active ingredient consistency of commercially available glucosamine sulfate products. J. Rheumatol., 29: 2407–2409.
- 33. Towheed T.E., Maxwell L., Anastassiades T.P. et al. (2009)Glucosamine therapy for treating osteoarthritis. Cochrane Database Syst. Rev., CD002946.
- 34. Eriksen P., Bartels E.M., Altman R.D. et al. (2014) Risk of bias and brand explain the observed inconsistency in trials on glucosamine for symptomatic relief of osteoarthritis: a meta-analysis of placebo-controlled trials. Arthritis Care Res. (Hoboken), 66: 1844–1855.
- 35. Herrero-Beaumont G., Ivorra J.A., Del Carmen Trabado M. et al. (2007) Glucosamine sulfate in the treatment of knee osteoarthritis symptoms: a randomized, double-blind, placebo-controlled study using acetaminophen as a side comparator. Arthritis Rheum., 56: 555–567.
- 36. Reginster J.Y. (2007) The efficacy of glucosamine sulfate in osteoarthritis: financial and nonfinancial conflict of interest. Arthritis Rheum., 56: 2105–2110.
- 37. Jadad A.R., Moore R.A., Carroll D. et al. (1996) Assessing the quality of reports of randomized clinical trials: is blinding necessary? Control Clin. Trials, 17: 1–12.
- 38. Zhang W., Nuki G., Moskowitz R.W. et al. (2010) OARSI recommendations for the management of hip and knee osteoarthritis: part III: Changes in evidence following systematic cumulative update of research published through January 2009. Osteoarthritis Cartilage, 18: 476–499.
- 39. Bjordal J.M., Klovning A., Ljunggren A.E., Slordal L. (2007) Short-term efficacy of pharmacotherapeutic interventions in osteoarthritic knee pain: A meta-analysis of randomised placebo-controlled trials. Eur. J. Pain, 11: 125–138.
- 40. Pavelka K., Bruyere O., Rovati L.C. et al. (2003) Relief in mild-to-moderate pain is not a confounder in joint space narrowing assessment of full extension knee radiographs in recent osteoarthritis structure-modifying drug trials. Osteoarthritis Cartilage, 11: 730–737.
- 41. Altman R.D., Abadie E., Avouac B. et al. (2005) Total joint replacement of hip or knee as an outcome measure for structure modifying trials in osteoarthritis. Osteoarthritis Cartilage, 13: 13–19.
- 42. Bruyere O., Pavelka K., Rovati L.C. et al. (2008) Total joint replacement after glucosamine sulphate treatment in knee osteoarthritis: results of a mean 8-year observation of patients from two previous 3-year, randomised, placebo-controlled trials. Osteoarthritis Cartilage, 16: 254–260.
- 43. Scholtissen S., Bruyere O., Neuprez A. et al. (2010) Glucosamine sulphate in the treatment of knee osteoarthritis: cost-effectiveness comparison with paracetamol. Int. J. Clin. Pract., 64: 756–762.
- 44. Black C., Clar C., Henderson R. et al. (2009) The clinical effectiveness of glucosamine and chondroitin supplements in slowing or arresting progression of osteoarthritis of the knee: a systematic review and economic evaluation. Health Technol. Assess, 13: 1–148.
- 45. Rovati L.C., Girolami F., D’Amato M., Giacovelli G. (2015) Effects of glucosamine sulfate on the use of rescue non-steroidal anti-inflammatory drugs in knee osteoarthritis: results from the Pharmaco-Epidemiology of GonArthroSis (PEGASus) study. Semin Arthritis Rheum., published online 29 Oct 2015; doi: http://dx.doi.org/10.1016/j.semarthrit.2015.10.009.
- 46. Cooper C., Adachi J.D., Bardin T. et al. (2013) How to define responders in osteoarthritis. Curr. Med. Res. Opin., 29: 719–729.

Leave a comment