Ефективність системної ензимної терапії в корекції обмінних порушень та функціонального стану периферичних артерій у пацієнтів із метаболічним синдромом в поєднанні з остеоартрозом
Резюме. У статті наведено дані дослідження ефективності препарату системної ензимотерапії (СЕТ) у запобіганні розвитку та прогресуванню метаболічних порушень, а також функціональних змін периферичних артерій у хворих із метаболічним синдром у поєднанні з остеоартрозом. У результаті проведеного дослідження виявлено, що у цих хворих спостерігається підвищена активність системного запалення, порушення ліпідного та вуглеводного обмінів, підвищена атерогенність плазми крові, а також ознаки ендотеліальної дисфункції плечової артерії порівняно зі здоровими особами. Застосування препарату СЕТ протягом 6 міс характеризувалося зниженням активності запального процесу, зменшенням гіперглікемії та дисліпідемії, нормалізацією атерогенності плазми крові, про що свідчило зниження вмісту С-реактивного протеїну у крові, концентрації глюкози та глікозильованого гемоглобіну, рівня тригліцеридів, зниження співвідношення тригліцеридів/ліпопротеїнів високої щільності та кількості модифікованих ліпопротеїнів. Крім того, встановлено відновлення функціонального стану ендотелію на макро- та мікросудинному рівнях, що визначали за зростанням вираженості вазодилатації плечової артерії та збільшенням приросту кровотоку при проведенні проби з реактивною гіперемією.
В останні десятиліття в науковій та клінічній практиці набуло широкого використання поняття «коморбідність», суть якого полягає не просто в поєднанні декількох хвороб, а передбачає наявність нових механізмів їх розвитку, додаткової клінічної картини, ускладнень та перебігу, не властивих основній хворобі, а також суттєвий вплив на якість і тривалість життя [1]. Перебіг коморбідності буває за типом «синтропії» — ураження органів та їх систем спільними патогенетичними механізмами або ж за типом «інтерференції» — потенціюючого впливу одного захворювання на розвиток іншого. В обох випадках коморбідними захворюваннями вважають порушення, поєднання яких відбувається найчастіше, які характеризуються певними спільними етіопатогенетичними чинниками [2].
Серед поширених та значимих коморбідних станів вітчизняні та зарубіжні вчені виділяють проблему поєднання кардіоваскулярної патології та ураження опорно-рухового апарату, зокрема остеоартрозу (ОА) [13]. Так, R. Lawrence, згідно з даними звіту NHEFS із 1982 по 1984 р., вивчив смертність у хворих із рентгенологічними ознаками ОА колінних суглобів порівняно з особами відповідного віку та статі без ознак ОА. Встановлено, що у досліджуваної категорії хворих серцево-судинна смертність на 15% перевищувала таку в осіб без ураження колінних суглобів. Найбільш значима статистична різниця спостерігалась у жінок віком 55–59 років.
Висока поширеність серцево-судинної патології у хворих на ОА значною мірою може бути зумовлена частим поєднанням у осіб цієї категорії основного захворювання та комплексу факторів кардіоваскулярного ризику, у вигляді метаболічного синдрому (МС). Так, у дослідженні 2009 р. із залученням 7714 хворих на ОА групою вчених із США встановлено зв’язок між наявністю ОА та частотою МС, який був більш вираженим у хворих молодого віку. Отримані в дослідженні дані свідчили, що МС спостерігали у 59% випадків хворих на ОА, в той час, як у досліджуваних без ОА його поширеність становила 23%. Крім того, досліджувані хворі незалежно від статі та раси характеризувалися на 37% вищою частотою артеріальної гіпертензії, на 25% вищою частотою абдомінального ожиріння, на 17% вищою частотою гіперглікемії, більш високим рівнем тригліцеридів (ТГ) та зниженим рівнем ліпопротеїнів високої щільності (ЛПВЩ) порівняно з особами без ознак ОА [12].
До того ж, результати досліджень останніх років демонструють залежність між вираженістю і кількістю компонентів МС та активністю запального процесу в суглобах, незалежно від наявності інших традиційних факторів кардіоваскулярного ризику, зокрема надмірної маси тіла, порушень обміну ліпідів. Так, при проведенні проспективного дослідження «The Framingem Offspring Study» встановлено залежність між наявністю ОА колінного суглоба та поширеністю МС, крім того, виявлено зв’язок між активністю запального процесу та кількістю компонентів МС, який зберігався навіть після врахування індексу маси тіла [11].
Як вважає ряд дослідників, однією з головних причин розвитку та прогресування МС як доклінічної форми ішемічної хвороби серця (ІХС) у осіб із ревматичними захворюваннями суглобів може бути хронічне підвищення активності імунозапальних процесів. На користь такої думки свідчить встановлена в експериментальних та клінічних дослідженнях здатність медіаторів запалення, зокрема — фактора некрозу пухлини (ФНП)-α, інтерлейкінів (ІЛ)-1β, -6, С-реактивного протеїну (СРП), інгібітору активатора тканинного плазміногену-1 та інших — викликати розвиток інсулінорезистентності як патогенетичної основи МС, з усім каскадом пов’язаних із ним метаболічних, структурних та коагуляційних порушень [8]. Пригнічення передачі інсулінового сигналу в умовах прозапального статусу реалізується як прямим впливом медіаторів запалення на інсуліновий рецептор, так і опосередковано — через активацію ліполізу в периферичних тканинах із подальшим зростанням концентрації вільних жирних кислот і зниженням чутливості зрілих адипоцитів до інсуліну [10, 14].
Підвищений рівень циркулюючих медіаторів запалення має безпосереднє відношення до формування атерогенного профілю ліпідів крові. Під їх дією активується ліпогенез у печінці та пригнічується активність ліпопротеїнової ліпази, що призводить до розвитку значної гіпертригліцеридемії та підвищення секреції білка апо-В, вміст якого у крові прямо відображає кількість високоатерогенних дрібних щільних часток. Крім того, в умовах підвищеної активності запального процесу відбувається заміщення ефірів холестерину (ХС) у ЛПВЩ на ТГ, зниження синтезу білка апо-А1, його вмісту в складі ЛПВЩ, з подальшою втратою ними антиоксидантних та антиатерогенних функцій.
Прямий зв’язок між вмістом маркерів запалення у плазмі крові та вираженістю компонентів МС був простежений в ряді багатоцентрових популяційних досліджень. В одному з них встановлено чітку зворотну залежність між інсулінорезистентністю та рівнем СРП, підвищення вмісту якого у плазмі крові на 2,7 мг/л поєднувалося зі зростанням ризику розвитку МС на 50% [7]. В іншому дослідженні в рамках Framingham Offspring Study за участю 528 осіб з ожирінням наявність МС реєстрували у 41–61% випадків, у цих же пацієнтів встановлено найвищі показники активності оксидативного стресу та системного запалення. Цей зв’язок зберігав свою силу навіть після врахування індексу маси тіла [15].
Таким чином, поєднання МС та ОА зумовлює необхідність корекції у цих хворих цілого ряду порушень, а саме пригнічення запального процесу, зменшення вираженості больового синдрому в суглобах, корекцію обмінних порушень та зниження кардіоваскулярного ризику, що досягається шляхом застосування цілого ряду медикаментозних препаратів [16]. Проте наявність спільних етіопатогенетичних механізмів передбачає можливість комплексного впливу на перебіг запального процесу в суглобах, активність системного запального процесу, вираженість порушень обміну ліпідів та вуглеводів, а також на атерогенність плазми крові [6].
У практиці лікування при захворюваннях опорно-рухового апарату запального походження широкого застосування набувають препарати системної ензимної терапії (СЕТ). Завдяки вираженим протизапальним, антиоксидантним та імуномодулювальним властивостям їх ефективно застосовують у комбінованих схемах лікування при ОА [3]. Крім того, згідно з даними провідних вітчизняних вчених, препарати СЕТ продемонстрували свій терапевтичний вплив у комбінованому лікуванні при ІХС та в корекції порушень ліпідного спектра крові, що може бути покладено в основу антиатерогенної дії препаратів СЕТ. Таким чином, застосування протизапальної терапії для запобігання розвитку та прогресуванню МС може стати новим дієвим напрямком лікування у хворих із високою активністю системного запалення [9].
Мета дослідження — визначення можливості запобігання прогресуванню МС та його проатерогенній дії у хворих на ОА шляхом пригнічення запального компонента препаратами СЕТ.
Об’єкт і методи дослідження
Нами обстежено 80 пацієнтів із МС у поєднанні з ОА.
У дослідженні МС визначали у пацієнтів згідно з критеріями Консенсусу з діагностики МС 2009 р. (A Joint Interim Statement of the International Diabetes Federation Task Force on Epidemiology and Prevention; National Heart, Lung, and Blood Institute; American Heart Association; World Heart Federation; International Atherosclerosis Society; and International Association for the Study of Obesity) для європейської популяції — за наявності щонайменше 3 із 5 компонентів, серед яких: окружність талії >80 см у жінок та >94 см — у чоловіків, рівень ТГ — ≥1,7 ммоль/л, систолічний артеріальний тиск (АТ) >130 мм рт. ст. та/чи діастолічний АТ >85 мм рт. ст., рівень ХС ЛПВЩ — <1,3 ммоль/л, гіперглікемія натще — рівень глюкози >5,6 ммоль/л [4].
На момент включення в дослідження у хворих установлено діагноз ОА одного або обох колінних суглобів, І–ІІ рентгеногологічної стадії згідно з клінічними критеріями суглобів Американського коледжу ревматології (ACR) та Європейської антиревматичної ліги (EULAR) 2010 р. перегляду [17]. На основі оцінки больового синдрому в колінних суглобах за візуальною аналоговою шкалою (26,3±3,1 мм) та усіх шкал індексу WOMAC (біль — 134,2±10,4 мм, скутість — 37,5±4,1 мм, функція — 470,6±39,9 мм, глобальна — 610,5±58,7 мм) у досліджуваних хворих установлено симптомний перебіг ОА. Середня тривалість захворювання на ОА становила 12,7±1,1 міс.
Хворих розподілили на дві групи: 1-ша група — 37 хворих, які застосовували препарат СЕТ, стандартне лікування при гонартрозі та немедикаментозне лікування, з яких 15 жінок (середній вік — 44,2±3,6 року) та 22 чоловіки (середній вік — 46,1±2,8 року). До 2-ї групи увійшли 43 хворих, які застосовували стандартне лікування при lexapro weight loss гонартрозі та методи немедикаментозного лікування — 20 жінок (середній вік — 48,7±3,9 року) та 23 чоловіки (середній вік — 46,7±4,2 року). Контрольну групу становили 20 здорових осіб зіставного з основними групами віку.
Стандартне лікування при гонартрозі полягало в місцевому застосуванні нестероїдних протизапальних препаратів (пластирі, гелі, мазі), а також прийомі за потребою при больовому синдромі ацетамінафену в максимальній дозі до 4000 мг/добу. Немедикаментозним лікуванням вважали модифікацію способу життя, зменшення маси тіла, лікувальну фізкультуру та дотримання дієти.
Препарат СЕТ призначали у стандартному терапевтичному дозуванні — 3 драже 3 рази на добу, після прийому їжі протягом 6 міс. Обстеження проводили на початку дослідження та в динаміці через 6 міс.
Усім пацієнтам проводили забір венозної крові для оцінки прозапального статусу за допомогою визначення рівня СРП, активності моноцитів (МЦ) за рівнем внутрішньоклітинного малонового діальдегіду (МДА), процесів вільнорадикального окиснення ліпідів (за вмістом МДА у плазмі крові), активності ренін-ангіотензинової системи (шляхом визначення активності ангіотензинперетворювального ферменту (АПФ).
Оцінювали показники обміну вуглеводів за рівнем глюкози натще та рівнем глікозильованого гемоглобіну (HbA1c). Крім того, оцінювали ліпідний обмін, шляхом визначення рівнів ХС, ТГ та основних класів ліпопротеїнів у крові — низької (ЛПНЩ), дуже низької щільності (ЛПДНЩ) та ЛПВЩ, а також проводили розрахунок співвідношення ТГ/ХС ЛПВЩ.
Атерогенність плазми крові визначали за вмістом ХС та ТГ у мишачих макрофагах (ММ), що відображало вміст модифікованих ЛПНЩ та ЛПДНЩ відповідно. Здатність модифікованих ліпопротеїнів виступати в якості аутоантигенів оцінювали за вмістом ХС та ТГ у циркулюючих імунних комплексах (ЦІК).
Допплерівське обстеження периферичних судин проводили на апараті «Imagic-5000» («KontronMedical», Франція), за допомогою лінійного датчика 7 МГц у триплексному режимі (В-режим, кольорове допплерівське картування потоку, спектральний аналіз допплерівського зсуву частот).
Для оцінки ендотеліального механізму регуляції судинного тонусу використовували пробу потікзалежної (ендотелійзалежної) вазодилатації. Пробу проводили на плечовій артерії (ПА) на 2–5 см вище ліктьової впадини з вимірюванням внутрішньопросвітного діаметра артерії, пікової систолічної швидкості кровотоку (Vps ПА) та кінцево-діастолічної швидкості кровотоку (Ved ПА). Вимірювання проводили первино за 30 с до компресії артерії та повторно через 30 с після 5-хвилинної компресії плеча манжеткою сфігмоманометра. Компресію плеча відтворювали відповідно до методики D. Celermajer: з використанням тиску в середньому 250 мм рт. ст., або такого, що перевищував показник систолічного АТ не менше ніж на 40–50 мм рт. ст. [5], до припинення кровотоку в досліджуваній артерії. Реакцію ендотелію ПА оцінювали як відношення різниці між діаметром у спокої та під час гіперемії до діаметра у спокої (%).
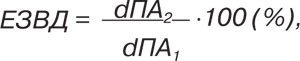
де ЕЗВД — показник ендотелійзалежної вазодилатації; dПА1 — середній діаметр ПА у спокої; dПА2 — середній діаметр ПА після накладання манжети.
Збільшення просвіту ПА на <10% після компресії вважали проявами ендотеліальної дисфункції.
Ступінь дилатації артерії напряму залежить від напруження зсуву на ендотелії, до виникнення якого призводить зміна швидкості току крові в місці дослідження внаслідок декомпресії. Формування гемодинамічного удару відбувається внаслідок впливу багатьох факторів, основними з яких є стан дистального русла (активація метаболічного та біогенного механізмів регуляції), рівень серцевого викиду, показник системного АТ, в’язкість крові. Тому при збереженні ендотеліальної функції ступінь дилатації артерії при реактивній гіперемії може бути різним. Враховуючи складнощі у порівнянні результатів, коли в одних хворих значно зростала швидкість кровотоку та не спостерігалося достовірної зміни діаметра артерії, а в інших — вірогідно менше змінювався діаметр артерії при порівнюваних швидкостях, нами було застосовано уніфікований показник — коефіцієнт чутливості артерії до напруження зсуву на ендотелії, що характеризує її здатність до ендотелійзалежної дилатації.
Напруження зсуву вираховували за формулою:
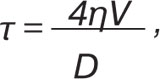
де η — в’язкість крові (у середньому — 0,05 Пз); V — максимальна швидкість кровотоку; D — діаметр артерії.
За цією формулою вираховували напруження зсуву — початкове (τ0) та при реактивній гіперемії (τ1). Знаючи зміну стимулу — напруження зсуву, та відповідну йому зміну діаметра артерії, можна вирахувати чутливість ПА до напруження зсуву (К):
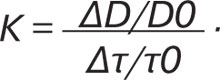
Отримані результати опрацьовували статистично із застосуванням пакета Microsoft Exсel шляхом обчислення середньої арифметичної — М та похибки середньої арифметичної — m. Достовірність різниці показників визначали за допомогою критерію достовірності — р, розрахованого на основі t-критерію Стьюдента. Різницю показників на різних термінах дослідження вважали достовірною при р<0,05. Для виявлення зв’язків між показниками застосовано парний кореляційний аналіз.
Результати та їх обговорення
За результатами обстеження у пацієнтів з ОА та супутнім МС нами виявлено значно більш виражену активність процесів системного запалення та оксидативного стресу порівняно зі здоровими особами (рис. 1). Так, рівень СРП — маркера системного запалення та одного з найважливіших білків гострої фази — у досліджуваних хворих перевищував такий у здорових в 5,6 разу (7,03±0,71 мг/л у хворих із МС в поєднанні з ОА порівняно з 1,25±0,10 мг/л у групі здорових; p<0,001). Крім того, в досліджуваній групі відзначено в 3 рази вищий рівень МДА в циркулюючих МЦ (3,61±0,46 мкмоль/мг білку порівняно 1,21±0,09 мкмоль/мг білка; p<0,001), що свідчило про високу активність МЦ крові.
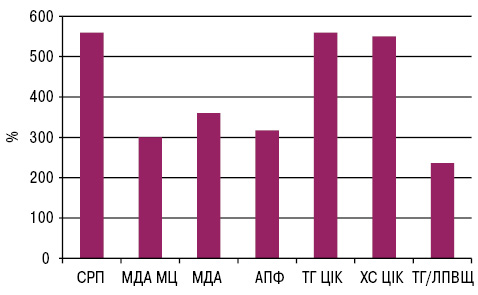
За 0 на графіку взято значення у здорових осіб.
Висока активність системного запалення у цих пацієнтів супроводжувалася наявністю оксидативного стресу, про що свідчили у 3,8 раза вищі концентрації в сироватці МДА — кінцевого продукту вільнорадикального окиснення ліпідів (3,4±0,12 мкмоль/л порівняно з 0,89±0,05 мкмоль/л у групі здорових осіб; p<0,001). Важливим фактором, що визначав інтенсивність запалення та оксидативного стресу у хворих з ОА та супутнім МС, був у 3,17 раза вищий рівень активності АПФ (51,21±2,19 мккат) порівняно з 16,12±2,77 мккат/л у групі здорових (p<0,001).
На фоні прозапального статусу у пацієнтів із МС в поєднанні з ОА спостерігали виражені порушення ліпідного обміну у вигляді атерогенної дисліпідемії, серед ознак якої були на 85% підвищені рівні ТГ та ЛПДНЩ порівняно з показниками у групі здорових осіб (2,65±0,31 та 1,2±0,14 ммоль/л відповідно, порівняно з 1,42±0,09 та 0,65±0,02 ммоль/л відповідно; p<0,001). Ці зміни поєднувалися зі зниженим на 30% рівнем ЛПВЩ у 1-й групі (0,95±0,018 порівняно з 1,36±0,07 у контрольній групі; p<0,001). Крім того, більш високим у групі пацієнтів із МС в поєднанні з ОА був рівень загального ХС (6,51±0,29 ммоль/л порівняно з 5,0±0,22 ммоль/л у групі здорових осіб; p<0,001). Закономірно більшим у досліджуваних пацієнтів було співвідношення ТГ/ЛПВЩ (1,68±0,09 у.о. порівняно з 0,71±0,19 у.о. в контрольній групі; p<0,001). Проатерогенний характер дисліпідемії у хворих із МС підтверджувався на 24% більш високим вмістом апо-В (122,7±3,2 мг/л порівняно з 98,1±3,23 у здорових; р<0,001) та на 40% зниженим вмістом апо-А1 (82,2±3,1 мг/л порівняно з 136,2±7,52 мг/л у здорових осіб; р<0,001).
Окрім кількісних змін ліпопротеїнів крові, відзначено і якісні їх зміни у вигляді атерогенної модифікації. Модифіковані ліпопротеїни виявляли антигенні властивості та викликали розвиток імунної реакції з їх включенням у склад ЦІК, про що свідчили значно вищі концентрації ХС та ТГ у ЦІК. Так, концентрації ХС та ТГ у ЦІК у пацієнтів досліджуваної групи перевищували відповідно в 5,5 та 5,6 раза показники у здорових осіб (70,61±4,09 мг/дл порівняно з 12,8±0,8 мг/дл та 58,0±3,5 мг/дл порівняно з 10,8+0,8 мг/дл відповідно; p<0,001).
Паралельно з високою активністю прозапального статусу і атерогенними змінами ліпідного складу крові у пацієнтів із МС у поєднанні з ОА спостерігалися порушення функціональних властивостей периферичних артерій (рис. 2). Згідно з результатами первинного вимірювання діаметра ПА, достовірних відмінностей між досліджуваними хворими та контрольною групою не виявлено (3,84±0,76 мм порівняно з 3,77±0,69 мм у контрольній групі; р>0,05). При проведенні проби з реактивною гіперемією у групі пацієнтів із МС в поєднанні з ОА відзначали більш низькі показники потікзалежної вазодилатації (5,35±0,34% порівняно з 13,18±0,36% у відносно здорових осіб; p<0,001), а також на 50 та 70% менший приріст Vps та Ved відповідно порівняно з групою контролю, що свідчило про наявність вираженої ендотеліальної дисфункції в ПА та зниження дилататорного резерву в судинах прекапілярного русла. Як результат порушення продукції ендотелієм судини вазоактивних молекул у відповідь на зростання швидкості потоку крові та напруження зсуву в досліджуваній групі коефіцієнт чутливості артерії до напруження зсуву (К) був на 41% нижчим порівняно з контрольною групою (0,052±0,0024 порівняно з 0,084±0,0052; p<0,001).
Застосування препарату СЕТ у досліджуваних хворих асоціювалося зі зниженням активності запального процесу. Так, рівень СРП у плазмі крові знизився на 46% через 6 міс спостереження (від 7,05±0,71 до 3,74±0,50 мг/л; р<0,001), в той час, як у групі осіб, які не отримували СЕТ, рівень СРП був на 31% вищим вихідного значення (р<0,01). Разом з цим у 1-й групі знижувалась і активність МЦ крові, про що свідчило зниження вмісту МДА у МЦ на 32% (від 3,29±0,10 до 2,22±0,08 мкмоль/мг білка; р<0,001). Крім того, закономірним було і зниження інтенсивності вільнорадикальних процесів як основного ефекторного механізму системного запалення: вміст МДА в сироватці крові вірогідно знижувався в кінці 6-го місяця дослідження на 49% (від 2,99±0,24 до1,52±0,1 мкмоль/л; р<0,001). Водночас концентрація сироваткового МДА у 2-й групі при повторному обстеженні перевищувала початкове значення на 12,5% (р<0,05).
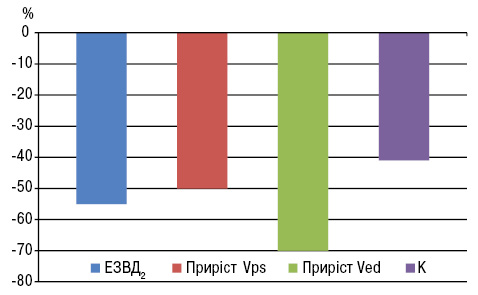
За 0 на графіку взято значення у здорових осіб.
Поряд зі зниженням активності системного запалення та інтенсивності оксидативного стресу, одним із вагомих механізмів протизапальної дії СЕТ було зниження активності АПФ, яка у групі її застосування в кінці дослідження була на 16,8 мккат/л меншою свого вихідного значення (на 33% — від 51,21±2,19 до 34,41±2,71 мккат/л; р<0,001). Водночас у хворих групи порівняння встановлено зростання активності ренін-ангіотензинової системи на 18% (від 41,98±2,18 до 49,49±3,57 мккат/л; р<0,05).
Застосування препарату СЕТ у хворих із МС в поєднанні з ОА, крім вираженого протизапального ефекту, характеризувалося захисним впливом на прогресування ІР. Встановлено, що рівень глюкози у крові у групі СЕТ від вихідного показника вірогідно не відрізнявся (від 6,76±0,27 до 6,18±0,21 ммоль/л в кінці 6-го місяця дослідження; р>0,05). Незважаючи на відсутність значимих змін рівня глюкози в крові, вміст HbA1c у групі застосування СЕТ до кінця 6-го місяця знизився на 0,64 мкмоль фруктози/г Hb (на 12% — від 5,72±0,22 до 5,08±0,20 мкмоль фруктози/г Hb; р<0,05), тоді як у групі порівняння вміст HbA1c вірогідно не змінювався (від 5,90±0,17 до 6,25±0,17мкмоль фруктози/г Hb; р>0,05).
Пригнічення активності запального процесу, інтенсивності вільнорадикальних реакцій та зниження інсулінорезистентності на фоні прийому препарату СЕТ у досліджуваних хворих асоціювалося із захисним впливом препарату на обмін ліпідів, що проявлялось у запобіганні прогресуванню атерогенної дисліпідемії.
Встановлено ефективність препарату СЕТ на зростання рівня ТГ крові, що проявлялося зниженням їх вмісту в плазмі крові до кінця спостереження на 32% (від 2,65±0,31 до1,81±0,16 ммоль/л; р<0,05). Разом з тим у групі порівняння до кінця 6-го місяця дослідження вміст ТГ у крові зростав на 0,44 ммоль/л (на 16% — від 2,75±0,15 до 3,19±0,14 ммоль/л; р<0,05). Аналогічною за вираженістю та вірогідністю в обох групах була динаміка ХС ЛПДНЩ. У групі СЕТ значимого зниження вмісту ХС ЛПНЩ при повторному обстеженні після 6 міс лікування не спостерігалося (від 4,13±0,23 до 3,78±0,32 ммоль/л у кінці 6-го місяця; р>0,05). Рівень загального ХС та ХС ЛПНЩ вірогідно не змінювався і у групі порівняння. Вміст ХС ЛПВЩ у крові відносно його значення на початку дослідження у групі застосування СЕТ (від 0,95±0,02 до 1,02±0,04 ммоль/л у кінці 6-го місяця; р>0,05), як і у групі порівняння (від 0,92±0,02 до 0,93±0,02 ммоль/л у кінці 6-го місяця; р>0,05) вірогідно не відрізнявся. Зниження вираженості дисліпідемії підтверджувалося значним зменшенням в кінці 6-го місяця спостереження співвідношення ТГ/ЛПВЩ у групі лікування СЕТ (на 40% — від 2,79±0,13 до 1,77±0,09; р<0,001) та його зростанням у групі порівняння (на 16% — від 3,0±0,09 до 3,5±0,07; р<0,05).
Крім того, lipitor substitute у хворих, які застосовували лікування СЕТ, установлено значиме зниження рівня апо-В, який при повторному обстеженні був на 20% нижчим свого вихідного значення (від 128,7±4,7 до 103,3±2,5 мг/л; р<0,001), що за відсутності динаміки вмісту ХС ЛПНЩ було важливим свідченням зниження концентрації дрібних щільних часток та зниження атерогенного потенціалу ХС ЛПНЩ. Разом з тим у групі порівняння середній вміст апо-В зріс у кінці 6-го місяця спостереження на 12% (від 116,6±2,2 до 131,3±3,8 мг/л; р<0,05). Разом із пригніченням проатерогенних механізмів на фоні лікування препаратом СЕТ спостерігалось якісне відновлення антиатерогенних властивостей ХС ЛПВЩ, про що свідчило підвищення вмісту апо-А1 (на 34% — від 74,0±2,9 до 99,5±7,5 мг/л; р<0,05), lexapro dosage в той час як у групі порівняння вміст апо-А1 до кінця дослідження, хоча і невірогідно, але знижувався (від 90,5±3,4 до 84,6±2,6 мг/л у кінці 6-го місяця дослідження; р>0,05).
Зниження градації системного запалення, нормалізація вуглеводного та ліпідного обмінів закономірно приводили до пригнічення атерогенності плазми крові та зниження активності модифікації ліпопротеїнів крові. Згідно з отриманими даними, вміст ХС у ММ у кінці 6-го місяця лікування знизився на 32% (від 230,22±8,54 до 156,0±8,3 мкг/мг білка; р<0,001), що відображало активність модифікації ХС ЛПНЩ. Ще більш виражено та вірогідно знижувався вміст ТГ у ММ, показник якого був на 56% (від 220,43±8,55 до 97,0±4,1мкг/мг білка; р<0,001) нижчим вихідного значення на заключному етапі дослідження. Про пригнічення здатності ліпопротеїнів виступати в якості аутоантигенів свідчили більш низькі показники вмісту ХС та особливо — ТГ у ЦІК. Так, рівень ХС в ЦІК через 6 міс становив на 44% нижче початкового рівня (від 58,57±3,25 до 39,8±4,13 мг/дл; р<0,001), тоді як у хворих групи порівняння він вірогідно зростав та перевищував вихідне значення на 15% (р<0,05). Значимо знижувався в групі СЕТ і вміст ТГ у ЦІК, який при повторному обстеженні був на 39% нижчим (від 58,57±3,25 до 35,7±3,0 мг/дл; р<0,01), що було результатом імуномодулювального впливу препарату СЕТ на пригнічення аутоантигенних властивостей ліпопротеїнів. Варто зазначити, що вираженість аутоантигенних властивостей ліпопротеїнів у групі порівняння збільшувалася до кінця дослідження, про що свідчили на 44 та 39% більш високий вміст ХС та ТГ у ЦІК відповідно.
Застосування протизапального лікування у вигляді препарату СЕТ протягом 6 міс на фоні нормалізації запального та метаболічного статусів, а також зниження атерогенності плазми крові приводило у досліджуваних хворих до оптимізації регуляції судиннорухової функції та механізмів опосередкованих функцією ендотелію (рис. 3).
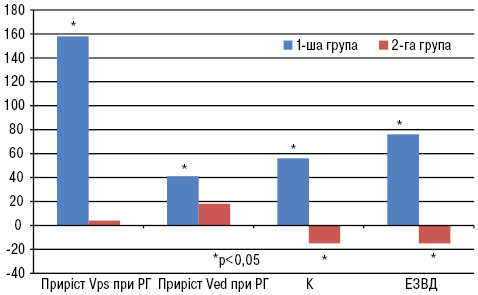
За 0 на графіку взято 100% значення відповідних показників на початку дослідження; РГ — реактивна гіперемія.
Встановлено значний вплив лікування препаратом СЕТ на стан функції ендотелію магістральних судин, що оцінювали за змінами діаметра ПА в умовах проведення манжеткової проби. Так, ЕЗВД ПА у ході реактивної гіперемії хоча і не досягала норми, проте характеризувалася збільшенням на 76% відносно рівня, який спостерігався до початку лікування (від 5,01±0,37 до 8,80±0,94%; р<0,001). Водночас у групі порівняння ендотеліальна дисфункція продовжувала прогресувати, що оцінювали за зниженням ЕЗВД при повторному обстеженні на 15% відносно вихідного значення (від 6,06±0,36 до 5,12±0,27%; р<0,05). Зазначимо, що у групі лікування у 4 осіб спостерігали відновлення ЕЗВД >10%, що дозволяє розцінювати у них функцію ендотелію як нормальну. Ще одним підтвердженням функціональної нормалізації ендотелійзалежних механізмів у групі застосування СЕТ було зростання коефіцієнта чутливості до напруження зсуву на 56% вихідного показника (від 0,052±0,003 до 0,081±0,007; р<0,05).
Крім того, на фоні застосування препарату СЕТ суттєво відновлювалася функція і периферичних судин, про що свідчило збільшення приросту Vps після декомпресії ПА на 158% (від 53,67±1,58 до 99,3±5,06 см/с на початку дослідження та від 61,2±2,34 до 134,5±6,75см/с — на його завершальному етапі; р<0,05) та приросту Ved — на 41% (відповідно від 7,88±0,94 до 11,15±0,92 см/с та від 6,82±0,20 до 8,8±0,9; р<0,05), тоді як у 2-й групі приріст швидкості в ПА підчас реактивної гіперемії вірогідно не змінився.
Значимість хронічного запального процесу в порушенні вазорегулюючої функції ендотелію підтвердилася результатами проведеного парного кореляційного аналізу. Так, встановлена сильна пряма залежність між концентрацією СРП та коефіцієнтом чутливості до напруження зсуву на ендотелії (r=0,89; р<0,01), а також вираженістю потікзалежної вазодилатації (r=0,89; р<0,01). Крім того, встановлено зворотний кореляційний зв’язок між ступенем вазодилатації у пробі з реактивною гіперемією та концентрацією АПФ крові (r=–0,7; р<0,01) і МДА сироватки (r=–0,52; р<0,05). Зв’язків між вираженістю вазодилатації ПА, коефіцієнтом чутливості до напруження зсуву на ендотелії та рівнем загального ХС не встановлено, проте спостерігався зворотний кореляційний зв’язок між вираженістю розширення ПА та концентрацією ХС в ЦІК (r=–0,54; р<0,05) та ТГ у ЦІК (r=–0,6; р<0,05), що підтверджує виражений проатерогенний потенціал та пошкоджувальну дію на ендотелій ліпопротеїнів, модифікованих в умовах системного запалення.
Висновки
1. Хворі з МС у поєднанні з ОА характеризуються підвищеною активністю системного запалення разом із високою інтенсивністю оксидативного стресу, що проявлялося у 5 разів вищим рівнем СРП, у 2,9 раза вищою активністю МЦ, у 3,5 раза вищим вмістом у сироватці крові МДА, а також порушенням обміну глюкози та ліпідів. Поєднання системного запального процесу з метаболічними порушеннями асоціювалося зі значним зростанням атерогенності плазми крові та супроводжувалося зменшенням вираженості ЕЗВД ПА.
2. Лікування препаратом СЕТ у досліджуваних хворих супроводжувалося пригніченням у них активності системного запального процесу та інтенсивності оксидативного стресу, про що свідчило зниження рівня СРП в кінці 6 міс лікування на 46%, активності МЦ — на 32%, активності АПФ — на 33% та інтенсивності оксидативного стресу — на 49%.
3. Застосування препарату СЕТ у досліджуваних хворих протягом 6 міс характеризувалося захисним ефектом щодо метаболізму та частковою нормалізацією обміну вуглеводів. І хоча рівень глюкози крові натще вірогідно не змінився, рівень НbA1c знизився на 12%. Виявлено вплив СЕТ на нормалізацію ліпідного обміну, про що свідчило зниження рівня ТГ у крові на 28%, ХС — на 10% (р>0,05) та співвідношення ТГ/ЛПВЩ на 37%. Крім того, встановлено виражене зниження рівня апо-В (на 20%), що свідчило про зниження концентрації дрібних щільних часток. А також зростання концентрації апо-А1 на 34% як результат відновлення антиатерогенного захисту.
4. Зниження градації системного запалення та нормалізація метаболічного статусу асоціювалися у досліджуваних хворих зі зниженням атерогенності плазми крові. Так, встановлено пригнічення активності модифікації ХС ЛПНЩ та ХС ЛПДНЩ, про що свідчили на 32 та 56% нижчий вміст ХС та ТГ у ММ відповідно. Разом із цим встановлено пригнічення аутоантигенного компонента ліпопротеїнів, що оцінювали за зниженням вмісту ХС та ТГ у ЦІК на 44 та 39% відповідно.
5. Застосування препарату СЕТ у досліджуваних хворих зумовлювало нормалізацію регуляції кровотоку в ПА, що підтверджувалося впливом лікування на функцію ендотелію при проведенні проби з реактивною гіперемією. І хоча ЕЗВД не досягала норми (>10%), проте зростання діаметра ПА було на 76% більшим порівняно з вихідним значенням. Встановлено зростання інтегрального показника — коефіцієнта чутливості до напруження зсуву — на 56%. Про відновлення ендотелійзалежних механізмів на рівні мікроциркуляторного русла свідчило підвищення показника приросту Vps та Ved під час проби з реактивною гіперемією — на 158 та 41% відповідно.
Список використаної літератури
1. Белоусов Ю.В. (2012) Коморбидность при заболеваниях пищеварительной системы. Здоровье ребенка, 1(36): 134–136.
2. Белялов Ф.И. (2011) Лечение внутренних болезней в условиях коморбидности. Иркутск, 305 с.
3. Веремеенко К.Н., Коваленко В.Н. (2000) Системная энзимотерапия. Теоретические основы, опыт клинического применения. МОРИОН, Киев, с. 79–82.
4. Alberti K., Robert H., Scott M. (2009) Harmonizing the metabolic syndrome. Circulation., 120: 1640–1645.
5. Celermajer D.S., Sorensen K.E., Gooch V.M. (1992) Non-invasive detection of endothelial dysfunction in children and adults at risk of atherosclerosis. Lancet, 340: 1111–1115.
6. DeLano F.A., Schmid-Schönbein G.W. (2008) Proteinase activity and receptor cleavage. mechanism for insulin resistance in the spontaneously hypertensive rat. Hypertension, 52: 415–423.
7. Ford E.S. (2003) C-reactive protein concentration and cardiovascular disease risk factors in children: findings from The National Health and Nutrition Examination Survey 1999–2000. Circulation, 108: 1053–1058.
8. Glund S., Deshmukh A., Long Y.C. (2007) Interleukin-6 directly increases glucose metabolism in resting human skeletal muscle. Diabetes, 56: 1930–1637.
9. Hall D.A., Zaiac A.R., Cox R. et al. (1982) The effect of enzyme therapy on plasma lipid levels in the elderly. Atherosclerosis, 43: 209–215.
10. Houstis N., Rosen E.D., Lander E.S. (2006) Reactive oxygen species have a casual role in multiple forms of insulin resistance. Nature, 440: 944–948.
11. Monira H., Wang Y., Cicuttini F. et al. (2014) Incidence of total knee and hip replacement for osteoarthritis in relation to the metabolic syndrome and its components: a prospective cohort study. Semin Arthritis Rheum., 43(4): 429–436.
12. Puenpatom R.A., Victor T.W. (2009) Increased prevalence of metabolic syndrome in individuals with osteoarthritis: an analysis of NHANES III data. Postgrad. Med., 121(6): 9–20.
13. Reid J., Morton D., Wingard D. (2010) Obesity and other cardiovascular disease risk factors and their association with osteoarthritis in Southern California American Indians, 2002–2006. Ethn. Dis., 20(4): 416–422.
14. Sakaida I., Okita K. (2005) The role of oxidative stress in NASH and fatty liver model. Hepatol. Res., 33: 128–131.
15. Vita J.A., Keaney J.F. Jr., Larson M.G. et al. (2004) Brachial artery vasodilator function and systemic inflammation in the Framingham Offspring Study. Circulation, 110: 3604–3609.
16. Whelton A., Gibofsky A. (2011) Minimizing cardiovascular complications during the treatment of osteoarthritis. Am. J. Ther., 18(6): 466–476.
17. Zhang W., Doherty M., Peat G. et al. (2010) EULAR evidence-based recommendations for the diagnosis of knee osteoarthritis. Ann. Rheum. Dis., 69: 483–489.
Эффективность системной энзимной терапии в коррекции обменных нарушений и функционального состояния периферических артерий у больных с метаболическим синдромом в сочетании с остеоартрозом
Резюме. В статье представлены данные исследования эффективности препарата системной энзимотерапии (СЭТ) в предупреждении развития и прогрессирования метаболических нарушений, а также функциональных изменений периферических артерий у больных с метаболическим синдромом в сочетании с остеоартрозом. В результате проведенного исследования выявлено, что у этих больных наблюдается повышенная активность системного воспаления, нарушения липидного и углеводного обменов, высокая атерогенность плазмы крови, а также признаки эндотелиальной дисфункции плечевой артерии в сравнении с группой здоровых лиц. Применение СЭТ в течении 6 мес характеризировалось снижением активности воспалительного процесса, уменьшением гипергликемии и дислипидемии, нормализацией атерогенности плазмы крови, о чем свидетельствовало снижение уровня С-реактивного протеина в крови, концентрации глюкозы и гликозилированного гемоглобина, уровня триглицеридов, снижение соотношения триглицеридов/липопротеинов высокой плотности и количества модифицированных липопротеинов. Кроме того, установлено восстановление функционального состояния эндотелия на макро- и микрососудистом уровне, что определяли по возрастанию выраженности вазодилатации плечевой артерии и увеличению прироста кровотока при проведении пробы с реактивной гиперемией.
системное воспаление, дисфункция эндотелия, остеоартроз, метаболический синдром, системная энзимотерапия.
Адреса для листування:
Козлюк Аліна Сергіївна
03680, Київ, вул. Народного ополчення, 5
ДУ «ННЦ «Інститут кардіології
ім. М.Д. Стражеска» НАМН України»

Leave a comment