Конгрес EULAR 2014 (Париж, 11–14 червня): огляд за матеріалами конгресу
Коваленко В.Н.1, Гнилорыбов A.М.2, Тер-Вартаньян С.Х.3, Яременко О.Б.4, Головач И.Ю.5, Ковганич Т.А. 6, Рекалов Д.Г.7
- 1Державна установа «ННЦ «Інститут кардіології ім. акад. М.Д. Стражеска НАМН України», Київ
- 2ГУ «Институт неотложной и восстановительной хирургии им. В.К. Гусака НАМН Украины»
- 3Городской ревматологический центр, Киев Центральная городская клиническая больница г. Киева
- 4Національний медичний університет ім. О.О. Богомольця, Київ
- 5Клінічна лікарня «Феофанія» ДУС, Київ
- 6Національний медичний університет, Київ -Центральна міська клінічна лікарня, Київ
- 7Запорізький державний медичний університет
Резюме. Робота містить огляд основних доповідей і тем, представлених на останньому Конгресі Європейської антиревматичної ліги (EULAR). Обговорюються питання ролі коморбідних ревматичних станів, важливого значення біосимілярних препаратів у лікуванні ревматичних хвороб, нові рекомендації щодо візуалізації при спондилоартриті, останні дані щодо безпеки адалімумабу при ювенільному ревматоїдному артриті, генетичні предиктори при ревматоїдному артриті, можливість припинення імуносупресивної терапії при системному червоному вовчаку та деякі інші актуальні для сучасної ревматології теми.
В последние десятилетия основными форумами для ревматологов всего мира стали два: американский, который ежегодно проводит Американская коллегия ревматологов (American College of Rheumatology — ACR), и европейский — Конгресс Европейской антиревматической лиги (European League Against Rheumatism — EULAR). Последний Конгресс EULAR состоялся в Париже 11–14 июня 2014 г. Как всегда, на этом самом представительном в мире форуме ревматологов (в этом году в Париж съехались около 13 тыс. ревматологов из более чем 90 стран) в течение 4 рабочих дней были обсуждены самые актуальные вопросы диагностики и лечения ревматических заболеваний. Было представлено более 4000 работ, выполненных в течение последнего года. На 180 научных сессиях выступили около 500 экспертов, которые предложили вниманию участников более 650 презентаций.
Предлагаем вниманию читателя короткий обзор важнейших докладов и тем, представленных на Конгрессе.
КОМОРБИДНОСТЬ И РЕВМАТИЧЕСКИЕ ЗАБОЛЕВАНИЯ: ВЫСОКАЯ СТОИМОСТЬ РАСХОДОВ ПО ЛЕЧЕНИЮ
Результаты исследований последних лет, проведенных в Европе, свидетельствуют о чрезвычайной стоимости болезней скелетной-мышечной системы для развитых стран. В Европе на расходы по лечению пациентов с хроническими заболеваниями уходит от 7 до 80% средств, выделенных на медицинскую помощь. Значительная доля этих средств расходуется на пациентов с хроническими ревматическими заболеваниями — на более чем 150 нозологических форм.
В Нидерландах проведено перекрестное исследование, в которое были включены 8904 человека в возрасте старше 18 лет. Исследователи изучали образ жизни людей, социодемографические факторы, регистрировали врачебные диагнозы и расходы на лечение на протяжении последних 3 мес.

Из обследованных 8,5% отмечали наличие по меньшей мере 1 проблемы с опорно-двигательным аппаратом, 6,1% — не меньше 2 коморбидных состояний, 5,6% — ≥3 проблем, связанных с опорно-двигательной системой.
При вычислениях исследователи использовали фармакоэкономический калькулятор, разработанный в 2010 г. в Нидерландах.
У пациентов с наличием одной проблемы с опорно-двигательной системой расходы на ее лечение были больше, чем на лечение при любом хроническом заболевании (например опухоль, болезни легких, кишечника или др.). При наличии одновременно двух проблем, одна из которых связана с опорно-двигательным аппаратом, расходы увеличивались еще примерно в полтора раза (табл. 1).
Таким образом, в развитых европейских странах коморбидные ревматические состояния резко повышают расходы на лечение пациентов, что следует учитывать специалистам разных специальностей. Профессор Gerd Burmester подчеркнул, что эти результаты можно смело распространить и на США: «Общество зачастую не понимает, насколько важно и как дорого обходится лечение при ревматических заболеваниях. В настоящее время намного больше внимания уделяется проблеме высокой стоимости для общества сердечно-сосудистых заболеваний или психических расстройств. Если вы неподвижны — вы не можете работать, в то время как при болезнях сердца люди зачастую сохраняют трудоспособность. Это свидетельствует о неотложной необходимости разработки методов по снижению данных расходов» [1].
(с учетом характера коморбидности)
| Заболевания (включая мышечно-скелетные) | Здоровые | Мужчины, евро (дол. США) |
Женщины, евро (дол. США) |
|---|---|---|---|
| 0 | 170 (230) | – | – |
| 1 | – | 328 (444) | 483 (654) |
| 2 | – | 483 (654) | 711 (963) |
| Без мышечно-скелетных заболеваний | |||
| 0 | 170 (230) | – | – |
| 1 | – | 220 (298) | 323 (437) |
| 2 | – | 355 (481) | 522 (707) |
РАСТУЩАЯ РОЛЬ БИОСИМИЛЯРОВ В РЕВМАТОЛОГИИ
В этом году одной из самых важных тем было обсуждение результатов сравнительных исследований продолжительного применения различных ингибиторов фактора некроза опухоли (ФНО)-α и их биосимиляров. Биологические препараты невозможно повторить, поэтому создание их генериков (точных копий оригинала) — задача невыполнимая. Это обусловлено тем, что продукция осуществляется разными клетками, которые различаются как векторы, с помощью которых проводится перенос генетического материала в клетку — продуцент лекарственного вещества. В связи с этим имеются важные отличия в процедуре проверки эффективности и безопасности биосимиляров в сравнении с оригинальными препаратами, причем биосимиляры, согласно нормам Европейского Союза (ЕС), проходят значительно более тщательное тестирование, чем генерические низкомолекулярные препараты. Всегда есть определенные сомнения в отношении как экстраполяции показаний к назначению, так и в отношении потенциальной иммуногенности препаратов. Первый биосимиляр — моноклональное антитело — зарегистрирован в ЕС только в 2013 г.
Как выразился профессор Ulf Müller-Ladner, руководитель отделения ревматологии Университета в Гессене (Германия) и один из научных сопредседателей EULAR: «… Ревматологи всего мира за последние 10 лет использовали в лечении миллионы упаковок анти-ФНО-препаратов, и настало время ответить на вопросы, касающиеся долговременной эффективности и побочного влияния, в том числе на когнитивную функцию и опухоли. В отношении биосимиляров, последние исследования направлены на сравнение эффективности и безопасности этих лекарственных препаратов и оригинальных биологических средств».
Биосимиляры становятся все более актуальными в практической медицине, что связано с ростом их предложения на фармацевтическом рынке. В то же время все большую актуальность приобретают вопросы сравнительной эффективности оригинальных биологических препаратов и их биосимиляров, а также вопросы сравнения профиля безопасности. И, конечно, главный вопрос: можно ли отнести эффект биосимиляров к влиянию данного класса препаратов или действие каждого из препаратов в значительной степени «индивидуально».
На сегодняшний день биосимиляры одобрены в Азии, Канаде, Европе, Индии, но не в США. Все большее число компаний разрабатывает биосимилярные препараты. Только в Корее 6 или 7 компаний находятся в процессе выведения биосимиляров на рынок. Это происходит в связи с большими надеждами, возлагаемыми на эти препараты. Однако хотя ожидается, что биосимиляры будут существенно дешевле оригинальных биологических препаратов, ревматологи нуждаются в доказательствах их эффективности, истинной биоэквивалентности и рентабельности. Поэтому подобные работы представляют чрезвычайный интерес для ревматологической общественности и пациентов.
На Конгрессе в Париже были представлены результаты прямого сравнительного исследования нескольких новых биосимиляров, в том числе HD203 (биосимиляр этанерцепта) в сравнении с этанерцептом, и BOW015 (биосимиляр инфликсимаба) — в сравнении с инфликсимабом. Оба препарата изучены в двух двойных слепых рандомизированных плацебо-контролируемых исследованиях третьей фазы.
Исследование эффективности и безопасности HD203 по сравнению с этанерцептом
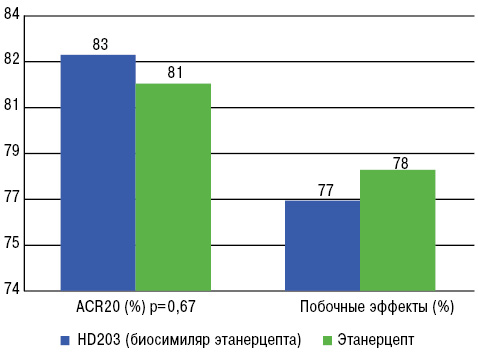
В данное исследование были вовлечены 294 пациента с активным ревматоидным артритом (РА) в Южной Корее [2]. Все пациенты ранее получали метотрексат подкожно 2 раза в неделю на протяжении 48 нед. Половина больных принимали HD203 25 мг подкожно, остальные — оригинальный этанерцепт также в дозе 25 мг. На 24-й неделе ответ по критериям ACR20 практически не отличался в обеих группах — группе HD203 и группе этанерцепта (82,48% vs 81,36%; р=0,67). Эта пропорция сохранялась на 12-й и на 48-й неделе. Однако ответ по критерию ACR50 был несколько выше при лечении HD203 на 24-й и 48-й неделе. Не выявлено существенных различий между частотой побочных эффектов, обусловленных лечением, между группами HD203 и этанерцепта (76,87% vs 78,08% соответственно) (рис. 1). Никаких неожиданных побочных эффектов также не выявлено, однако у некоторых пациентов обеих групп в крови отмечено появление антител к препарату.
Сравнение эффективности и безопасности биосимиляра BOW015 и инфликсимаба
Работа была представлена д-ром Jonathan Kay, MD, из Мемориального медицинского центра (Worcester, Massachusetts, USA). В исследование включили 189 больных с активным РА на фоне лечения метотрексатом в стабильной дозе. Главной конечной точкой была пропорция пациентов, достигшая ответа по критериям ACR20 к 16-й неделе [3].
Ответ на лечение оценивали на 0; 2; 6; 14 и 16-й неделе.
Установлено, что пропорция ответчиков была сравнима в каждой из этих лечебных групп. Это свидетельствует о том, что оба препарата по эффективности терапевтически эквивалентны.
Исследование CTP-13 (биосимиляр инфликсимаба)
Этот биосимиляр был представлен на Конгрессе в двух исследованиях [4, 5]. CTP-13 — биосимиляр инфликсимаба, производимый корейской компанией «Celltrion», в настоящее время уже одобрен к применению в ЕС и Канаде. В исследовании PLANETRA был представлен сравнительный анализ эффективности биосимиляра и инфликсимаба на материале 606 пациентов, пролеченных на протяжении 54 нед (рандомизация 1:1) [4]. У 336 участников исследования проанализированы рентгенологические изменения и динамика активности, и основные показатели не отличались между исследованными группами.
Показатель ACR20 на 54-й неделе лечения CT-P13 был достигнут у 57,0% больных, при лечении инфликсимабом — у 52,0% пациентов (95% доверительный интервал (CI) –0,03–0,13). ACR50 и ACR70 также были сравнимы между группами (CT-P13 — 33,1 и 16,2%; инфликсимаб — 31,6 и 15,1% соответственно). Ремиссия достигнута соответственно у 26,4 и 27,8% пациентов (DAS28-CRP); кроме того, у 14,3 и 14,8% соответственно достигнута низкая активность болезни, в то время как высокая активность отмечалась приблизительно у 80% до начала исследования. Частота выявления антител к препарату также практически не отличалась в группах: CT-P13 — 52,3%, инфликсимаб — 49,5%. Динамика общего числа Sharp в течение года в обеих группах была сравнимой (CT-P13: 104,6 исходно и 70,4 через 54 нед лечения; в группе инфликсимаба: 103,6 и 73,0 соответственно).
Профиль безопасности CT-P13 и инфликсимаба был также сравним (табл. 2).
и его биосимиляра CT-P13
| Показатель, n (%) | CT-P13 (n=302) | Инфликсимаб (n=300) |
|---|---|---|
| С ≥1 побочным эффектом | 131 (43,4) | 134 (44,7) |
| С ≥1 серьезным побочным эффектом | 42 (13,9) | 31 (10,3) |
| С ≥1 побочным эффектом (в том числе инфекционным) | 69 (22,8) | 69 (23,0) |
Биосимиляр ритуксимаба PF-05280586
Еще в одном исследовании представлено сравнение фармакокинетики PF-05280586 («Pfizer»), биосимиляра ритуксимаба, с оригинальным ритуксимабом, производимым в США или ЕС. В работе продемонстрирован сопоставимый фармакокинетический профиль биосимиляра и оригинального препарата у 198 пациентов, рандомизированных в три группы, и схожая частота побочных эффектов и профиля безопасности [6].
Таким образом, на Конгрессе представлены результаты исследований четырех новых биосимилярных препаратов, в которых продемонстрирована схожесть полученных эффектов и профиля безопасности. Растущее количество биосимиляров и связанное с этим увеличение их клинических испытаний свидетельствуют о живом интересе к данному классу препаратов, а также о том, что этот класс лекарственных средств — новая парадигма в лечении пациентов с ревматическими заболеваниями.
Биосимиляры: основные выводы Конгресса
Биосимиляры не являются генериками; создание точной копии биологического препарата невозможно.
ЕС предъявляет более суровые требования к тестированию биосимиляров, чем к генерикам.
Первый биосимиляр в ЕС зарегистрирован в 2007 г., первый биосимиляр — моноклональное антитело — в 2013 г.
Имеются сомнения в отношении экстраполяции показаний биосимиляра и оригинального препарата, а также в отношении одинаковой иммуногенности оригинальных биологических препаратов и их биосимиляров.
Биосимиляры — новое перспективное направление в лечении при ревматических заболеваниях.
АДАЛИМУМАБ ПРИ ЮВЕНИЛЬНОМ РЕВМАТОИДНОМ АРТРИТЕ (ЮРА): ПОДТВЕРЖДЕНИЕ БЕЗОПАСНОСТИ И ПЕРЕНОСИМОСТИ ПРИ ДЛИТЕЛЬНОМ ПРИМЕНЕНИИ
В настоящее время продолжается сравнительное изучение безопасности и переносимости адалимумаба при полиартикулярном течении ЮРА в 10-летнем исследовании. На Конгрессе в Париже представлены промежуточные результаты данного проекта (4 года наблюдения) [7]. В исследование были включены дети в возрасте от 2 до 17 лет. В промежуточном анализе проанализированы 765 пациентов — 459 были пролечены с применением адалимумаба (с/без метотрексата), 305 — только с применением метотрексата. 131 больной переведен с метотрексата на адалимумаб в связи с неэффективностью последнего. Пациенты, включенные в наблюдение и принимавшие адалимумаб, были несколько старше (12,2 vs 9,6 года), соответственно, имели большую массу тела (47,8 vs 37,9 кг) и были выше (150,3 vs 137,2 см), чем больные, применявшие монотерапию метотрексатом. Кроме того, у пациентов на монотерапии средняя продолжительность болезни была больше (3,8 vs 1,3 года). Все другие демографические характеристики были сходны в обеих группах.
Побочные эффекты зарегистрированы у 30,9% пациентов в группе адалимумаба и несколько чаще (у 40,0%) в группе монотерапии метотрексатом. Тяжелые побочные эффекты отмечены у 4,8% в группе адалимумаба и 3,9% — в группе метотрексата. Не отмечено смертельных исходов или опухолей. Таким образом, никаких дополнительных рисков приема этих препаратов по отношению к уже известным в этой работе не выявлено. Самым серьезным инфекционным осложнением были оппортунистические инфекции, в то время как случай туберкулеза в этой популяции исследователи не зарегистрировали. И хотя полный отчет по эффективности также предполагается представить значительно позже, предварительные данные по эффективности лечения также были проанализированы и представлены. Основным критерием эффективности было снижение среднего индекса активности ЮРА (Juvenile Arthritis Disease Activity Score в 71 суставе (JADAS71). Показано, что JADAS71 снижался к 6-му месяцу в обеих лечебных группах (табл. 3, рис. 2).
| Период | Адалимумаб | Метотрексат (монотерапия) |
|---|---|---|
| Исходно | 12,1 | 13,1 |
| 1 мес | 8,5 | 11,2 |
| 3 мес | 5,7 | 6,4 |
| 6 мес | 5,4 | 5,1 |
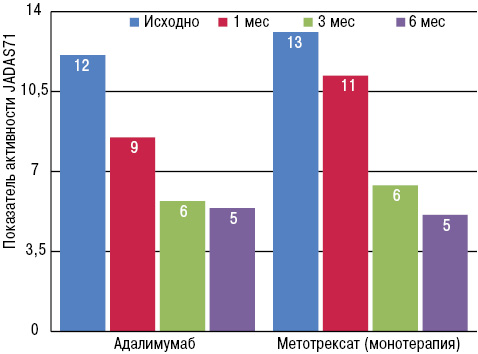
Основное значение этого исследования состоит в том, что оно демонстрирует относительную безопасность длительного лечения пациентов с ЮРА адалимумабом.
МНОГООБЕЩАЮЩИЕ РЕЗУЛЬТАТЫ САРИЛУМАБА В ЛЕЧЕНИИ ПРИ РА
SARIL-RA-MOBILITY — первое из четырех запланированных исследований третьей фазы сарилумаба — ингибитора рецепторов к интерлейкину (ИЛ)-6 [8]. В отличие от тоцилизумаба, этот препарат является полностью «гуманизированным» лекарственным средством. При среднетяжелом и тяжелом РА клинический, рентгенологический и функциональный ответ при сочетанной терапии сарилумабом с метотрексатом значительно лучше, чем при монотерапии метотрексатом. Эффективность сарилумаба была исследована в двух дозах подкожно каждые 2 нед.
Участвовали более 200 центров в 30 странах мира, пациентов рандомизировали в три группы: сарилумаб 150 мг, сарилумаб 200 мг и плацебо. Все участники получали препарат в комбинации с метотрексатом. Использовали три главные конечные точки: улучшение по критериям ACR по меньшей мере 20% (ACR20) на 24-й неделе лечения; функциональный индекс HAQ-DI (Health Assessment Questionnaire — Disability Index) на 16-й неделе терапии; и рентгенологический индекс структурных нарушений mTSS (modified total Sharp score), предложенный van der Heijde, на 52-й неделе лечения.
В результате достоверно лучшие (по сравнению с плацебо) результаты лечения были у пациентов при применении сарилумаба, особенно в дозе 200 мг (табл. 4).
при лечении сарилумабом и плацебо
| Конечная точка | Сарилумаб | Плацебо | |
|---|---|---|---|
| 150 мг | 200 мг | ||
| ACR20 на 24-й неделе, % | 58 | 66 | 33 |
| HAQ-DI на 16-й неделе | –0,53 | –0,55 | –0,29 |
| mTSS на 52-й неделе | 0,90 | 0,25 | 2,78 |
| ACR70 на 24-й неделе, % | 20 | 25 | 7 |
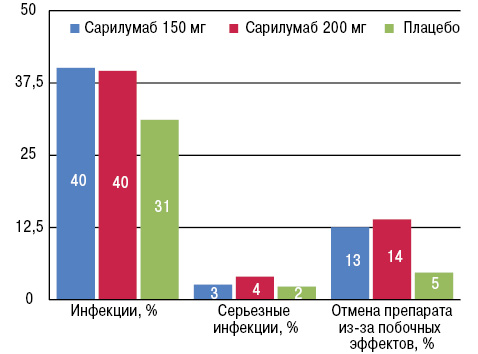
Как и ожидалось, побочные эффекты наблюдали несколько чаще при применении сарилумаба, чем в группе плацебо (табл. 5, рис. 3).
| Побочные эффекты | Сарилумаб 150 мг | Сарилумаб 200 мг | Плацебо |
|---|---|---|---|
| Инфекции, % | 40,1 | 39,6 | 31,1 |
| Серьезные инфекции, % | 2,6 | 4,0 | 2,3 |
| Прекращение лечения из-за приема препарата, % |
12,5 | 13,9 | 4,7 |
ВЫСОКИЙ СЕРДЕЧНО-СОСУДИСТЫЙ РИСК ПРИ СИНДРОМЕ ШЕГРЕНА
Профессор Antonio Avina-Zubieta, MD, научный исследователь Исследовательского центра артритов (Ванкувер, Канада), представил данные нового популяционного исследования [9]. Известно, что сердечно-сосудистые заболевания являются частыми спутниками РА и системной красной волчанки (СКВ). Подобных работ по синдрому Шегрена очень мало в связи с невысокой распространенностью данного заболевания в популяции. Авторами проанализированы базы данных амбулаторных обращений и госпитализаций в Британской Колумбии с 1990 по 2010 г., а также распределения лекарственных средств с 1995 по 2010 г. для выявления пациентов с синдромом Шегрена в базах дан ных. Согласно полученным результатам, у пациентов с синдромом Шегрена отмечается значительно более высокий риск острого коронарного синдрома (ОКС) и инсультов, чем в общей популяции, особенно в течение 1-го года после установления диагноза. Исследователи пришли к выводу, что ОКС и инсульт следует рассматривать даже не как коморбидное состояние, а как прямое осложнение заболевания.
Для каждого пациента с синдромом Шегрена были подобраны 10 человек контрольной группы соответствующего возраста и пола. В течение 3,1 года наблюдения частота ОКС при синдроме Шегрена была в 2 раза (!) выше, чем в контроле (2,4% vs 1,2%), также как и распространенность (7,7 vs 3,5 на 1000 пациенто-лет).
Частота инсультов также существенно выше при синдроме Шегрена, чем в контроле (1,6% vs 1,1%), как и распространенность (5,1 vs 3,4 на 1000 пациенто-лет). При мультивариантном анализе относительный риск (ОР) развития ОКС при синдроме составил 2,36, а ОР инсульта — 1,6 по отношению к контролю (рис. 4). В течение 1-го года наблюдения после установления диагноза «сухого» синдрома ОР развития ОКС был еще выше и составлял 3,6; подобной тенденции по отношению к инсульту не выявлено.
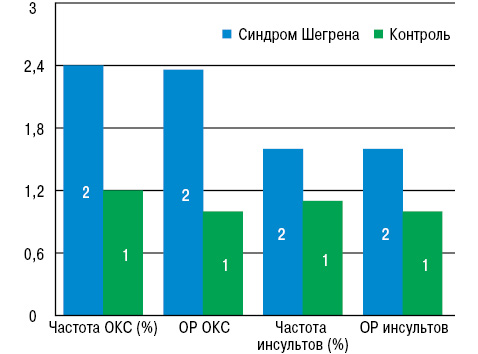
Исследователи предположили, что полученные результаты связаны с ролью воспаления в генезе этих коморбидных состояний, поскольку частота и выраженность воспалительных реакций, наблюдаемых у пациентов в начале исследования, как правило, были более значимыми.
Таким образом, полученные данные нацеливают ревматологов и врачей других специальностей на повышение бдительности в отношении возможных сердечно-сосудистых осложнений при синдроме Шегрена.
ГЕНЕТИЧЕСКИЕ ПРЕДИКТОРЫ ТЯЖЕСТИ РА И ОТВЕТА НА ЛЕЧЕНИЕ
Генотипирование HLA-DRB1 в позициях 11, 71, и 74 позволяет прогнозирование тяжесть РА и ответ на лечение. Подобное исследование на ранней стадии заболевания может помочь стратифицировать пациентов с риском структурного поражения и выявлять тех, кто с большей вероятностью ответит на биологическую терапию анти-ФНО-препаратами. Об этом свидетельствуют результаты когортного мультицентрового исследования, с которыми на Конгрессе выступил профессор Sebastien Viatte из Исследовательского центра генетики и геномики артритов в Манчестере (Великобритания) [10].
До последнего времени так называемый shared epitope — группу аллелей гена HLA-DRB1 — связывали с высокой вероятностью развития РА. Недавно установлено, что позиция 11 гена HLA-DRB1, находящаяся за пределами классического «shared» эпитопа, также является сильным предиктором развития РА. Позиции 11, 71, и 74 определяют 16 гаплотипов (комбинаций сегментов гена); эффект последних варьирует от риска развития до защиты от возникновения РА. Однако до настоящего времени влияние гаплотипов на тяжесть течения болезни и чувствительность к терапии не исследовалась.
Доктор Viatte и его коллеги использовали результаты трех независимых мультицентровых проспективных когортных исследований для оценки предположения о том, могут ли позиции 11, 71 и 74 гена HLA-DRB1 прогнозировать рентгенологические исходы, ответ на анти-ФНО-лечение и смертность у больных РА. В когортное исследование NOAR вошли данные 1691 пациента с 2811 рентгенограммами; в когорту ERAS — 421 больной с 3758 рентгенограммами; когорта BRAGGSS включала данные ответа на терапию 1846 больных.
Установлено, что аминокислота валин в позиции 11 HLA-DRB1 (Val11) оказалась сильной независимой детерминантой структурного повреждения суставов (ОР 1,75). Подтверждение этого факта получено в других когортах.
Позиции 71 и 74 также были независимыми предикторами, однако комбинация трех позиций еще сильнее ассоциировалась с исходами заболевания.
Гаплотип Val11Lys71Ala74, носителем которого были 52% больных, ассоциировался с хорошим ответом по критериям EULAR. В среднем, основываясь на данных только этого гаплотипа, для получения одного дополнительного ответчика необходимо пролечить 17 пациентов с помощью анти-ФНО-препаратов.
Отметим, что смертность от любых причин и сердечно-сосудистую смертность можно прогнозировать с помощью определенных из 16 гаплотипов.
МЕТОТРЕКСАТ: СВЕЖИЙ ВЗГЛЯД НА КЛЮЧЕВОЙ ПРЕПАРАТ
На Конгрессе были представлены ряд исследований, касающихся особенностей применения, и новые данные по эффективности старого знакомого в лечении при РА — метотрексата.
Так, группа ученых из Великобритании, возглавляемая Tony Hammond,показала, что при недостаточной эффективности таблетированного метотрексата переключение на парентеральные формы препарата может обеспечить очень хороший ответ на лечение [11].
В очень интересной работе из Швейцарии, представленной Rodrigo Mueller и Johansen von Kempis,показано, что в случае начала терапии метотрексатом подкожно 51% реагируют достижением ремиссии или низкой активности заболевания без необходимости добавления к терапии биологических препаратов по меньшей мере в течение 1 года [12].
Много работ были посвящены сравнению эффективности монотерапии тоцилизумабом или абатасептом с комбинацией с метотрексатом. Большинство работ продемонстрировали намного большую эффективность комбинации этих биологических препаратов с метотрексатом. Например, по данным анализа европейской базы данных, эффект от лечения тоцилизумабом сохранялся на протяжении 2,2 года при монотерапии и 3,5 года — при комбинации с метотрексатом [13]. Аналогичные препараты представлены в отношении абатасепта в комбинации с метотрексатом [14].
В исследовании AVERT [15] сравнили три варианта лечения: абатасепт + метотрексат, монотерапия абатасептом и только метотрексат. Комбинация оказалась намного более эффективной в достижении ремиссий, чем монотерапия каждым из препаратов. Эти данные подтверждены в японском исследовании [16]. Однако в исследовании, проведенном во Франции и представленном на Конгрессе, показано, что монотерапия абатасептом при невозможности применения метотрексата также была весьма успешной [17].
ИНГИБИТОРЫ ЯНУС-КИНАЗЫ В ЛЕЧЕНИИ ПРИ РА: НОВЫЕ ПОДХОДЫ
Уникальность ингибиторов янус-киназы (JAK) состоит в их воздействии исключительно на семейство внутриклеточных ферментов, в то время как биологические препараты воздействуют на внеклеточные цитокины или рецепторы к ним. При этом тормозится JAK-STAT-система или путь, состоящий из JAK и сигнального белка-трансдуктора и активатора транскрипции (STAT), который участвует в реализации эффектов многих провоспалительных цитокинов и факторов роста.
При этом JAK фактически состоит из нескольких ферментов, блокирование каждого из которых имеет свои особенности. JAK 1 отвечает за включение сигнализации множества разнообразных цитокинов. Сигнализация JAK 3 характерна для гамма-цепей цитокинов (ИЛ-2, -4, -7 и других ИЛ). Сигнализация JAK 2, как и JAK 1, является довольно неоднородной, но ее торможение подавляет некоторые факторы роста (например эритропоэтин, гранулоцитарно-моноцитарный колониестимулирующий фактор, тромбопоэтин). Таким образом, при ингибировании JAK 2 можно ожидать гематологические побочные эффекты.
Ниже в таблице — некоторые ингибиторы JAK, результаты исследования которых были представлены на Конгрессе в Париже (табл. 6).
на Конгрессе EULAR в Париже (2014) [20, 21]
| Препарат | Избирательное ингибирование JAK | Стадия/одобрен |
|---|---|---|
| Тофацитиниб | JAK 3, 1 | Фаза 3/одобрен в отдельных странах, включая США |
| Барицитиниб | JAK 1, 2 | Фаза 3 |
| Филготиниб (GLPG0634) | JAK 1 | Фаза 2 |
| Децернотиниб (VX-509) | JAK 3 | Фаза 2 |
| ASP015K | JAK 1, 3 | Фаза 2 |
Следует отметить, что реализация эффектов ФНО проходит без участия системы JAK. Только тофацитиниб уже одобрен для применения Управлением по контролю за пищевыми продуктами и лекарственными средствами США (FDA) и уже прошел много клинических испытаний III фазы. Барицитиниб находится в III фазе клинических испытаний, а остальные три ингибитора JAK в настоящее время — во II фазе клинических испытаний.
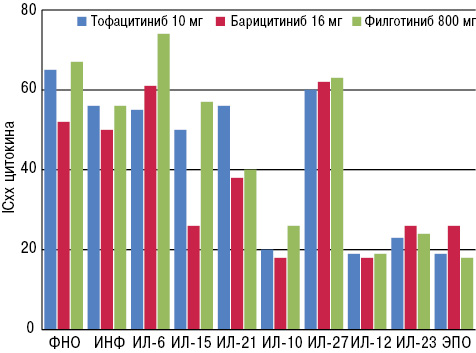
Один из докладов, представленных на Конгрессе EULAR в 2014 г., был посвящен вопросу возможного учета селективности разработанных в настоящее время препаратов [18]. При этом авторы учитывали выработку различных цитокинов in vitro, которые синтезируются после применения трех различных ингибиторов JAK (рис. 5).
Отметим, что, несмотря на указанные особенности каждого из препаратов, все они (тофацитиниб, барицитиниб и филготиниб) фактически были очень схожи между собой по профилю ингибирования цитокинов.
Одно из крупных исследований — программа ORAL Start program исследования монотерапии тофацитинибом в дозе 5 мг 2 раза в сутки на протяжении 24 мес [19]. Результаты представлены в табл. 7.
| Конечная точка | Тофацитиниб | Метотрексат | ||
|---|---|---|---|---|
| Исходно | Неделя 24-я | Исходно | Неделя 24-я | |
| Оценка состояния больным (ВАШ) | 60,2 | 24,42* | 57,71 | 28,81 |
| Оценка боли (ВАШ) | 59,06 | 23,03* | 58,77 | 27,52 |
| Физическая функция (HAQ-DI) | 1,54 | 0,58** | 1,52 | 0,77 |
| Усталость (FACIT-F) | 28,47 | 38,52* | 28,55 | 35,16 |
| HR-QoL (SF-36) | ||||
| Физическое состояние | 39,92 | 44,95*** | 33,58 | 41,53 |
| Ментальные функции | 40,48 | 47,32 | 40,93 | 46,42 |
*p<0,05; **p<0,001; ***p<0,0001; FACIT-F — функциональная оценка усталости, связанной с хроническим заболеванием; HAQ-DI — опросник оценки индекса нетрудоспособности; HR-QoL — качество жизни, связанное с состоянием здоровья; ВАШ — визуальная аналоговая шкала.
В результате исследования отмечено улучшение общей оценки состояния пациентов и уменьшение выраженности боли, улучшение физических и психических показателей качества жизни как при применении метотрексата, так и тофацитиниба, однако у тофацитиниба отмечен более благоприятный профиль по сравнению с метотрексатом.
Поскольку разные ингибиторы JAK подавляют разные JAK, следует ожидать различающиеся профили безопасности: например, ингибирование JAK 2 может вызвать больше гематологических нежелательных явлений. Современные данные свидетельствуют о том, что профиль безопасности тофацитиниба аналогичен профилю безопасности известных биологических препаратов, за исключением повышения частоты заболеваемости неосложненной формой опоясывающего лишая, некоторой лимфопении, а также весьма незначительного повышения уровня креатинина киназы или повышения концентрации креатинина в сыворотке крови.
УЛЬТРАЗВУК ПРЕДПОЧТИТЕЛЬНЕЕ БИОПСИИ В ДИАГНОСТИКЕ ГИГАНТОКЛЕТОЧНОГО АРТЕРИИТА
Исследователь Adam Croft, PhD из Центра прикладных исследований воспаления Университета из Birmingham (Великобритания), представил интересное сравнительное исследование диагностической ценности патоморфологического исследования биоптатов височной артерии и ультрасонографии [22]. В настоящее время биопсия височной артерии считается золотым стандартом в диагностике данного заболевания, однако эта инвазивная процедура связана с возможностью повреждения лицевого нерва и артерии. В то же время, хотя гистологический тест является специфичным, из-за низкой чувствительности частота ложноотрицательных заключений достигает 20%. В этой интересной работе показано, что краниальная ультрасонография в скором времени может заменить инвазивную биопсию как метод первой линии при подозрении на гигантоклеточный артериит в рутинной клинической практике. Выводы основаны на результатах изучения 87 больных с предполагаемым гигантоклеточным артериитом с января 2005 по июль 2013 г. У 36 больного диагноз был подтвержден, причем из 30 человек с позитивным результатом на ультразвуковом исследовании (УЗИ) у 29 в течение 3 мес получено подтверждение диагноза клинически. Результаты УЗИ оказались наиболее сильными предикторами диагноза, а шанс выявления заболевания — в 41 раз выше при УЗИ, чем при биопсии височной артерии (табл. 8).
| Показатель | Краниальная ультрасонография, % |
Биопсия височной артерии, % |
|---|---|---|
| Чувствительность | 81 | 53 |
| Специфичность | 97 | 100 |
| Положительная предикторная ценность | 97 | 100 |
| Отрицательная предикторная ценность | 88 | 47 |
Высокая положительная и отрицательная предикторная ценность УЗИ свидетельствуют о том, что при клиническом подозрении на гигантоклеточный артериит биопсии можно избежать. Современные рекомендации EULAR подтверждают, что УЗИ можно использовать как диагностический метод при данном артериите, однако авторы предполагают, что в ближайшее время роль этого метода будет существенно усилена в существующих рекомендациях. Исследователи предлагают УЗИ в качестве альтернативного метода ранней диагностики.
ПЕРВЫЕ РЕКОМЕНДАЦИИ EULAR ПО ВИЗУАЛИЗАЦИИ ПРИ СПОНДИЛОАРТРИТЕ
Комиссия экспертов EULAR приняла на Конгрессе 10 рекомендаций по использованию методов визуализации при осевой и периферической форме спондилоартрита. В состав комиссии вошел 21 эксперт, включая ревматологов и рентгенологов, из 11 европейских стран, которые проанализировали результаты 158 исследований и мнения экспертов в отношении различных аспектов визуализации, что привело к формированию 10 практических и клинических рекомендаций. Эти рекомендации на Конгрессе были представлены профессором Lene Terslev из университетского госпиталя в Глострупе (Дания) [23].
Отметим, что рекомендации предлагают продолжить использование рентгенисследования из-за широкой распространенности и низкой стоимости метода.
Рентгенологическое исследование остается основным методом детекции сакроилеитов, однако магнитно-резонансная томография (МРТ) — альтернативный метод при короткой продолжительности симптомов и у пациентов молодого возраста. При подозрении на спондилит (даже не подтвержденных клинически или рентгенологически) — следует проводить МРТ илеосакральных сочленений.
МРТ также рекомендован для мониторирования осевого спондилоартрита, причем наличие воспаления на МРТ — хороший предиктор клинического ответа при спондилоартрите.
МРТ также рекомендована для детекции энтезитов, тендосиновитов и артритов при периферической форме спондилоартрита. При мониторинге активности заболевания предлагают применять сочетанное использование УЗИ и МРТ.
Контрастные исследования не несут дополнительной ценности и не рекомендованы к использованию.
Эксперты также отмечают, что доказательность рекомендаций выше при аксиальном спондилоартрите, чем при периферической форме.
ПЕРВЫЕ БИОМАРКЕРЫ ОСТЕОАРТРОЗА
Наличие в крови трех специфических микро-РНК может быть предиктором тяжести остеоартроза. Отметим, что это первое подобное популяционное исследование [24]. Авторы отмечают, что в будущем это может позволить прогнозировать риск тяжести остеоартроза и предпринимать превентивные меры достаточно рано.
Как известно, микро-РНК используют в различных областях медицины, особенно при опухолях, диабете, сердечно-сосудистых заболеваниях. Они могут оставаться стабильными при различных температуре и условиях и доступны исследованию в крови. В связи с этим исследователи использовали в работе сыворотку крови пациентов с остеоартрозом, которые вошли в когортное исследование Bruneck (с 1995 по 2010 г.). Главной конечной точкой было эндопротезирование тазобедренного или коленного суставов.
За период наблюдения эндопротезирование коленных или тазобедренных суставов по поводу тяжелого остеоартроза проведено 67 из 816 больных. Эти пациенты были значительно старше (р=0,053) и с более высоким индексом массы тела (р=0,002).
Все образцы крови были протестированы на уровень микро-РНК в начале наблюдения, причем для дальнейшего анализа исследователи из 374 микро-РНК-кандидатов в биомаркеры выбрали 12 анализов. В регрессионном анализе выявили три биомаркера, связанные с эндопротезированием как исходом заболевания: miR-454, miR-885-5p, let-7e. Один из авторов работы доктор C. Beyer отметил, что самым многообещающим микро-РНК является let-7e.
Остается множество вопросов: Где синтезируются эти микро-РНК в пораженных суставах? Могут ли они влиять на активность болезни? Актуальны ли они в других когортах пациентов? Конечно, полученные данные требуют проверки в более крупных исследованиях.
Следует предположить, что микро-РНК в скором времени имеют все шансы на внедрение в клиническую практику. Малые РНК относительно несложно определять, и в данной клинической ситуации, если это подтвердится в других работах, достаточно исследовать 1–2 микро-РНК.
ОТНОШЕНИЕ ПАЦИЕНТА К ЛЕЧЕНИЮ ВЛИЯЕТ НА ЕГО РЕЗУЛЬТАТЫ
В Великобритании проведено заслуживающее внимания исследование влияния отношения пациента к лечению (психологического настроя) на эффективность лечения. Профессор психологии Института фармацевтики Джон Вейнман (John Weinman) (King’s College, London) и соавторы выявили, что приверженность лечению у больных, применяющих ингибиторы ФНО, обычно лучше, чем при лечении обычными базисными препаратами [25]. Вера пациента и его надежда на результаты лечения влияют на приверженность лечебному плану.
Обследованы около 7200 пациентов с РА, анкилозирующим спондилоартритом, псориатическим спондилоартритом, болезнью Крона, неспецифическим язвенным колитом и псориазом из 33 стран с помощью валидных опросников, включая опросник BMQ (Beliefs About Medicines Questionnaire — опросник отношения пациента к лекарственным препаратам) и MMAS-4 (short Morisky Medication Adherence Scale — короткая шкала приверженности лечению Morisky). Средний возраст пациентов составил 47,5 года, продолжительность болезни — 11,7 года.
В целом большинство пациентов привержены лечению, независимо от характера заболевания и вида терапии. В то же время при любом варианте лечения, приверженность была существенно ниже у амбивалентных (сомневающихся в результатах лечения) пациентов, чем у больных, доверяющих врачу без особых сомнений (46–69% vs 56–78%).
При всех исследованных заболеваниях, приверженность лечению в целом была выше при использовании анти-ФНО-препаратов (оценка по шкале MMAS-4:3,4–3,7), чем при монотерапии базисным препаратом (MMAS-4: 2,6–3,3) или при приеме комбинации базисных средств (MMAS-4:2,8–3,4).
Таким образом, наличие исходных сомнений в целесообразности лечения негативно влияет на его эффективность. Исследователи в своих выводах подчеркнули, что изучение отношения пациента к предполагаемой терапии во время обычной консультации и устранение некоторых ошибочных убеждений в отношении предлагаемого лечения или связанных с ним рисков позволит избежать потенциального несоблюдения режима. Авторы также отмечают, что они находятся в начале пути изучения взаимосвязи между приверженностью лечению и исходной уверенностью в правильности выбора терапии, но уже сейчас можно утверждать, что такая взаимосвязь существует. Конечно, в приведенной работе не изучены причины амбивалентности и ее источники, не исследованы половые и географические различия, влияние на отношение пациентов к продолжительности и тяжести заболевания.
ПРЕКРАЩЕНИЕ ИММУНОСУПРЕССИВНОЙ ТЕРАПИИ ПРИ СКВ ВОЗМОЖНО У НЕКОТОРЫХ ПАЦИЕНТОВ
В новом ретроспективном исследовании, представленном на Конгрессе EULAR, показано, что у некоторых пациентов с СКВ при достижении ремиссии возможно прекращение иммуносупрессивной терапии без развития обострения заболевания. Как известно, современные руководства по лечению СКВ не содержат рекомендаций — когда и как прекращать применение иммуносупрессантов. Решение этой проблемы ложится на плечи практикующих врачей. Результаты настоящего исследования подтверждают, что прекращение подобной терапии, нередко чреватой развитием серьезных побочных эффектов, возможно у некоторых групп пациентов.
Доктор Захи Тума (Zahi Touma, MD) с коллегами из Отделения ревматологии университета Торонто (Канада) наблюдал 179 пациентов с СКВ в отделении СКВ в Торонто с 1970 по 2012 г. [26]. Всем больным были назначены иммуносупрессанты (азатиоприн, метотрексат или мофетила микофенолат), а затем предпринята попытка снижения дозы препарата или полной отмены. Всем пациентам снижали дозу по меньшей мере на 25%, а при достижении клинической ремиссии, что устанавливали на основании отсутствия активности болезни (по индексу Systemic Lupus Erythematosus Disease Activity), применение иммуносупрессантов прекращали, оставляя <7,5 мг/сут по преднизолону. Средний возраст на момент снижения дозы иммуносупрессантов составил 40,4 года, средняя продолжительность болезни — 11,4 года. По каждому пациенту собирали данные в трех временных отрезках: в начале снижения дозы, в момент прекращения применения иммуносупрессантов и в конце исследования. Обострением считали возобновление применения иммуносупрессанта или повышение дозы преднизолона при наличии клинически активной СКВ.
Из всех участников исследования 99 (56%) больных смогли прекратить применение иммуносупрессантов полностью. Среди последних 74% не имели обострений болезни в течение 2 лет, а 50% — в течение 3 лет и оставались клинически стабильными до 5 лет.
У большинства больных, у которых в течение 2 лет развилось обострение, были позитивные серологические тесты с наличием специфических для СКВ антител. Кроме того, частота обострений была ниже, если снижение дозы иммуносупрессантов проводили постепенно. Таким образом, прекращение лечения возможно, однако его следует проводить очень аккуратно и постепенно, а больных — тщательно мониторировать после завершения применения иммуносупрессантов.
В заключение следует отметить, что программа Конгресса EULAR была чрезвычайно насыщенной и интересной. Ревматология продолжает оставаться одной из наиболее динамично развивающихся медицинских дисциплин.
Список использованной литературы
- 1. van der Zee-Neuen A., Putrik P., Ramiro S. et al. (2014) The number of morbidities drives the health care expenditures and presence of a musculoskeletal condition is additionally accountable for higher costs. Ann. Rheum. Dis., 73(Suppl. 2). Abstracts OP0197.
- 2. Bae S.C., Kim J.S., Choe J.Y. et al. (2014) on behalf of Hera Study Investigators. A randomized, double-blind, phase 3 equivalence trial comparing the etanercept biosimilar, HD203, with Enbrel, in combination with methotrexate (MTX) in patients with rheumatoid arthritis (RA). Program and abstracts of the European League Against Rheumatism (EULAR) Congress 2014. Paris, France. Abstract OP0011.
- 3. Kay J., Chopra A., Chandrashekara S. et al. (2014) A phase 3, randomized, double-blind, active comparator study of the efficacy and safety of BOW015, a biosimilar infliximab, in patients with active rheumatoid arthritis on stable methotrexate doses. Program and abstracts of the European League Against Rheumatism (EULAR) Congress 2014. Paris, France. Abstract OP0012.
- 4. Yoo D.H., Racewicz A., Brzezicki J. et al. (2014) A phase 3 randomised controlled trial to compare CT-P13 with infliximab in patients with active rheumatoid arthritis: 54 week results from the PLANETRA study. Program and abstracts of the European League Against Rheumatism (EULAR) Congress 2014. Paris, France. Abstract OP0068.
- 5. Park W., Jaworski J., Brzezicki J. et al. (2014) A randomized, double-blind, parallel-group, phase 1 study comparing the pharmacokinetics, safety, and efficacy of CT-P13 and infliximab in patients with active ankylosing spondylitis: 54 week results from the PLANETAS study. Program and abstracts of the European League Against Rheumatism (EULAR) Congress 2014. Paris, France. Abstract FRI0421.
- 6. Yin D., Becker J.C., Melia L.A. et al. (2014) A phase I pharmacokinetics trial comparing PF-05280586 (a potential biosimilar) and rituximab in subjects with active rheumatoid arthritis with active disease in TNF failures (REFLECTIONS B328-01). Program and abstracts of the European League Against Rheumatism (EULAR) Congress 2014. Paris, France. Abstract FRI00309.
- 7. Horneff G., Ruperto N., Wallace C. et al. (2014) Long-term safety and effectiveness of adalimumab in children with moderately to severely active polyarticular or polyarticular-course juvenile idiopathic arthritis. Ann. Rheum. Dis., 73(Suppl. 2). Abstract OP0006.
- 8. Genovese M., Fleischmann R.M., Kivitz A.J. et al. (2014) Effects of sarilumab plus mtx on clinical, radiographic, and functional endpoints in patients with moderate-to-severe rheumatoid arthritis: results of a phase 3, randomized, double-blind, placebo-controlled, international study. Ann. Rheum. Dis., 73(Suppl. 2). Abstract OP0028.
- 9. Avina-Zubieta A., Etminan M., Choi H.K. et al. (2007) Risk of cardiovascular mortality in rheumatoid arthritis: a systematic review of observational studies. Ann. Rheum. Dis., 66(Suppl. II): 320. Abstracts FRI0135.
- 10. Viatte S., Plant D., Han B. et al. (2014) Personalized genetic medicine: amino acid positions 11, 71 and 74 in hla-drb1 predict disease severity, treatment response and mortality in rheumatoid arthritis; multi-centre prospective cohort studies. Ann. Rheum. Dis., 73(Suppl. 2). Abstract OP0190.
- 11. Liakos A., Batley M., Hammond T. et al. (2014) Subcutaneous methotrexate is more efficacious and better tolerated than oral methotrexate: the experience of a large group of patients in the rheumatology department of a district general hospital. Program and abstracts of the European League Against Rheumatism (EULAR) Congress 2014. Paris, France. Abstract ABO593.
- 12. Mueller R., Schiff M.H., Haile S.R. et al. (2014) Effectiveness, tolerability, and safety of subcutaneous methotrexate in early rheumatoid arthritis: clinical data from the St. Gallen cohort. Program and abstracts of the European League Against Rheumatism (EULAR) Congress 2014. Paris, France. Abstract THU0140.
- 13. Gabay C., Hetland M., Hauge E.M. et al. (2014) Retention of tocilizumab therapy: a comparison between tocilizumab in monotherapy and in combination with DMARDS based on the TOCERRA collaboration. Program and abstracts of the European League Against Rheumatism (EULAR) Congress 2014. Paris, France. Abstract SAT0036.
- 14. Finckh A., Neto D., Bomez-Reino J. et al. (2014) The impact of DMAR co-thearpy on abatacept effectiveness in rheumatoid arthritis patients. A pan-European analysis of RA registries. Program and abstracts of the European League Against Rheumatism (EULAR) Congress 2014. Paris, France. Abstract FRU0298.
- 15. Taeuchi T., Kaneko Y., Atsumi T. et al. (2014) Induction of clinical remission followed by drug-free withdrawal with abatacept combination and monotherapy in erly RA: results from the AVERT study over 18 months. Program and abstracts of the European League Against Rheumatism (EULAR) Congress 2014. Paris, France. Abstract SAT0257.
- 16. Takahashi N., Kojima T., Funahashi K. et al. (2014) on behalf of the TBCR Study Group. Impact of concomitant methotrexate on the enhanced clinical efficacy of abatacept after 24 weeks in rheumatoid arthritis patients. Program and abstracts of the European League Against Rheumatism (EULAR) Congress 2014. June 11–14, 2014. Paris, France. Abstract SAT0243.
- 17. Truchetet M.E., Poursac N., Barnetche T. et al. (2014) Maintenance and efficacy of abatacept monotherapy compared to abatacept + conventional synthetic DMARD in patients with rheumatoid arthritis: data from ORA Registry. Program and abstracts of the European League Against Rheumatism (EULAR) Congress. June 11–14, 2014. Paris, France. Abstract SAT0236.
- 18. Dowty M., Lin T., Wang L. et al. (2014) Ack of differentiation of janus kinase inhibitors in rheumatoid arthritis based on janus kinase pharmacology and clinically meaningful concentrations. Ann. Rheum. Dis., 73(Suppl. 2). Abstract OP0147.
- 19. Alten R., Strand V., Fleischmann R. et al. (2014) Effects of tofacitinib monotherapy versus methotrexate on patient-reported outcomes in the 2-year phase 3 oral start trial in methotrexate-naïve patients with rheumatoid arthritis. Ann. Rheum. Dis., 73(Suppl. 2). Abstract OP0152.
- 20. van Vollenhoven R., Genovese M.C., Zhang Y. et al. (2014) A phase 2B, 24-week study of VX-509 (decernotinib), an oral selective janus kinase 3 inhibitor, in combination with background methotrexate in rheumatoid arthritis. Program and abstracts of the European League Against Rheumatism (EULAR) Congress 2014; June 11–14; Paris, France. Abstract OPO151.
- 21. Namour F., Tsset C., van’t Klooster G. et al. (2014) Dose selection of GLPG0634, a selective JAK1 inhibitor, for rheumatoid arthritis phase 2B studies: PK/PD and exposure-DAS28 modeling approach. Program and abstracts of the European League Against Rheumatism (EULAR) Congress. June 11–14, 2014. Paris, France. Abstract THU0123.
- 22. Croft A., Thompson N., Duddy M. et al. (2014) Can we replace temporal artery biopsy with cranial ultrasound for the diagnosis of giant cell arteritis? A retrospective cohort study of the diagnostic utility of ultrasound in routine clinical practice. Ann. Rheum. Dis., 73(Suppl. 2). Abstract OP00056.
- 23. Terslev L. (2014) Ten EULAR recommendations for use of imaging in spondyloarthritis clinical practice. Ann. Rheum. Dis., 73(Suppl. 2). Abstract SP0143.
- 24. Beyer C., Zampetaki A., Lin N.Y. et al. (2014) Signature of circulating microRNAs in osteoarthritis. Ann. Rheum. Dis., 73(Suppl. 2). Abstract OP0003.
- 25. Michetti P., Weinman J., Mrowietz U. et al. (2014) Multi-country, cross-sectional study to determine patient-specific and general beliefs towards medication and their treatment adherence to selected systemic therapies in 6 chronic immune-mediated inflammatory diseases (ALIGN). Ann. Rheum. Dis., 73(Suppl. 2). Abstract 0198.
- 26. Touma Z., Gladman D.D., Ibanez D. et al. (2014) DO we know how and when to stop immunosuppressants in lupus patients? Ann. Rheum. Dis., 73(Suppl. 2). Abstract OP0042.
Адрес для переписки:
Коваленко Владимир Николаевич
03680, Киев, ул. Народного ополчения, 5
ГУ «Национальный научный центр
«Институт кардиологии им. Н.Д. Стражеско
НАМН Украины»

Leave a comment