СПІЛЬНІСТЬ І ВІДМІННОСТІ ЗМІН АДСОРБЦІЙНО-РЕОЛОГІЧНИХ ВЛАСТИВОСТЕЙ КРОВІ ПРИ ПЕРВИННому СИСТЕМНому ВАСКУЛІТі
Синяченко О.В., Герасименко А.М. , Синяченко П.О., Наумович М.А.
Резюме. Резюме. Мета і завдання роботи — порівняльна оцінка клініко-патогенетичної значущості змін адсорбційно-реологічних властивостей крові (АРВК) у хворих на геморагічний васкуліт (ГВ), есенціальний кріоглобулінемічний васкуліт (КВ) і мікроскопічний поліангіїт (МПА), визначення зв’язків із параметрами ендотеліальної функції судин. Об’єкт і методи. Обстежено 116 хворих (53 — із ГВ, 34 — із КВ, 29 — із МПА). З використанням комп’ютерних тензіометрів «MPT 2-Lauda», «ADSA-Toronto» та «PAT2-Sinterface» вивчали поверхневі в’язкість (ПВ), пружність (ПП) і натяг (ПН) сироватки крові, модуль її в’язкопружності (ВП), час релаксації (ЧР), підраховували кут нахилу (КН) і фазовий кут (ФК) тензіограм, а за допомогою віскозиметра «Low-Shear-30» досліджували об’ємну в’язкість (ОВ) крові. Результати та їх обговорення. ГВ, КВ та МПА характеризуються підвищенням ОВ і ПН сироватки крові на тлі зниження ВП та незмінених показників ЧР. Існують певні відмінності порушень АРВК у хворих з окремими нозологічними формами системного васкуліту, які виявляються відсутністю змін КН тензіограм при ГВ, ПВ при КВ і ФК при МПА, впливом ОВ на тяжкість суглобового синдрому при ГВ, ПВ при КВ і ПП при МПА, залежністю вираженості уражень шкіри у разі ГВ від стану міжфазної активності сироватки крові, нервової системи у пацієнтів із КВ, від об’ємних віскозних властивостей крові, нирок при МПА від поверхневих віскозних. Спостерігається тісний взаємозв’язок змін АРВК і ендотеліальної функції судин. Висновки. При ГВ, КВ та МПА існують спільність і відмінності АРВК, які пов’язані з ендотеліальною дисфункцією судин і беруть участь у патогенетичній побудові захворювань.
Введение
Первичный системный васкулит (СВ) является гетерогенной группой заболеваний, характеризующихся воспалением и некрозом сосудистой стенки, которых объединяет неизвестная этиология, недостаточно изученный патогенез, полиорганность поражения и, зачастую, неблагоприятный прогноз (Markoviс A., 2012; Ruperto N., 2012; Дядык А.И., 2013; Шилкина Н.П., Дряженкова И.В., 2013). Распространенность СВ неуклонно повышается, составляя 0,02% численности всего населения (Mohammad A.J. et al., 2009). К самым частым иммунокомплексным СВ относятся геморрагический (ГВ) и криоглобулинемический васкулит (КВ), а среди СВ, ассоциированных с антинейтрофильными цитоплазматическими антителами (АНЦА) — микроскопический полиангиит (МПА). Согласно последним эпидемиологическим исследованиям, распространенность ГВ среди взрослого населения достигает 30 человек на 100 тыс. населения (Piram M., Mahr A., 2013), а МПА — 130 человек (Watts R.A. et al., 2012).
Подчеркивается как клинико-патогенетическая общность СВ, так и определенные отличия отдельных нозологических форм (Fishbein G.A., Fishbein M.C., 2011; Gibelin A. et al., 2011; Shin J.I. et al., 2011; Кузьміна А.П., 2013). Дифференциальная диагностика является довольно сложной, поскольку клиническая симптоматика СВ характеризуется наличием «перекрещивающихся синдромов» (Шилкина Н.П., Дряженкова И.В., 2013). Для СВ характерна повышенная вязкость крови с ее гиперкоагуляцией, высокой агрегацией тромбоцитов и наличием антифосфолипидных антител (Duval A., Pouchot J., 2008; Finke C. et al., 2011; Стрижаков Л.А. и соавт., 2012).
Необходимо отметить, что всем СВ присуща эндотелиальная дисфункция сосудов (Biasucci L.M., Cardillo M.T., 2012; Stillman I.E., Karumanchi S.A., 2012), которая определяется иммунными воспалительно-некротическими изменениями в стенках сосудов (Tzoulaki I. et al., 2007; Шилкина Н.П., 2010). Наличие циркулирующих антител при СВ изменяет физико-химические свойства крови (Kumano Y. et al., 2012; Monach P.A. et al., 2012), что негативно влияет на эндотелиоциты сосудистой стенки (Haubitz M. et al., 2009). Нарушения поверхностно-активных, релаксационных и вязкоэластичных свойств крови уже установлены при вторичном васкулите, обусловленном системными заболеваниями соединительной ткани (Синяченко О.В., 2011). На хорошие перспективы изучения адсорбционно-реологических свойств крови (АРСК) при заболеваниях сосудов указывают K. Kotani и соавторы (2008), Y.P. Chui и P.A. Heng (2010). Существует связь жесткости сосудистой стенки и периферического сосудистого сопротивления с параметрами межфазной (поверхностной) активности крови (Martin E.M. et al., 2010). Цель и задачи данной работы — сравнительная оценка клинико-патогенетической значимости изменений физико-химических АРСК у больных ГВ, КВ и МПА, определение связей с параметрами эндотелиальной функции сосудов (ЭФС).
Объект и методы исследования
Под наблюдением находились 116 больных СВ, среди которых было 53 пациента (60% мужчин и 40% женщин в возрасте 15–53 лет) с ГВ, 34 (38% мужчин и 62% женщин в возрасте 30–70 лет) — с эссенциальным КВ, 29 (59% мужчин и 41% женщин в возрасте 36–58 лет) — с МПА. Средний возраст больных ГВ составил 28,9±1,37 года, КВ — 53,7±1,59 года, МПА — 45,7±1,28 года, длительность заболевания — соответственно 8,5±0,80; 3,6±0,28 и 5,6±0,57 года, І, ІІ, ІІІ степень активности ГВ констатирована соответственно в 15; 38 и 47% наблюдений, КВ — в 6; 41 и 53%, МПА — в 24; 45 и 31%.
Патология почек у больных ГВ диагностирована в 70% наблюдений, сердца — в 53%, при КВ — соответственно в 62 и 40%, при МПА — в 82 и 59%. Показатели скорости клубочковой фильтрации (по формуле Кокрофта — Голта) составили соответственно 102,7±5,33; 113,6±3,2 и 115,1±2,91 мл/мин, среднего артериального давления — 120,8±3,09; 106,0±2,28 и 113,7±3,13 мм рт. ст., общего периферического сосудистого сопротивления — 2833,3±173,57; 2545,9±109,1 и 3037,9±141,89 дин · с · см.
Гипер-IgA-емия (>M+SD показателей здоровых) выявлена у 89% больных ГВ, а параметры IgA/SIg составили 12,3±0,77%. На момент обследования криоглобулины в крови выявлены в 94% наблюдений КВ, носительство вирусного гепатита В — в 18%, гепатита С — в 44%. Наличие АНЦА в крови (антител к протеиназе-3 — АП3 и к миелопероксидазе — АМП) имело место у 28% пациентов с ГВ (во всех случаях АП3), у 21% — с КВ (АМП) и у 90% больных МПА (АП3 — у 31%, АМП — у 81%, АП3 + АМП — у 22%). Кроме того, у 6% больных ГВ выявлены в крови антитела к нативной дезоксирибонуклеиновой кислоте (АДНК), а у 15% — антитела к кардиолипину (АКЛ), при МПА — соответственно в 4 и 72% наблюдений, серопозитивность по ревматоидному фактору отмечена у 9% пациентов с ГВ и у 17% — с МПА.
Межфазную тензиореометрию сыворотки крови проводили с использованием компьютерного аппарата «MPT2-Lauda» (Германия), основанного на методе максимального давления в пузырьке, «ADSA-Toronto» (Германия-Канада), основанного на методе анализа формы осесимметричных капель, и «PAT2-Sinterface» (Германия), основанного на методе осциллирующей капли. Изучали поверхностные вязкость (ПВ) и упругость (ПУ) сыворотки крови, модуль ее вязкоупругости (ВУ), равновесное (статическое) поверхностное натяжение (ПН), подсчитывали угол наклона (УН) и фазовый угол (ФУ) тензиограмм. В наших исследованиях применяли быструю стрессовую деформацию расширения поверхности при времени 1200 с. После расширения капли ПН медленно релаксировало, возвращаясь к своему первоначальному значению. Время релаксации (ВР) характеризовало способность монослоя восстанавливать исходное состояние. С помощью ротационного вискозиметра «Low-Shear-30» (Швейцария) дополнительно исследовали объемную вязкость (ОВ) сыворотки крови.
Иммуноблотинговым методом (наборы «Euroline-Euroimmun»», Германия) исследовали АП3 и АМП, иммуноферментным — АДНК и АКЛ, концентрации вазоконстрикторов эндотелина-1 и тромбоксана-A2, вазодилататоров простациклина и циклического аденозинмонофосфата (ридер «PR2100-Sanofi diagnostic pasteur», Франция). С помощью биоанализаторов «ВS-200» (Китай) и «Olympus-AU-640» (Япония) определяли сывороточное содержание общего белка, альбуминов, С-реактивного протеина, β2-микроглобулина, фибриногена, иммуноглобулинов (Ig) A, G, M, циркулирующих иммунных комплексов и ревматоидного фактора. В качестве контроля обследованы 52 практически здоровых человека, среди которых было 35% мужчин и 65% женщин в возрасте от 18 до 58 лет (в среднем — 32,9±1,31 года).
Статистическую обработку полученных результатов исследований проводили с помощью компьютерного вариационного, непараметрического, корреляционного, одно- (ANOVA) и многофакторного (ANOVA/MANOVA) дисперсионного анализа (программы «Microsoft Excel» и «Statistica-Stat-Soft», США). Оценивали средние значения (M), их стандартные ошибки (m), стандартные отклонения (SD), коэффициенты корреляции, критерии дисперсии, Стьюдента, Уилкоксона — Рао, Макнемара — Фишера и достоверность статистических показателей (р).
Результаты исследования
Параметры АРСК у здоровых и больных людей представлены в табл. 1. При ГВ наблюдается повышение ОВ и ФУ тензиограмм при уменьшении ПВ и ВУ, что соответственно отмечается у 42; 55; 47 и 19% обследованных пациентов, причем интегральные АРСК зависят от степени активности и тяжести течения патологического процесса, поражений поджелудочной железы, нервной системы и сердца, а отдельные физико-химические показатели определяются функцией почек, изменениями со стороны желудочно-кишечного тракта и печени.
Проведенный корреляционный анализ показал наличие достоверных связей значений ПВ с длительностью заболевания и величиной клубочковой фильтрации, ОВ — со степенью активности ГВ и уровнем фибриногенемии, ВУ и ВР — с тяжестью течения патологического процесса, ПН — с активностью болезни и параметрами в крови С-реактивного протеина, β2-микроглобулина, IgA и ревматоидного фактора. С учетом данных дисперсионного и корреляционного анализа сделано заключение, имеющее определенную практическую значимость: о высокой степени активности ГВ свидетельствуют показатели ОВ >2 мПа · с и ПН >72 мН/м (>M±SD больных).
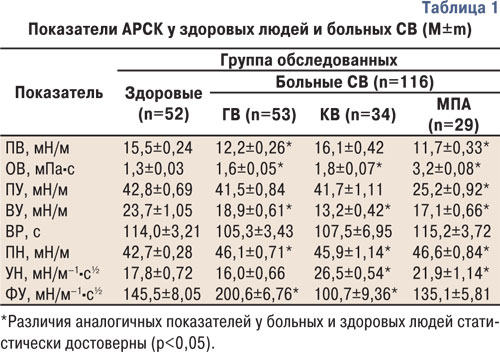
По сравнению с показателями у здоровых людей контрольной группы при КВ имеет место увеличение ОВ на 39%, ПН — на 8% и УН — на 49% при уменьшении ВУ на 44% и ФУ на 31% (рис. 1), что соответственно выявлено у 41; 47; 82; 94 и 35% обследованных больных, зависит от тяжести поражений сердца, почек и нервной системы, связано с диастолической дисфункцией левого желудочка сердца, с параметрами артериального давления и периферического сосудистого сопротивления.
С возрастом у больных КВ снижаются показатели ВУ, но повышаются значения УН, что демонстрирует корреляционный анализ. Степень активности заболевания прямо соотносится с уровнем ПН, среднее артериальное давление — обратно с ВУ, а периферическое сосудистое сопротивление — с ВУ и ОВ. Показатели ПВ и ВР разнонаправленно коррелируют с уровнем фибриногенемии (соответственно позитивная и негативная связь), ОВ — обратно с носительством антигена вируса гепатита С, ПУ — прямо c концентрацией IgG, ПН — имеет позитивные корреляционные связи со значениями криоглобулинемии. Полагаем, что показатель ОВ <1,4 мПа · с (<M±SD больных) может косвенно указывать на HVC-носительство при КВ, а ПН >52,5 мН/м (>M±SD больных) — отражать выраженность криоглобулинемии.
Как свидетельствует ANOVA, на тяжесть суставного синдрома оказывает патогенетическое влияние ПВ, неврологических расстройств — ОВ, на нарушения электрической проводимости сердца — ВУ, на развитие диастолической дисфункции левого желудочка сердца — ВР.
МПА сопровождается достоверным уменьшением на 24% ПВ, на 41% — ПУ и на 28% — ВУ при повышении в 2,5 раза ОВ, на 9% — ПН и на 23% — УН, что соответственно наблюдается у 90; 97; 31; 100; 7 и 55% больных, причем АРСК участвуют в патогенезе заболевания, имеют гендерные особенности, зависят от степени активности патологического процесса, наличия артериальной гипертензии, нефротического синдрома и почечной недостаточности, степени поражения суставов и внутренних органов, а отдельные физико-химические показатели тесно связаны с уровнем в крови общего белка, иммуноглобулинов, циркулирующих иммунных комплексов, ревматоидного фактора, АДНК и АКЛ. У мужчин с МПА на 20% выше показатели ПВ и на 22% — ВУ, но на 14% ниже значения ОВ (см. рис. 1). Такие гендерные особенности параметров АРСК обусловливают половой диморфизм клинического течения заболевания.
С учетом вариационного, дисперсионного и корреляционного анализа сделаны заключения, имеющие определенную практическую значимость: 1) показатели ОВ >3,6 мПа · с и ВУ <13,5 мН/м (больше или меньше M±SD больных) отражают высокую степень активности МПА; 2) параметры ВР >135 с (>M±SD больных с повышенным артериальным давлением) являются прогнознегативными в отношении артериальной гипертензии.
При МПА тяжесть поражения кожи, клапанного аппарата сердца, нервной системы и аорты, а также наличие диастолической дисфункции левого желудочка сердца никак не связаны с АРСК. В свою очередь, по данным ANOVA, степень активности заболевания зависит от показателей ПВ, ОВ и ВУ, выраженность поражений суставов — от ПУ, сердца — от ОВ, почек — от ПУ и ПН, развитие нарушений возбудимости миокарда — от ВР, электрической проводимости сердца — от ВУ, размеры камер сердца — от ОВ, периферическое сосудистое сопротивление — от ПВ, среднее артериальное давление и скорость клубочковой фильтрации — от ПВ, ОВ и ПУ.
Обсуждение результатов
Общностью всех СВ стало повышение вязких свойств и межфазной активности сыворотки крови, что отражает близкие изменения состава белково-липидных поверхностно-активных веществ (сурфактантов) и инсурфактантов (поверхностно-неактивных), например неорганических электролитов. Такие макроэлементы, как K, Na, Ca, Mg, Cl, содержащиеся в сыворотке крови больных СВ, небелковые азотистые продукты (аммиак, нитраты, нитриты, мочевина, мочевая кислота и пр.) и углеводы существенно изменяют ПН этой биологической жидкости. Указанные компоненты влияют на интегральные физико-химические свойства самой крови и на структуру белка, связывая или ионизируя аминокислотные группы, взаимодействуя с полипептидной цепью, нарушая конформацию молекулы в объеме и поверхностном слое. Общность и различия АРСК при ГВ, КВ и МПА нашли отражение в табл. 2.
Изменение концентраций поверхностно-активных веществ в крови больных СВ существенно однонаправленно влияют на дилатационные реологические характеристики сывороточного альбумина (Lucassen-Reynders E.H. et al., 2010). Результаты исследований in vitro свидетельствуют, что если для раствора чистого протеина характерно быстрое уменьшение ФУ в исследованном диапазоне частот (практически до нуля), то небольшие добавки других сурфактантов уже существенно увеличивают ФУ тензиограмм и уменьшают ВУ (Fainerman V.B. et al., 2010; Mir M.A. et al., 2010; Nag K. et al., 2010). Эти изменения АРСК имеют место при всех СВ.
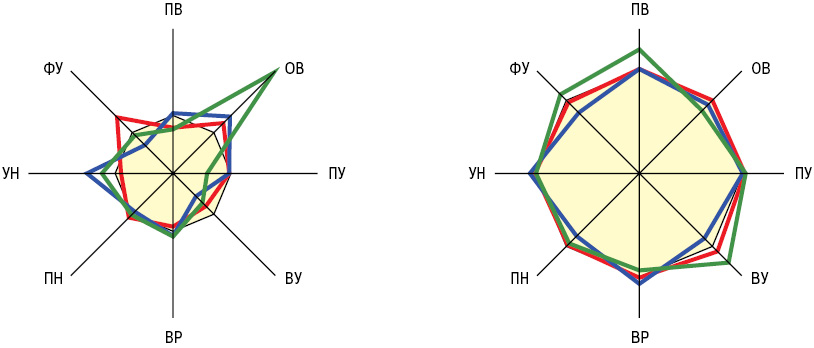
Различия параметров вязкоупругих (вязкоэластичных) свойств крови, УН и ФУ тензиограмм представлены на рис. 2 и 3. Если при ГВ отсутствуют изменения параметров УН, то у больных КВ — значений ПВ, а в случаях МПА — ФУ. Эти составляющие тензиограмм могут иметь дифференциально-диагностическое значение при характеристике отдельных СВ. Отметим, что высокая ОВ в сыворотке крови, по данным дисперсионного анализа ANOVA, при ГВ определяет тяжесть суставного синдрома (распространенность, индексы Ричи, Лансбури и рентгеносонографической тяжести артрита), при КВ — поражение нервной системы (моно- и полинейропатия, радикулопатия, цервикокраниалгия, дисциркуляторная энцефалопатия, астеновегетативный и кортиконуклеарный синдромы), при МПА — функциональное состояние почек.

Во всех группах больных отмечены нормальные релаксационные свойства сыворотки крови. При этом у пациентов с КВ отсутствует дисперсионное влияние ПУ на почки, а в случаях МПА — обратная корреляционная связь показателя ПУ со скоростью клубочковой фильтрации. В этой связи отметим, что изменения площади межфазной поверхности капли сыворотки крови нарушают адсорбционное равновесие и инициируют процессы, которые ведут к восстановлению равновесного (статического) состояния системы (Zholob S.A. et al., 2007; Kotsmar C. et al., 2009). Такими восстановительными процессами являются диффузионный перенос вещества из объема к поверхности капли, процессы адсорбции/десорбции сурфактанта, конформационные сдвиги или агрегация адсорбированных молекул, а также химические реакции в поверхностном слое. Параметры ПУ у больных МПА достоверно отличаются от аналогичных значений при КВ. Гипотетически, изменение площади поверхности капли сыворотки крови у больных МПА происходит не по гармоническому закону синусоидальных деформаций, а связь между изменением площади поверхности и ответом системы на это воздействие ПУ может быть выражена через дилатационный модуль, учитывающий все релаксационные процессы (Kovalchuk N.M. et al., 2007; Kaliviotis E., Yianneskis M., 2009; Fainerman V.B. et al., 2010). Дилатационный модуль характеризует ПУ межфазных слоев.
Все СВ сопровождаются эндотелиальной дисфункцией сосудов (Biasucci L.M., Cardillo M.T., 2012; Stillman I.E., Karumanchi S.A., 2012), которая во многом определяется иммунными воспалительно-некротическими изменениями сосудистых стенок с нарушениями реологических свойств крови (Tzoulaki I. et al., 2007; Шилкина Н.П., 2010). Проблема гемореологии охватывает множество взаимосвязанных и взаимообусловленных процессов, среди которых выделяют закономерности циркуляции крови в сосудах и поведения клеток (адгезия, агрегация, деформация), свертывания крови (коагуляция, фибринолиз, тромбообразование) и транскапиллярный обмен (Brunette J. et al., 2012). Нарушение АРСК закономерно участвует в патогенетических построениях при атеросклеротических поражениях сосудов, а такой параметр, как ОВ, самым тесным образом связан с ЭФС, процессами вазоконстрикции/вазодилатации (Baskurt O.K., 2008).
По нашим данным, с параметрами ЭФС при СВ не связаны ПВ, ПУ, ВУ и УН тензиограмм, тогда как с концентрацией эндотелина-1 у больных ГВ и КВ существуют достоверные корреляции уровней ОВ, ВР, ПН и ФУ. Кроме того, при МПА ОВ и ВР обратно соотносятся с содержанием простациклинемии. Параметры циклического гуанозинмонофосфата в случаях ГВ прямо коррелируют с ФУ и обратно — с ПН.
Показатели ПН у больных ГВ и КВ дисперсионно влияют на концентрацию в крови циклического гуанозинмонофосфата и содержание эндотелина-1. Помимо сказанного, уровень простациклина зависит от состояния ПВ, эндотелина-1 — от ВР и ОВ. С последним показателем при ГВ отмечают прямые корреляционные связи индексов агрегации тромбоцитов и эритроцитов. Следует подчеркнуть, что у больных ГВ наблюдаются процессы гиперкоагуляции крови с высокой агрегационной способностью тромбоцитов и и эритроцитов (Стрижаков Л.А. и соавт., 2012).
Выводы
1. СВ (ГВ, КВ, МПА) характеризуются повышением ОВ и ПН в сыворотке крови на фоне снижения ВУ и неизмененных показателей ВР этой биологической жидкости, а параметры ВУ имеют гендерные особенности и способны оказывать патогенетическое влияние на клинические признаки поражения сердца.
2. Существуют определенные различия нарушений АРСК у больных с отдельными нозологическими формами СВ, которые проявляются отсутствием изменений УН тензиограмм при ГВ, ПВ при КВ и ФУ при МПА, влиянием ОВ на тяжесть суставного синдрома при ГВ, ПВ — при КВ и ПУ — при МПА, зависимостью выраженности поражений кожи в случаях ГВ от состояния межфазной активности сыворотки крови, нервной системы у пациентов с КВ, от объемных вискозных свойств крови, почек при МПА от поверхностных вискозных.
3. Наблюдаются тесные взаимосвязи изменений АРСК и ЭФС, которые при всех СВ проявляются влиянием параметров эндотелинемии на ОВ в сыворотке крови, при ГВ, кроме того — на ВР, при КВ — на ПВ, при МПА — на ПУ, а для КВ характерна связь объемных вязких свойств крови с показателями тромбоксанемии на фоне отсутствия зависимости от значений простациклинемии, что может стать критериями дифференциальной диагностики отдельных СВ.
Список использованной литературы
- Дядык А.И. (2013) Системные васкулиты в современной клинической практике. Издатель Заславский, Донецк, 248 с.
- Кузьміна А.П. (2013) Клінічна схожість симптомів системних васкулітів при різному походженні. Укр. ревматол. журн., 53(3): 133–134.
- Синяченко О.В. (2011) Адсорбционно-реологические свойства биологических жидкостей в ревматологии. Донеччина, Донецк, 286 с.
- Стрижаков Л.А., Моисеев С.В., Семенкова Е.Н. и др. (2012) Сердечно-сосудистые осложнения и дисфункция эндотелия при системных васкулитах. Тер. арх., 84(5): 31–36.
- Шилкина Н.П. (2010) Ревматические болезни и атеросклероз: роль реологического и микроциркуляторного ухудшения. Ангиол. сосуд. хир., 16(2): 23–29.
- Шилкина Н.П., Дряженкова И.В. (2013) Системные васкулиты: этапы диагностики. Тер. арх., 85(4): 39–42.
- Baskurt O.K. (2008) In vivo correlates of altered blood rheology. Biorheology, 45(6): 629–638.
- Biasucci L.M., Cardillo M.T. (2012) Biomarkers of inflammation and endothelial function: the holy grail of experimental and clinical medicine? Vascul. Pharmacol., 56(1–2): 26–28.
- Brunette J., Mongrain R., Laurier J. et al. (2012) 3D flow study in a mildly stenotic coronary artery phantom using a whole volume PIV method. Med. Eng. Phys., 30(9): 1193–1200.
- Chui Y.P., Heng P.A. (2010) A meshless rheological model for blood-vessel interaction in endovascular simulation. Prog. Biophys. Mol. Biol., 103(2–3): 252–261.
- Duval A., Pouchot J. (2008) Livedo: from pathophysiology to diagnosis. Rev. Med. Interne, 29(5): 380–392.
- Fainerman V.B., Aksenenko E.V., Petkov J.T. et al. (2010) Adsorption layer characteristics of mixed oxyethylated surfactant solutions. J. Phys. Chem. B., 114(13): 4503–4508.
- Finke C., Schroeter J., Kalus U. et al. (2011) Plasma viscosity in giant cell arteritis. Eur. Neurol., 66(3): 159–164.
- Fishbein G.A., Fishbein M.C. (2011) Lung vasculitis and alveolar hemorrhage: pathology. Semin. Respir. Crit. Care Med., 32(3): 254–263.
- Gibelin A., Maldini C., Mahr A. (2011) Epidemiology and etiology of wegener granulomatosis, microscopic polyangiitis, churg-strauss syndrome and goodpasture syndrome: vasculitides with frequent lung involvement. Semin. Respir. Crit. Care Med., 32(3): 264–273.
- Haubitz M., Dhaygude A., Woywodt A. (2009) Mechanisms and markers of vascular damage in ANCA-associated vasculitis. Autoimmunity, 42(7): 605–614.
- Kaliviotis E., Yianneskis M. (2009) An energy-rate based blood viscosity model incorporating aggregate network dynamics. Biorheology, 46(6): 487–508.
- Kotani K., Adachi S., Osaki Y. et al. (2008) Relationship between alcohol habits and hemorheology by a micro channel method in a general population. Clin. Cardiol., 31(10): 488–491.
- Kotsmar C., Pradines V., Alahverdjieva V.S. et al. (2009) Thermodynamics, adsorption kinetics and rheology of mixed protein-surfactant interfacial layers. Adv. Colloid Interface Sci., 150(1): 41–54.
- Kovalchuk N.M., Vollhardt D., Fainerman V.B. et al. (2007) Recognition and dissociation kinetics in the interfacial molecular recognition of barbituric acid by amphiphilic melamine-type monolayers. J. Phys. Chem. B., 111(28): 8283–8289.
- Kumano Y., Yoshida N., Fukuyama S. et al. (2012) Central retinal artery occlusion in a patient with ANCA-negative Churg-Strauss syndrome. Clin. Ophthalmol., 6: 1225–1228.
- Lucassen-Reynders E.H., Benjamins J., Fainerman V.B. (2010) Dilational rheology of protein films adsorbed at fluid interfaces. Curr. Op. Coll. Interf. Sci., 15: 264–270.
- Markoviс A. (2012) Vasculitis and vasculopathy. Acta Med. Croatica, 66(1): 19–24.
- Martin E.M., Duck F.A., Ellis R.E. et al. (2010) Ultrasound-induced contraction of the carotid artery in vitro. Ultrasound. Med. Biol., 36(1): 166–172.
- Mir M.A., Khan J.M., Khan R.H. et al. (2010) Effect of spacer length of alkanediyl-alpha,omega-bis(dimethylcetylammonium bromide) gemini homologues on the interfacial and physicochemical properties of BSA. Colloids Surf. B. Biointerfaces., 77(1): 54–59.
- Mohammad A.J., Jacobsson L.T., Westman K.W. et al. (2009) Incidence and survival rates in Wegener’s granulomatosis, microscopic polyangiitis, Churg-Strauss syndrome and polyarteritis nodosa. Rheumatology, 48(12): 1560–1565.
- Monach P.A., Kümpers P., Lukasz A. et al. (2012) Circulating angiopoietin-2 as a biomarker in ANCA-associated vasculitis. PLoS One, 7(1): 30197.
- Nag K., Vidyashankar S., Devraj R. et al. (2010) Physicochemical studies on the interaction of serum albumin with pulmonary surfactant extract in films and bulk bilayer phase. J. Colloid Interface Sci., 352(2): 456–464.
- Piram M., Mahr A. (2013) Epidemiology of immunoglobulin A vasculitis (Henoch-Schönlein): current state of knowledge. Curr. Opin. Rheumatol., 11(1): 75–77.
- Ruperto N. (2012) Paediatric rheumatology international trials organisation (PRINTO). Classification criteria and diagnostic tests for vasculitides. J. Rheumatol., 39(8): 1503–1505.
- Shin J.I., Park S.J., Kim J.H. (2011) Coexistent Wegener’s granulomatosis and Goodpasture’s disease: what is the mechanism? J. Rheumatol., 38(7): 1521–1523.
- Stillman I.E., Karumanchi S.A. (2012) Vasculitis is an antiangiogenic state J. Am. Soc. Nephrol., 23(1): 8–10.
- Tzoulaki I., Murray G.D., Lee A.J. et al. (2007) Inflammatory, haemostatic, and rheological markers for incident peripheral arterial disease: Edinburgh Artery Study. Eur. Heart J., 28(3): 354–362.
- Watts R.A., Mooney J., Skinner J. et al. (2012) The contrasting epidemiology of granulomatosis with polyangiitis (Wegener’s) and microscopic polyangiitis. Rheumatology, 51(5): 926–931.
- Zholob S.A., Makievski A.V., Miller R. et al. (2007) Optimisation of calculation methods for determination of surface tensions by drop profile analysis tensiometry. Adv. Colloid Interface Sci., 31(134–135): 322–329.
Адрес для переписки:
Синяченко Олег Владимирович
83003, Донецк, просп. Ильича, 16
Донецкий Национальный медицинский
университет им. Максима Горького,
кафедра пропедевтики внутренней
медицины и общей практики —
семейной медицины
Е-mail: synyachenko@ukr.net

Leave a comment