АНЕМІЯ У ХВОРИХ НА АНКІЛОЗИВНИЙ СПОНДИЛІТ, ОСОБЛИВОСТІ ГЕМОПОЕЗУ ТА ФЕРОКІНЕТИКИ ЗАЛЕЖНО ВІД ЇЇ ПАТОГЕНЕТИЧНОГО ТИПУ
Shevchuk O.V.1, Zviahina O.V.2
- 1Науково-дослідний інститут реабілітації інвалідів Вінницького національного медичного університету ім. М.І. Пирогова МОЗ України
- 2Вінницький національний медичний університет ім. М.І. Пирогова
Резюме. Мета. Вивчити частоту та спектр анемії у хворих на анкілозивний спондиліт (АС), охарактеризувати особливості їх гемопоезу та ферокінетики, а також визначити зв’язок зі статтю, віком і тривалістю захворювання. Об’єкт і методи. Під спостереженням перебували 118 пацієнтів з діагнозом АС відповідно до модифікованих критеріїв Нью-Йорка. Групу контролю становили 26 практично здорових осіб, репрезентативних за віком і статтю. Анемію встановлювали при рівні гемоглобіну нижче 120 г/л. Для оцінки гемопоезу та ферокінетики проводили вимірювання рівня гемоглобіну, еритроцитів, MCV, рівня заліза та феритину в сироватці крові, загальної залізозв’язуючої здатності сироватки крові (ЗЗЗС), коефіцієнт насичення трансферину та розчинні рецептори трансферину. Результати. Анемія у хворих на АС виявляється у 28,8% випадків, а ще у 10 (11,9%) реєструють латентний дефіцит заліза. Спектр анемії представлений анемією хронічного захворювання (АХЗ) — 44,1%, АХЗ з дефіцитом заліза (29,4%) та залізодефіцитною анемією (ЗДА) — 23,5%. За цитометричною характеристикою ЗДА у 75% пацієнтів мікроцитарна, а АХЗ і АХЗ з дефіцитом заліза — у 86,8 та 70% відповідно — нормоцитарна. Зміни гемопоезу та ферокінетики у хворих на АС із ЗДА характеризувалися найвищими рівнями еритроцитів, ЗЗЗС та розчинних рецепторів трансферину, мікроцитозом та найнижчими рівнями заліза в сироватці крові, коефіцієнта насичення трансферину та феритину. У пацієнтів з АХЗ спостерігалися помірні зміни обміну заліза, пацієнти з АХЗ із супутнім дефіцитом заліза за цими показниками займали проміжні позиції. Обговорення. Отримані нами дані зіставні з результатами інших дослідників, які вказують, що частота анемії в різних етнічних групах хворих на АС варіює в межах 18,5–45,8% (Braun J. et al., 2009; Kim K.J., Cho C.S., 2012; Щербаков Г.И. и соавт., 2016; Bulut Y. et al., 2017). Висновки. Анемію у хворих на АС виявлено у 28,8% випадків. Анемічний синдром був представлений АХЗ, АХЗ із дефіцитом заліза та ЗДА. ЗДА була переважно мікроцитарного характеру, а АХЗ і АХЗ із дефіцитом заліза — нормоцитарного. Спрямованість змін гемопоезу та ферокінетики у хворих на АС залежить від типу анемії.
УДК 616.155.194:616.721-002.77:612.119+575.1
DOI: 10.32471/rheumatology.2707-6970.78.13002
ВСТУП
Анемія є поширеним ускладненням анкілозивного спондиліту (АС), що асоціюється з активністю захворювання, вираженістю больового синдрому, втомою та погіршенням прогнозу захворювання (Braun J. et al., 2009; Bes C. et al., 2013; Dagli M. et al., 2014). Точна поширеність анемії у хворих на АС невідома, однак в ряді досліджень залежно від етнічної приналежності, тяжкості перебігу захворювання, особливостей лікування вона варіює в межах 18,5–45,8% (Braun J. et al., 2009; Kim K.J., Cho C.S., 2012; Щербаков Г.И. и соавт., 2016; Bulut Y. et al., 2017).
Основними причинами анемії у хворих на АС є дефіцит факторів гемопоезу (заліза, вітаміну В12, фолієвої кислоти), хронічне запалення (анемія хронічного захворювання — АХЗ), автоімунні процеси (автоімунна гемолітична анемія) і токсична дія лікарських препаратів (апластична анемія). Найчастіше у (33,3–78,72)% хворих на АС анемічний синдром представлений АХЗ і у (21,28–66,7)% — залізодефіцитною анемією (ЗДА) (Kim K.J., Cho C.S., 2012; Щербаков Г.И. и соавт. 2016). Однак у багатьох випадках, особливо при ревматичних захворюваннях, анемія є наслідком поєднання ЗДА та АХЗ (Niccoli L. et al., 2012). Дефіцит заліза, що розвивається, призводить до порушень нормального синтезу гемоглобіну і виникнення гіпохромної мікроцитарної анемії. У таких випадках діагностика функціонального дефіциту заліза повинна базуватися не лише на зниженні вмісту гемоглобіну в крові, але й на визначенні кількості ретикулоцитів та дослідженні маркерів обміну заліза (Nairz M. et al., 2016). Отже, підсумовуючи викладене, можна сказати, що патогенез виникнення анемії у хворих на АС є доволі складним і повинен базуватися на отриманні доказів на користь того чи іншого типу анемії, шляхом дослідження стану гемопоезу та ферокінетики. Поширеність анемії у хворих на АС в Подільському регіоні України також невідома.
Мета дослідження — вивчити частоту і спектр анемії у хворих на АС, охарактеризувати особливості їх гемопоезу та ферокінетики, а також визначити зв’язок зі статтю, віком і тривалістю захворювання.
ОБ’ЄКТ І МЕТОДИ ДОСЛІДЖЕННЯ
У дослідженні взяли участь 118 пацієнтів (102 (86,4%) чоловічої та 16 (13,6%) жіночої статі) з АС, що перебували на лікуванні в ревматологічному відділені Науково-дослідного інституту реабілітації осіб з інвалідністю Вінницького національного медичного університету ім. М.І. Пирогова та в ревматологічному відділенні Вінницької міської клінічної лікарні № 1 у 2017–2018 рр. Вік пацієнтів становив 19–75 років, вони відповідали модифікованим Нью-Йоркським критеріям діагностики АС (Linden S.V.D. et al., 1984), надали інформовану згоду для участі в цьому дослідженні, що проводилося відповідно до Гельсінської декларації 1975 р. (переглянуто у 2000 р.). Усіх пацієнтів розподілили на три групи: 84 пацієнти з АС без анемічного синдрому, 34 пацієнти — з анемічним синдром та контрольна група, що включала 26 практично здорових осіб без автоімунних системних захворювань. Виключено було пацієнтів із тяжкими супутніми захворювання у стадії загострення або декомпенсації, наявність яких могла вплинути на результати дослідження, а також тих, хто протягом останнього місяця приймав препарати, що впливають на еритропоез.
Анемію діагностували пацієнтам при зниженні концентрації гемоглобіну <120 г/л та встановлювали на основі діагностичних критеріїв Weiss (Weiss G. et al., 2013). Латентний дефіцит заліза встановлювали особам із рівнем гемоглобіну не нижче 120 г/л та при зниженні рівня заліза в сироватці крові <12 мкмоль/л, підвищенні загальної залізозв’язувальної здатності сироватки крові (ЗЗЗС) >69 мкмоль/л та насиченні трансферину залізом <17%.
При обстеженні у кожного пацієнта вимірювали рівень гемоглобіну (Hb), еритроцитів, MCV, рівень заліза в сироватці крові, ЗЗЗС, феритин у сироватці крові, коефіцієнт насичення трансферину (КНТ), розчинні рецептори трансферину (sTfR).
Усі лабораторні показники визначали загальноприйнятими методами. Гематологічні показники визначали на апараті ERMA PCE-210 (Японія), біохімічні показники — на апараті (аналізатор біохімічний Humalyzer 2000). Вміст sTfR в сироватці крові визначали імуноферментним методом за набором «Soluble Transferrin (sTfR) test system» (Monobind Inc., USA), феритину за набором «Ferritin» (ORGENTEC Diagnostika, Німеччина) відповідно до інструкції фірми-виробника. Статистичну обробку отриманих результатів проводили з використанням пакета статистичних програм «Microsoft Office Excel 2007» з визначенням середнього арифметичного, квадратичного відхилення та середньої помилки середнього арифметичного. Вірогідність результатів оцінювали за допомогою критерію Стьюдента (вірогідними вважалися відмінності при р<0,05) та критерію Фішера.
РЕЗУЛЬТАТИ ТА ЇХ ОБГОВОРЕННЯ
Серед 118 хворих на АС анемію виявляли у 34 (28,8%) хворих. У 27 (79,4%) вона була легкого ступеня тяжкості, у 7 (20,6%) — середнього ступеня. Латентний дефіцит заліза реєструвався у 10 (11,9%) осіб з рівнем гемоглобіну не нижче 120 г/л. Серед всіх осіб з анемією у 15 (44,1%) хворих були ознаки АХЗ, у 10 (29,4%) — АХЗ з функціональним дефіцитом заліза та у 8 (23,5%) — ЗДА (табл. 1). Ще один пацієнт мав ознаки В12/фолієводефіцитної анемії. Рівень гемоглобіну та кількість еритроцитів у всіх групах хворих були достовірно меншими, ніж в контрольній групі. Порівнюючи патогенетичні групи хворих за цими показниками, відмітили, що в осіб із ЗДА рівень гемоглобіну був найнижчим, однак вірогідно не відрізнявся від хворих з АХЗ та АХЗ з дефіцитом заліза. Але ці групи пацієнтів суттєво різнилися за величиною MCV. Найменший (73,49±3,14 фл) середній розмір еритроцитів був в осіб із ЗДА, вірогідно більшим (87,30±3,06 фл) він був у хворих з поєднанням АХЗ та дефіциту заліза і найбільшим (95,17±1,92 фл) — у хворих з АХЗ. В останній групі він був достовірно вищим, ніж у хворих на АХЗ із дефіцитом заліза.
| Показники | Контроль, n=26 | ЗДА, n=8 | АХЗ із дефіцитом заліза, n=10 | АХЗ, n=15 |
|---|---|---|---|---|
| Гемоглобін, г/л | 134,85±1,86 | 92,88±5,78* | 103,20±2,71* | 102,53±2,20* |
| Еритроцити, 1012/л | 4,29±0,08 | 3,69±0,25* | 3,70±0,10* | 3,61±0,08* |
| MCV, фл | 92,17±1,26 | 73,49±3,14* | 87,30±3,06# | 95,17±1,92#& |
| Залізо, мкмоль/л | 15,67±0,86 | 8,30±0,21* | 9,52±0,12*# | 11,51±0,21*#& |
| ЗЗЗС, мкмоль/л | 54,60±1,92 | 74,81±3,18* | 58,09±1,16# | 54,54±0,64#& |
| КНТ, % | 27,48±1,60 | 11,22±0,49* | 16,43±0,30*# | 21,10±0,24*#& |
| Феритин, мкг/л | 29,77±2,33 | 21,98±1,53* | 28,03±5,02 | 34,37±3,03# |
| sTfR, мг/л | 3,29±0,14 | 8,35±0,81* | 4,72±0,43*# | 3,77±0,25# |
| Гематокрит | 0,37±0,00 | 0,27±0,02* | 0,32±0,00*# | 0,34±0,00*#& |
*Вірогідні відмінності щодо групи контролю, p<0,05; #вірогідні відмінності щодо групи хворих із ЗДА, p<0,05; &вірогідні відмінності щодо групи хворих АХЗ+ЗДА, p<0,05.
За цитометричною характеристикою (рисунок) ЗДА у 75% хворих була мікроцитарною та у 25% —нормоцитарною, АХЗ з дефіцитом заліза у 60% — нормоцитарною та у 20% — мікро- та макроцитарною, а АХЗ у 73% — нормоцитарною та у 20% — макроцитарною.
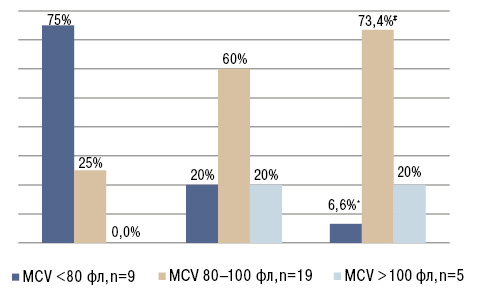
Подібні відмінності між групами виявлені також за показниками ферокінетики. Так, у групі пацієнтів із ЗДА виявлявся достовірно нижчий (не лише від АХЗ, але й АХЗ із дефіцитом заліза) рівень заліза в сироватці крові. У цій же групі найвищою (на 29 та 37% відповідно) була ЗЗЗС. Хворі на ЗДА також характеризувалися найнижчим коефіцієнтом насичення трансферину залізом та гематокритом. КНТ в останній групі був на 46% нижчим, ніж у групі АХЗ із дефіцитом заліза та на 88% — ніж в осіб з АХЗ. Аналіз рівнів феритину в сироватці крові залежно від типу анемії свідчив, що в осіб із ЗДА порівняно з АХЗ рівень феритину був найнижчими, а розчинних рецепторів до трансферину — найвищим. Пацієнти з поєднанням АХЗ із дефіцитом заліза за цими показниками займали проміжне місце між хворими із ЗДА та АХЗ.
Аналіз не виявив особливостей тих чи інших варіантів анемії зі статтю хворих (табл. 2). Лише серед пацієнтів з АХЗ переважали особи чоловічої статі. Не встановлено достовірної залежності між різними патогенетичними варіантами з віком хворих. Серед хворих з АХЗ із дефіцитом заліза переважали пацієнти середнього (35–55 років) віку. Ми не помітили також статистично вірогідної різниці в частоті зазначених типів анемій у хворих на АС залежно від тривалості захворювання.
| Показник | ЗДА, n=8 | АХЗ з дефіцитом заліза, n=10 | АХЗ, n=15 | |||
|---|---|---|---|---|---|---|
| M±m (г/л) | n (%) | M±m (г/л) | n (%) | M±m (г/л) | n (%) | |
| Жінки | 82,7±2,29 | 4 (50) | 108,0±3,03 | 4 (40) | 106,0±2,7 | 3 (20) |
| Чоловіки | 103,0±9,1 | 4 (50) | 100,0±3,64 | 6 (60) | 101,7±2,65 | 12 (80)* |
| Зв’язок із віком, років | ||||||
| 19–35 | 95,0±8,54 | 3 (37,5) | 112,0±0,00 | 1 (10) | 103,8±1,98 | 5 (33,3) |
| 35–55 | 78,3±0,88 | 3 (37,5) | 102,3±3,21 | 8 (80)# | 99,5±4,33 | 7 (46,6) |
| 55–75 | 111,5±6,5 | 2 (25) | 102,0±0,00 | 1 (10) | 107,3±1,45 | 3 (20) |
| Зв’язок із тривалістю захворювання, років | ||||||
| <5 | 93,4±6,52 | 5 (62,5) | 100,0±8,72 | 3 (30) | 97,0±6,54 | 4 (26,7) |
| 5–10 | 80,0±0,00 | 1 (12,5) | 105,0±4,04 | 3 (30) | 102,2±2,87 | 6 (40) |
| >10 | 98,0±20,0 | 2 (25) | 104,3±2,29 | 4 (40) | 107,4±0,81 | 5 (33,3) |
*Вірогідні відмінності щодо групи жінок з АХЗ, p<0,05; #вірогідні відмінності щодо групи хворих на АС з АХЗ та дефіцитом заліза віком 19–35 років, p<0,05.
Відзначимо, що за ступенем анемії патогенетичні варіанти відрізнялися. Зокрема, ЗДА у більшості випадків (62,5%) була середнього ступеня тяжкості і лише 37,5% — легкого ступеня; в осіб з АХЗ із дефіцитом заліза та чистою АХЗ практично у 90% випадків — легкої і лише у 10% — середньої тяжкості (табл. 3).
| Ступінь | ЗДА, n=8 | АХЗ з дефіцитом заліза, n=10 | АХЗ, n=15 | |||
|---|---|---|---|---|---|---|
| M±m | n (%) | M±m | n (%) | M±m | n (%) | |
| І | 111,7±3,76 | 3 (37,5) | 105,3±1,87 | 9 (90) | 105,4±5,60 | 13 (86,6) |
| ІІ | 81,6±2,11* | 5 (62,5) | 84±0,00* | 1 (10)* | 84,00±6,00* | 2 (13,4)* |
*Вірогідні відмінності щодо групи хворих з анемією І ступеня, p<0,05.
Таким чином, підсумовуючи вищевикладені результати, відзначили, що серед обстежених 118 пацієнтів із АС анемічний синдром діагностовано у 34 (28,8%) пацієнтів, у 84 (71,2%) хворих ознак анемії не виявлено. Серед 84 хворих на АС без наявних ознак анемії латентний дефіцит заліза реєстрували у 10 (11,9%) осіб з рівнем гемоглобіну не нижче 120 г/л. Наші дані виявились зіставними з результатами інших дослідників, які свідчать, що частота анемії в різних етнічних групах хворих на АС варіює в межах 18,5–45,8% (Braun J. et al., 2009; Kim K.J., Cho C.S., 2012; Щербаков Г.И. и соавт., 2016; Bulut Y. et al., 2017).
Серед пацієнтів з анемічним синдромом АХЗ виявлено у 44,1% хворих, АХЗ із дефіцитом заліза — у 29,4% хворих, ЗДА — у 23,5% осіб. За даними російських дослідників (Щербаков Г.И. и соавт., 2016), серед хворих на АС АХЗ виявлено у 78,72%, а ЗДА — у 21,28% хворих. За даними корейської популяції хворих на АС, перше місце (66,7% хворих) за частотою займала ЗДА, друге — АХЗ (33,3% хворих) (Kim K.J., Cho C.S., 2012). Ще вдвічі нижчу (15%) частоту АХЗ виявляли в італійській популяції хворих на АС (Niccoli L. et al., 2012). На нашу думку, така різна частота анемій, очевидно, пов’язана з різним соціально-економічним станом населення, особливостями лікування, вираженістю запального процесу тощо. Нами не встановлено достовірної залежності між частотою тих чи інших варіантів з віком пацієнтів. Не виявлено вірогідної різниці й за тривалістю захворювання. Однак серед хворих із АХЗ переважали чоловіки над жінками зі співвідношенням 4:1. Дані літератури свідчать, що анемічний синдром у пацієнтів із АС частіше спостерігається в дебюті хвороби (Kim K.J., Cho C.S., 2012).
Дослідженням не виявлено суттєвих відмінностей між групами хворих за вмістом гемоглобіну та кількістю еритроцитів. Однак пацієнти вірогідно різнилися за величиною MCV. Найбільший середній розмір еритроцитів притаманний пацієнтам з АХЗ, вірогідно менший — у хворих із поєднанням АХЗ та дефіциту заліза, і найнижчі значення MCV були у хворих із ЗДА. За цитометричною характеристикою ЗДА у 75% хворих була мікроцитарною, АХЗ із дефіцитом заліза у 60% — нормоцитарною, а АХЗ у 73% — нормоцитарною. Подібність цитометричної картини описана в дослідженні (Щербаков Г.И. и соавт., 2016).
У 62,5% хворих із ЗДА виявлено анемію середнього ступеня тяжкості, тоді як у групах з АХЗ та АХЗ з дефіцитом заліза таких було лише 10%. За даними досліджень (Kim K.J., Cho C.S., 2012), серед пацієнтів із АС особи з АХЗ в більшості мають легкий ступінь анемії, тоді як ЗДА частіше середнього чи тяжкого ступеня.
Проведені нами дослідження свідчать, що основні показники ферокінетики суттєво залежали від патогенетичного варіанту анемії. Зокрема, в осіб із ЗДА рівень заліза в сироватці крові був вірогідно нижчим, ніж у хворих із АХЗ. Саме при ЗДА ЗЗЗС крові була найвищою, коефіцієнт насичення трансферину залізом і рівень феритину були найнижчими порівняно із хворими з АХЗ. Однак в осіб зі ЗДА виявлено найвищий рівень розчинних рецепторів трансферину, а в осіб з АХС — відповідно найнижчий. Водночас пацієнти з поєднанням АХЗ із дефіцитом заліза за цими показниками займали проміжне місце між хворими із ЗДА та АХЗ. Дані літературних джерел чітко вказують, що рецептори трансферину в сироватці крові є важливим маркером дефіциту заліза (Суржикова Г.С. и соавт., 2013; Braga F. et al., 2014). У разі його нестачі кістковий мозок збільшує продукцію рецепторів трансферину і тим самим спрямовує залізо вже із трансферином до клітин кісткового мозку для нормального еритропоезу (Braga F. et al., 2014; Gupta D.K. et al., 2016). За даними досліджень (Bulut Y. et al., 2017), рівні рецепторів трансферину є найвищими в осіб із ЗДА, і вони є одними з найчутливіших диференційно діагностичних критеріїв дефіциту заліза в умовах високої активності запального процесу у хворих на АС.
ВИСНОВКИ
1. Анемія у хворих на АС виявляється у 28,8% випадків, у 10 (11,9%) реєструють латентний дефіцит заліза. Спектр анемії представлений АХЗ (44,1%), АХЗ з дефіцитом заліза (29,4%) та ЗДА (23,5%).
2. За цитометричною характеристикою ЗДА у 75% пацієнтів мікроцитарна, а АХЗ та АХЗ з дефіцитом заліза у 86,8 та 70% відповідно — нормоцитарна.
3. Спрямованість змін гемопоезу та ферокінетики у хворих на АС залежить від типу анемії. Для хворих на ЗДА характерними є найвищі рівні еритроцитів, ЗЗЗС та sTfR, мікроцитоз та найнижчі рівні заліза в сироватці крові, КНТ та феритину. У хворих з АХЗ реєструються лише помірні зміни обміну заліза, пацієнти з АХЗ із супутнім дефіцитом заліза за цими показниками займають проміжні позиції.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
- Суржикова Г.С., Клочкова-Абельянц С.А. (2013) Растворимые трансферриновые рецепторы в дифференциальной диагностике гипохромных анемий. Политравма, 3: 62–65.
- Щербаков Г.И., Фомина Н.В., Павлова В.Ю. (2016) Виды анемии и их связь с активностью заболевания у больных с анкилозирующим спондилоартритом. Вопросы организации и информатизации здравоохранения, S: 386–388.
- Bes C., Yazici A., Soy M. (2013) Monoclonal anti-TNF antibo-dies can elevate hemoglobin level in patients with ankylosing spondylitis. Rheum. Int., 33(6): 1415–1418. doi: 10.1007/s00296-012-2539-5.
- Braga F., Infusino I., Dolci A., Panteghini M. (2014) Soluble transferrin receptor in complicated anemia. Clinica chimica acta, 431: 143–147. doi: https://doi.org/10.1016/j.cca.2014.02.005.
- Braun J., van Der Heijde D., Doyle M.K. et al. (2009) Improvement in hemoglobin levels in patients with ankylosing spondylitis treated with infliximab. Arthritis Care & Research, 61(8): 1032–1036. doi: 10.1002/art.24865.
- Bulut Y., Tas D.A., Ozturk O.G., Karaogullarindan U. (2017) SAT0396 Investigation of iron deficiency anemia in ankylosing spondylitis patients. Ann. Rheum. Dis.,76: 921–922. doi: 10.1136/annrheumdis-2017-eular.5913.
- Dagli M., Yilmaz S., Sivrikaya A., Ozturk B. (2014) Serum Prohepsidin and Hepsidin Levels in patients with Ankylosing Spondylitis: A prospective study. J. Clin. Anal. Med., 7(1): 38–41. doi: 10.4328/JCAM.2451.
- Gupta D.K., Choudhary R.K., Sharma M. et al. (2016) Role of soluble transferrin receptor and soluble transferrin receptor index in diagnosing iron deficiency anemia in patients with chronic kidney disease. Astrocyte, 3(3): 125. doi: 10.4103/2349-0977.201006.
- Kim K.J., Cho C.S. (2012) Anemia of chronic disease in ankylosing spondylitis: improvement following anti-TNF therapy/ankilozan spondilitte kronik anemi hastaligi: anti-TNF Tedavisini Takiben Iyilesme. Turk. J. Rheumatol., 27 (2): 90. doi: http://dx.doi.org/10.5606/tjr.2012.014.
- Nairz M., Theurl I., Wolf D., Weiss G. (2016) Iron deficiency or anemia of inflammation? Wiener Medizinische Wochenschrift, 166(13–14): 411–423. doi: https://doi.org/10.1007/s10354-016-0505-7.
- Niccoli L., Nannini C., Cassara E. et al. (2012) Frequency of anemia of inflammation in patients with ankylosing spondylitis requiring anti‐TNFα drugs and therapy‐induced changes. Int. J. Rheum. Dis., 15(1): 56–61. doi: https://doi.org/10.1111/j.1756-185X.2011.01662.x.
- Linden S.V.D., Valkenburg H.A., Cats A. (1984) Evaluation of diagnostic criteria for ankylosing spondylitis. Arthritis & Rheumatism, 27(4): 361–368. doi: https://doi.org/10.1002/art.1780270401.
- Weiss G., Schett G. (2013) Anaemia in inflammatory rheumatic diseases. Nat. Rev. Rheumatol., 9(4): 205. doi: https://doi.org/10.1038/nrrheum.2012.183.
АНЕМИЯ У БОЛЬНЫХ АНКИЛОЗИРУЮЩИМ СПОНДИЛИТОМ, ОСОБЕННОСТИ ГЕМОПОЭЗА И ФЕРРОКИНЕТИКИ В ЗАВИСИМОСТИ ОТ ЕЕ ПАТОГЕНЕТИЧЕСКОГО ТИПА
1Винницкий национальный медицинский университет им. Н.И. Пирогова
2Научно-исследовательский институт реабилитации инвалидов Винницкого национального медицинского университета им. Н.И. Пирогова МЗ Украины
Резюме. Цель. Изучить частоту и спектр анемии у больных анкилозирующим спондилитом (АС), охарактеризовать особенности их гемопоэза и феррокинетики, а также определить связь с полом, возрастом и длительностью заболевания. Объект и методы. Под наблюдением находились 118 пациентов с диагнозом АС в соответствии с модифицированными критериями Нью-Йорка. Группу контроля составили 26 практически здоровых лиц репрезентативных по возрасту и полу. Анемию устанавливали при снижении уровня гемоглобина ниже 120 г/л. Для оценки гемопоэза и феррокинетики проводили измерения уровня гемоглобина, эритроцитов, MCV, уровня железа и ферритина в сыворотке крови, общей железосвязывающей способности сыворотки крови (ОЖСС), коэффициент насыщения трансферрина и растворимые рецепторы трансферрина. Результаты. Анемия у больных АС определяется в 28,8% случаев, а еще у 10 (11,9%) регистрируют латентный дефицит железа. Спектр анемии представлен анемией хронического заболевания (АХЗ) — 44,1%, АХЗ с дефицитом железа (29,4%) и железодефицитной анемией (ЖДА) — 23,5%. По цитометрической характеристике ЖДА у 75% пациентов микроцитарная, а АХЗ и АХЗ с дефицитом железа в 86,8 и 70% соответственно — нормоцитарная. Изменения гемопоэза и феррокинетики у больных АС с ЖДА характеризовались наивысшими уровнями эритроцитов, ОЖСС и растворимых рецепторов трансферрина, микроцитозом и низкими уровнями железа в сыворотке крови, коэффициента насыщения трансферрина и ферритина. У пациентов с АХЗ наблюдались умеренные изменения обмена железа, пациенты с АХЗ с сопутствующим дефицитом железа по этим показателям занимали промежуточные позиции. Обсуждение. Полученные нами данные сопоставимы с результатами других исследователей, указывающих, что частота анемии в различных этнических группах больных АС варьирует в пределах 18,5–45,8% (Braun J. et al., 2009; Kim K.J., Cho C.S., 2012; Щербаков Г.И. и соавт., 2016; Bulut Y. et al., 2017). Выводы. Анемию у больных АС выявлено в 28,8% случаев. Анемический синдром был представлен АХЗ, АХЗ с дефицитом железа и ЖДА. ЖДА была преимущественно микроцитарного характера, а АХЗ и АХЗ с дефицитом железа — нормоцитарного. Направленность изменений гемопоэза и феррокинетики у больных АС зависит от типа анемии.
Ключевые слова: анкилозирующий спондилит, анемия хронического заболевания, железодефицитная анемия, гемопоэз, феррокинетика.
ANEMIA IN PATIENTS WITH ANKYLOSING SPONDYLITIS, PECULIARITIES HEMOPOIESIS AND FERROKINETICS IN DEPENDING FROM PATHOGENETIC TYPE
1M.I. Pirogov Vinnytsia National Medical University
2Research Institute of Disability Rehabilitation of M.I. Pirogov Vinnitsa National Medical University of Ministry of Health of Ukraine
Summary. Аim. To study the frequency and spectrum of anemia in patients with ankylosing spondylitis (AS), to characterize the features of their hematopoiesis and ferrokinetics, as well as to determine the relationship with sex, age and duration of the disease. Object and methods. A total of 118 patients were diagnosed with AS in accordance with the modified New York criteria. The control group consisted of 26 healthy individuals, representative of age and gender. Anemia was exhibited with a decrease in hemoglobin level of less than 120 g/l. To assess hematopoiesis and ferokinetics, hemoglobin, erythrocytes, MCV, serum iron, total iron binding capacity of serum, serum ferritin, transferrin saturation coefficient, and soluble transferrin receptors were measured. Results. Anemia in patients with AS occurs in 28.8% of cases, and in 10 (11.9%) latent iron deficiency is recorded. The spectrum of anemia is represented by ACD (44.1%), ACD with iron deficiency (29.4%) and IDA (23.5%). The cytometric characteristics of IDA in 75% of patients are microcytic, while ACD and ACD with iron deficiency of 86.8% and 70%, respectively, are normocytic. Changes in hematopoiesis and ferokinetics in patients with AS with IDA were characterized by high levels of red blood cells, TIBC and sTfR, microcytosis and low levels of serum iron, CST and ferritin. In patients with ACD, moderate changes in iron metabolism were observed, patients with ACD with concomitant iron deficiency occupied intermediate positions by these indicators. Discussion. Our findings were comparable to those of other researchers who indicate that the frequency of anemia in different ethnic groups of patients with AS varies within 18.5–45.8% (Braun J. et al., 2009; Kim K.J., Cho C.S., 2012; Щербаков Г.И. и соавт., 2016; Bulut Y. et al., 2017). Conclusions. Anemia in patients with AS was found in 28.8% of cases. Anemic syndrome was represented by ACD, ACD with iron deficiency and IDA. IDA was predominantly microcytic in nature, and ACD and ACD with iron deficiency normocytic. The direction of changes in hematopoiesis and ferokinetics in patients with AS depends on the type of anemia.
Key words: ankylosing spondylitis, anemia of chronic disease, iron deficiency anemia, hemopoiesis, ferrokinetics.
Адреса для листування:
Шевчук Сергій Вікторович
21100, Вінниця, Хмельницьке шосе, 104
НДІ реабілітації інвалідів ВНМУ ім. М.І. Пирогова,
відділ клінічної ревматології

Leave a comment