РОЛЬ ВИЗНАЧЕННЯ РІВНЯ КАЛЬПРОТЕКТИНУ КРОВІ (MRP8/14) ДЛЯ ПРОГНОЗУВАННЯ ЗАГОСТРЕННЯ ЮВЕНІЛЬНОГО ІДІОПАТИЧНОГО АРТРИТУ ПІСЛЯ ВІДМІНИ ЛІКУВАННЯ
Бойко Я.1, Іванова В.2, Козіна Т.3, Вакарук М.4, Шевченко Н.5, Вайзер Н.6, Синоверська О.7, Чубата О.8, Марчук О.9
- 1Львівський національний медичний університет ім. Данила Галицького
- 2Донецький національний медичний університет, Кропивницький
- 3ТОВ «Медикгруп», Херсон
- 4КУ «Одеська обласна дитяча клінічна лікарня»
- 5Харківський національний університет ім. В.Н. Каразіна
- 6КЗ «Маріупольське територіальне медичне об’єднання здоров’я дитини та жінки»
- 7ДВНЗ «Івано-Франківський національний медичний університет»
- 8КНП «Обласна клінічна дитяча лікарня» Кіровоградської обласної ради, Кропивницький. Донецький національний медичний університет, Кропивницький
- 9Вінницька обласна дитяча клінічна лікарня
Резюме. У частини хворих на ювенільний ідіопатичний артрит (ЮІА) після відміни лікування розвивається загострення хвороби. Важливо визначити такі біомаркери субклінічної активності захворювання, які допоможуть верифікувати пацієнтів із ЮІА, в яких після відміни лікування не буде розвиватися загострення хвороби. Мета дослідження — визначення прогностичного значення рівня кальпротектину крові (MRP8/14) у хворих на ЮІА перед повною відміною лікування для прогнозування ризику розвитку загострення захворювання. Результати дослідження свідчать, що через 3 міс після відміни лікування у пацієнтів із ЮІА у стані неактивної хвороби загострення розвинулося у 5 (9,3%) із 54 хворих. Медіана рівня кальпротектину перед відміною терапії становила 1700 нг/мл у хворих, у яких виникло загострення, та 1500 нг/мл — у решти. Через 6 міс загострення розвинулося додатково у 3 (6,3%) із 48 пацієнтів, які продовжували перебувати під спостереженням, а медіана рівня кальпротектину становила 1300 та 1500 нг/мл відповідно. Через 12 міс загострення додатково розвинулося ще у 13 (28,9%) із 45 пацієнтів, які продовжували перебувати під спостереженням, а медіана рівня кальпротектину становила у цих хворих перед відміною лікування 1100 та 1650 нг/мл відповідно. Висновки. Після відміни лікування у пацієнтів із ЮІА у стані неактивної хвороби впродовж наступного року спостереження загострення розвивалося у 38,9% хворих. Результати дослідження не виявили статистичної різниці у рівнях кальпротектину крові у пацієнтів із ЮІА, які перебували у стані неактивної хвороби перед повною відміною лікування, із розвитком загострення та без загострення хвороби через 3; 6 та 12 міс.
УДК 616.72-002.77-053.2-07-08:612.12
Вступ
У більшості пацієнтів із ювенільним ідіопатичним артритом (ЮІА) при застосуванні сучасної терапії досягається стан неактивної хвороби та ремісії. Після повної відміни терапії загострення розвивається лише у частини пацієнтів. Тому логічним є запитання: «Кому із хворих на ЮІА можна відмінити терапію без подальшого розвитку загострення?». Важливо верифіковувати тих хворих на ЮІА у ремісії, в яких після відміни лікування не розвиватиметься загострення хвороби. Досі не існує протоколів і чітких рекомендацій щодо відміни лікарських засобів у пацієнтів із ЮІА, які досягли стану неактивної хвороби чи ремісії. На сьогодні рішення щодо повного припинення терапії у дітей, хворих на ЮІА, базується на практичному та емпіричному досвіді дитячих ревматологів. Тож чи можна прогнозувати перебіг хвороби після відміни терапії? Чи існують біомаркери, які б прогнозували можливе загострення хвороби? Низка сучасних лабораторних маркерів дає можливість відображати субклінічну активність хвороби. До таких належить MRP8/14, так званий кальпротектин крові. Оскільки рівень MRP8/14 відображає субклінічну активність ЮІА, цей показник можна використовувати для моніторингу за ефективністю лікування, а також для прогнозування загострення хвороби після відміни лікування. Результати ряду досліджень свідчать, що MRP8/14 може слугувати самостійним прогностичним маркером ризику розвитку загострення ЮІА після відміни лікування.
Мета виконаного дослідження — визначення прогностичного значення рівня кальпротектину крові (MRP8/14) у пацієнтів із ЮІА перед повною відміною лікування для прогнозування ризику розвитку загострення захворювання.
Об’єкт і методи дослідження
Проведено дослідження рівня кальпротектину у сироватці крові 54 пацієнтів із ЮІА, які перебували у стані неактивної хвороби, з різних регіонів України (Львів, Кропивницький, Івано-Франківськ, Одеса, Херсон, Харків, Вінниця, Маріуполь, Тернопіль). Діагноз ЮІА встановлювали за класифікаційними критеріями ILAR, Durban, 1997, Edmonton, 2001. Стан неактивної хвороби визначали згідно з критеріями Wallace, 2011 [13]. Критерієм включення у дослідження була наявність у дітей з ЮІА стану неактивної хвороби тривалістю щонайменше 6 міс. Пацієнтам була проведена планова відміна всієї терапії впродовж 1 тиж після забору крові для визначення рівня кальпротектину крові (MRP8/14). Зразки сироватки крові до часу дослідження заморожували при температурі мінус 20 °С. Транспортування зразків крові проводилося у замороженому стані. Подальше спостереження хворих, охоплених цим дослідженням, тривало впродовж наступних 12 міс та включало візити до лікаря кожних 3 міс із проведенням клінічних та лабораторних обстежень. Дослідження рівня кальпротектину проводилося при першому огляді (В0) та через 3 міс після відміни лікування (В1).
Визначення рівня кальпротектину у сироватці крові проведено за допомогою реагентів EK-MRP8/14 Buhlmann (MRP8/14 (S100A8/9)), Швейцарія, методом ELISA. Дослідження виконано в лабораторії Комунального некомерційного підприємства Львівської обласної ради «Західноукраїнський спеціалізований дитячий медичний центр».
Статистичну обробку даних виконано за допомогою пакета програм «STATISTIC 8.0». Розподіл кількісних показників у групі представлений як медіана (мінімум–максимум) [нижній–верхній квартилі], оскільки розподіл параметричних показників у вибірках не був гаусівським (перевірка за критеріями Шапіро — Уїлка). Порівняння рангових і параметричних показників виконано за критеріями Манна — Уїтні (p), які не потребують перевірки на нормальність розподілу і придатні для порівняння невеликих вибірок.
Результати дослідження
У дослідження було включено 54 хворих на ЮІА із 9 українських центрів дитячої ревматології. Медіана віку цих пацієнтів становила 8,6 року з медіаною тривалості хвороби 36,0 міс. Серед пацієнтів переважали діти жіночої статі (68,5%). Усі учасники дослідження перебували у стані неактивної хвороби, медіана якої становила 11 міс, мінімальна тривалість стану неактивної хвороби — 6 міс. У дослідження були включені пацієнти з усіма варіантами перебігу захворювання, серед яких переважали (59,3%) хворі на олігоартрит, у 22,2% пацієнтів був поліартикулярний ЮІА, по 9,3% — припадало на пацієнтів із системним ЮІА (сЮІА) та ентезит-артритом. Більшість (88,9%) пацієнтів отримували базову монотерапію метотрексатом, трьом хворим призначали метотрексат з біологічними препаратами (одному — з тоцилізумабом, другому — з адалімумабом, третьому — з етанерцептом), один хворий отримував етанерцепт, інший — сульфасалазин. Медіана рівня кальпротектину крові у всіх пацієнтів із ЮІА, які перебували у стані неактивної хвороби, перед повною відміною лікування становила 1550 (200–30 000) нг/мл, а за умови попередньої терапії лише метотрексатом — 1450 (200 — 30 000) нг/мл (табл. 1). У проведеному нами дослідженні оцінено можливу залежність рівня кальпротектину у пацієнтів із ЮІА у стані неактивної хвороби від варіанта перебігу (табл. 2), тривалості неактивної хвороби до моменту відміни лікування (табл. 3), від віку дитини (до та після 5 років) (табл. 4), тривалості хвороби до моменту відміни лікування (табл. 5). Результати досліджень свідчать, що у пацієнтів із ЮІА, які мають клінічні ознаки стану неактивної хвороби, медіани рівня кальпротектину визначаються на рівні від 600 нг/мл (ентезит-артрит), 1400 нг/мл (олігоартрит), 1800 нг/мл (поліартрит), до 3200 нг/мл (системний артрит), однак статистично достовірної різниці у рівнях кальпротектину крові між хворими з різними варіантами ЮІА не виявлено (див. табл. 2). Зокрема, не виявлено статистично достовірної різниці рівня кальпротектину крові від тривалості стану неактивної хвороби: 6; 6–12; ≥12 міс. Показник медіани рівня кальпротектину крові у пацієнтів із ЮІА зі станом неактивної хвороби тривалістю 6 міс становив 1900 нг/мл, тривалістю 6–12 міс — 1150 нг/мл та >12 міс — 1550 нг/мл (див. табл. 3). Медіана рівня кальпротектину крові у пацієнтів із ЮІА у стані неактивної хвороби віком до 5 років становила 1650 нг/мл та у старших 5 років — 1450 нг/мл (див. табл. 4). Медіана рівня кальпротектину крові у пацієнтів із ЮІА у стані неактивної хвороби, в яких хвороба тривала до 24 міс, була 1200 нг/мл, а ≥24 міс — 1600 нг/мл, що теж не мало статистично значущої різниці (див. табл. 5).
| Загальна кількість осіб | 54 |
|---|---|
| Вік на момент дослідження, років, медіана (min–max) | 8,6 (1,8–18,6) |
| Вік дебюту ЮІА, років, медіана (min–max) | 3,7 (1,1–17,0) |
| Стать, кількість осіб (%):
жіноча чоловіча |
37 (68,5)17 (31,5) |
| Тривалість хвороби, міс, медіана (min–max) | 36,0 (10,0–180,0) |
| Тривалість стану неактивної хвороби, міс, медіана (min–max) | 11,0 (6,0–36,0) |
| Варіант перебігу ЮІА, кількість осіб:
системний поліартрит олігоартрит ентезит-артрит |
– 5 12 32 5 |
| Критерії неактивної хвороби:
системні прояви, немає/наявні артрит, немає/наявний ШОЕ, мм/год, медіана (min–max) увеїт, немає/наявний ВАШ, балів, медіана (min–max) JADAS27, балів, медіана (min–max) |
– 54/0 54/0 5 (2–20) 54/0 0 (0–1) 0 (0–1) |
| CHAQ, медіана (min–max) | 0 (0–0) |
| Терапія, на якій досягнуто стану неактивної хвороби:
метотрексат метотрексат, етанерцепт метотрексат, адалімумаб метотрексат, тоцилізумаб метотрексат, делагіл сульфасалазин етанерцепт |
– 48 1 1 1 1 1 1 |
| Кальпротектин крові, нг/мл, медіана (min–max) | 1550 (200–30 000) |
| *Кальпротектин крові, нг/мл, медіана (min–max) | 1450 (200–30 000) |
*Терапія лише метотрексатом. Тут і далі: ШОЕ — швидкість осідання еритроцитів.
| Варіант перебігу | Кількість хворих | Рівень кальпротектину, нг/мл, медіана (min–max) | p |
|---|---|---|---|
| Олігоартрит | 32 | 1400 (200–30 000) | p=0,54
p=0,09 p=0,67 p=0,21 p=0,92 p=0,40 |
| Поліартрит | 12 | 1800 (200–11 200) | |
| Системний артрит | 5 | 3200 (500–22 600) | |
| Ентезит-артрит | 5 | 600 (400–24 000) |
При порівнянні хворих на:
- p — олігоартрит та поліартрит;
- p — олігоартрит та системний артрит;
- p — олігоартрит та ентезит-артрит;
- p — поліартрит та системний артрит;
- p — поліартрит та ентезит-артрит;
- p — системний артрит та ентезит-артрит.
| Тривалість неактивної хвороби, міс | Кількість хворих | Рівень кальпротектину, нг/мл, медіана (min–max) | p |
|---|---|---|---|
| ≤6 | 10 | 1900 (500–22 600) | p=0,16
p=0,36 p=0,56 |
| 6–12 | 18 | 1150 (200–30 000) | |
| ≥12 | 26 | 1550 (200–24 000) |
При порівнянні пацієнтів із тривалістю хвороби: p — ≤6 та 6–12 міс; p — ≤6 та ≥12 міс; p — 6–12 та ≥12 міс.
| Вік хворого, років | Кількість хворих | Рівень кальпротектину, нг/мл, медіана (min–max) | p |
|---|---|---|---|
| ≤5 | 8 | 1650 (400–22 600) | 0,91 |
| >5 | 46 | 1450 (200–30 000) |
| Тривалість хвороби, міс | Кількість хворих | Рівень кальпротектину, нг/мл, медіана (min–max) | p |
|---|---|---|---|
| ≤24 | 17 | 1200 (200–24 000) | 0,38 |
| >24 | 37 | 1600 (200–30 000) |
Через 3 міс було отримано дані 54 пацієнтів та виявлено, що у 5 (9,3%) з них розвинулося загострення ЮІА (табл. 6). Медіана рівня кальпротектину у хворих на ЮІА через 3 міс після відміни лікування становила 800 нг/мл. Проведено порівняння рівня кальпротектину крові перед відміною лікування у хворих на ЮІА, у яких через 3 міс після відміни терапії розвинулося загострення (5 пацієнтів) та в яких не розвинулося загострення (49 пацієнтів). Статистично достовірної різниці у цих показниках не виявлено, медіани рівня кальпротектину у них становили 1500 і 1700 нг/мл відповідно.
| Усього, кількість осіб | 54 | |
|---|---|---|
| Стать, чол./жін., кількість | 17/37 | |
| Системні прояви, кількість | 0 | |
| Артрити, кількість | 9 | |
| Увеїт, кількість осіб | 0 | |
| ШОЕ, мм/год, медіана (min–max) | 6 (1–65) | |
| Кальпротектин*, нг/мл, медіана (min–max) | 800 (400–26 400) | |
| Розвиток загострення через 3 міс, кількість: абс. (%) | 5 (9,3) | |
| Кальпротектин у хворих на ЮІА на Візиті 0, у яких розвинулося загострення через 3 міс, нг/мл, медіана (min–max) | 1700 (920–24 000) | p=0,35 |
| Кальпротектин у хворих на ЮІА на Візиті 0, у яких не розвинулося загострення через 3 міс, нг/мл, медіана (min–max) | 1500 (200–30 000) | |
*Визначено у 33 хворих.
Через 6 міс загострення спостерігали вже у 8 (14,8%) хворих. Подібно до попередніх результатів, статистично достовірної різниці у показниках рівня кальпротектину у хворих на ЮІА перед відміною лікування, у яких розвинулося і не розвинулося загострення, не виявлено, медіана рівня кальпротектину становила по 1500 нг/мл відповідно (табл. 7).
| Усього, кількість осіб | 53* | |
|---|---|---|
| Стать, чол./жін., кількість осіб | 17/36 | |
| Системні прояви, кількість осіб | 0 | |
| Артрити, кількість осіб | 6 | |
| Увеїт, кількість осіб | 0 | |
| ШОЕ, мм/год, медіана (min–max) | 5 (2–25) | |
| Розвиток загострення через 6 міс, кількість: абс. (%) | 8 (15,1) | |
| Кальпротектин у хворих на ЮІА на Візиті 0, у яких розвинулося загострення через 6 міс, нг/мл, медіана (min–max) | 1500 (600–24 000) | p=0,619 |
| Кальпротектин у хворих на ЮІА на Візиті 0, у яких не розвинулося загострення через 6 міс, нг/мл, медіана (min–max) | 1500 (200–30 000) | |
У табл. 7–9: *одна пацієнтка вибула з дослідження через 3 міс.
Через 12 міс загострення вже розвинулося у 21 (39,6%) особи. Рівень кальпротектину перед відміною лікування у пацієнтів із ЮІА із загостренням становив 1300 нг/мл, а без загострення — 1650 нг/мл (табл. 8).
| Усього, кількість осіб | 53* | |
|---|---|---|
| Стать, чол./жін., кількість осіб | 17/36 | |
| Розвиток загострення через 12 міс, кількість осіб: абс. (%) | 21 (39,6) | |
| Кальпротектин у хворих на ЮІА на Візиті 0, у яких розвинулося загострення через 12 міс, нг/мл, медіана (min–max) | 1300 (200–30 000) | p=0,34 |
| Кальпротектин у хворих на ЮІА на Візиті 0, у яких не розвинулося загострення через 12 міс, нг/мл, медіана (min–max) | 1650 (200–11 200) | |
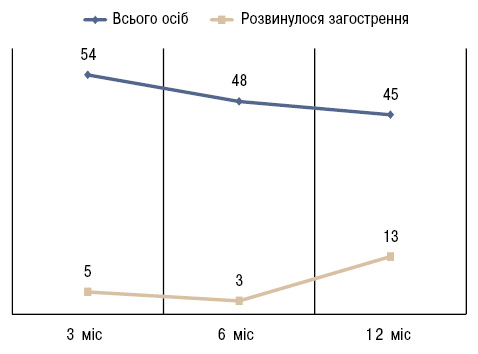
Таким чином, встановлено, що через 3 міс загострення розвинулося у 5 (9,3%) із 54 хворих (табл. 9). Медіана рівня кальпротектину перед відміною лікування у них становила 1700 нг/мл, а у пацієнтів, у яких не розвинулося загострення — 1500 нг/мл. Одна дівчинка через 3 міс вибула з дослідження. Через 6 міс загострення розвинулося додатково у 3 (6,3%) із 48 пацієнтів, які продовжували участь у дослідженні, а медіана рівня кальпротектину становила 1300 та 1500 нг/мл відповідно. Через 12 міс загострення додатково розвинулося у ще 13 (28,9%) із 45 пацієнтів, які продовжували перебувати під моніторингом у дитячих ревматологів, а медіана рівня кальпротектину перед відміною лікування у цих хворих становила 1100 та 1650 нг/мл відповідно (рисунок).
| Спостереження, загострення/всього (% загострення) | Кальпротектин у хворих на ЮІА на Візиті 0, нг/мл, медіана (min–max) | p | |
|---|---|---|---|
| загострення | без загострення | ||
| Через 3 міс
N=5/54 (9,3%) |
1700 (920–24 000) | 1500 (200–30 000) | 0,35 |
| Через 6 міс
N=3/48* (6,3%) |
1300 (600–1900) | 1500 (200–30 000) | 0,70 |
| Через 12 міс
N=13/45 (28,9%) |
1100 (200–30 000) | 1650 (200–11 200) | 0,16 |
*Одна пацієнтка вибула з дослідження через 3 міс.
Результати та їх обговорення
Упродовж останніх років кальпротектин крові (MRP8/14) широко вивчається як потенційний біомаркер активності хвороби та відповіді на лікування при ревматичних та інших запальних захворюваннях. Встановлена пряма кореляція кальпротектину крові у хворих на ЮІА з показником активності JADAS 27, ШОE та СРБ [1]. У пацієнтів із ентезитасоційованим артритом виявлено зв’язок між рівнями MRP8/14 і активністю захворювання [12]. На сьогодні визначення рівня кальпротектину крові вважають верифікаційним маркером для діагностики сЮІА, оскільки це дозволяє проводити диференційну діагностику із багатьма захворюваннями, які супроводжуються гарячкою. Вперше у дослідженні M. Frosch (2008) було показано, що рівень кальпротектину в сироватці крові достовірно зростає у пацієнтів з активним сЮІА (до 14 920±4030 нг/мл) порівняно зі здоровими дітьми контрольної групи, пацієнтами з онкологічними та інфекційними хворобами [8]. Результати раніше проведеного нами дослідження показали, що рівень кальпротектину крові був вищим у хворих із системним перебігом хвороби (медіана 13 800 нг/мл) і достовірно відрізнявся від показників у здорових дітей (медіана 1800 нг/мл), показників пацієнтів зі суглобовими формами ЮІА (медіана 2700 нг/мл) хворих на поліартрит із від’ємним ревматоїдним фактором (медіана 3800 нг/мл) та олігоартрит (медіана 2500 нг/мл). Найвищі показники кальпротектину крові виявлено у хворих із вперше діагностованим сЮІА: медіана становила 32 500 нг/мл (від 13 800 до 177 000 нг/мл) [1]. Значення рівня кальпротектину у крові (MRP8/14) для діагностики сЮІА підтверджене у багатьох роботах, тому сьогодні визначення рівня кальпротектину крові (MRP8/14) є загальновизнаним біомаркером для підтвердження діагнозу сЮІА [3, 6].
Показано, що у хворих на ревматоїдний артрит MRP8/14 є предиктором ефективної відповіді на біологічне лікування [4]. Серед гетерогенної групи пацієнтів з ЮІА дослідження MRP8/14 встановили, що цей показник допомагає спрогнозувати терапевтичну відповідь на лікування метотрексатом [11]. Результати цього дослідження дають можливість використання інформації про рівні MRP8/14 для вирішення питання про те, який пацієнт буде відповідати на терапію метотрексатом, а якому пацієнту краще швидше призначати біологічне лікування.
Дослідження з визначення рівня кальпротектину крові у хворих на ЮІА показали, що його рівень був підвищеним порівняно зі здоровим контролем та вищим у пацієнтів, у яких хвороба була активною порівняно із хворими у стані ремісії ЮІА та становила 9600 (100–48 610) нг/мл та 2965 (0–45,390) нг/мл відповідно [8].
Оскільки є доведеною роль кальпротектину крові (MRP8/14) як чутливого маркера субклінічної активності у хворих на ЮІА, а його рівень достовірно різниться у пацієнтів із ЮІА в активній фазі та ремісії хвороби, цю інформацію про результати його визначення почали використовувати з метою прогнозування рецидиву хвороби після припинення лікування як інструмент визначення перебігу ЮІА.
Прогностичну цінність рівнів MRP8/14 щодо ризику розвитку рецидиву у хворих на ЮІА, які перебували у клінічній ремісії впродовж принаймні одного року після припинення лікування метотрексатом, відображено у низці робіт. Вперше про прогностичне значення кальпротектину крові було заявлено у роботі D. Foell та співавторів [5]. Отримані ним результати показали, що рівень MRP8/14 >250 нг/мл достовірно прогнозує ризик розвитку загострення ЮІА [5]. Цими ж авторами була висловлена гіпотеза, що три біомаркери (S100A12, MRP8/14 та hsCRP) можуть бути предикторами розвитку загострення після відміни лікування у хворих на ЮІА. Це дослідження показало, що такий біомаркер, як MRP8/14, може слугувати самостійним прогностичним маркером ризику розвитку загострення ЮІА після відміни лікування. При порівнянні пацієнтів, які перебували у стані стабільної ремісії, та хворих на ЮІА, у яких розвинулося загострення впродовж 6 міс після відміни лікування, медіана рівня MRP8/14 становила 440 та 850 нг/мл відповідно [7]. Проведено вивчення зв’язку рівня MRP8/14 із загостренням хвороби після відміни етанерцепту. Пацієнти, в яких загострення відбувалося впродовж 6 міс після відміни етанерцепту, мали вищий рівень кальпротектину крові у період припинення лікування, ніж пацієнти, які не мали загострення, медіана рівня кальпротектину крові у них становила 1025 проти 505 нг/мл відповідно [2]. Аналогічні результати отримано щодо прогнозування загострення сЮІА у роботі D. Holzinger та співавторів, які довели, що високі рівні MRP8/14 прогнозують загострення у хворих на сЮІА [10]. У хворих на сЮІА рівень MRP8/14 >740 нг/мл під час клінічної ремісії прогнозував загострення сЮІА [10].
Отримані нами результати відрізняються від даних, отриманих колегами. Нами не виявлено статистичної різниці рівнів кальпротектину крові у пацієнтів із ЮІА перед повною відміною лікування із розвитком загострення та без загострення через 3; 6 та 12 міс. Медіани рівнів кальпротектину крові у хворих на ЮІА перед відміною терапії, у яких розвинулося загострення хвороби через 3; 6 і 12 міс, становили 1700; 1500 та 1300 нг/мл відповідно. Водночас у хворих на ЮІА, в яких не розвинулося загострення, рівень кальпротектину крові через 3; 6 і 12 міс становив 1500; 1500 та 1650 нг/мл відповідно. То чому ж отримані нами результати кардинально відрізняються від опублікованих даних? Наші результати показали суттєво нижчі показники кальпротектину крові у наших пацієнтів із ЮІА, які перебувають у стані неактивної хвороби, порівняно з отриманими нами раніше даними про його рівень у періоді активності хвороби. Однак, незважаючи на цю різницю, виявилося, що його низький рівень не може спрогнозувати наступне загострення хвороби. Можливо, рівень кальпротектину міг би прогнозувати наступне загострення лише у хворих на сЮІА. Ці міркування базуються на зіставленні патогенезу сЮІА (автозапальний) та походженні кальпротектину (MRP8/14), який продукується моноцитами та відображає активацію механізмів вродженого імунітету, що є основою патогенезу сЮІА. На нашу думку, слід провести подальші дослідження щодо прогнозування ризику загострення, які стосуватимуться виключно пацієнтів із системним артритом.
Однак наші результати зіставні з даними дослідження, яке вивчало прогностичне значення кальпротектину крові перед відміною інгібіторів фактора некрозу пухлини у 137 хворих на поліартикулярний ЮІА, опублікованими у 2018 р. Не виявлено кореляції між часом до рецидиву захворювання і рівнем кальпротектину крові (MRP8/14) перед відміною інгібітора фактора некрозу пухлини [9]. Автори цього дослідження намагалися знайти відповідь на запитання, чому в їхньому дослідженні роль кальпротектину крові мала обмежене значення для прогнозування загострення. Розглядалося питання наявності в обстежуваних пацієнтів із ЮІА інфекційного захворювання, яке могло би впливати на вихідний рівень кальпротектину крові (MRP8/14). Однак основне пояснення, на думку авторів, полягало у кліренсі біологічного препарату, який отримували ці пацієнти, що мало вплив на досліджуваний біомаркер. Це дослідження стосувалося пацієнтів, які отримували біологічну терапію інгібіторами фактора некрозу пухлини, що відрізняло хворих, включених у наше дослідження.
Для нас важливими є подальші дослідження біомаркерів, які б могли прогнозувати загострення у хворих на ЮІА. Це можуть бути дослідження кальпротектину крові у гомогенних групах пацієнтів, зокрема із сЮІА. Ймовірно, аналіз комбінованих біомаркерів (клінічних, лабораторних, інструментальних) виявиться більш перспективним у плані розробки біомаркерів, які зможуть спрогнозувати загострення ЮІА у дітей після повної відміни лікування.
Висновки
Після відміни лікування у пацієнтів з ЮІА у стані неактивної хвороби загострення розвивається у 38,9% хворих впродовж наступного року спостереження. Результати дослідження не виявили статистичної різниці у рівнях кальпротектину крові у пацієнтів з ЮІА, які перебували у стані неактивної хвороби перед повною відміною лікування, із розвитком загострення та без загострення хвороби через 3; 6 та 12 міс.
Список використаної літератури
- Бойко Я.Є. (2016) Діагностичне та прогностичне значення кальпротектину (MRP8/MRP14) у крові хворих на різні варіанти ювенільного ідіопатичного артриту. Здоровье ребенка, 7(75): 18–24.
- Anink J., Van Suijlekom-Smit L.W.A., Otten M.H. et al. (2015) MRP8/14 serum levels as a predictor of response to starting and stopping anti-TNF treatment in juvenile idiopathic arthritis. Arthritis Res. Ther., 17(1): 200.
- Bojko Ya. (2017) Measurement of blood calprotectin (MRP-8/MRP-14) levels in patients with juvenile idiopathic arthritis. Reumatologia, 55(1): 10–14.
- Choi I.Y., Gerlag D.M., Herenius M.J. et al. (2015) MRP8/14 serum levels as a strong predictor of response to biological treatments in patients with rheumatoid arthritis. Ann. Rheum. Dis., 74: 499–505.
- Foell D., Frosch M., Schulze zur Wiesch A. et al. (2004) Methotrexate treatment in juvenile idiopathic arthritis: when is the right time to stop? Ann. Rheum. Dis., 63(2): 206–208.
- Frosch M., Ahlmann M., Vogl T. et al. (2009) The myeloid-related proteins 8 and 14 complex, a novel ligand of Toll-like receptor 4, and interleukin-1β form a positive feedback mechanism in systemic-onset juvenile idiopathic arthritis. Arthritis Rheum., 60(3): 883–891.
- Gerss J., Roth J., Holzinger D. et al.; for the Paediatric Rheumatology International Trials Organization (PRINTO) (2012) Phagocyte-specific S100 proteins and high-sensitivity C reactive protein as biomarkers for a risk-adapted treatment to maintain remission in juvenile idiopathic arthritis: a comparative study. Ann. Rheum. Dis., 71: 1991–1997.
- Gohar F., Husmann E., Haas P.J. et al. (2013) PReS-FINAL-2216: Biomarkers MRP8/14 and S100A12 correspond with flare and remission clinical status in Sojia patients in the AID-NET registerPediatr. Rheumatol. Online J., 11(2): 206.
- Hinze C.H., Foell D., Johnson A.L. et al. (2019) Serum S100A8/A9 and S100A12 Levels in Children with Polyarticular Forms of Juvenile Idiopathic Arthritis: Relationship to Maintenance of Clinical Inactive Disease During and Flare after Discontinuation of Anti-TNF Therapy. Arth. Rheum., 71(3): 451–459.
- Holzinger D., Frosch M., Kastrup A. et al. (2012) The Toll-like receptor 4 agonist MRP8/14 protein complex is a sensitive indicator for disease activity and predicts relapses in systemic-onset juvenile idiopathic arthritis. Ann. Rheum. Dis., 71(6): 974–980.
- Moncrieffe H., Ursu S., Holzinger D. et al. (2013) A subgroup of juvenile idiopathic arthritis patients who respond well to methotrexate are identified by the serum biomarker MRP8/14 protein. Rheumatology (Oxford), 52: 1467–1476.
- Rahman M.T., Myles A., Gaur P. et al. (2014) TLR4 endogenous ligand MRP8/14 level in enthesitis-related arthritis and its association with disease activity and TLR4 expression. Rheumatology (Oxford), 53: 270–274.
- Wallace C.A., Giannini E.H., Huang B. et al. Childhood Arthritis Rheumatology Research Alliance; Pediatric Rheumatology Collaborative Study Group; Paediatric Rheumatology International Trials Organisation (2011) American College of Rheumatology provisional criteria for defining clinical inactive disease in select categories of juvenile idiopathic arthritis. Arthritis Care Res. (Hoboken), 63: 929–936.
РОЛЬ ОПРЕДЕЛЕНИЯ УРОВНЯ КАЛЬПРОТЕКТИНА КРОВИ (MRP8/14) ДЛЯ ПРОГНОЗИРОВАНИЯ ОБОСТРЕНИЯ ЮВЕНИЛЬНОГО ИДИОПАТИЧЕСКОГО АРТРИТА ПОСЛЕ ОТМЕНЫ ЛЕЧЕНИЯ
Резюме. У части больных ювенильным идиопатическим артритом (ЮИА) после отмены лечения ЮИА развивается обострение болезни. Важно определить такие биомаркеры субклинической активности заболевания, которые помогут верифицировать больных ЮИА, у которых после отмены лечения не будет развиваться обострение болезни. Целью исследования является определение прогностического значения уровня кальпротектина крови (MRP8/14) у больных ювенильным идиопатическим артритом перед полной отменой лечения для прогнозирования риска развития обострения заболевания. Результаты исследования свидетельствуют о том, что через 3 мес после отмены лечения у пациентов с ЮИА в состоянии неактивной болезни возникло обострение у 5 (9,3%) из 54 больных. Медиана уровня кальпротектина перед отменой терапии составила 1700 нг/мл у больных, у которых возникло обострение, и 1500 нг/мл — у остальных. Через 6 мес обострение возникло дополнительно у 3 (6,3%) из 48 пациентов, продолжавших находиться под наблюдением, а медиана уровня кальпротектина составила 1300 и 1500 нг/мл соответственно. Через 12 мес обострение дополнительно возникло еще у 13 (28,9%) из 45 пациентов, продолжавших находиться под мониторингом, а медиана уровня кальпротектина перед отменой лечения составляла у этих больных 1100 и 1650 нг/мл соответственно. Выводы. После отмены лечения у пациентов с ЮИА в состоянии неактивной болезни в течение следующего года наблюдения обострение развивалось у 38,9% больных. Результаты исследования не показали статистической разницы в уровнях кальпротектина крови у пациентов с ЮИА, находящихся в состоянии неактивной болезни перед полной отменой лечения, с развитием обострения и без обострения болезни через 3; 6 и 12 мес.
ювенильный идиопатический артрит, MRP8/14, кальпротектин крови, биомаркеры, обострение, прогнозирование.
Адреса для листування:
Бойко Ярина Євгенівна
79017, Львів, вул. Коціловського, 21/8
E-mail: jboyko@ukr.net

Leave a comment