Лікарсько-індукований червоний вовчак: сучасні дані про механізми розвитку та асоційовані лікарські препарати
- 1Клінічна лікарня «Феофанія» Державного управління справами, Київ
- 2ДУ «Дніпровська медична академія» МОЗ України, Дніпро
Резюме. Лікарсько-індукований червоний вовчак (ЛІЧВ) — це автоімунний феномен, викликаний певними лікарськими препаратами, який призводить до синдрому з характерними клініко-лабораторними ознаками системного червоного вовчака (СЧВ). Спектр лікарських препаратів, асоційованих з ЛІЧВ, значно змінився за останні десятиріччя, оскільки багато ліків, що були причиною ЛІЧВ, зараз практично не застосовуються. Найпоширенішими препаратами, що викликають вовчак на сьогодні, є інгібітори фактора некрозу пухлини (іФНО)-α, інгібітори протонної помпи (ІПП), інтерферони, метилдезорфін, сульфасалазин, карбамазепін, ацебутолол, ізоніазид, каптоприл, пропілтіоурацил, тербінафін і міноциклін. Описана велика кількість клінічних випадків підгострого ЛІЧВ, викликаного ІПП. Проаналізовано 29 клінічних оглядів ЛІЧВ, опублікованих за останні 2 роки. Виникнення автоімунних реакцій на тлі застосування генно-інженерних біологічних препаратів, насамперед іФНО-α, становило 41,4% випадків, найпоширенішими препаратами були хіміотерапевтичні агенти (54,5%), асоційовані з підгострим шкірним червоним вовчаком. Описані ймовірні нові патогенетичні механізми виникнення ЛІЧВ. Розглянуто питання диференційного діагнозу ЛІЧВ і СЧВ, а також терапевтичні підходи до ЛІЧВ.
УДК:615.065:616-002.52-02-036-08
Введение
Лекарственно-индуцированная красная волчанка (ЛИКВ, Drug-induced lupus erythematosus — DILE) представляет собой волчаночноподобное аутоиммунное заболевание, которое обычно возникает при хроническом воздействии определенных лекарственных препаратов (от месяцев до нескольких лет) и разрешается после прекращения приема препарата-«виновника» или препарата-индуктора. С учетом отсроченной временной ассоциации между приемом препарата и возникновением симптомов, ЛИКВ часто не диагностируется.
Распознавание ЛИКВ приписывают Хоффману, который впервые сообщил о волчаночноподобных симптомах после лечения сульфадиазином в 1945 г. [31]. Позднее, в 1985 г., сообщалось о возникновении подострой кожной красной волчанки (ПККВ) на фоне приема гидрохлоротиазида, что привело к появлению концепции лекарственно-индуцированной ПККВ [60]. На сегодняшний день более 100 препаратов из более чем 10 групп могут выступать индукторами развития ЛИКВ [18, 74]. Но только прокаинамид и гидралазин считаются двумя препаратами наивысшего риска: с 20% [63] и 5–8% [82] частотой развития ЛИКВ соответственно. В настоящее время применение этих препаратов в клинической практике уменьшается. Однако в последнее время растет число случаев ЛИКВ, вызванной новыми препаратами, которые используются в онкологической практике, и генно-инженерными биологическими модуляторами у пациентов с аутоиммунными заболеваниями [13].
Пять наиболее распространенных классов лекарств, которые могут быть связаны с ЛИКВ, включают:
- Ингибиторы фактора некроза опухоли (иФНО)-α (этанерцепт и инфликсимаб).
- Противомикробные препараты, включая тербинафин (также связанный с лекарственно-индуцированной ПККВ), миноциклин (ЛИКВ с более высокой частотой возникновения гепатита) и противотуберкулезные препараты, включая изониазид, пиразинамид и рифабутин.
- Антиконвульсанты, такие как фенитоин, вальпроевая кислота, карбамазепин.
- Антиаритмические препараты, такие как прокаинамид, хинидина сульфат и пропафенон.
- Антигипертензивные, такие как гидроксизин, миноксидил, и тимолол.
В этом обзоре обобщен спектр лекарственных препаратов, ассоциированных с возникновением ЛИКВ, сформирована текущая структура разнообразных механизмов, патогенетически связанных с ЛИКВ, с акцентом на обновление лекарственных препаратов и механизмов, о которых сообщалось в течение последних 2 лет.
Клинико-лабораторная характеристика ЛИКВ
Подобно идиопатической волчанке, ЛИКВ можно разделить на три основные формы:
- системная ЛИКВ;
- лекарственно-индуцированная подострая кожная красная волчанка (ЛИПККВ);
- хроническая кожная ЛИКВ.
Последние две формы имеют преимущественно кожные проявления и могут быть определены как лекарственно-индуцированная кожная красная волчанка (ЛИККВ).
Системная ЛИКВ характеризуется незначительной артралгией, миалгией, серозитами и конституциональными симптомами [9]. ЛИКВ, как правило, клинически отличается от системной красной волчанки (СКВ). При ЛИКВ повреждения органов-мишеней обратимы и клинически имеют менее тяжелые проявления, чем при СКВ, при этом поражения почек и центральной нервной системы отмечаются редко. Несколько лекарственных препаратов, ассоциированных с ЛИКВ, являются заметными исключениями: при применении гидралазина, пеницилламина и иФНО-α в патологический процесс обычно вовлекаются почки, в то время как применение миноциклина ассоциируется с тяжелым поражением печени [18]. Поражение кожи также менее распространено при ЛИКВ по сравнению с СКВ; ЛИКВ имеет тенденцию быть менее «светочувствительным» заболеванием, чем СКВ, за исключением лекарственных препаратов, которые, как известно, вызывают фотосенсибилизацию: тиазидные диуретики. Кроме того, ЛИКВ обычно имеет более высокую частоту возникновения пурпуры и узловатой эритемы и меньшую частоту синдрома Рейно по сравнению с СКВ [4]. ЛИКВ можно отличить от СКВ и по эпидемиологическим факторам: СКВ, как правило, отмечается у афроамериканских женщин молодого возраста, в то время как ЛИКВ чаще всего является болезнью пациентов европеоидной расы пожилого возраста и не имеет полового диморфизма [4].
Лабораторные тесты также могут помочь в проведении дифференциального диагноза ЛИКВ и СКВ. Для ЛИКВ менее характерно появление анемии или тромбоцитопении, снижения уровней C3 и C4, нарушения функции печени и почек, патологии в анализе мочи. И ЛИКВ, и СКВ являются ANA-позитивными состояниями, и, хотя антитела к гистонам классически связаны с ЛИКВ, они также могут отмечаться у 50% пациентов с СКВ. Anti-Sm, dsDNA специфичны для СКВ, тогда как ssDNA чаще выявляют при ЛИКВ [65]. Положительный волчаночный антикоагулянт и антикардиолипиновые антитела, в основном IgM-класса, выявляются у 7–20% больных с ЛИКВ, как правило, в невысоких титрах и не ассоциируются с развитием тромботических осложнений [1]. У больных, получавших миноциклин, сульфасалазин и аллопуринол, при развитии ЛИКВ определялись положительные антинейтрофильные цитоплазматические антитела (АНЦА) [20]. Однако выявления только лабораторных маркеров без клинической симптоматики недостаточно для установления диагноза ЛИКВ [74]. В табл. 1 просуммированы дифференциально диагностические признаки ЛИКВ и СКВ.
| Признаки | СКВ | ЛИКВ |
|---|---|---|
| Клинические |
|
|
| Течение болезни | Хроническое рецидивирующее | Регресс после отмены препарата |
| Лабораторные |
|
|
| Иммунофлуоресцентная гистопатология |
|
|
ЛИПККВ является наиболее распространенным подтипом ЛИКВ с преобладающим поражением кожи и чаще отмечается у женщин пожилого возраста [42]. Существует генетическая предрасположенность к ЛИПККВ у пациентов с повышенной частотой HLA-B8 и HLA DR3. ЛИПККВ, по сравнению с ПККВ, имеет тенденцию к распространенному поражению кожи с более тяжелыми проявлениями, включающим более высокую распространенность скуловых поражений, васкулитов, булл и мультиформной эритемы. Висцеральные и системные проявления не характерны для ЛИПККВ, в отличие от ПККВ, в большинстве случаев имеет место изолированное поражение кожи.
Ретроспективный анализ 70 больных ПККВ показал, что в 21% случаев имела место лекарственно-индуцированная форма, наиболее часто обусловленная применением гипотензивных препаратов: тиазидных диуретиков, ингибиторов ангиотензинпревращающего фермента (ИАПФ) и блокаторов кальциевых каналов [76]. Кроме того, к лекарственным средствам, ассоциированным с развитием ЛИПККВ, относят блокаторы бета-адренорецепторов, статины, противогрибковые препараты, антидепрессанты и генно-модифицированные биологические препараты [76]. Недавно в качестве возможных причинных агентов стали рассматривать тербинафин (противогрибковый препарат), бупропион (антидепрессант) и ацебутолол (блокатор бета-адренорецепторов) [16, 26]. Клиническая картина ЛИПККВ характеризуется поражением кожи в виде чешуйчатой, кольцевидной или папулосквамозной сыпи, напоминающей псориатические высыпания, с преимущественной локализацией на передней поверхности грудной клетки, верхней части спины, руках и лице [46]. У 80% больных определяются анти-Ro/SSA-антитела, у 30–40% — анти-La/SSB-антитела, у 75% — антитела к гистонам.
Хроническая кожная ЛИКВ отмечается редко и часто индуцируется применением соединений флюороурацила и нестероидных противовоспалительных препаратов [45]. Дискоидные поражения кожи чаще определяются при хронической кожной ЛИКВ, чем при двух других подтипах.
Рекомендации, предложенные А.Т. Borchers и соавторами в 2007 г. [9] и далее усовершенствованные Х. Xiao и С. Chang в 2014 г. [80] (табл. 2), могут помочь в некоторой степени подтвердить диагноз ЛИКВ. Следует отметить, что диагноз ЛИКВ должен быть установлен, исходя из данных общего клинического осмотра, тщательного сбора анамнеза применения лекарственных препаратов, а также всесторонней оценки заболевания в течение периода после воздействия и отмены лекарственного препарата, являющегося возможной причиной.
|
|
|
|
Определение препарата, индуцирующего развитие ЛИКВ, является первым и самым важным шагом в менеджменте ЛИКВ. Тем не менее, ЛИКВ легко может быть не распознана в клинической практике с учетом следующих факторов: отсроченная реакция и невыявление связи между воздействием лекарств и появлением симптомов; достаточно раннее применение новых лекарств без достаточной разработки и оценки прогнозирования их долгосрочного эффекта во время терапии; недостаточное понимание патофизиологических механизмов ЛИКВ.
Лекарственные препараты, индуцирующие развитие лекарственной красной волчанки
Препараты, ассоциированные с ЛИКВ, имеют различную химическую структуру: ароматические амины, гидразиновые и сульфгидрильные группы, что указывает на отсутствие единой химической конфигурации, обусловливающей возникновение ЛИКВ [83]. Между тем, большинство лекарственных препаратов, способствующих возникновению ЛИКВ, подробно обобщены в научной литературе [7, 17, 55, 65]. Они стратифицированы по четырем категориям — лекарственные препараты, которые определенно, вероятно и возможно вызывают ЛИКВ, и недавно заявленные (табл. 3); также они могут быть сгруппированы по категориям уровней риска — группы высокого, среднего, низкого или очень низкого риска (рис. 1).
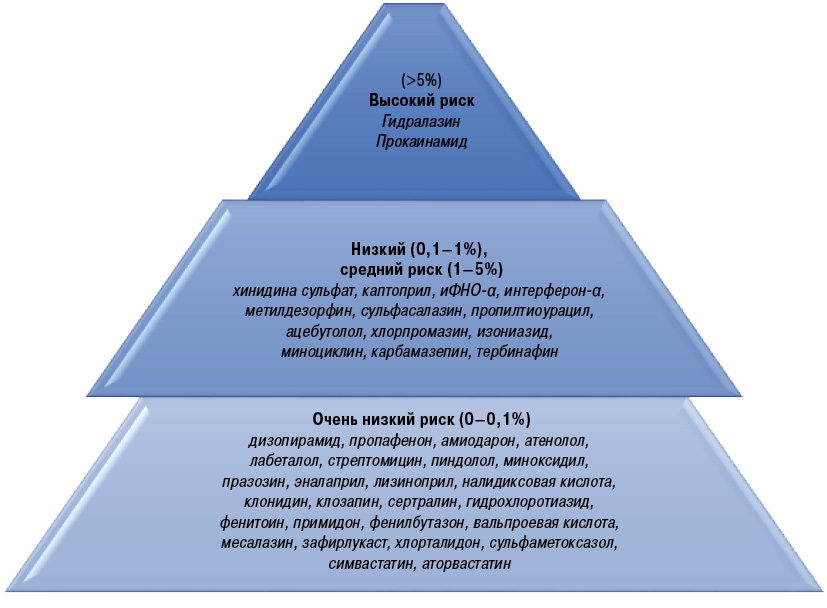
| Лекарственные препараты, определенно вызывающие ЛИКВ |
|
| Лекарственные препараты, вероятно вызывающие ЛИКВ |
|
| Лекарственные препараты, возможно вызывающие ЛИКВ |
|
| Недавно заявленные лекарственные препараты, вызывающие ЛИКВ |
|
Наиболее распространенными препаратами, вызывающими системную ЛИКВ, являются гидралазин (высокий риск), прокаинамид (высокий риск), изониазид (средний риск), миноциклин (очень низкий риск) и совсем недавно заявленные иФНО-α (низкий риск) [4, 9, 74]. Препараты, наиболее вероятно вызывающие ЛИПККВ, включают гидрохлоротиазид [60], блокаторы кальциевых каналов и иАПФ [55]. Лекарственные препараты, такие как ингибиторы протонной помпы (ИПП) [11, 39, 50], тербинафин [41], иммуномодуляторы (лефлуномид [46], иФНО-α [22]), и химиотерапевтические агенты [19, 30, 77] также могут вызвать ЛИПККВ.
Популяционное исследование случай-контроль, проведенное С.М. Gronhagen и соавторами (2012) [29], подтвердило связь между некоторыми лекарственными препаратами и риском возникновения ЛИПККВ со значительно увеличенным отношением шансов (OШ), выявленным для тербинафина (OШ 52,9), иФНО-α (OШ 8,0), противоэпилептических средств (OШ 3,4) и ИПП (OШ 2,9). Хроническая кожная ЛИКВ обычно индуцируется соединениями флюороурацила или их современными производными, такими как капецитабин [49]. Тербинафин, иФНО-α и антиэпилептики могут вызывать как ЛИПККВ, так и ЛИКВ.
ИПП-индуцированная красная волчанка
ИПП-индуцированная красная волчанка заслуживает большей осведомленности в клинической практике, поскольку случаи ЛИПККВ, связанные с ИПП, регистрируются все чаще и имеют все более широкий масштаб распространения. ИПП, часто назначаемые для лечения при язвенной и гастроэзофагеальной рефлюксной болезни (ГЭРБ), снижают секрецию вырабатываемой соляной кислоты путем ингибирования насоса Kfl/Hfl АТФазы в париетальных клетках желудка [66]. В швейцарском исследовании случай–контроль, проведенном С.М. Gronhagen и соавторами (2012) [29], 66 из 234 случаев ЛИПККВ были ассоциированы именно с применением ИПП. В 2014 г. в Дании, в ретроспективном обзоре медицинских карт 429 пациентов с кожной формой красной волчанки были выявлены 24 пациента с ИПП-индуцированной ЛИПККВ [64].
В недавнем исследовании Т.С. Michaelis и соавторов (2017) [50] установлено, что с августа 2009 г. по май 2016 г. (исследование случай–контроль из Швеции, при этом исследование С.М. Gronhangen и соавторов [29] было исключено) случаи волчанки, связанные с ИПП, увеличились на 34,1% по сравнению со всеми другими препаратами, тогда как ассоциация возникновения ЛИПККВ с антигипертензивными и противогрибковыми препаратами снизилась на 28,9 и 22,4% соответственно [50]. Недавний ретроспективный обзор, в котором представлены 88 случаев с ЛИПККВ, ассоциированной с применением ИПП, позволяет предположить, что указанная группа препаратов является одной из наиболее распространенных классов препаратов-«виновников» в настоящее время [40]. Необходимо проведение исследований, направленных на изучение механизмов, лежащих в основе развития ЛИПККВ, связанной с применением ИПП.
Системная ЛИКВ, индуцированная иФНО-α
Системная ЛИКВ, индуцированная иФНОα, является наиболее актуальной проблемой для ревматологов, которые назначают эти препараты в своей практике довольно-таки часто, особенно последнее время [7, 56, 68]. Распознавание ЛИКВ у пациентов, применяющих препараты данной группы, достаточно трудный процесс [63], поскольку кожные реакции с признаками аутоиммунного воспаления и без таковых очень распространены у пациентов, получающих эти препараты.
В обзоре М. Ramos-Casals и соавторов (2008) описано 105 пациентов, у которых развилась ЛИКВ после начала анти-ФНО-α-терапии; в этой группе симптомы люпуса появлялись в среднем через 41 нед после начала терапии [59]. В большинстве случаев речь шла о применении этанерцепта или инфликсимаба и реже адалимумаба, что может быть результатом его меньшего кумулятивного эффекта [75]. В сообщении о 33 случаях применения анти-ФНО-α-агентов, которые индуцировали ЛИКВ, M.F. Costa и соавторы (2008) сообщили, что 21 случай был связан с инфликсимабом, 10 — с этанерцептом и только 2 — с адалимумабом [22]. У пациентов с ЛИКВ, ассоциированной с иФНО-α, отмечается высокая распространенность положительных аутоиммунных маркеров, а именно антител к двухцепочечной ДНК, антител к ENA, гипокомплементемия, а также более высокая частота как кожных, так и системных заболеваний, особенно поражения почек и возникновения серозитов, по сравнению с классической ЛИКВ, вызванной другими препаратами [58]. Кожные проявления при анти-ФНО-α-ассоциированной ЛИКВ представляют собой фотосенсибилизацию и дискоидные высыпания. Кожные проявления чаще наблюдаются у пациентов, получающих этанерцепт, тогда как инфликсимаб вызывает более высокую частоту возникновения серозитов.
Применение анти-ФНО-α-агентов также связано с появлением других аутоантител — антикардиолипиновых антител, тогда как классическая ЛИКВ чаще ассоциируется с антигистоновыми антителами. М. DeBandt (2006) рассмотрел единственный случай тромбоза у пациента с антикардиолипиновыми антителами и ЛИКВ, индуцированной анти-ФНО-α, хотя у половины исследованных пациентов с ЛИКВ выявлены антитела к кардиолипинам [23].
Механизм, лежащий в основе индукции ЛИКВ при терапии иФНО-α, изучен недостаточно. Одна из гипотез заключается в том, что связывание препарата с клеточной поверхностью вызывает клеточный апоптоз, который, снижая экспрессию CD44, нарушает клиренс обломков ядер и нейтрофилов и стимулирует продукцию аутоантител, направленных на ядерные антигены и ДНК [22]. Вторая гипотеза состоит в том, что подавление ответа T-хелперов 1-го типа в результате терапии анти-ФНО-α вызывает избыточный ответ T-хелперов 2-го типа, стимулирует продукцию Th2-цитокинов, интерлейкина (ИЛ)-10 и интерферона-α, приводя к чрезмерной продукции аутоантител с последующим развитием волчаночно-подобной симптоматики [10]. Третье предположение относительно патогенеза ЛИКВ, ассоциированного с иФНО-α, заключается в том, что пациенты, применяющие эти лекарства, более склонны к развитию бактериальных инфекций, которые являются мощными стимуляторами активации поликлональных В-лимфоцитов и выработки аутоантител [15]. И еще одна гипотеза заключается в том, что иФНО-α могут угнетать продукцию цитотоксических Т-клеток, что приводит к уменьшению элиминации аутоантител, представляющих В-клетки.
Обзор исследований, посвященных ЛИКВ, за последние 2 года
Нами проведен обзор литературы с целью определения изменений в списке препаратов, которые являются триггерами ЛИКВ, за последние 2 года (табл. 4). Поиск выполнен в PubMed, проанализированы обзоры клинических случаев ЛИКВ, опубликованные с 1 января 2016 г. по 30 декабря 2018 г. Поиск проводился по ключевой фразе — «лекарственно-индуцированная красная волчанка», использовались только англоязычные работы. Импакт-фактор журналов не принимался во внимание. Большая серия случаев ИПП-ассоциированной ЛИПККВ была исключена из последующего анализа, поскольку факт индуцирования ЛИКВ этой группой препаратов установлен и оговорен ранее.
| № п/п | Пол/возраст | Лекарство (дозы) | Группа препаратов | Форма ЛИКВ | Латентный период | Аутоантитела | Исход симптомов после отмены препарата | Источник литературы |
|---|---|---|---|---|---|---|---|---|
| 1 | М/39 | Клозапин (25 мг/сут) | Антипсихотический препарат | Системная ЛИКВ | 8 дней | ANA+ | Ремиссия | [14, Buzina N., 2016] |
| 2 | М/91 | Миноциклин (200 мг/сут) | Системный антибиотик | Системная ЛИКВ | 2 года | ANA+, dsDNA+ | Улучшение | [73, Starobin D., 2017] |
| 3 | Ж/62 | Триметоприм/сульфаметоксазол | Системный антибиотик | Системная ЛИКВ | 1 нед | ANA+, гистон+, dsDNA–,SSA–, SSB– | Ремиссия | [36, Jose A., 2017] |
| 4 | М/21 | Гидралазин (50 мг) | Антигипертензивный препарат | Системная ЛИКВ | 2 мес | Гистона+, ANA– | Ремиссия | [85, Zeitjian V., 2017] |
| 5 | Ж/36 | Гидралазин (50 мг) | Антигипертензивный препарат | Системная ЛИКВ | 18 мес | гистон+, dsDNA–,SSA–, SSB– | Улучшение | [34, Iyer P.,2017] |
| 6 | Ж/35 | Гидралазин (10 мг) | Антигипертензивный препарат | Системная ЛИКВ | 4 нед | Гистон+, ANA–, dsDNA– | Улучшение | [32, Holman S.K., 2017] |
| 7 | Ж/14 | Инфликсимаб | Иммуномодулятор (iTNF-a) | Системная ЛИКВ | 7 мес | ANA+, dsDNA+ | Ремиссия | [70, Shovman O., 2018] |
| 8 | Ж/64 | Инфликсимаб | Иммуномодулятор (iTNF-a) | Системная ЛИКВ | 11 мес | Гистон+, dsDNA–, ANA+ | Ремиссия | [70, Shovman O., 2018] |
| 9 | Ж/67 | Инфликсимаб | Иммуномодулятор (iTNF-a) | Системная ЛИКВ | 3 мес | ANA+ | Ремиссия | [70, Shovman O., 2018] |
| 10 | Ж/48 | Инфликсимаб | Иммуномодулятор (iTNF-a) | Системная ЛИКВ | 3 года | ANA+, dsDNA+ | Ремиссия | [43, Magno Pereira V., 2017] |
| 11 | Ж/42 | Адалимумаб | Иммуномодулятор (iTNF-a) | Системная ЛИКВ | 2 года | ANA+ | Улучшение | [41, Lomicova I., 2017] |
| 12 | Ж/9 | Карбамазепин (200 мг/сут) |
Противосудорожный препарат | Системная ЛИКВ | 3 года | ANA+, гистон+, | Ремиссия | [51, Molina-Ruiz A.M., 2017] |
| 13 | Ж/60 | Митотан (300 мг) | Химиотерапевтический препарат | ЛИПККВ | 1 мес | ANA–, SSA–, SSB– | Ремиссия | [47, Mayor-Ibarguren A., 2016] |
| 14 | М/42 | Интерферон альфа-2a | Иммуномодулятор | ЛИПККВ | 24 нед | ANA–, гистон–, dsDNA– | Не определено | [61, Reyes H.A., 2016] |
| 15 | Ж/63 | Гемцитабин | Химиотерапевтический препарат | ЛИПККВ | 2 нед | SSA–, SSB–, гистон– |
Ремиссия | [8, Ben Zvi M., 2016] |
| 16 | Ж/50 | Лефлуномид (20 мг/сут) |
Иммуномодулятор | ЛИПККВ | 3 года | ANA+, гистон+, SSA+, SSB–, dsDNA– | Улучшение | [69, Singh H., 2016] |
| 17 | Ж/67 | Капецитабин | Химиотерапевтический препарат | ЛИПККВ | 6 нед | ANA+, SSA+ | Улучшение | [38, Kim W.I., 2016] |
| 18 | Ж/54 | Пирфенидон | Новый антифиброзный препарат | ЛИПККВ | 8 нед | dsDNA+, ANA–, гистон–,SSA–, SSB– |
Улучшение | [37, Kelly A.S., 2017] |
| 19 | Ж/69 | Анастрозол | Химиотерапевтический препарат | ЛИПККВ | 16 мес | SSA+, ANA–, SSB– | Улучшение | [27, Fisher J., 2016] |
| 20 | Ж/14 | Гидроксикарбаленд (1500 мг/сут) | Химиотерапевтический препарат | ЛИПККВ | 5 лет | ANA+, гистон+, SSA–, SSB– | Улучшение | [81, Yanes D.A., 2017] |
| 21 | Ж/50 | Палбоциклиб | Химиотерапевтический препарат | ЛИПККВ | 2 мес | ANA+, dsDNA–, SSA–, SSB– | Ремиссия | [54, Pinard J., 2018] |
| 22 | Ж/35 | Эмтрицитабин, рилпивирин, тенофовирадизопроксила фумарат (комбинация) | Антиретровирусная терапия | ЛИПККВ | 3 года | ANA+, dsDNA+, гистон+ |
Ремиссия | [44, Mantis J., 2017] |
| 23 | Ж/34 | Тербинафин (крем для топического применения) |
Противогрибковый препарат | ЛИПККВ | несколько лет | ANA+, SSA+ | Ремиссия | [57, Ramachandran S.М., 2017] |
| 24 | Ж/62 | Внутривенный иммуноглобулин (1,3 г/кг/мес) | Иммуномодулятор | ЛИККВ | 6 нед | Не определены | Улучшение | [3, Adrichem M.E., 2017] |
| 25 | Ж/45 | Внутривенный иммуноглобулин (1,2 г/кг/мес) | Иммуномодулятор | ЛИККВ | 6 мес | Не определены | Улучшение | [3, Adrichem M.E., 2017] |
| 26 | М/42 | Внутривенный иммуноглобулин (1,3 г/кг/мес) | Иммуномодулятор | ЛИККВ | 2 нед | SSA+ | Улучшение | [3, Adrichem M.E., 2017] |
| 27 | Ж/67 | Внутривенный иммуноглобулин (1 г/кг/мес) | Иммуномодулятор | ЛИККВ | <3 нед | ENA+ | Улучшение | [3, Adrichem M.E., 2017] |
| 28 | М/54 | Подкожный иммуноглобулин (1,8 г/кг/мес) | Иммуномодулятор | ЛИККВ | 22 мес | ANA+, ENA– | Ремиссия | [3, Adrichem M.E., 2017] |
| 29 | М/60 | Внутривенный иммуноглобулин (0,8 г/кг/мес) | Иммуномодулятор | ЛИККВ | 6 мес | ENA+ | Улучшение | [3, Adrichem M.E., 2017] |
Так, проанализировано 29 случаев ЛИКВ в 22 статьях (см. табл. 4) [3, 8, 27, 32, 34, 36–38, 41, 43, 44, 47, 51, 54, 57, 61, 69, 70, 73, 81, 85], среди которых: 12 (41,4%) случаев были системными ЛИКВ, 11 (37,9%) — ЛИПККВ, в 6 (20,7%) случаях — ЛИККВ без дальнейшей трансформации в ЛИПККВ или в хроническую кожную ЛИККВ.
12 случаев системной ЛИКВ включали 9 (75%) пациенток женского пола и 3 (25%) мужчин, средний возраст которых составил 44 года (диапазон — 9 лет–91 год). иФНО-α были наиболее часто применяемыми препаратами, которые вызывали системную ЛИКВ в течение последних 2 лет (всего 5 случаев: 4 были связаны с инфликсимабом и 1 — с адалимумабом). Следует отметить, что в педиатрической популяции отмечено 2 случая системной ЛИКВ, ассоциированных с инфликсимабом и карбамазепином, что позволяет сделать вывод о более редком возникновении случаев ЛИКВ в этой популяции пациентов. Однако ЛИКВ следует подозревать у пациентов более молодого возраста при длительном лечении определенными препаратами.
Все три случая системной ЛИКВ, индуцированной гидралазином, протекали на фоне отрицательных ANA, в отличие от серологических результатов положительного сывороточного ANA у большинства пациентов с ЛИКВ ранее, что позволяет предположить, что диагноз гидралазин-индуцированной красной волчанки не следует исключать, если ANA отрицательные.
В 11 случаях ЛИПККВ было 10 пациентов женского пола и 1 — мужского, средний возраст составил 47,6 года (диапазон — 14–69 лет). Чаще всего ЛИПККВ была ассоциирована с получением пациентами химиотерапии, при этом 6 случаев, как сообщалось, были вызваны митотаном, гемцитабином, капецитабином, анастрозолом, гидроксикарбалендом и палбоциклибом. Митотан, антифибротический препарат пирфенидон и антиретровирусная терапия ВИЧ были впервые идентифицированы как триггеры ЛИПККВ, не описанные ранее. Кожная красная волчанка, вызванная лечением иммуноглобулином, отмечалась в серии случаев с ЛИККВ у трех пациентов женского пола и трех — мужского (средний возраст — 55 лет, диапазон — от 42 до 67 лет).
Механизмы, принимающие участие в развитии ЛИКВ
Несмотря на то что с возникновением ЛИКВ ассоциированы различные препараты разных классов и с разным механизмом действия, большинство исследований, изучающих патологические механизмы при ЛИКВ, были сосредоточены, главным образом, на прокаинамиде и гидралазине. Было предложено несколько механизмов, включая генетическую предрасположенность, биотрансформацию лекарственного средства и эпигенетическую дисрегуляцию в различных иммунных клетках. Механизмы, лежащие в основе патогенеза ЛИКВ, обобщены на рис. 2.
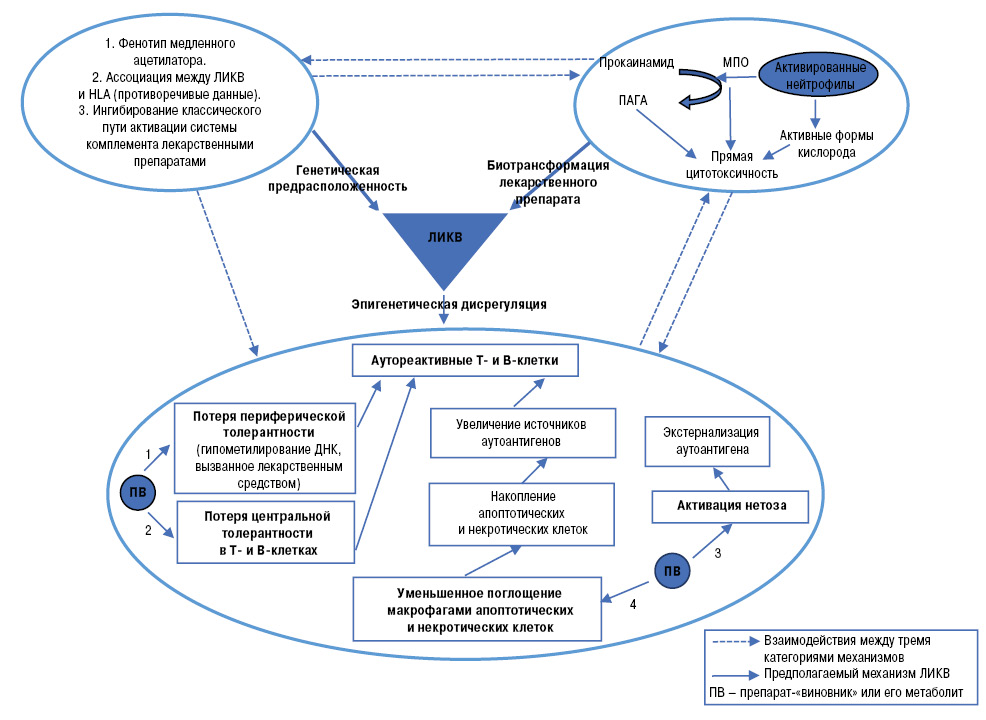
Генетическая предрасположенность
Безоговорочно признано, что генетическая предрасположенность играет ведущую роль в развитии ЛИКВ. Такие лекарственные препараты, как прокаинамид, гидралазин и изониазид, содержат структуру ароматических аминов или гидразинов и преимущественно метаболизируются путем ацетилирования с использованием ферментов N-ацетилтрансферазы [84]. Установлено, что большинство пациентов с красной волчанкой, вызванной прокаинамидом или гидралазином, являются медленными ацетилаторами, которые более склонны к накоплению аутоантител после воздействия прокаинамида или гидралазина по сравнению с быстрыми ацетилаторами [79].
В отличие от результатов прокаинамида и гидралазина, возникновение ЛИКВ, ассоциированной с изониазидом, по-видимому, не связано с фенотипом ацетилатора, хотя изониазид также метаболизируется ацетилированием [25]. Кроме того, в некоторых исследованиях предполагалось наличие ассоциаций между появлением ЛИКВ и определенными антигенами лейкоцитов человека (HLA), таким как HLA-DR2, HLA-DR3, и нулевыми аллелями комплемента класса III C4A и C4B, но эти результаты подвергнуты сомнениям [72]. Система комплемента также может играть важную роль в патогенетических механизмах ЛИКВ. Е. Sim и соавторы [68] сообщили, что гидралазин, пеницилламин, изониазид и продукты метаболизма прокаинамида могут быть мощными ингибиторами ковалентной реакции связывания компонента комплемента C4, который может ингибировать активацию комплемента компонента C3 в классическом пути комплемента, препятствуя клиренсу иммунных комплексов.
Генетическая предрасположенность, особенности биотрансформации лекарственного препарата и эпигенетическая дисрегуляция являются тремя важными компонентами современных гипотетических патогенных механизмов развития ЛИКВ. Вместо того чтобы работать независимо, эти факторы взаимодействуют друг с другом, вызывая ЛИКВ. Генетическая предрасположенность: исследования, выявляющие генетическую предрасположенность, можно обобщить по трем основным аспектам, перечисленным в левом верхнем кругу (см. рис. 2). Биотрансформация: прокаинамид подвергается опосредованному нейтрофилами окислительному метаболизму с образованием ПАГА. ПАГА, MПO и активные формы кислорода обусловливают прямую цитотоксичность. Эпигенетическая дисрегуляция: лекарственные препараты и их метаболиты вызывают эпигенетическую дисрегуляцию на Т- и В-клетках (1, 2), макрофагах (3) и нейтрофилах (4), что в конечном итоге приводит к генерации аутореактивных Т- и В-клеток, запускающих ЛИКВ (см. рис. 2).
Биотрансформация лекарственного препарата
Прокаинамид, окисляясь активированными нейтрофилами, приводит к выработке токсичного метаболита, называемого ПАГА. ПАГА вместе с MПO и активными формами кислорода, выделяющимися при окислительном метаболизме прокаинамида, обусловливают цитотоксичность [35]. Кроме того, аутоантитела против МПО выявлены в сыворотке крови у пациентов с ЛИКВ, что косвенно подтвердило роль МПО-опосредованного метаболизма в развитии ЛИКВ [52]. Другие препараты, включая гидралазин, хинидина сульфат, фенитоин, сульфоны, пеницилламин, хлорпромазин и изониазид, подвергаются биотрансформации, аналогичной прокаинамиду, генерируя реактивные метаболиты, запускающие ЛИКВ. Напротив, лекарства в малых молекулах могут, связываясь с белками, активировать процесс гаптенизации и тем самым стимулировать иммунные реакции [17].
Эпигенетическая дисрегуляция в адаптивных иммунных клетках и другие механизмы аутореактивности
Сообщалось, что биотрансформированные препараты-«виновники» или их метаболиты изменяют эпигенетические свойства иммунных клеток и в конечном итоге приводят к ЛИКВ. В ранних исследованиях эпигенетического механизма ЛИКВ было предложено несколько механизмов с участием Т- или В-клеток. Продемонстрировано, что гидралазин и прокаинамид ингибируют метилирование ДНК Т-клеток [21]. В частности, прокаинамид действует как конкурентный ингибитор ДНК-метилтрансферазы, в то время как гидралазин предотвращает индукцию ДНК-метилтрансферазы путем ингибирования сигнального пути ERK [24]. Гипометилирование ДНК в Т-клетках приводит к повышению экспрессии антигена-1 (LFA-1), ассоциированной с функцией лимфоцитов, стимулируя аутореактивность. Адаптивный перенос этих аутореактивных Т-клеток мышам вызывал у них волчаночноподобное заболевание [83].
Другие исследования показывают, что ПАГА — метаболит прокаинамида — влияет на центральную толерантность Т-клеток, приводя к выработке аутореактивных Т-клеток, запускающих аутоиммунные процессы [62]. Точно так же гидралазин способен нарушать толерантность к В-клеткам и способствовать генерации патогенной аутореактивности за счет нарушения изменения структуры рецептора посредством ингибирования сигнального пути ERK [48]. Хинидина сульфат и прокаинамид в терапевтических концентрациях ингибируют поглощение апоптотических тимоцитов макрофагами, что превращает эти аккумулированные клетки в источники неконтролируемого поглощения аутоантигенов в определенных условиях [2].
R.D. Sontheimer и соавторы (2009) [71] обсудили доказательства, вероятно, относящиеся к патогенезу ЛИПККВ, указав, что лекарственные средства, индуцирующие ЛИПККВ, способны вызывать фотосенсибилизацию, дополнительно усиливая кожные иммунные ответы, которые вызывают увеличение локальной продукции интерферона I типа и нисходящих молекул, таких как хемокин ( C-X-C motif) лиганд 9 (CXCL9).
Роль нетоза и врожденной иммунной системы
Совсем недавно в патогенезе развития ЛИКВ была описана роль нетоза — уникального механизма гибели нейтрофильных клеток. Нейтрофильные внеклеточные ловушки представляют собой трехмерные сетчатые структуры, содержащие ядерную ДНК и цитозольные белки, секретируемые активированными нейтрофилами после специфических стимулов [12].
Ядерный материал и гранулированные белки, богатые аутоантигенами, высвобождаются во время нетоза, что впоследствии индуцирует развитие аутоиммунной реакции [28]. В 2018 г. J.A. Irizarry-Caro и соавторы [33] описали, что прокаинамид и гидралазин способствуют образованию нейтрофильной экстрацеллюлярной ловушки посредством запуска нейтрофильных мускариновых рецепторов и увеличения внутриклеточного потока кальция in vitro, соответственно демонстрируя вклад врожденных иммунных реакций в развитие ЛИКВ. Отметим, что в той же статье также было указано, что миноциклин и клозапин, препараты, которые реже ассоциируются с ЛИКВ, не вызывают нетоза. Предполагается, что дополнительные будущие эксперименты как in vitro, так и in vivo, раскроют и подтвердят роль лекарственно-индуцированного нетоза при ЛИКВ [67].
Лечение
Основополагающим принципом лечения при ЛИКВ является отмена препарата-«виновника» ЛИКВ, после чего в течение 3 нед–6 мес следует ожидать регресса патологической симптоматики. При этом антительный ответ даже на фоне прекращения терапии может удерживаться на протяжении года и более. В ряде случаев требовалось усиление иммуносупрессивной терапии. Сообщалось о назначении 40% больным глюкокортикоидов. В 12% наблюдений возникла необходимость в дополнительной иммуносупрессивной терапии азатиоприном, циклофосфамидом, лефлуномидом, метотрексатом и микофенолата мофетилом [53, 59]. Имеются сведения о развитии тяжелого миозита на фоне ЛИКВ у больной РА при лечении адалимумабом, для купирования которого были назначены пульс-терапия глюкокортикоидами и два курса ритуксимаба, после чего достигнута полная ремиссия [5].
Немаловажным и открытым остается вопрос о возможности продолжения терапии альтернативными иФНО-α у больных c ЛИКВ. Приводятся данные о возможности возобновления такого лечения без рецидива симптомов, однако подобные наблюдения крайне малочисленны, а выводы не являются окончательными [5, 6, 58, 59, 78].
Прогноз у большинства пациентов c ЛИКВ благоприятный. Полный регресс проявлений и нормализация уровня аутоантител наблюдаются после отмены лекарственного препарата, впоследствии рецидивов не отмечается. В редких случаях возможно появление выраженных неврологических или почечных нарушений с формированием остаточных явлений.
Для обеспечения безопасности больных необходимо выполнять рекомендации по профилактике ЛИКВ. Требуется тщательное наблюдение пациентов и раннее распознавание осложнений, возникающих на фоне терапии иФНО-α. Четких рекомендаций по профилактике не существует. Полагают, что одновременное применение иммуносупрессивных препаратов может снижать частоту образования аутоантител и тем самым — частоту развития ЛИКВ [80]. Важно помнить, что применение иФНО-α может являться причиной возникновения ЛИКВ. Таким образом, следует с наибольшей вероятностью верифицировать диагноз ревматоидного артрита до начала биологической терапии. И при планировании терапии иФНО-α необходим детальный иммунологический скрининг, тщательный мониторинг состояния пациента в процессе лечения для выявления кожных, суставных и висцеральных нарушений.
Выводы
В статье обобщены текущие знания о ЛИКВ с акцентом на последние события в этой области. Нами выполнен систематический обзор новых случаев ЛИКВ, о которых сообщалось в течение последних 2 лет, чтобы проанализировать наблюдаемый сдвиг в отношении препаратов, ассоциированных с ЛИКВ, с течением времени, хотя малочисленность публикаций является очевидным ограничением. В проведенном анализе выявлены препараты, недавно описанные как триггеры ЛИКВ, и редкие случаи ЛИКВ у детей. Случаи ЛИКВ, ассоциированные с ИПП и препаратами анти-ФНО-терапии, в настоящее время в современной ревматологической практике отмечаются чаще, чем с менее применяемыми препаратами, такими как прокаинамид и гидралазин. Вероятно, в будущем появится большее количество описания клинических случаев ЛИКВ в связи с увеличением применения и расширением целей иммунотерапии у онкологических пациентов, включая ингибиторы контрольных точек иммунного ответа. В табл. 5 суммированы ключевые моменты клиники и диагностики ЛИКВ.
Общие сведения
|
Клинические симптомы
|
Лабораторная диагностика
|
Список использованной литературы
- 1. Головач И.Ю. (2018) Люпус-нефрит: современная парадигма лечения. Почки, 7(2): 122–131.
- 2. Ablin J., Verbovetski I., Trahtemberg U. et al. (2005) Quinidine and procainamide inhibit murine macrophage uptake of apoptotic and necrotic cells: a novel contributing mechanism of drug-induced-lupus. Apoptosis, 10:1009–1018.
- 3. Adrichem M.E., Starink MV, van Leeuwen E.M. et al. (2017) Drug-induced cutaneous lupus erythematosus after immunoglobulin treatment in chronic inflammatory demyelinating polyneuropathy: a case series. J. Peripher. Nerv. Syst., 22: 213–218.
- 4. Aguirre Zamorano M.A., Lopez Pedrera R., Cuadrado Lozano M.J. (2010) Drug-induced lupus. Med. Clin. (Barc.),135: 124–129.
- 5. Almoallim H., Almasari A., Khadawardi H. (2011) Lupus Myositis with Normal Creatinine Kinase Levels Following Adalimumab Use in a Rheumatoid Arthritis Patient. Turk. J. Rheumatol., 26(4): 328–332.
- 6. Almoallim H., Al-Ghamdi Y., Almaghrabi H., Alyasi O. (2012) Anti-tumor necrosis factor-α induced systemic lupus erythematosus. Open. Rheumatol. J., 6: 315–319.
- 7. Araujo-Fernandez S., Ahijon-Lana M., Isenberg D.A. (2014) Drug-induced lupus: including antitumour necrosis factor and interferon induced. Lupus, 23: 545–553.
- 8. Ben Zvi M., Vaknine H., Menczer J. et al. (2016) Gemcitabine-induced subacute cutaneous lupus erythematosus: a case report. Chemotherapy, 61: 236–239.
- 9. Borchers A.T., Keen C.L., Gershwin M.E. (2007) Drug-induced lupus. Ann. N. Y. Acad. Sci, 1108: 166–182.
- 10. Borg F.A., Isenberg D.A. (2007) Syndromes and complications of interferon therapy. Curr. Opin. Rheumatol., 19(1): 61–66.
- 11. Bracke A., Nijsten T., Vandermaesen J. et al. (2005) Lansoprazole-induced subacute cutaneous lupus erythematosus: two cases. Acta Derm. Venereol., 85: 353–354.
- 12. Brinkmann V., Reichard U., Goosmann C. et al. (2004) Neutrophil extracellular traps kill bacteria. Science, 303:1532–1535.
- 13. Bukhari M. (2012) Drug-induced rheumatic diseases: a review of published case reports from the last two years. Curr. Opin. Rheumatol., 24: 182–186.
- 14. Buzina N., Eterovic M. (2016) Life-threatening lupus-like syndrome associated with clozapine. J. Clin. Psychopharmacol., 36: 532–534.
- 15. Caramaschi P., Biasi D., Colombatti M. et al. (2006) Anti-TNF alpha therapy in rheumatoid arthritis and autoimmunity. Rheumatol. Int., 26: 209–214.
- 16. Cassis T.B., Callen J.P. (2005) Bupropion-induced subacute cutaneous lupus erythematosus. Australas J. Dermatol.,46(4): 266–269.
- 17. Chang C., Gershwin M.E. (2010) Drugs and autoimmunity: a contemporary review and mechanistic approach. J. Autoimmun., 34: J266–J275.
- 18. Chang C., Gershwin M.E. (2011) Drug-induced lupus erythematosus: incidence, management and prevention. Drug. Saf., 34: 357–374.
- 19. Chen M., Crowson A.N., Woofter M. et al. (2004) Docetaxel (taxotere) induced subacute cutaneous lupus erythematosus: report of 4 cases. J. Rheumatol., 31: 818–820.
- 20. Choi H.K., Merkel P.A., Walker A.M., Niles J.L. (2000) Drug-associated antineutrophil cytoplasmic antibody-positive vasculitis. Arthritis Rheum., 43(2): 405–413.
- 21. Cornacchia E., Golbus J., Maybaum J. et al. (1988) Hydralazine and procainamide inhibit T cell DNA methylation and induce autoreactivity. J. Immunol., 140: 2197–2200.
- 22. Costa M.F., Said N.R., Zimmermann B. (2008) Drug-induced lupus due to antitumor necrosis factor alpha agents. Semin. Arthritis Rheum., 37: 381–387.
- 23. De Bandt M. (2006) Lessons for lupus from tumour necrosis factor blockade. Lupus, 15(11): 762–767.
- 24. Deng C., Lu Q., Zhang Z. et al. (2003) Hydralazine may induce autoimmunity by inhibiting extracellular signal-regulated kinase pathway signaling. Arthritis Rheum., 48: 746–756.
- 25. Evans D.A., Bullen M.F., Houston J. et al. (1972) Antinuclear factor in rapid and slow acetylator patients treated with isoniazid. J. Med. Genet., 9: 53–56.
- 26. Fenniche S., Dhaoui A., Ammar F.B. et al. (2005) Acebutolol-induced subacute cutaneous lupus erythematosus. Skin. Pharmacol. Physiol.,18(5): 230–233.
- 27. Fisher J., Patel M., Miller M., Burris K. (2016) Anastrozole-induced subacute cutaneous lupus erythematosus. Cutis., 98: E22–E26.
- 28. Grayson P.C., Kaplan M.J. (2016) At the bench: neutrophil extracellular traps (NETs) highlight novel aspects of innate immune system involvement in autoimmune diseases. J. Leukoc. Biol., 99: 253–264.
- 29. Gronhagen C.M., Fored C.M., Linder M. et al. (2012) Subacute cutaneous lupus erythematosus and its association with drugs: a population-based matched case-control study of 234 patients in Sweden. Br. J. Dermatol., 167: 296–305.
- 30. Guhl G., Diaz-Ley B., Garcıa-Garcıa C. et al. (2009) Chemotherapy-induced subacute lupus erythematosus. Lupus, 18: 859–860.
- 31. Hoffman B.J. (1945) Sensitivity to sulfadiazine resembling acute disseminated lupus erythematosus. Arch. Dermatol. Syphilol., 51: 190–192.
- 32. Holman S.K., Parris D., Meyers S., Ramirez J. (2017) Acute low-dose hydralazineinduced lupus pneumonitis. Case Rep. Pulmonol., 2650142.
- 33. Irizarry-Caro J.A., Carmona-Rivera C., Schwartz D.M. et al. (2018) Brief report: drugs implicated in systemic autoimmunity modulate neutrophil extracellular trap formation. Arthritis Rheumatol., 70: 468–474.
- 34. Iyer P., Dirweesh A., Zijoo R. (2017) Hydralazine induced lupus syndrome presenting with recurrent pericardial effusion and a negative antinuclear antibody. Case Rep. Rheumatol., 5245904.
- 35. Jiang X., Khursigara G., Rubin R.L. (1994) Transformation of lupus-inducing drugs to cytotoxic products by activated neutrophils. Science, 266: 810–813.
- 36. Jose A., Cramer A.K., Davar K., Gutierrez G. (2017) A case of drug-induced lupus erythematosus secondary to trimethoprim/sulfamethoxazole presenting with pleural effusions and pericardial tamponade. Lupus, 26: 316–319.
- 37. Kelly A.S., De la Harpe Golden P., D’Arcy C., Lally A. (2018) Drug-induced lupus erythematosus secondary to pirfenidone. Br. J. Dermatol., 178(6): 1437–1438.
- 38. Kim W.I., Kim J.M., Kim G.W. (2016) Subacute cutaneous lupus erythematosus induced by capecitabine: 5-FU was innocent. J. Eur. Acad. Dermatol. Venereol., 30: e163–e164.
- 39. Lowe G.C., Henderson C.L., Grau R.H. et al. (2011) A systematic review of druginduced subacute cutaneous lupus erythematosus. Br. J. Dermatol., 164: 465–472.
- 40. Laurinaviciene R., Sandholdt L.H., Bygum A. (2017) Drug-induced cutaneous lupus erythematosus: 88 new cases. Eur. J. Dermatol., 27: 28–33.
- 41. Lomicova I., Suchy D., Pizinger K., Cetkovska P. (2017) A case of lupus-like syndrome in a patient receiving adalimumab and a brief review of the literature on drug-induced lupus erythematosus. J. Clin. Pharm. Ther., 42: 363–366.
- 42. Lorentz K., Booken N., Goerdt S., Goebeler M. (2008) Subacute cutaneous lupus erythematosus induced by terbinafine: case report and review of literature. J. Dtsch. Dermatol. Ges., 6: 823–828.
- 43. Magno Pereira V., Andrade C., Figueira R. et al. (2017) Infliximab-induced lupus: a case report. GE Port J. Gastroenterol., 24: 84–88.
- 44. Mantis J., Bhavsar R., Abrudescu A. (2017) Drug-induced lupus erythematosus associated with antiretroviral therapy in a patient with human immunodeficiency virus: a case report. Cureus, 9: e1661.
- 45. Marzano A.V., Ramoni S., Del Papa N. et al. (2008) Leflunomide-induced subacute cutaneous lupus erythematosus with erythema multiforme-like lesions. Lupus, 17: 329–331.
- 46. Marzano A.V., Vezzoli P., Crosti C. (2009) Drug-induced lupus: an update on its dermatologic aspects. Lupus, 18: 935–940.
- 47. Mayor-Ibarguren A., Roldan-Puchalt M.C., Gomez-Fernandez C. et al. (2016) Subacute cutaneous lupus erythematosus induced by mitotane. JAMA Dermatol., 152: 109–111.
- 48. Mazari L., Ouarzane M., Zouali M. (2007) Subversion of B lymphocyte tolerance by hydralazine, a potential mechanism for drug-induced lupus. Proc. Natl. Acad. Sci, 104: 6317–6322.
- 49. Merlin F., Prochilo T., Kildani B. et al. (2008) Discoid lupus erythematosus (DLE)-like lesions induced by capecitabine. Int. J. Colorectal. Dis., 23: 715–716.
- 50. Michaelis T.C., Sontheimer R.D., Lowe G.C. (2017) An update in drug-induced subacute cutaneous lupus erythematosus. Dermatol Online J., 23(3).
- 51. Molina-Ruiz A.M., Lasanta B., Barcia A. et al. (2017) Drug-induced systemic lupus erythematosus in a child after 3 years of treatment with carbamazepine. Australas J. Dermatol., 58: e20–e22.
- 52. Nassberger L., Sjoholm A.G., Jonsson H. et al. (1990) Autoantibodies against neutrophil cytoplasm components in systemic lupus erythematosus and in hydralazine-induced lupus. Clin. Exp. Immunol., 81: 380–383.
- 53. Papagoras C., Voulgari P.V., Drosos A.A. (2010) Strategies after the failure of the first antitumor necrosis factor alpha agent in rheuma toid arthritis. Autoimmun. Rev., 9(8): 574–582.
- 54. Pinard J., Patel M., Granter S.R. et al. (2018) Subacute cutaneous lupus erythematosus induced by palbociclib. J. Cutan. Med. Surg., 22(3): 341–343.
- 55. Pretel M., Marques L., Espana A. (2014) Drug-induced lupus erythematosus. Actas Dermosifiliogr., 105: 18–30.
- 56. Quaresma M.V., Bernardes Filho F., Oliveira F.B. et al. (2015) Anti-TNF-alpha and hydralazine drug-induced lupus. An. Bras. Dermatol., 90(3 Suppl. 1): 125–129.
- 57. Ramachandran S.M., Leventhal J.S., Franco L.G. et al. (2017) Topical drug-induced subacute cutaneous lupus erythematosus isolated to the hands. Lupus Sci Med., 4: e000207.
- 58. Ramos-Casal M., Brito-Zeron P., Munoz S. et al. (2007) Autoimmune diseases induced by TNF-targeted therapies. Analysis of 233 cases. Medicine (Baltimore), 86(4): 242–251.
- 59. Ramos-Casals M., Brito-Zerón P., Soto M.J. et al. (2008) Autoimmune diseases induced by TNF-targeted therapies. Best Pract. Res. Clin. Rheumatol., 22(5): 847–861.
- 60. Reed B.R., Huff J.C., Jones S.K. et al. (1985) Subacute cutaneous lupus erythematosus associated with hydrochlorothiazide therapy. Ann. Intern. Med., 103: 49–51.
- 61. Reyes H.A., Cativo E.H., Sy A.M. (2016) Drug-induced subacute cutaneous lupus erythematosus in a patient receiving therapy for chronic hepatitis C. Am. J. Ther., 23: e1965–e1967.
- 62. Rubin R.L., Kretz-Rommel A. (1999) Initiation of autoimmunity by a reactive metabolite of a lupus-inducing drug in the thymus. Environ Health Perspect, 107(Suppl. 5): 803–806.
- 63. Rubin R.L. (2015) Drug-induced lupus. Expert Opin Drug Saf., 14(3): 361–378.
- 64. Sandholdt L.H., Laurinaviciene R., Bygum A. (2014) Proton pump inhibitor-induced subacute cutaneous lupus erythematosus. Br. J. Dermatol., 170: 342–351.
- 65. Sarzi-Puttini P., Atzeni F., Capsoni F. et al. (2005) Drug-induced lupus erythematosus. Autoimmunity., 38(7): 507–518.
- 66. Sachs G., Shin J.M., Howden C.W. (2006) Review article: the clinical pharmacology of proton pump inhibitors. Aliment. Pharmacol. Ther., 23(Suppl. 2): 2–8.
- 67. Sawalha A.H. (2018) Editorial: the innate and adaptive immune response are both involved in drug-induced autoimmunity. Arthritis Rheumatol., 70: 330–333.
- 68. Sim E., Dodds A.W., Goldin A. (1989) Inhibition of the covalent binding reaction of complement component C4 by penicillamine, an antirheumatic agent. Biochem. J., 259: 415–419.
- 69. Singh H., Sukhija G., Tanwar V. et al. (2016) Rare occurrence of drug induced subacute cutaneous lupus erythematosus with leflunomide therapy. J. Clin. Diagn. Res., 10: OD06–OD07.
- 70. Shovman O., Tamar S., Amital H. et al. (2018) Diverse patterns of anti-TNF-alphainduced lupus: case series and review of the literature. Clin. Rheumatol., 37: 563–568.
- 71. Sontheimer R.D., Henderson C.L., Grau R.H. (2009) Drug-induced subacute cutaneous lupus erythematosus: a paradigm for bedside-to-bench patient-oriented translational clinical investigation. Arch. Dermatol. Res., 301: 65–70.
- 72. Speirs C., Fielder A.H., Chapel H. et al. (1989) Complement system protein c4 and susceptibility to hydralazine-induced systemic lupus erythematosus. Lancet, 333: 922–924.
- 73. Starobin D., Guller V., Gurevich A., Tal S. (2017) Minocycline induced lupus with yellow colored chylous exudative pleural effusion. Respir. Med. Case Rep., 22: 113–116.
- 74. Vasoo S. (2006) Drug-induced lupus: an update. Lupus, 15: 757–761.
- 75. Vedove C.D., Del Giglio M., Schena D., Girolomoni G. (2009) Drug-induced lupus erythematosus. Arch. Dermatol. Res., 301(1): 99–105.
- 76. Uetrecht J. (2005) Drug-induced lupus erythematosus. In: Kuhn A., Lehmann P., Ruzicka T. (eds) Cutaneous lupus erythematosus., Springer, Berlin, р. 117–132.
- 77. Weger W., Kranke B., Gerger A. et al. (2008) Occurrence of subacute cutaneous lupus erythematosus after treatment with fluorouracil and capecitabine. J. Am. Acad. Dermatol., 59(2 Suppl. 1): S4–S6.
- 78. Williams V.L., Cohen P.R. (2011) TNF alpha antagonist-induced lupus-like syndrome: report and review of the literature with implications for treatment with alternative TNFalpha antagonists. Int. J. Dermatol.,50(5): 619–625.
- 79. Woosley R.L., Drayer D.E., Reidenberg M.M. et al. (1978) Effect of acetylator phenotype on the rate at which procainamide induces antinuclear antibodies and the lupus syndrome. N. Engl. J. Med., 298: 1157–1159.
- 80. Xiao X., Chang C. (2014) Diagnosis and classification of drug-induced autoimmunity (DIA). J. Autoimmun., 48–49: 66–72.
- 81. Yanes D.A., Mosser-Goldfarb J.L. (2017) A cutaneous lupus erythematosus-like eruption induced by hydroxyurea. Pediatr. Dermatol., 34: e30–e31.
- 82. Yokogawa N., Vivino F.B. (2009) Hydralazine-induced autoimmune disease: comparison to idiopathic lupus and ANCA-positive vasculitis. Mod. Rheumatol., 19: 338–347.
- 83. Yung R.L., Richardson B.C. (2011) Chapter 22: drug-induced lupus mechanisms A2. In: Robert L.G. (ed.) Systemic lupus erythematosus (fifth edition). Academic Press, San Diego, CA, p. 385–403.
- 84. Yung R., Powers D., Johnson K. et al. (1996) Mechanisms of drug-induced lupus. II. T cells overexpressing lymphocyte function-associated antigen 1 become autoreactive and cause a lupuslike disease in syngeneic mice. J. Clin. Invest., 97: 2866–2871.
- 85. Zeitjian V., Mehdizadeh A. (2017) ANA-negative hydralazine-induced pericardial effusion. Case Rep. Med., 1–3: 3521541.
Адрес для переписки:
Головач Ирина Юрьевна
03142, Киев, ул. Заболотного, 21
Клиническая больница «Феофания» ГУД
Центр ревматологии
Е-mail: golovachirina@gmail.com

Leave a comment