КАРДІОВАСКУЛЯРНА ПАТОЛОГІЯ У ХВОРИХ НА АНКІЛОЗИВНИЙ СПОНДИЛІТ: ОГЛЯД ЛІТЕРАТУРИ І ВЛАСНІ СПОСТЕРЕЖЕННЯ
- 1ДЗ «Дніпропетровська медична академія» МОЗ України
- 2Клінічна лікарня «Феофанія» Державного управління справами, Київ
Резюме. Анкілозивний спондиліт (AС) належить до групи спондилоартритів, у патологічний процес в основному залучаються хребет і крижово-клубові суглоби з можливим розвитком також і периферичних артритів. Позасуглобові ураження при АС представлені офтальмологічними, серцево-судинними, легеневими або неврологічними проявами. Ураження серцево-судинної системи спостерігається у 2–10% пацієнтів, суттєво впливаючи на смертність і перебіг захворювання в цілому. У представленій роботі проаналізовані властиві АС кардіальні ускладнення, такі як аортит, періаортит, аортальна регургітація, атріовентрикулярна блокада, потовщення стулок аортального та мітрального клапанів, перикардит і дисфункція лівого шлуночка. Найчастішими клінічними проявами ураження серцево-судинної системи є порушення провідності й аортальна недостатність. Ураження серцево-судинної системи найчастіше відзначають у пацієнтів із тривалим анамнезом АС, HLA-B27-асоційованим перебігом, залученням до патологічного процесу периферичних суглобів. Субклінічні зміни серцево-судинної системи при AС слід диференціювати і спостерігати для визначення їх прогностичного значення та клінічного перебігу. Електрокардіографія і оцінка показників ехокардіографії повинні бути частиною рутинного менеджменту пацієнтів з АС.
ВВЕДЕНИЕ
Анкилозирующий спондилит (AС) является хроническим, системным воспалительным заболеванием группы спондилоартритов (СпА), в патологический процесс при котором в основном вовлекаются крестцово-подвздошные суставы, позвоночник, с возможным развитием периферических артритов и типичных для данного заболевания внесуставных проявлений [20]. Болезнь чаще поражает мужчин молодого возраста. Человеческий лейкоцитарный антиген (HLA)-B27, представленный у большинства пациентов, обусловливает особые патофизиологические механизмы развития и прогрессирования заболевания [44]. Внесуставные проявления представлены вовлечением глаз, легких, нервной и сердечно-сосудистой (СС)-систем [21]. Поражение СС-системы при АС отмечают у 2–10% пациентов [45], такая незначительная доля, вероятно, обусловлена длительным и бессимптомным течением кардиоваскулярных нарушений при АС и несвоевременной диагностикой.
Клинически дифференцируют пять разновидностей вовлечения СС-системы при АС по анатомическому признаку [14, 22, 45, 66]:
1. Поражение аорты и ее структур — аортит, периаортит, расслоение аорты с возможной необходимостью кардиохирургических вмешательств.
2. Нарушения проводимости с вовлечением атриовентрикулярного (АВ)-узла и ножек пучка Гиса с вероятными последующими показаниями для установления кардиостимулятора.
3. Вовлечение миокарда с возможным развитием дисфункции левого желудочка (ЛЖ).
4. Пороки клапанов — аортальная недостаточность, митральная недостаточность и стеноз с возможным последующим протезированием клапанов.
5. Перикардит с угрозой тампонады сердца.
Наиболее частые клинические СС-проявления — нарушения проводимости и аортальная недостаточность [22]. Поражение СС-системы наиболее часто отмечают у пациентов с длительным анамнезом АС и вовлечением в патологический процесс периферических суставов [41].
В изучении кардиоваскулярной патологии при АС четко прослеживаются два основных направления. Первое появилось в начале 50-х годов XX в. — это исследование поражений сердца и сосудов в рамках системности АС (аортит, клапанная патология, нарушение проводимости); второе направление начало развиваться относительно недавно и связано с изучением атеросклероза и риска возникновения ишемической болезни сердца (ИБС) у пациентов с АС. Развитие последнего направления связано с накоплением сведений о повышении общей и СС-смертности у пациентов с воспалительными заболеваниями суставов в целом [65] и при АС в частности [51] по сравнению с общим популяционным уровнем. Повышенная смертность при AС обусловлена воздействием как прямых факторов, так и косвенных, таких как рак и СС-смертность [52], причем СС-заболевания являются ведущей причиной смерти у пациентов с AС. В исследовании случай-контроль в Швеции смертность среди пациентов с AС составила 14,5% [8], значительно превалировала среди мужчин по сравнению с женщинами, ведущей причиной смерти были СС-заболевания (40,0%), злокачественные новообразования (26,8%) и инфекционные болезни (23,2%).
В настоящей работе проведен анализ литературы по вопросам патологии сердца и сосудов у больных АС.
ФАКТОРЫ СЕРДЕЧНО-СОСУДИСТОГО РИСКА У БОЛЬНЫХ АНКИЛОЗИРУЮЩИМ СПОНДИЛИТОМ
Последние исследования достоверно свидетельствуют, что кардиоваскулярная летальность пациентов с АС превышает уровень смертности в популяции на 20–40% [40]. Причины этих результатов обусловлены, во-первых, наличием у таких пациентов классических факторов СС-риска: системное воспаление, генетическая предрасположенность, неблагоприятное воздействие лекарственных средств, а, во-вторых, непосредственным поражением СС-системы аутоиммунного генеза. У пациентов с АС выявлено увеличение толщины комплекса интима-медиа, снижение уровня холестерина (ХС) липопротеидов высокой плотности (ЛПВП) и триглицеридов (ТГ), выявлена тенденция к повышению индекса атерогенности и развитию метаболического синдрома [41, 50]. Как известно, снижение уровня ХС ЛПВП коррелирует с активностью воспаления [18]: повышение скорости оседания эритроцитов (СОЭ) >30 мм/ч сочетается со снижением содержания ТГ на 3,8% и ХС ЛПВП — на 5,7%, что сопровождается снижением концентрации аполипопротеина А1, который обладает противовоспалительным действием [31]. Повышение острофазовых показателей (уровень С-реактивного белка (СРБ), СОЭ) ассоциируется не только с дислипидемией, но и с неблагоприятным кардиоваскулярным прогнозом в целом [15].
C. Han и соавторы [28] также установили повышение СС-риска у пациентов с АС по сравнению с популяцией. Аналогичные результаты получены и в исследовании M.J. Peters и коллег [49]: инфаркт миокарда у больных АС диагностирован в 4,4% случаев, в то время как в сопоставимой по возрасту и полу общей популяции данное заболевание выявлено только в 1,2% случаев. По данным выполненного в Швеции популяционного исследования [58], у больных АС (n=935) показано более частое, чем в популяции, развитие ИБС, гипертензии, сахарного диабета, АВ-блокады [58]. Кроме того, отметим повышенный риск возникновения СС-событий на фоне постоянного применения нестероидных противовоспалительных средств; существует ряд исследований, доказывающих это утверждение [23].
Резерв коронарного кровотока (РКК) используется для оценки функции коронарных артерий с точки зрения микрососудистой циркуляции. Некоторые эксперты подчеркнули прогностическую значимость этого измерения у пациентов с атеросклерозом. В своем исследовании, результаты которого опубликованы в 2008 г., M. Caliskan и соавторы [17] использовали трансторакальную допплеровскую эхокардиографию (эхоКГ) для оценки РКК у пациентов с AС и определили, что значения РКК были достоверно снижены. Кроме того, уровни СРБ и фактора некроза опухоли (ФНО)-α коррелировали с показателями РКК у этих пациентов. В другом исследовании, проведенном в 2010 г., изучали частоту инфаркта миокарда у пациентов с АС: отмечено повышение частоты инфарктов в популяции AС в 2–3 раза [51]. Важно, что не было различий в примененной антиревматической терапии у пациентов с АС с историей инфаркта миокарда или без него. H. Divecha и соавторы [19] продемонстрировали, что в результате влияния повышенного уровня провоспалительных маркеров (СРБ и интерлейкина-6) на метаболизм липидов и активность инсулина у пациентов с АС развивались инсулинорезистентность и дислипидемия, стимулирующие атерогенез. Сообщалось также, что длительное повышение уровня воспалительные маркеров, несмотря на отсутствие клиники, ускоряет риск развития ИБС [19].
Следует отметить, что пациенты с АС имеют также повышенный риск возникновения инсульта. Проведенное популяционное, ориентированное на возраст и пол исследование в Китае, продемонстрировало увеличение количества случаев ишемического инсульта для группы пациентов с АС [36].
Из всего вышесказанного можно сделать вывод, что у пациентов с аутоиммунными заболеваниями, в том числе при АС, воспаление может рассматриваться как основной пусковой фактор атерогенеза, поскольку воспалительный процесс играет ведущую роль в формировании нестабильности атеросклеротической бляшки, изменении соотношения тромбогенных и фибринолитических факторов, развитии повреждения и дисфункции эндотелия и других механизмов, способствующих атеротромбозу [24, 49].
ВОВЛЕЧЕНИЕ АОРТЫ И СВЯЗАННЫХ С НЕЙ СТРУКТУР
Поражение аорты — одно из частых внесуставных проявлений АС, характеризующееся наличием воспалительных изменений адвентиции (аортит), дегенеративными/атеросклеротическими изменениями комплекса интима–медиа, которые приводят к фиброзу, расширению восходящего отдела и дуги аорты, сужению и облитерации vasa vasorum и периваскулярной инфильтрации [1, 26]. Окклюзия vasa vasorum является характерной особенностью воспалительного процесса, связанного с HLA-B27 [54]. Аортит при АС имеет отличительные характеристики, они касаются, прежде всего, преимущественной локализации воспалительного процесса: обычно это небольшая по протяженности часть аорты, охватывающая корень и восходящий отдел. Иногда в области корня аорты, между основанием аортального клапана и передней митральной створкой (так называемая зона аортомитрального соединения) воспалительно-фиброзная ткань образует локальное утолщение в виде гребня — subaortic bump, что может быть выявлено при эхоКГ. Аортит в большинстве случаев сопровождается вальвулитом аортального клапана, который приводит к фиброзу, утолщению и нисходящей ретракции створок. Развивающаяся аортальная регургитация обусловлена как дилатацией аорты, так и клапанной недостаточностью [1].
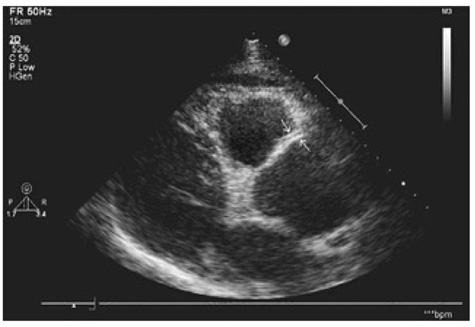
Расширение корня аорты является наиболее частой причиной формирования относительной аортальной недостаточности у больных АС [38]. Вовлекаются не только восходящий отдел аорты, но также и субаортальные структуры, такие как мембранозная часть межжелудочковой перегородки, что приводит к нарушениям проводимости; основание передней митральной створки, что обусловливает развитие митральной недостаточности. Наиболее часто поражаемые при этом заболевании структуры — восходящий отдел аорты, корень аорты, створки аортального и митрального клапанов, а также зона перехода задней стенки основания аорты в переднюю митральную створку. В этом месте формируется гребневидное утолщение эндокарда, представленное поствоспалительной фиброзной тканью (рис. 1). Данный феномен, известный под названием «субаортальный гребень», или «subaortic bump», впервые был описан B.H. Bulkey и W.C. Roberts в 1973 г. и считается специфичным для АС и других СпА [16].
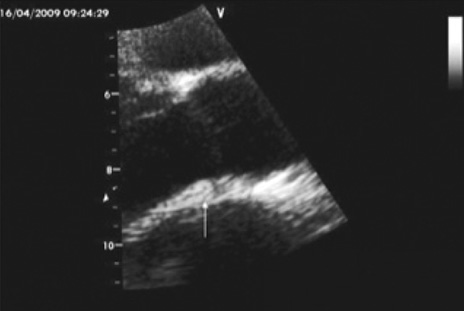
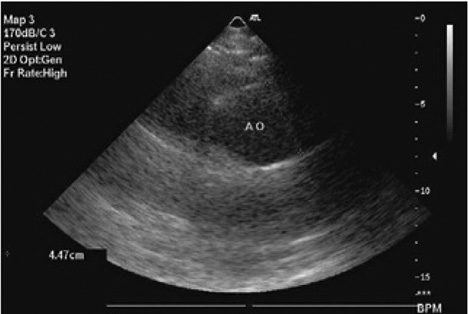
На эхоКГ при АС можно выявить изменения корня и восходящего отдела аорты в виде утолщения и/или дилатации (рис. 2), утолщение створок аортального клапана (рис. 3).
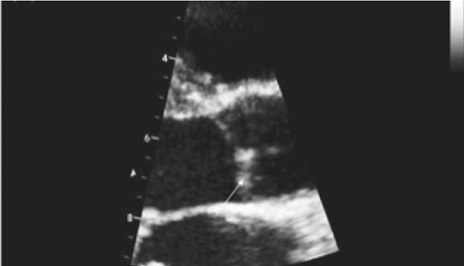
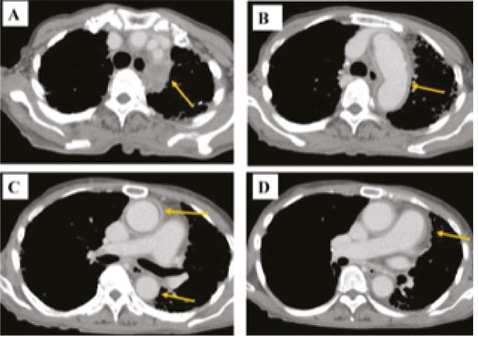
Данные изменения можно выявить и при проведении компьютерной томографии (КТ). На рис. 4 представлены результаты КТ пациента в возрасте 31 года с АС.
Гистологические исследования, проводившиеся в ходе оперативных вмешательств, продемонстрировали признаки острого и хронического воспаления в области как основания аорты, так и митрального клапана: отек, инфильтрация лимфоцитами и плазматическими клетками, пролиферация фибробластов; очаговое разрушение мышечных и эластичных структур, утолщение интимы и адвентиции, облитерация сосудов, изменения, сходные с сифилитическим аортитом [34]. Не выявлено вегетаций, абсцессов, аневризм и микроорганизмов. Характерным признаком аортита при АС считается отсутствие аортального стеноза.
При АС и других СпА аортит в большинстве случаев протекает малосимптомно и диагностируется случайно или ретроспективно у больных с выявленными на эхоКГ изменениями в виде дилатации аорты и аортальной регургитации [1].
В настоящее время появляется все больше данных о том, что развитие периаортита также весьма характерно для АС [46]. Если первоначальные сведения о наличии данной патологии были единичными и в основном опирались на данные секционного материала, то с внедрением в практику магнитно-резонансной томографии, спиральной КТ и позитронно-эмиссионной томографии выявление периаортита у пациентов с АС не является редкостью. Периаортитом называют воспалительное аневризматическое расширение аорты и перианевризматический ретроперитонеальный фиброз [62]. На рис. 5 представлено циркулярное однородное утолщение стенки аорты до 5 мм и плотный перианевризмальный фиброз у пациента в возрасте 35 лет с АС, обратившегося по поводу острой боли в животе [37].
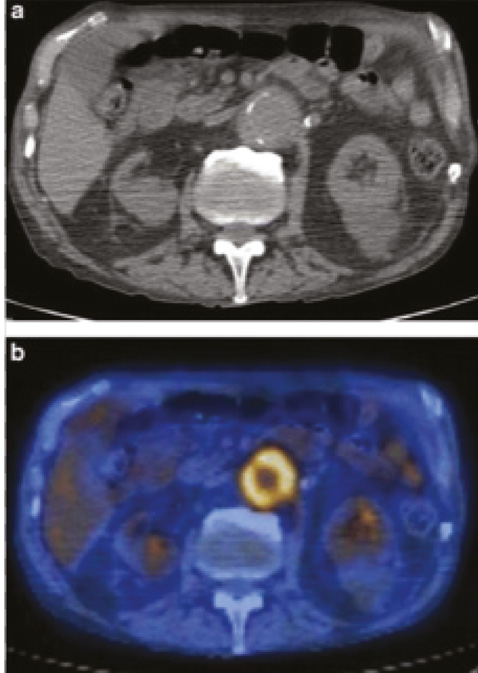
Ретроперитонеальный фиброз характеризуется формированием соединительной ткани вокруг аорты и подвздошных артерий. В наиболее тяжелых случаях формирующаяся грануляционная ткань может приводить к сдавлению мочеточников, артериальных, венозных или лимфатических стволов, провоцируя боль в животе, спине, олигурию, венозную и артериальную недостаточность нижних конечностей, лимфостаз. Парадоксальное усиление боли после физических упражнений у пациентов с АС также требует исключения ретроперитонеального фиброза. Гистологически при периаортите выявляются воспалительные изменения и фиброз [48]. Васкулит сосудов забрюшинного пространства также не является редкостью при гистологическом исследовании [48]. Предполагается, что основой патогенеза ретроперитонеального фиброза является атипичная иммунная реакция, направленная на жировую ткань у лиц, предрасположенных к аутоиммунным болезням. А. Afeltra и соавторы [5] проанализировали 18 случаев ретроперитонеального фиброза у лиц со СпА (из них у 12 диагностирован АС): HLA-B27 выявлен лишь у 50% пациентов, в то время как при АС без ретроперитонеaльного фиброза HLA-B27 отмечают в 80–90% случаев. Таким образом, периаортит явно ассоциируется с наличием АС, в то время как связь с носительством HLA-B27 не столь очевидна.
Распространенность поражений аортального клапана при АС составляет 4% на ранней стадии заболевания (определяемой как продолжительность заболевания <15 лет) и 10% — на более поздних стадиях заболевания (определяемая как продолжительность заболевания >30 лет) [33]. Поражение клапанного аппарата сердца чаще всего проявляется аортальной недостаточностью, которая может быть как относительной, связанной с аортитом и расширением корня аорты, так и связанной с фиброзными изменениями створок самого клапана [55]. Несколько реже отмечают митральную недостаточность. Сочетанные пороки сердца при АС являются редкостью. Макроскопическое исследование при аортальной недостаточности у пациентов с АС чаще всего выявляет расширение клапанного кольца и утолщение створок клапанов. Фиброз створок может быть как равномерным (от основания до края), так и располагаться в виде отдельных узлов. Гистологическое исследование пораженных клапанов выявляет воспалительные и дегенеративные изменения: пролиферацию клеток интимы, локальные инфильтраты, в основном представленные мононуклеарными клетками в области комплекса интима–медиа и фиброзным утолщением адвентиции, возможна неоваскуляризация створок клапанов [43]. В более подробных исследованиях выявлено, что клеточный воспалительный процесс, приводящий к эндартерииту вокруг корня и клапанов аорты, поддерживаемый агрегацией тромбоцитов, приводит к утолщению ткани, а также к недостаточности аортального клапана, стимулируя гиперактивность фибробластов [55].
В большинстве случаев формирование аортального порока происходит в течение многих лет, и шум аортальной регургитации может выслушиваться задолго до появления признаков недостаточности кровообращения, хотя описаны единичные случаи быстрого формирования аортальной недостаточности [46]. Наиболее чувствительным методом верификации клапанной патологии сердца является чреспищеводная эхоКГ. C.A. Roldan и соавторы [55], используя данный метод, показали наличие изменений корня аорты и створок митрального и аортального клапанов у 82% пациентов с АС, а наличие аортальной регургитации — в 50% случаев. Установлено, что частота изменений корня аорты и клапанного аппарата сердца при АС повышается со временем и ассоциируется с другими видами кардиоваскулярной патологии [47]. Также в данном исследовании выявлены утолщения и повышение жесткости корня аорты, дилатация крупных сосудов. В своем исследовании с последующим наблюдением в течение > 39 мес установлено у 24% пациентов развитие со временем новых аномалий корня или клапанов аорты, тогда как возникшая ранее недостаточность клапанов прогрессировала со значительным ухудшением симптомов [56]. У 20% исследуемых пациентов проводили протезирование клапана в связи с развитием признаков выраженной сердечной недостаточности.
В недавно опубликованном шведском регистровом исследовании [9] проведена оценка частоты аортальной регургитации у пациентов с различными субтипами СпА: с АС (n=6 448), с псориатическим артритом (ПсА) (n=16 063) и недифференцированным СпА (нСпА) (n=5 190). Установлена более высокая частота регургитационных событий при всех формах СпА: 0,7 случаев на 1000 пациенто-лет в сравнении с популяционным уровнем — 0,4 на 100 пациенто-лет.
L. Bergfeldt и соавторы изучили группу из 91 пациента с изолированной аортальной регургитацией с помощью HLA-типирования, клинического и рентгенологического исследования [10]. HLA-B27 выявлен у 88% пациентов мужского пола с сочетанием аортальной регургитации и тяжелых форм нарушений проводимости. Сделано предположение, что эта комбинация представляет собой новый связанный с HLA-B27 кардиальный синдром. По данным L. Bergfeldt и соавторов, аортит и АВ-блокада также ассоциированы с носительством HLA-В27-антигена в 67–88% случаев, а среди 26 пациентов с искусственным водителем ритма оказалось 22 (85%) позитивных по HLA-В27 пациента [11].
Хотя недостаточность аортального клапана занимает ведущие позиции поражения клапанного аппарата у пациентов с АС, также у этих пациентов можно диагностировать митральную недостаточность, но в значительно меньшей доле случаев [39]. Есть сведения и об ассоциации митрального стеноза с АС [26]. Митральная недостаточность и стеноз — достаточно редкое поражение сердца при АС, но могут привести к развитию сердечной недостаточности [59]. Механизм развития пороков митрального клапанов заключается в распространении фиброза субаортальных тканей до створок митрального клапана. Таким образом, фиброз непосредственно потенцирует развитие митральной недостаточности и снижает подвижность клапана. Стеноз же вызван гипертрофией ЛЖ вследствие тяжелой аортальной недостаточности [44]. Полученные данные указывают на необходимость активного инструментального поиска клапанных патологий у пациентов с АС.
Еще одним грозным осложнением патологии аорты при АС является расслоение аорты, частота которой составляет 2,9 на 100 тысяч [42]. Это наиболее тяжелое внесуставное проявление АС [45]. Чаше всего пациенты жалуются на боль в груди; однако могут быть и атипичные проявления: отсутствие боли или наличие неврологической или ишемической симптоматики [27]. Расслоение аорты обычно отмечают в возрасте от 50 до 70 лет, у мужчин в два раза чаще, чем у женщин [27]. Основу для развития расслоения сосуда при АС составляет истончение интимы–медиа аорты. На рис. 6 представлена расслаивающаяся аневризма аорты у пациента 48 лет с АС и длительностью заболевания 21 год. Основным признаком диссекции аорты при эхоКГ является дополнительный контур стенки сосуда, который делит сосуд на две части.
Согласно данным проведенных нами исследований, при АС вовлекаются в патологический процесс и сосуды малого круга кровообращения; поражение легочных сосудов протекает с повышением легочного артериального давления и легочного сосудистого сопротивления, в генезе которых участвует СРБ, имеющий прогностическую значимость [4].
НАРУШЕНИЕ РИТМА И ПРОВОДИМОСТИ ПРИ АС
Нарушения ритма и проводимости как частые внесуставные проявления СпА могут дебютировать до появления первых суставных симптомов СпА, что несомненно требует правильной трактовки, клинической настороженности и раннего выявления. Наиболее доступный метод исследования — электрокардиограмма (ЭКГ). А. Yildirir и соавторы продемонстрировали, что расчет дисперсии Q–T на ЭКГ дает ценную информацию о возможном развитии аритмии [67]. Таким образом, пациенты с повышенным риском развития аритмии могут быть направлены для более детального обследования в оценке кардиальных признаков ревматического заболевания.
Наиболее часто наблюдаемым признаком поражения СС-системы у пациентов с АС является аномалия проводимости, которая обычно предшествует другим характерным для АС кардиальным проявлениям, таким как недостаточность клапанов [32]. Нарушения проводимости выявлено у 5–10% пациентов с АС. У части HLA-B27-позитивных пациентов суставные симптомы АС отсутствовали, однако установлено нарушение проводимости; 20% пациентов с постоянным кардиостимулятором оказались HLA-B27-позитивными. Выявлено, что нарушение АВ-проводимости в виде АВ-блокады I степени имело значительно более высокую распространенность у пациентов с АС, чем в обычной популяции, а нарушения проводимости связаны с активностью и продолжительностью заболевания. Среди пациентов, перенесших оперативное вмешательство по поводу АВ-блокад, больные АС отмечены в 15 раз чаще, чем в общей популяции [32]. По данным еще одного исследования, АВ-блокада ІІ–ІІІ степени отмечалась с частотой 0,9 случая на 1000 пациенто-лет при АС, 1,2 случая — на 1000 пациенто-лет при ПсА и 0,7 случая —на 1000 пациенто-лет при нСпА; одновременно частота данных нарушений проводимости в общей популяции была более низкой — 0,4 случая на 1000 пациенто-лет [9]. Частота развития АВ-блокад высоких градаций при АС была в 2,3 раза выше, чем в общей популяции, что требовало более частых кардиохирургических вмешательств — установления кардиостимулятора. Потребность в установлении пейсмейкера у пациентов с АС достоверно выше, чем в общей популяции — в 2,1 раза.
Существуют две теории этиологии нарушений проводимости у пациентов с АС: воспаление, приводящее к повреждению межжелудочковой перегородки, и дисфункции АВ-узла в результате нарушения проведения импульса от синоатриального узла. Эти процессы обусловливают возникновение суправентрикулярной экстрасистолической аритмии и формирование АВ-блокад [67]. Е. Toussirot и соавторы предположили, что также нарушения вегетативной нервной системы могут приводить к дефектам проводимости и аритмиям и, следовательно, неблагоприятно влиять на прогноз заболевания [60]. Кроме того, в данном исследовании у пациентов с АС уровни СОЭ, СРБ, тяжесть заболевания прямо коррелировали с тяжестью поражения вегетативной нервной системой [60]. Такие же данные о корреляции воспалительной активности патологического процесса и тяжести вовлечения нервной системы получены и в проведенном нами исследовании [3].
Иногда дилатация аорты и сдавление ею межжелудочковой перегородки приводит к АВ II–III степени и фасцикулярным блокадам [55]. Имеются данные о развитии синоатриальной блокады у пациентов с АС [12].
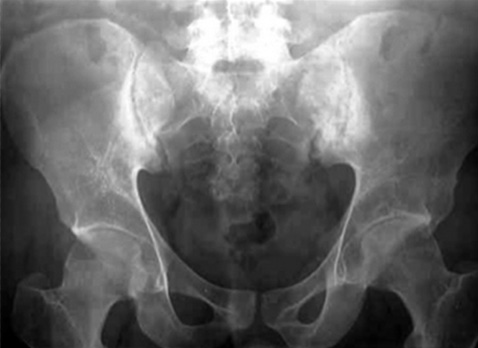
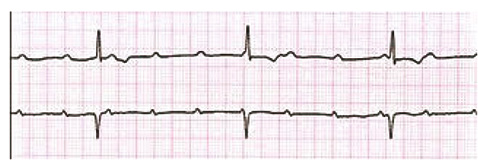
Представлен клинический случай нарушения проводимости у пациента с АС в дебюте заболевания. 22-летний мужчина предъявлял жалобы на боль в пояснице, выраженность которой уменьшалась после физической нагрузки и усиливалась после отдыха в течение последних 1,5 года. На рентгенограмме крестцово-подвздошных сочленений выявлен двусторонний сакроилеит III стадии (рис. 7), HLA-B27 положительный. Патологии со стороны кожи, глаз, кишечника и мочеполовой системы не выявлено. Согласно модифицированным критериям Нью-Йоркской классификации для AС, пациенту установлен диагноз «анкилозирующий спондилит». Индексы активности BASDAI и BASMI составляли 4,8 и 2 соответственно. Применение нестероидных противовоспалительных препаратов в течение 2 мес не дало положительного ответа. Было инициировано лечение этанерцептом, через 6 мес выраженность боли в пояснице значительно уменьшилась. Однако пациент отметил синкопальный эпизод 2 мес назад; проведена электрокардиография, на которой выявлена полная АВ-блокада (рис. 8). В дальнейшем пациенту была проведена имплантация кардиостимулятора DDD-R.
Риск возникновения кардиальных осложнений повышается с возрастом пациента, продолжительностью AС, наличием HLA-B27 и наличием поражения периферических суставов [61]. СС-проявления обычно возникают при длительном течении АС, однако могут появляться и в более ранние сроки, как продемонстрировано в нашем клиническом наблюдении.
Еще одним частым нарушением ритма при СпА является фибрилляция предсердий (ФП). Она встречается с частотой 7,1 случай на 1000 пациенто-лет при АС по сравнению с контролем — 5,5 случаев на 1000 пациенто-лет [9]. Возможно, с более высокой частотой ФП связан также более высокий риск развития инсульта у пациентов с АС, а также с ПсА [36, 53]. Сегодня получены данные многочисленных исследований о том, что псориаз и ПсА ассоциированы с ФП и ишемическим инсультом независимо от возраста, пола, коморбидной патологии, сопутствующего лечения и социально-экономического статуса [6]. Воспаление и оксидативный стресс считаются ведущими патофизиологическими факторами такой взаимосвязи.
ДИСФУНКЦИЯ ЛЕВОГО ЖЕЛУДОЧКА
Сегодня известно, что АС ассоциирован не только с патологией аорты и нарушением проводимости, но и с такими кардиальными осложнениями, как диастолическая дисфункция ЛЖ, перикардит, сердечная недостаточность и кардиомегалия [35].
ЭхоКГ у пациентов с АС дает возможность выявить изменения не только эндокарда, перикарда, клапанного аппарата сердца, но и геометрии сердца, позволяя визуализировать наличие гипертрофии ЛЖ. Такие изменения необходимо учитывать при оценке статуса больного, поскольку увеличение массы миокарда ЛЖ ведет в дальнейшем к диастолической дисфункции и способствует неполноценной коронарной перфузии [14]. Не было полностью выяснено, являются ли изменения со стороны СС-системы в результате развития AС вторичными по отношению к первичному вовлечению кардиомиоцитов или вторичными по отношению к первичному вовлечению клапанов и аорты. Существуют дополнительные, негемодинамические, факторы развития гипертрофии миокарда ЛЖ у больных АС: персистирующее системное воспаление и эндотелиальная дисфункция [2, 57].
В некоторых исследованиях, в которых изучалась функция ЛЖ у пациентов с АС, сообщается не только о диастолической, но и систолической дисфункции [66]. D.A. Brewerton и соавторы при проведении клинического, эхоКГ- и гистопатологического исследований пациентов с АС выявили различную степень систолической дисфункции у 50% исследуемых с явными нарушениями сократительной функции [13]. Наиболее выраженной оказалась диастолическая дисфункция, прежде всего ЛЖ. Согласно гистопатологическим данным, авторы выявили преимущественно воспалительные изменения миокардиальной ткани. В своих исследованиях A. Yildirir и соавторы [68] специально изучали диастолическое наполнение ЛЖ у пациентов с АС, демонстрируя статистически значимое замедление скорости раннего (скорость E-волны) и позднего (скорость A-волны) диастолического наполнения. У этих пациентов соотношение скорости раннего и позднего диастолического наполнения было достоверно меньше, чем в группе контроля. Аналогичные данные получены и другими исследователями [25], которые оценивали диастолическую дисфункцию во время физической активности, используя радионуклидную ангиографию. Однако диастолическая дисфункция при АС обычно не является столь выраженной, чтобы вызвать диастолическую сердечную недостаточность.
ВЛИЯНИЕ МЕДИКАМЕНТОЗНЫХ АГЕНТОВ НА РАЗВИТИЕ СЕРДЕЧНО-СОСУДИСТЫХ ЗАБОЛЕВАНИЙ ПРИ АНКИЛОЗИРУЮЩЕМ СПОНДИЛИТЕ
Терапевтические агенты, такие как ингибиторы ФНО (иФНО), подавляя воспалительную активность, оказывают влияние на снижение частоты возникновения кардиоваскулярных событий при AС. На фоне приема иФНО отмечены изменения уровня липидов у пациентов с АС [29, 63]: повышение общего ХС (+4,6%), ХС липопротеидов низкой плотности (+4,3%) и ХС ЛПВП (+3,7%) после лечения иФНО в течение 52 нед [29], одновременно с существенным снижением уровня воспаления. Изменения уровней липидов продемонстрировано и в другой когорте пациентов с АС, получавших в течение 12 нед этанерцепт [63]. Во время терапии уровень СРБ значительно снизился на фоне повышения уровня ЛПВП и аполипопротеина А. Это привело к улучшению соотношения общего ХС/ХС ЛПВП (от 3,9 до 3,7) и аполипопротеина B/аполипопротеина A-I, которое со временем уменьшилось на 7,5%. В проспективном когортном исследовании субклинический атеросклероз сонной артерии у пациентов с AС после лечения иФНО стабилизировался или замедлил прогрессирование [64], что отражает снижение риска СС-осложнений у этих пациентов. После 1 года лечения иФНО наблюдалось улучшение скорости пульсовой волны аорты, уменьшение прогрессирования толщины интима–медиа [7]. Однако эти многообещающие результаты должны получить дальнейшее подтверждение в рандомизированных клинических исследованиях.
Подводя итоги, еще раз подчеркнем, что AС ассоциирован с поражением СС-системы и значительно влияет на СС-смертность и -заболеваемость. Именно поражение СС-системы является одним из частых и ярких внесуставных проявлений СпА. Наиболее характерными для АС являются такие кардиальные проявления:
- Аортит.
- Aortic bump (утолщение стенок аорты).
- Аортальная регургитация (реже — митральная регургитация).
- Миокардиальный фиброз.
- Нарушения проводимости — АВ-блокады I, II, III степени.
- Коронарная болезнь сердца.
- Дисфункция ЛЖ вследствие патологического ремоделирования миокарда и сердечная недостаточность.
Эти состояния длительное время могут носить бессимптомный характер и выявляться только при целенаправленном диагностическом поиске. У пациентов с АС установлено также повышение частоты традиционных факторов риска (дислипидемия, курение, метаболический синдром и др.), повышение острофазовых показателей (СОЭ, СРБ и др.), наличие системного воспалительного процесса. Необходимо также помнить о возможном развитии ургентных кардиологических ситуаций у пациентов с АС. При острой боли в груди у пациентов с АС, прежде всего, следует исключить расслоение аорты, и, при необходимости, выполнить неотложные мероприятия. Особое внимание также следует уделять синкопальным состояниям, что может быть проявлением нарушений проводимости.
Таким образом, кардиологическое обследование пациентов с AС должно быть проведено в рутинном порядке, особенно у лиц с продолжительным анамнезом заболевания, вовлечением периферических суставов и положительным HLA-B27. Тот факт, что вовлечение в патологический процесс СС-системы может возникнуть до появления клинических характерных признаков AС, должно насторожить ревматологов, терапевтов и кардиологов для исключения данного заболевания. Электрокардиография и оценка эхоКГ должны быть частью рутинного менеджмента пациентов с АС с целью оценки кардиоваскулярного риска и ранней диагностики поражений СС-системы.
Список использованной литературы
- 1. Годзенко А.А., Бочкова А.Г., Мухортова О.В. и др. (2013) Аортит при анкилозирующем спондилите: возможности диагностики и лечения. Науч.-практич. ревматол., 51(4): 451–455.
- 2. Поддубный Д.А., Ребров А.П. (2007) Гипертрофия и ремоделирование левого желудочка у больных анкилозирующим спондилитом: роль дисфункции эндотелия. Регионар. кровообр. микроцирк.,74(7): 73–78.
- 3. Синяченко О.В., Егудина Е.Д., Селезнева С.В. и др. (2016) Периферическая нейропатия при воспалительных заболеваниях суставов. Укр. ревматол. журн., 64(2): 34–39.
- 4. Синяченко О.В., Егудина Е. Д., Чернышова О.Е. и др. (2017) Ангиопатия при анкилозирующем спондилите. Боль. Суставы. Позвоночник, 7(1): 78–82.
- 5. Afeltra A., Gentilucci U.V., Rabitti C. et al. (2005) Retroperitoneal fibrosis and ankylosing spondylitis: which links? Semin. Arthr. Rheum., 35: 43–48.
- 6. Ahlehoff O., Gislason G.H., Jørgensen C.H. et al. (2012) Psoriasis and risk of atrial fibrillation and ischaemic stroke: a Danish Nationwide Cohort Study. Eur. Heart J., 33(16): 2054–2064.
- 7. Angel K., Provan S.A., Fagerhol M.K. et al. (2012) Effect of 1-year anti-TNF-alpha therapy on aortic stiffness, carotid atherosclerosis, and calprotectin in inflammatory arthropathies: a controlled study. Am. J. Hypertens., 25(6): 644–650.
- 8. Bakland G., Gran J.T., Nossent J.C. (2011) Increased mortality in ankylosing spondylitis is related to disease activity. Ann. Rheum. Dis., 70(11): 1921–1925.
- 9. Bengtsson K., Forblad-d’Elia H., Lie E. et al. (2018) Risk of cardiac rhythm disturbances and aortic regurgitation in different spondyloartghritis subtypes in comparison with general population: a register-based study from Sweden. Ann. Rheum. Dis., 77(4): 541–548.
- 10. Bergfeldt L., Insulander P., Lindblom D. et al. (1988) HLA-B27: An important genetic risk factor for lone aortic regurgitation and severe conduction system abnormalities. Am. J. Med., 85: 12–18.
- 11. Bergfeldt L. (1997) HLA-B27-associated cardiac disease. Ann. Intern. Med., 127: 621–629.
- 12. Bergfeldt L., Vallin H., Edhag O. (1984) Complete heart block in HLA-B27 associated disease. Electrophysiological and clinical characteristics. Br. Heart J., 51: 184–188.
- 13. Brewerton D.A., Gibson D.G., Goddard D.H. et al. (1987) The myocardium in ankylosing spondylitis. A clinical, echocardiographic, and histopathological study. Lancet., 1(8540): 995–998.
- 14. Brunner F., Kunz A., Weber U. et al. (2006) Ankylosing spondylitis and heart abnormalities: do cardiac conduction disorders, valve regurgitation and diastolic dysfunction occur more often in male patients with diagnosed ankylosing spondylitis for over 15 years than in the normal population? Clin. Rheumatol., 25: 24–29.
- 15. Buckley D.I., Fu R., Freeman M. et al. (2009) C-reactive protein as a risk factor for coronary heart disease: a systematic review and meta- analyses for the U.S. Preventive Services Task Force. Ann. Intern. Med., 151: 483–495.
- 16. Bulkley B.H., Roberts W.C. (1973) Ankylosing spondylitis and aortic regurgitation. Description of the characteristic cardiovascular lesion from study of eight necropsy patients. Circulation, 48: 1014–1027.
- 17. Caliskan M., Erdogan D., Gullu H. et al. (2008) Impaired coronary microvascular and left ventricular diastolic functions in patients with ankylosing spondylitis. Atherosclerosis, 196(1): 306–312.
- 18. Choy E., Sattar N. (2009) Interpreting lipid levels in the context of high-grade inflammatory states with a focus on rheumatoid arthritis: a challenge to conventional cardiovascular risk actions. Ann. Rheum. Dis., 68: 460–469.
- 19. Divecha H., Sattar N., Rumley A. et al. (2005) Cardiovascular risk parameters in men with ankylosing spondylitis in comparison with non-inflammatory control subjects: relevance of systemic inflammation. Clin. Sci (Lond.), 109(2): 171–176.
- 20. Dougados M., Baeten D. (2011) Spondyloarthritis. Lancet, 377(9783): 2127–2137.
- 21. El Maghraoui A. (2011) Extra-articular manifestations of ankylosing spondylitis: prevalence, characteristics and therapeutic implications. Eur. J. Intern. Med., 22: 554–560.
- 22. Eriksson J.K., Jacobsson L., Bengtsson K., Askling J. (2017) Is ankylosing spondylitis a risk factor for cardiovascular disease, and how do these risks compare with those in rheumatoid arthritis? Ann. Rheum. Dis., 76(2): 364–370.
- 23. Essers I., Stolwijk C., Boonen A. et al. (2016) Ankylosing spondylitis and risk of ischemic heart disease: a population-based cohort study. Ann. Rheum. Dis., 75(1): 203–209.
- 24. Gonzalez-Juanatey C., Vazquez-Rodriguez T.R., Miranda-Filloy J.A. et al. (2009) The high prevalence of subclinical atherosclerosis in patients with ankylosing spondylitis without clinically evident cardiovascular disease. Medicine (Baltimore), 88: 358–365.
- 25. Gould B.A., Turner J., Keeling D.H. et al. (1995) Myocardial dysfunction in ankylosing spondylitis. Ann. Rheum. Dis., 51(2): 227–232.
- 26. Gupta B.K., Panwar R.B., Kabra P.K. et al. (2003) Ankylosing spondylitis in association with mitral stenosis, mitral regurgitation, and aortic regurgitation: a case report and review of the literature. Echocardiography, 20(3): 275–277.
- 27. Hagan P.G., Nienaber C.A., Isselbacher E.M. et al. (2000) The International Registry of Acute Aortic Dissection (IRAD): new insights into an old disease. JAMA, 283(7): 897–903.
- 28. Han C., Robinson D.W.Jr., Hackett M.V. et al. (2006) Cardiovascular disease and risk factors in patients with rheumatoid arthritis, psoriatic arthritis, and ankylosing spondylitis. J. Rheumatol., 33(11): 2167–2172.
- 29. Heslinga S.C., Peters M., Ter Wee M. et al. (2015) Reduction of inflammation drives lipid changes in ankylosing spondylitis. J. Rheumatol., 42(10): 1842–1845.
- 30. Kaneko S., Yamashita H., Sugimori Y. et al. (2014) Ankylosing spondylitis -associated aortitis: a case report. SpringerPlus, 3: 509.
- 31. Kang E., Choi S., Lee S., Park Y. (2007) Atherogenic lipid profile in ankylosing spondylitis. Ann. Rheum. Dis., 66(II): 399.
- 32. Kazmierczak J., Peregud-Pogorzelska M., Biernawska J. et al. (2007) Cardiac arrhythmias and conduction disturbances in patients with ankylosing spondylitis. Angiology, 58(6): 751–756.
- 33. Klingberg E., Sveälv B.G., Täng M.S. et al. (2015) Aortic Regurgitation Is Common in Ankylosing Spondylitis: Time for Routine Echocardiography Evaluation? Am. J. Med., 128(11): 1244–1250.
- 34. Krarup N., Poulsen S., Baandrup U. (2007) Aorto-mitral inflammation in rheumatological disease: transoesophageal echocardiographic presentation. Eur. J. Echocardiography, 8(5): 346–351.
- 35. Lautermann D., Braun J. (2002) Ankylosing spondylitis cardiac manifestations. Clin. Exp. Rheumatol., 20(28): 11–15.
- 36. Lin C.W., Huang Y.P., Chiu Y.H. et al. (2014) Increased risk of ischemic stroke in young patients with ankylosing spondylitis: a population-based longitudinal follow-up study. PLoS One, 9(4): e94027.
- 37. Litmanovic D.E., Yildirim A., Bankier A.A. et al. (2012) Insights into imaging of aortitis. Insights Imaging, 3(6): 545–560.
- 38. Looi J.L., Pui K., Hart H. et al. (2011) Valvulitis and aortitis associated with ankylosing spondylitis: early detection and monitoring response to therapy using cardiac magnetic resonance imaging. Int. J. Rheum. Dis., 14(4): e56–e58.
- 39. Luckie M., Irion L., Khattar R.S. (2009) Severe mitral and aortic regurgitation in association with ankylosing spondylitis. Echocardiography, 26(6): 705–710.
- 40. Mathieu S., Pereira B., Soubrier M. (2015) Cardiovascular events in ankylosing spondylitis: an updated meta-analysis. Semin Arthritis Rheum., 44(5): 551–555.
- 41. Mathieu S., Gossec L., Dougados M. et al. (2011) Cardiovascular profile in ankylosing spondylitis: A systematic review and meta-analysis. Arthr. Care Res., 63(4): 557–563.
- 42. Meszaros I., Morocz J., Szlavi J. et al. (2000) Epidemiology and clinicopathology of aortic dissection. Chest, 117(5): 1271–1278.
- 43. Momeni M., Taylor N., Tehrani M. (2011) Cardiopulmonary Manifestations of Ankylosing Spondylitis. Int. J. Rheum., Art. ID 728471 (doi:10.1155/2011/728471).
- 44. Moyssakis I., Gialafos E., Vassiliou V.A. et al. (2009) Myocardial performance and aortic elasticity are impaired in patients with ankylosing spondylitis. Scand. J. Rheumatol., 38(3): 216–221.
- 45. Ozkan Y. (2016) Cardiac Involvement in Ankylosing Spondylitis. Clin. Med. Res., 8(6): 427–430.
- 46. Palazzia C., Salvaranib C., D’Angeloa S. et al. (2011) Aortitis and periaortitis in ankylosing spondylitis. Joint Bone Spine, 78(5): 451–455.
- 47. Park S.H., Sohn I.S., Joe B.H. et al. (2012) Early cardiac valvular changes in ankylosing spondylitis: a transesophageal echocardiography study. J. Cardiovasc. Ultrasound., 20: 30–36.
- 48. Parums D.V. (1990) The spectrum of chronic periaortitis. Histopathology, 16: 423–431.
- 49. Peters M.J., Symmons D.P., McCarey D. et al. (2010a) EULAR evidence based recommendations for cardiovascular risk management in patients with rheumatoid arthritis and other forms of inflammatory arthritis. Ann. Rheum. Dis., 69: 325–331.
- 50. Peters M.J., van der Horst-Bruinsma I.E., Dijkmans B.A., Nurmohamed M.T. (2004) Cardiovascular risk profile of patients with spondylarthropathies, particularly ankylosing spondylitis and psoriatic arthritis. Semin Arthr. Rheum., 34(3): 585–592.
- 51. Peters M.J., Visman I., Nielen M.M. et al. (2010b) Ankylosing spondylitis: a risk factor for myocardial infarction? Ann. Rheum. Dis., 69(3): 579–581.
- 52. Prati C., Claudepierre P., Pham T., Wendling D. (2011) Mortality in spondylarthritis. Joint Bone Spine, 78(5): 466–470.
- 53. Rhee T.M., Lee J.H., Choi E.K. et al. (2017) Increased Risk of Atrial Fibrillation and Thromboembolism in Patients with Severe Psoriasis: a Nationwide Population-based Study. Sci Rep., 7(1): 9973.
- 54. Roifman I., Beck P.L., Anderson T.J. et al. (2011) Chronic inflammatory diseases and cardiovascular risk: a systematic review. Can. J. Cardiol., 27: 174–182.
- 55. Roldan C.A., Chavez J., Wiest P.W. et al. (1998) Aortic root disease and valve disease associated with ankylosing spondylitis. J. Am. Coll. Cardiol., 32: 1397–1404.
- 56. Roldan C.A. (2008) Valvular and coronary heart disease in systemic inflammatory diseases: Systemic Disorders in heart disease. Heart, 94: 1089–1101.
- 57. Syniachenko O.V., Yehudina Ye.D., Chernyshova O.Ye. et al. (2018) Nature of endothelial dysfunction in ankylosing spondylitis. Unity Scien., 4: 109–112.
- 58. Szabo S.M., Levy A.R., Rao S.R. et al. (2011) Increased risk of cardiovascular and cerebrovascular diseases in individuals with ankylosing spondylitis: A population-based study. Arthr. Rheum., 63(11): 3294–3304.
- 59. Taarit Ben Ch., Kaffel D., Ben Maiz H., Khedher A. (2008) Cardiovascular manifestations in ankylosing spondylitis. Concerning 210 cases. Tunis Med., 86(6): 546–549.
- 60. Toussirot E., Bahjaoui-Bouhaddi M., Poncet J.C. et al. (1999) Abnormal autonomic cardiovascular control in ankylosing spondylitis. Ann. Rheum. Dis., 58(8): 481–487.
- 61. Ulusoy V., Ateş A., Çiçekcioğlu H. et al. (2006) Third- degree heart block developing in a female patient with HLA-B27 positive ankylosing spondylitis. Rheumatol Int., 26(8): 779–780.
- 62. Vaglio A., Palmisano A., Corradi D. et al. (2007) Retroperitoneal fibrosis: evolving concepts. Rheum. Dis. Clin. North Am., 33: 803–817.
- 63. van Eijk I.C., de Vries M.K., Levels J.H. et al. (2009) Improvement of lipid profile is accompanied by atheroprotective alterations in high-density lipoprotein composition upon tumor necrosis factor blockade: a prospective cohort study in ankylosing spondylitis. Arthr. Rheum., 60(5): 1324–1330.
- 64. van Sijl A.M., van Eijk I.C., Peters M.J. et al. (2015) Tumor necrosis factor blocking agents and progression of subclinical atherosclerosis in patients with ankylosing spondylitis. Ann. Rheum. Dis., 74(1): 119–123.
- 65. Verma I., Krishan P., Syngle A. (2015) Predictors of Atherosclerosis in Ankylosing Spondylitis. Rheumatol. Ther., 2(2): 173–182.
- 66. Yang D.H. (2012) Ankylosing Spondylitis and Cardiac Abnormalities. J. Cardiovasc. Ultrasound, 20(1): 23–24.
- 67. Yildirir A., Aksoyek S., Calguneri M. et al. (2000) QT dispersion as a predictor of arrhythmic events in patients with ankylosing spondylitis. Rheumatology, 39(8): 875–879.
- 68. Yildirir A., Aksoyek S., Calguneri M. et al. (2002) Echocardiographic evidence of cardiac involvement in ankylosing spondylitis. Clin. Rheumatol., 21(2): 129–134.
Адрес для переписки:
Егудина Елизавета Давидовна
ДЗ «Днепропетровская медицинская академия»
МОЗ Украины,
кафедра внутренней медицины № 3
E-mail: elizavetaegudina@gmail.com

Leave a comment