РЕВМАТОЛОГІЧНИЙ ПАРАНЕОПЛАСТИЧНИЙ СИНДРОМ ПРИ РАКУ ЛЕГЕНі
Синяченко О.В.1, Думанский Ю.В.1, Столярова О.Ю.2, Степко Ф.А.1
Резюме. Мета дослідження — вивчити поширеність ревматологічного паранеопластичного синдрому (ПНПС) і характер його окремих проявів при різних варіантах перебігу раку легені (РЛ). Під наглядом перебував 1071 хворий на РЛ віком від 24 до 86 років (в середньому — 59 років), з них 83% чоловіків та 17% жінок. Дрібноклітинний гістологічний варіант захворювання виявлений у 18% випадків, а недрібноклітинний — у 82%, співвідношення IA–ІВ, ІІА–ІІВ, ІІІА, ІІІВ і IV стадій захворювання становило 1:2:23:35:36. Ураження верхніх часток легень виявлено у 27% випадків, нижніх — у 15%, верхньонижньої локалізації ліворуч — у 19%, середньоверхньої — у 25%, середньонижньої — у 1%, середньої частки — у 4%, медіастинальний варіант хвороби відзначено у 9% спостережень. У 79% обстежених відзначено центральну форму РЛ, у 21% — периферичну. У 18% хворих на РЛ діагностують 20 варіантів ревматологічного ПНПС (1–8 на хворого), частіше визначається у жінок і має гендерні особливості поширеності (поліміозит, лейкоцитокластичний васкуліт, панікуліт або вузлова еритема), залежить від локалізації пухлинного процесу (середньочасткова, медіастинальна), стадії, ступеня тяжкості перебігу і гістологічного варіанта неоплазми (ревматоїдоподібний артрит, остеоартропатія, долонний фасцит, контрактури Дюпюїтрена, тендовагініт, дерматоміозит/поліміозит, васкуліт, панікуліт), характеру метастазування в лімфатичні вузли, віддалені органи й скелет, які впливають на додаткові паранеопластичні ознаки (ураження периферичної нервової системи, розвиток офтальмопатії та гінекомастії). Чинники ризику ПНПС при РЛ — наявність ексудативного плевриту, стиснення верхньої порожнистої вени, проростання пухлини у грудну стінку і середостіння. Результати корисні для розробки медичної технології ранньої діагностики РЛ, оперативного, променевого та медикаментозного лікування захворювання та контролю ефективності заходів, що проводяться, а також патогенетичної терапії при ПНПС.
АКТУАЛЬНОСТЬ ПРОБЛЕМЫ
В структуре онкологической заболеваемости лидирующие позиции занимает рак легкого (РЛ) (Ceniceros L. et al., 2015; Grаdalska-Lampart M. et al., 2015), от которого ежегодная смертность в разных регионах планеты возрастает на 5–15% (Qu H.M. et al., 2015). Риск развития РЛ повышается при многих ревматических заболеваниях (Picano E. et al., 2014; Radner H., 2016; Wang H.L. et al., 2017), которые не только ухудшают качество жизни, но и снижают выживаемость пациентов с легочной злокачественной неоплазмой (Katzen J.B. et al., 2015; Park J.K. et al., 2016). Факт взаимоотношений ревматологической и онкологической патологии определяется имеющейся выраженной однотипной дисрегуляцией системы иммунитета при обеих группах болезней (Azrielant S. et al., 2017). В последние годы связь РЛ и ревматических болезней рассматривается с новых позиций — в контексте формирования при таком новообразовании ревматологических признаков, включаемых в паранеопластический синдром (ПНПС), который непосредственно не связан с первичной опухолью и ее метастазами, а обусловлен сложными вторичными воспалительно-дегенеративными либо системными, либо локальными дистантными изменениями, зачастую протекающими в виде проявлений «перекреста» (overlap) ревматического и опухолевого заболеваний (Hébant B. et al., 2016; Ramírez-Bellver J.L. et al., 2017). ПНПС чаще возникает при мелкоклеточном РЛ и аденокарциноме легкого, проявляется костно-суставными, периартикулярными и мышечными симптомами (Leandro M.J., Isenberg D.A., 2010; Aggarwal R., Oddis C.V., 2011; Lange U. et al., 2014). Изучение ПНПС при РЛ является актуальной задачей современной ревматологии и онкологии (Durieux V. et al., 2017), а его распространенность и клинико-лабораторные признаки полностью не определены (Pileckyte M. et al., 2008; Hakkou J. et al., 2012). Цель исследования — изучить распространенность ПНПС и характер его отдельных проявлений при разных вариантах течения РЛ.
ОБЪЕКТ И МЕТОДЫ ИССЛЕДОВАНИЯ
Под наблюдением находился 1071 больной РЛ в возрасте от 24 до 86 лет (в среднем — 59,2±0,31 года), среди которых 82,8% мужчины и 17,2% женщины. Поражение верхних долей легких установлено в 27,0% случаев, нижних — в 15,3%, верхненижней локализации слева — в 18,7%, средневерхней — в 25,0%, средненижней — в 1,4%, средней доли — в 3,7%. Медиастинальный вариант болезни отмечали у 8,9% числа больных, а у 1,2% мужчин диагностирована верхушечная опухоль Панкоста — Тобиаса. У 78,7% обследованных отмечена центральная форма РЛ, у 21,3% — периферическая, мелкоклеточный гистологический вариант заболевания выявлен в 17,6% случаев, а немелкоклеточный — в 82,5% (аденокарцинома, плоскоклеточная и крупноклеточная карцинома в соотношении 3:3:1). Соотношение IA–ІВ, ІІА–ІІВ, ІІІА, ІІІВ и IV стадий заболевания составило 1:2:23:35:36. Средний показатель дифференциации РЛ (GDT) составил 1,19±0,038 балла, интегральной стадийности (STT) — 5,87±0,032 о.е., индекса тяжести опухолевого процесса (WTI) — 2,85±0,024 о.е., которую оценивали по формуле:
WTI = ln [T + N+ (SM)],
где ln — десятичный логарифм, Т — международный показатель характера первичной опухоли, N — международный показатель метастатического поражения региональных лимфатических узлов, SМ — сумма отдаленных органов и костей в метастазах. Для диагностики РЛ и его метастазов применяли методы обычной рентгенографии, компьютерной, магнитно-резонансной и позитронно-эмиссионной томографии, сонографии (аппараты «Multix-Compact-Siеmens», Германия, «Somazom-Emotion-6-Siemens», Германия, «Gygoscan-Intera-Philips», Нидерланды, «RDS-Eclipse-RD-Siemens», Германия, «Biograph-64-TruePoint-Siemens», Германия, «Envisor-Philips», Нидерланды), эзофагогастроскопии (фиброскоп «Olympus-GIF-Q20», Япония). Статистическая обработка полученных результатов исследований проведена с помощью компьютерного вариационного, непараметрического, корреляционного, одно- (ANOVA) и многофакторного (ANOVA/MANOVA) дисперсионного анализа (программы «Microsoft Excel» и «Statistica-Stat-Soft», США). Оценивали средние значения, их стандартные ошибки и отклонения, параметрические коэффициенты корреляции Пирсона и непараметрической Кендалла (t), дисперсии Брауна — Форсайта (BF) и Уилкоксона — Рао (WR), различий Стьюдента и Макнемара — Фишера (χ), а также критерий достоверности статистических показателей (p).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
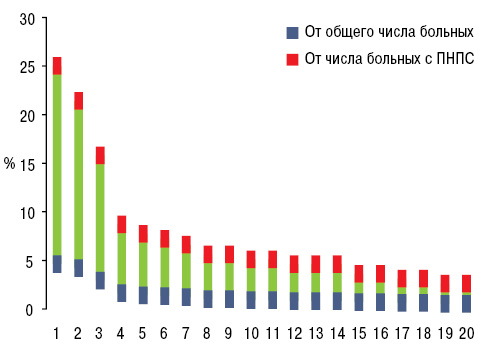
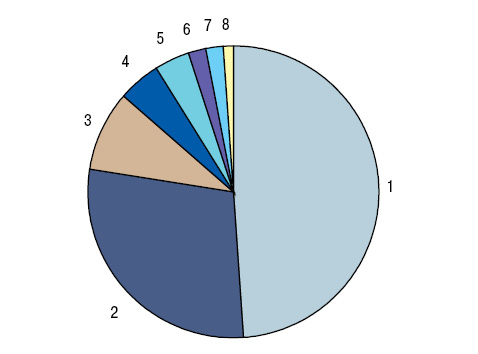
ПНПС установлен у 18,3% больных РЛ в соотношении мужчин и женщин 3:1. От общего количества обследованных ПНПС отмечен у 16,2% мужчин и 28,3% женщин (p<0,001). В разработку вошли только те пациенты, у которых первые манифестные признаки ПНПС были либо до одного года до начала проявлений опухолевого процесса, либо уже появились на фоне неоплазмы. У 4,6% общего числа наблюдений РЛ и у 25,0% больных с ПНПС диагностирована (рис. 1) остеоартропатия Мари — Бамбергера, соответственно у 4,2/21,4% — подагрический артрит, у 2,9/15,8% отмечены признаки ревматоидоподобного артрита, у 1,6/8,7% — панникулита или узловатой эритемы, у 1,4/7,7% — лейкоцитокластического васкулита, у 1,3/7,2% — синдрома Рейно или дигитального некротического васкулита, у 1,2/6,6% — дерматомиозита, соответственно по 1,0/5,6% — псевдоволчаночного и склеродермоподобного синдромов, по 0,9/5,1% — пальмарного фасцита и тендовагинита, по 0,8/4,6% — полимиозита, криоглобулинемического васкулита и энтезопатии, по 0,7/3,6% — контрактур Дюпюитрена и сухого синдрома Шегрена, по 0,6/3,1% — альгодистрофии и остеохондропатии Осгуда — Шлаттера, по 0,5/2,6% — системного васкулита, ассоциированного с антинейтрофильными цитоплазматическими антителами, соответствующих по критериям гранулематозу с полиангиитом и узелковому полиартерииту. Только один признак констатирован в ½ наблюдений ревматического ПНПС, два — в 28,6%, три — в 8,7%, четыре — в 5,1%, пять — в 3,6%, шесть и семь — соответственно в 1,5%, восемь — в 1,0% (в среднем 2,1±0,11 на больного), что нашло свое отражение на рис. 2.
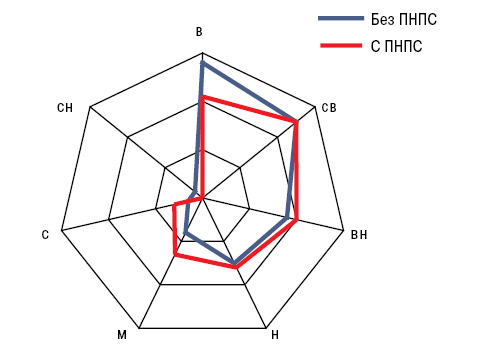
Установлено влияние пола на разнообразие ПНПС, что продемонстрировал дисперсионный анализ Брауна — Форсайта, при этом в среднем на одного мужчину приходилось 1,7±0,09 признаков, а на одну женщину — 2,8±0,29 (p<0,001). Отметим, что лейкоцитокластический васкулит и панникулит выявлены только у мужчин (соответственно в 10,4 и 11,8% случаев). Кроме того, гендерные особенности ПНПС касались развития исключительно у мужчин гранулематоза с полиангиитом и криоглобулинемического васкулита, тогда как полимиозит диагностирован у женщин в 3,4 раза чаще. Возникновение ПНПС тесно дисперсионно связано с локализацией опухолевого процесса, его STT и WTI, к тому же с последними двумя параметрами существуют высокодостоверные корреляционные связи Пирсона «распространенности пейзажа ПНПС». Необходимо отметить (рис. 3), что при наличии ПНПС на 85% достоверно чаще констатировали локализацию неоплазмы в средней доле и на 62% медиастинальный вариант РЛ.
Отмечено отсутствие при мелкоклеточном варианте РЛ таких признаков ПНПС, как остеоартропатия, остеохондропатия, альгодистрофия, псевдоволчаночный, склеродермоподобный и сухой синдромы, а также всех вариантов васкулитов, но при этом в случаях немелкоклеточного опухолевого процесса отсутствовали наблюдения ладонного фасцита. Цитологический диморфизм злокачественного новообразования в легких проявлялся различиями частоты ревматоидоподобного артрита, остеоартропатии, фасцита, контрактуры Дюпюитрена, тендовагинита, панникулита и узловатой эритемы, дерматомиозита, полимиозита и васкулитов, что представлено на рис. 4.
ОБСУЖДЕНИЕ
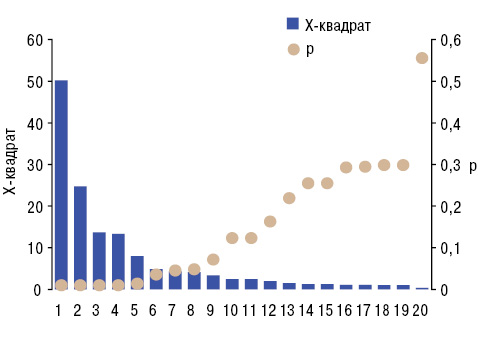
На основании анализов Брауна — Форсайта, Кендалла и Макнемара — Фишера (таблица) сделано следующее заключение, имеющее практическую направленность: факторами риска возникновения ПНПС являются экссудативный плеврит, сдавление верхней полой вены, прорастание опухоли в грудную стенку и средостение. Заметим, что также имеет место дисперсионная зависимость ПНПС от прорастания опухоли в пищевод и прямая корреляционная связь со сдавлением опухолью возвратного нерва. Локализация первичной неоплазмы легкого оказывает достоверное воздействие на формирование фасцита и васкулитов, GDT — на фасцит, псевдоволчаночный синдром и васкулит, STT — на ревматоидоподобный артрит, контрактуры Дюпюитрена, склеродермоподобный синдром, дерматомиозит и панникулит, WTI — на артрит, остеоартропатию и панникулит. С аденокарциномой легкого связаны фасцит, криоглобулинемический васкулит, волчаночноподобный и псевдосклеродермический синдромы, с плоскоклеточным РЛ — остеоартропатия, тендовагинит, дерматомиозит и панникулит. От степени метастазирования РЛ в лимфатические узлы зависит развитие остеоартропатии и остеохондропатии, в отдаленные органы — тендовагинита, полимиозита, панникулита и ревматоидоподобного артрита, в скелет — альгодистрофии, энтезопатии, криоглобулинемического васкулита, ревматоидоподобного и подагрического артритов. Подчеркнем, что при подагре метастазы в костях и суставах отмечали вдвое реже, чем у остальных пациентов.
| Осложнения РЛ | Доля случаев, % | Влияние на ПНПС | Корреляции с ПНПС | Отличия частоты | |||
|---|---|---|---|---|---|---|---|
| BF | p BF | t | р t | χ | p χ | ||
| 1 2 3 4 5 6 7 8 9 10 11 | 10 47 34 07 02 22,3 0,8 2,5 1,4 2,9 2,0 | 2,19 1,22 0,96 0,40 3,31 3,91 0,37 0,70 6,12 0,95 6,74 | 0,026 0,281 0,463 0,920 0,001< 0,001 0,936 0,695 <0,001 0,472 <0,001 | +0,078 -0,012 -0,037 -0,007 +0,020 +0,087 +0,012 +0,014 +0,127 +0,045 +0,146 | <0,001 0,582 0,078 0,746 0,348 <0,001 0,560 0,496 <0,001 0,032 <0,001 | 5,40 0,05 5,58 0,05 3,06 11,31 0,24 0,28 17,69 2,46 21,61 | 0,020 0,825 0,018 0,822 0,080 0,001 0,623 0,594 <0,001 0,117 <0,001 |
Среди наблюдаемых нами больных с ревматоидоподобным артритом реже, чем при идиопатическом ревматоидном артрите, отмечали полиартрит (77,4% наблюдений), симметричность поражения суставов (8,7%) и серопозитивность заболевания по ревматоидному фактору (6,5%), тогда как серопозитивность по антителам к циклическому цитруллиновому пептиду отмечена в 61,3% случаев. Индекс Ричи составил 8,6±1,12 балла, десятичный логарифм индекса Лансбури — 4,3±0,11 балла. Необходимо отметить, что, согласно данным литературы, у 4% пациентов с суставным ПНПС отмечают изолированный гонит, а среди этих пациентов в 2% случаев — немелкоклеточный РЛ (Cantini F. et al., 2012). Нами констатирован моногонит в 22,6% наблюдений ревматоидоподобного артрита, причем в процессе сонографии отмечено большое количество жировых тел Гоффа в полости суставов. При этом у всех больных был мелкоклеточный (!) РЛ. Особенностями подагрического артрита как ПНПС было отсутствие превалирования мужчин и гендерных особенностей течения суставного синдрома, высокая распространенность артикулярного поражения рук (85,7% случаев), не столь выраженная интенсивность, но бо`льшая продолжительность первого и последующих суставных кризов. Только у 11,9% пациентов со вторичной подагрой при РЛ выявлены периферические или костные тофусы. Отметим, что у больных подагрой повышен риск развития РЛ и наоборот, чем доказывается связь нарушений пуринового обмена и канцерогенеза (Wang W. et al., 2015). По результатам эпидемиологических исследований, выполненных C.F. Kuo и соавторами (2012), подагра была диагностирована у 3,7% взрослых людей, а злокачественные новообразования — у 6,7% из них. Как считают P. Boffetta и соавторы (2012), гиперурикемия является фактором риска канцерогенеза, а у 8,8% больных с развернутой картиной подагры эти авторы выявили злокачественные новообразования, что достоверно чаще, чем в популяции. По результатам выполненного многофакторного анализа Уилкоксона — Рао, на интегральные признаки ПНПС у больных РЛ влияет характер осложнений первичного опухолевого процесса, метастазов в отдаленных органах и костно-суставной системе, но не распространенность и степень метастатического поражения лимфатических узлов. Нами проанализирована связь отдельных проявлений ПНПС с наличием осложнений опухолевого процесса, отобраны те достоверные дисперсионно-корреляционные связи, которые одновременно соответствовали бы параметрам Брауна — Форсайта и Кендалла. Оказалось, что развитие тендовагинита и энтезопатии зависит от наличия у больных РЛ экссудативного плеврита и прорастания опухоли в средостение, панникулита, контрактур Дюпюитрена и ладонного фасцита — от прорастания злокачественного новообразования в пищевод и грудную стенку. Лейкоцитокластический васкулит, дерматомиозит, волчаночно- и склеродермоподобный синдромы были связаны с экссудативным плевритом, сдавлением опухолью верхней полой вены, компрессионным синдромом и обтурационным ателектазом. В этой связи представим некоторые комментарии. Паранеопластические ладонные фасциты и фиброзит могут быть проявлением не только первичного РЛ, а и метастазов в легких других злокачественных новообразований (Krishna K. et al., 2011; McGivern U., McAleese J., 2012; Tajima S. et al., 2015; Sheehy C. et al., 2017). В случаях мелкоклеточного РЛ пальмарный фасцит зачастую сочетается с аутоиммунным паранеопластическим васкулитом (Lazarev I. et al., 2015). У всех наблюдаемых нами больных с фасцитом отмечен мелкоклеточный гистологический вариант опухолевого процесса, но как раз ни в одном случае сочетаний с васкулитами не выявлено, поскольку все такие пациенты относились к группе больных с немелкоклеточным РЛ. Установлен еще такой факт, противоречащий данным литературы (Bursac D.S. et al., 2014): по результатам наших исследований при вторичном паранеопластическом дерматомиозите у больных РЛ превалирует не аденокарцинома, а мелкоклеточный вариант опухоли. В целом, как считают R. Takashima и соавторы (2017), в отличие от локализаций других злокачественных неоплазм, РЛ является нечастой причиной паранеопластического дерматомиозита/полимиозита, тогда как нами такая объединенная патология диагностирована у 2,1% общего числа пациентов с РЛ и у 11,2% наблюдений ПНПС. Отметим, что случаи паранеопластического дерматомиозита/полимиозита относятся к основному ПНПС синдрома Рейно при РЛ (Lambova S., Müller-Ladner U., 2013). Нами синдром Рейно и дигитальный некроз пальцев отмечены у 22,7% больных с таким кожномышечным вариантом ПНПС. Нами подтверждены данные литературы (Niklitschek S. et al., 2015; Pantoja Zarza L. et al., 2015), что самым частым сосудистым проявлением ПНПС при РЛ считается нейтрофильный лейкоцитокластический васкулит. Среди системных васкулитов, ассоциированных с антинейтрофильными цитоплазматическими антителами, известно сочетание РЛ и гранулематоза с полиангиитом Вегенера (Alston D. et al., 2016; Doberstein T. et al., 2017). Помимо такой системной ангиопатии, нами дополнительно диагностированы васкулит, напоминающий узелковый полиартериит, и криоглобулинемический васкулит, которые суммарно выявили у 1,3% общего числа больных РЛ и у 7,2% наблюдений ПНПС. Любопытно, что у всех пациентов с гранулематозным полиангиитом выявили высокое носительство антител к протеиназе-3, а в случаях узелкового полиартериита — антител к миелопероксидазе. Подчеркнем, что по данным литературы (Sachsman S.M. et al., 2016), панникулит отмечают как осложнение лучевой терапии РЛ. В этой связи еще раз отметим факт, что в дизайне исследования нами проанализировано течение РЛ до начала радиохимиотерапии. Общностью ПНПС, связанного с поражением костно-суставного аппарата и периартикулярных тканей, является дисперсионно-корреляционная зависимость Брауна — Форсайта и Кендалла от метастазов в печени, ребрах, плечевом суставе и крестцово-подвздошных сочленениях. При этом на развитие остеоартропатии Мари — Бамбергера оказывают достоверное влияние метастазы в бронхопульмональных, бифуркационных, подмышечных, подчелюстных, над- и подключичных лимфатических узлах; ревматоидоподобного артрита — метастазы в головном мозге и надпочечниках; подагрического артрита — метастазы в перикарде и позвоночнике. Следует остановиться еще на одном вопросе. У 2,3% общего числа и 12,8% числа лиц с ПНПС выявлена периферическая нейропатия, соответственно у 0,7/3,6% — офтальмопатия (увеит, склерит, кератит, конъюнктивит) и у 0,5/2,6% — гинекомастия, которые не относились к «ревматологическому ПНПС», но были с ним четко связаны. К тому же, эти клинические признаки не отмечены у остальных пациентов с РЛ без ПНПС. Отмечен безоговорочный половой диморфизм этих болезней, поскольку они установлены исключительно у мужчин. Примечательно, что нейропатия с сенсорными, моторными, вегетативными и смешанными расстройствами (в том числе туннельный синдром и синдром Гийена — Барре) отмечались при мелкоклеточном РЛ в 2,2 раза чаще, чем при немелкоклеточном варианте (p=0,038), а офтальмопатия и гинекомастия были прерогативой аденокарциномы легкого и плоскоклеточного РЛ. Развитие перечисленных неврологических, офтальмологических и эндокринологических проявлений ПНПС имели тесные связи с ревматологическими признаками ПНПС. Так, на появление нейропатии оказывали достоверное влияние ревматоидоподобный артрит, остеоартропатия и контрактуры Дюпюитрена, на офтальмопатию — васкулит и панникулит, на гинекомастию — ладонный фасцит и подагрический артрит. В литературе известны единичные случаи ПНПС Мари — Бамбергера у больных аденокарциномой легкого в сочетании с остеохондропатией голеней Осгуда — Шлаттера (Perković D. et al., 2013). Нами констатирована остеохондропатия у 8,2% пациентов РЛ с остеоартропатией (плоскоклеточный вариант опухоли) и у 1,4% без таковой (при аденокарциноме). Существует мнение, что «беспричинное» превращение пальцев в «барабанные палочки» и ногтей по типу «часовых стекол» диктует необходимость активного исключения аденокарциномы легкого (Raffayova H. et al., 2000; González-Silva Y. et al., 2016; Yap F.Y. et al., 2017). В свою очередь, добавим: «и плоскоклеточного РЛ». В целом прогностическое значение остеоартропатии у больных РЛ остается неизученным, а патогенез ее связывают с процессами опухолевого неоангиогенеза (Callemeyn J. et al., 2016).
ЗАКЛЮЧЕНИЕ
20 вариантов ревматологического ПНПС (от одного до восьми на больного) диагностируют у 18% больных РЛ, что чаще наблюдается у женщин и имеет гендерные особенности распространенности (полимиозит, лейкоцитокластический васкулит, панникулит или узловатая эритема), зависит от локализации опухолевого процесса (среднедолевая, медиастинальная), стадии, степени тяжести течения и гистологического варианта неоплазмы (ревматоидоподобный артрит, остеоартропатия, ладонный фасцит, контрактуры Дюпюитрена, тендовагинит, дерматополимиозит, васкулит, панникулит), характера метастазирования в лимфатические узлы, отдаленные органы и скелет, которые влияют на дополнительные паранеопластические признаки (поражение периферической нервной системы, развитие офтальмопатии и гинекомастии), а факторами риска ПНПС при РЛ являются наличие экссудативного плеврита, сдавления верхней полой вены, прорастание опухоли в грудную стенку и средостение.
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
- Aggarwal R., Oddis C.V. (2011) Paraneoplastic myalgias and myositis. Rheum. Dis. Clin. North. Am., 37 (4): 607–621.
- Alston D., Rajakariar R., Sheaff M., Lever N. (2016) Concurrent granulomatous polyangiitis and squamous cell carcinoma of the lung: a case of balancing treatment. BMJ Case. Rep., 13(4): 208–215.
- Azrielant S., Tiosano S., Watad A. et al. (2017) Correlation between systemic lupus erythematosus and malignancies: a cross-sectional population-based study. Immunol. Res. 65(2): 464–469.
- Boffetta P., Nordenvall C., Nyrén O., Ye W. (2012) A prospective study of gout and cancer. Eur. J. Cancer. Prev., 21(2): 127–132.
- Bursac D.S., Sazdanic-Velikic D.S., Tepavac A.P., Secen N.M. (2014) Paraneoplastic dermatomyositis associated with adenocarcinoma of the lung. J. Cancer Res. Ther., 10(3): 730–732.
- Callemeyn J., Van Haecke P., Peetermans W.E., Blockmans D. (2016) Clubbing and hypertrophic osteoarthropathy: insights in diagnosis, pathophysiology, and clinical significance. Acta Clin. Belg., 71(3): 123–130.
- Cantini F., Niccoli L., Nannini C. et al. (2012) Isolated knee monoarthritis heralding resectable non-small-cell lung cancer. A paraneoplastic syndrome not previously described. Ann. Rheum. Dis., 71(12): 1672–1674.
- Ceniceros L., Aristu J., Castanon E. et al. (2015) Stereotactic body radiotherapy (SBRT) for the treatment of inoperable stage I non-small cell lung cancer patients. Clin. Transl. Oncol., 55 (8): 213–219.
- Doberstein T., Swick B.L., Singh N. (2017) Skin nodule reveals lung cancer in a patient with granulomatosis with polyangiitis. Clin. Case Rep., 5(8): 1339–1340.
- Durieux V., Coureau M., Meert A.P., Berghmans T. (2017) Autoimmune paraneoplastic syndromes associated to lung cancer: A systematic review of the literature. Lung Cancer, 106(4): 102–109.
- González-Silva Y., Serrano-Manero M.P., Juez-García L. et al. (2016) Hypertrophic osteoarthropathy in lung adenocarcinoma. Semergen, 42(8): 149–151.
- Grаdalska-Lampart M., Karczmarek-Borowska B., Radziszewska A.U. (2015) Lung cancer in Podkarpackie region in the years 2002–2011. Pneumonol. Alergol. Pol., 83(2): 109–119.
- Hakkou J., Rostom S., Bahiri R., Hajjaj-Hassouni N. (2012) Paraneoplastic rheumatic syndromes: report of eight cases and review of literature. Rheumatol. Int., 32(6): 1485–1489.
- Hébant B., Miret N., Berthelot L. (2016) Generalized pruritus preceding paraneoplastic neuropathy. J. Clin. Neurosci., 26: 156–157.
- Katzen J.B., Raparia K., Agrawal R. et al. (2015) Early stage lung cancer detection in systemic sclerosis does not portend survival benefit: a cross sectional study. PLoS One., 10 (2): 0117829.
- Krishna K., Yacoub A., Hutchins L.F., Kortebein P.M. (2011) Palmar fasciitis with polyarthritis syndrome in a patient with breast cancer. Clin. Rheumatol., 30(4): 569–572.
- Kuo C.F., Luo S.F., See L.C. et al. (2012) Increased risk of cancer among gout patients: a nationwide population study. Joint Bone Spine, 79(4): 375–378.
- Lambova S., Müller-Ladner U. (2013) Capillaroscopic pattern in paraneoplastic Raynaud’s phenomenon. Rheumatol. Int., 33(6): 1597–1599.
- Lange U., Bachmann G., Müller-Ladner U. (2014) Tibial pain and unilateral knee arthritis: Precursors of paraneoplastic arthropathy. Z. Rheumatol., 70 (4): 332–335.
- Lazarev I., Shelef I., Refaely Y. et al. (2015) Two paraneoplastic autoimmune syndromes: limbic encephalitis and palmar fasciitis in a patient with small cell lung cancer. Rare Tumors., 7(3): 5721.
- Leandro M.J., Isenberg D.A. (2010) Rheumatic diseases and malignancy — is there an association? Scand. J. Rheumatol., 39(4): 185–188.
- McGivern U., McAleese J. (2012) Palmar fasciitis: a para-neoplastic phenomenon indicating recurrence of non small cell lung cancer — case report and review of the literature. Int. J. Rheum. Dis., 15(1): 8–9.
- Niklitschek S., González S., Vera-Kellet C. (2015) Leukocytoclastic vasculitis. Med. Clin., 145(5): 9–19.
- Pantoja Zarza L., Díez Morrondo C., Castro Rodríguez E. (2015) Paraneoplastic cutaneous vasculitis associated with lung cancer. Arch. Bronconeumol., 51(7): 365–366.
- Park J.K., Yang J.A., Ahn E.Y. et al. (2016) Survival rates of cancer patients with and without rheumatic disease: a retrospective cohort analysis. BMC Cancer, 16(4): 381–391.
- Perković D., Mihaljević S., Krstulović D.M. et al. (2013) Paraneoplastic hypertrophic osteoarthropathy. Reumatizam, 60(1): 29–31.
- Picano E., Semelka R., Ravenel J., Matucci-Cerinic M. (2014) Rheumatological diseases and cancer: the hidden variable of radiation exposure. Ann. Rheum. Dis., 73(12): 2065–2068.
- Pileckyte M., Baliūnaite R., Tamulaitiene V. (2008) Paraneoplastic rheumatic syndromes. Medicina, 39(5): 443–447.
- Qu H.M., Bai Y.N., Cheng N. et al. (2015) Trend analysis of cancer mortality in the jinchang cohort, China, 2001–2010. Biomed. Environ. Sci., 28(5): 364–369.
- Radner H. (2016) Multimorbidity in rheumatic conditions. Wien Klin. Wochenschr., 128(21–22): 786–790.
- Raffayova H., Schultz P., Malis F. (2000) Secondary hypertrophic osteoarthropathy in a patient with pulmonary carcinoma. Bratisl. Lek. Listy, 101(4): 219–222.
- Ramírez-Bellver J.L., Macías E., Bernárdez C. et al. (2017) Anti-NXP2-positive paraneoplastic dermatomyositis with histopathologic changes confined to the acrosyringia. Am. J. Dermatopathol., 39(1): 3–7.
- Sachsman S.M., Haydel D.M., Kim C.N. (2016) First reported case of postirradiation pseudosclerodermatous panniculitis after stereotactic body radiation therapy for the treatment of non-small cell lung cancer. Am. J. Dermatopathol., 38(2): 144–147.
- Sheehy C., Ryan J.G., Kelly M., Barry M. (2017) Palmar fasciitis and polyarthritis syndrome associated with non-small-cell lung carcinoma. Clin. Rheumatol., 36(11): 1951–1953.
- Tajima S., Takanashi Y., Koda K. (2015) Squamous cell carcinoma of the lung with highly proliferating fibromatosis-like stroma: a rare phenomenon. Int. J. Clin. Exp. Pathol., 8(5): 5870–5876.
- Takashima R., Takamatsu K., Shinkawa Y. et al. (2017) Dermatomyositis associated with lung neuroendocrine carcinoma. Intern. Med., 56(6): 719–724.
- Wang H.L., Zhou Y.M., Zhu G.Z. et al. (2017) Malignancy as a comorbidity in rheumatic diseases: a retrospective hospital-based study. Clin. Rheumatol., 16(5): 162–167.
- Wang W., Xu D., Wang B. et al. (2015) Increased risk of cancer in relation to gout: a review of three prospective cohort studies with 50,358 subjects. Mediators Inflamm., 20(15): 680853.
- Yap F.Y., Skalski M.R., Patel D.B. et al. (2017) Hypertrophic osteoarthropathy: clinical and imaging features. Radiographics, 37(1): 157–195.
Адрес для переписки:
Синяченко Олег Владимирович
Украина, 84404, Донецкая обл., Лиман, ул. Привокзальная, 27
Донецкий национальный медицинский университет
Е-mail: synyachenko@ukr.net
Генетическая основа гиперурикемии и вспышек подагры (ПГ)
Подготовил Александр Гузий
Уровень уратов в сыворотке крови (СК) и риск развития ПГ обусловлены генной экспрессией индивидуума под воздействием внешних факторов, то есть наследственность проявляется в дисперсии фенотипа. Для ПГ риск наследования — 45–73%. Геномассоциированное исследование систематически оценивает генную предрасположенность для распространенных (>1%) наследственных заболеваний. В исследовании с участием 110 тыс. европейцев выделены 28 генных локусов, кодирующих синтез белков — транспортеров мочевой кислоты в почках и кишечнике, а также вспомогательной молекулы PDZK1. Наибольшей активностью среди женщин обладает локус SLC2A9, среди мужчин — ABCG2. Эффекты экспрессии 28 одиночных нуклеотидных последовательностей сходны во всех предковых группах. Геномное секвенирование 33 тыс. человек в Восточной Азии позволило выделить 4 основных генных локуса, ответственных за обмен мочевой кислоты (SLC2A9, ABCG2, SLC22A12 и MAF), совпадающих с таковыми у европейцев. Значительно меньшие по масштабу исследования проведены среди африканской, американской (мексиканской) и микронезийской популяции. Во всех группах активность генного локуса SLC2A9 имела ведущее клиническое значение. Генный локус SLC2A9, кодирующий белок GLUT9, обусловливает ≈3% всех случаев повышения уровня уратов в СК, что является высоким показателем. До определения роли SLC2A9 в развитии ПГ прогресса в выявлении причинны заболевания нет. Выявлены локусы TLR4 и NLRP3 генов, кодирующих белковый компонент инфламмасом, участвующих в активизации вспышек ПГ. Его активизация в сочетании с более высоким уровнем преинтерлейкина-1β приводит к увеличению производства зрелого интерлейкина-1β и усилению иммунного ответа.
- Dalbeth N., Stamp L.K., Merriman T.R. (2017) The genetics of gout: towards personalised medicine? BMC Medicine, May 31.

Leave a comment