Роль гіперурикемії у розвитку кардіоваскулярної патології
Шуба Н.М., Воронова Т.Д., Литвиненко С.В.
Резюме. У статті представлені свіжі дані щодо значення гіперурикемії, а також активності власне ксантиноксидази в патогенезі розвитку таких кардіоваскулярних захворювань, як артеріальна гіпертензія, серцева недостатність, інфаркт міокарда, спричиненими значним зростанням гіперурикемії в останні роки (за даними епідеміологічних досліджень США, 2007–2008 рр.). Показана важливість ефективного контролю рівня сечової кислоти у зниженні загальної та кардіоваскулярної смертності, серцевої недостатності, фібриляції передсердь та інших хронічних захворювань серця. Доведена важливість селективного блокування ксантиноксидази у зниженні рівня сечової кислоти, особливо її високих значень, зокрема при недостатності функції нирок, а також у запобіганні розвитку ендотеліальної дисфункції.
В последние десять лет фундаментальные эпидемиологические и экспериментальные исследования доказали значительную роль мочевой кислоты (МК) как независимого фактора риска развития кардиоваскулярной и почечной патологии, особенно у пациентов с диабетом ІІ типа, гипертензией или сердечной недостаточностью (СН).
Отдельные исследования показали, что МК (как антиоксидант) является биологически активной и обеспечивает 60–70% всей антиоксидантной емкости плазмы крови. Высокий уровень обусловливает нейропротекторный эффект в центральной нервной системе, и в то же время воспалительные и нейродегенеративные заболевания, такие как болезнь Паркинсона, рассеянный склероз, неврит зрительного нерва. Также высокий уровень МК может индуцировать оксидативный стресс, эндотелиальную дисфункцию, воспаление и вазоспазм.
Такая двойная роль МК характеризуется отдельным термином — «парадокс МК».
Большинство, но не все, исследования сегодня показывают положительную независимую связь между гиперурикемией, общей и кардиоваскулярной смертностью, в связи с чем специалисты рекомендуют рассматривать ее как биомаркер для достижения целей лечения.
Термином «гиперурикемия» обозначают уровень МК в плазме крови >360 мкмоль/л.
Подагра — заболевание, развивающееся в результате отложения кристаллов МК в тканях.
Предлагаемые цели терапии по данным Американского колледжа ревматологов (American College of Rheumatology — ACR) (Khanna D. et al. 2012), рекомендаций Японского общества по подагре и нуклеинового обмена (Hisashi Yamanaka, 2012), Инициативы 3Е (Sivera F. et al. 2014), рекомендаций Европейской антиревматической лиги (The European League Against Rheumatism — EULAR) (Richette P. et al. 2016): уровень МК <6 мг/дл (360 мкмоль/л) для всех пациентов и <5 мг/дл (300 мкмоль/л) — для тяжелой подагры, которая характеризуется наличием тофусов при физикальном или визуализационном обследовании и вовлечением более 4 суставов.
Основным источником МК в организме является ее синтез при участии фермента ксантиноксидазы (ХО) в процессе метаболизма белков (пуринов). Типов ХО множество. Большинство из них отвечают за физиологические процессы распада белка. Отдельные ХО могут по разным причинам проявлять свою избыточную активность (например, ХО печени, что может быть связано с генетической предрасположенностью к ее гиперактивности у отдельных лиц) и вызывать стойкое повышение уровня МК. Также уровень МК может повышаться при патологических процессах, сопровождающихся массивной гибелью клеток и тканей, например при лейкемии, лимфоме, химиотерапии и лучевой терапии при онкологических заболеваниях. В отдельных случаях такое повышение МК может даже провоцировать приступ подагры.
Другой механизм развития гиперурикемии — нарушения экскреции МК почками. Это возможно при различной первичной или вторичной патологии почек. Что касается первичной патологии почек, то следует сделать акцент на генетически детерминированном дефекте ураттранспортного белка (UTP)-4, который отвечает за обратный захват МК в петле Генле. Соответственно, при его гиперактивности создаются условия для избыточного накопления МК в плазме крови.
Возможные причины повышения уровня МК представлены на рис. 1.
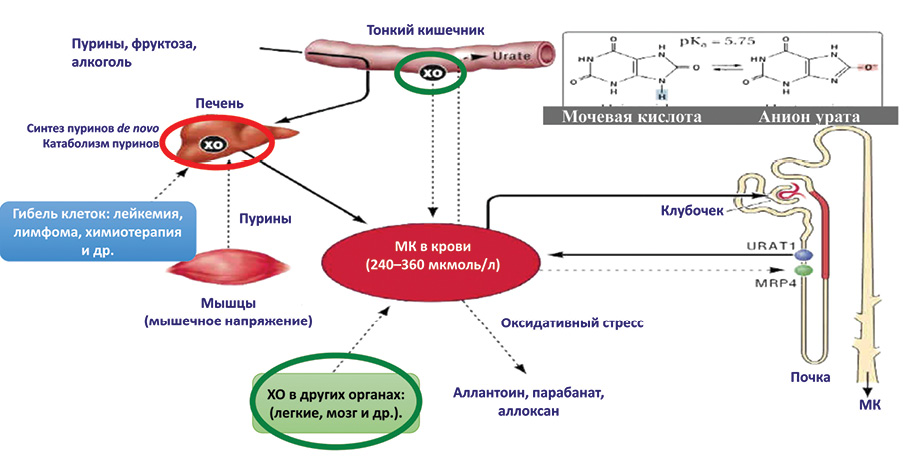
Учитывая, что большинство ХО выполняют физиологическую роль, при выборе препаратов блокаторов ХО для контроля гиперурикемии следует отдавать безусловное предпочтение селективным ингибиторам ХО, участвующим в избыточном синтезе МК. Последние преимущественно синтезируются в печени.
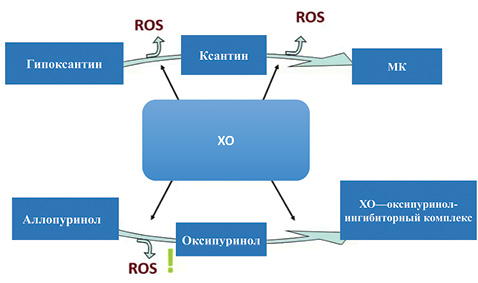
Аллопуринол, будучи пролекарством, трансформируется в организме в оксипуринол — активное вещество. В процессе этого метаболизма, течение которого также происходит при участии ХО, образуется большое количество свободных радикалов (reactive oxygen species — ROS). Свободные радикалы также могут вызывать дисфункцию эндотелия, что необходимо особенно учитывать у пациентов с кардиоваскулярным риском (рис. 2).
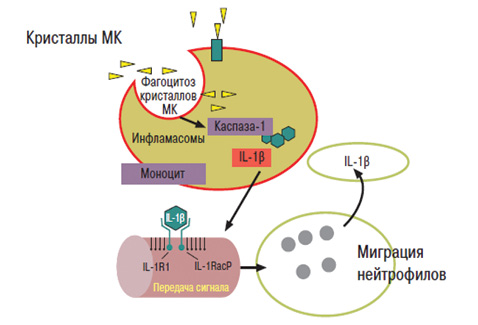
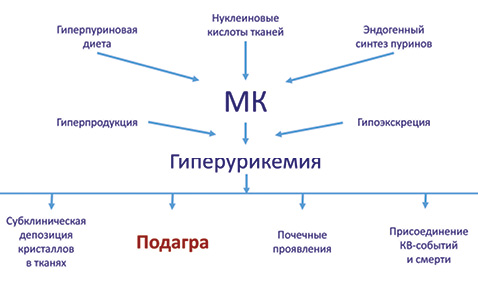
При избытке МК происходит ее фагоцитоз макрофагами. В результате этого активируются инфламасомы, что способствует активации интерлейкина (IL)-1 (IL-1β), что приводит к воспалительному процессу в тканях с миграцией нейтрофильных лейкоцитов, а также к транслокации его в сосуды, что обусловливает развитие дисфункции эндотелия (рис. 3) (Martinon F. et al. 2009). Гиперурикемия приводит к развитию субклинической депозиции кристаллов МК в тканях, подагре, поражению почек и присоединению кардиоваскулярной патологии и смертности (рис. 4).
В последние годы значительно выросла распространенность гиперурикемии в мире. Свидетельством тому являются эпидемиологические исследования, проведенные в США в 1988–1994, 2007–2008 гг. (Zhu Y. et al. 2011) (рис. 5).
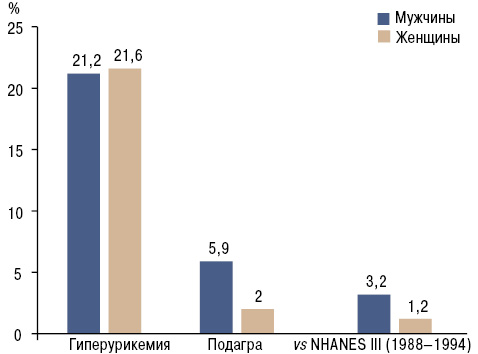
С высоким уровнем МК также ассоциируются следующие состояния:
- Артериальная гипертензия и прегипертензия (повышение риска в 2–3 раза за 5–7 лет).
- Заболевания почек (повышение риска в 5 раз за 2 года при уровне МК в плазме крови >330 мкмоль/л).
- Метаболический синдром.
- Обструктивное апноэ во сне.
- Сосудистые заболевания (сонных артерий, периферических артерий, коронарных артерий).
- Инсульт и сосудистая деменция.
- Преэклампсия.
- Воспалительные процессы.
- Эндотелиальная дисфункция.
- Оксидативный стресс.
- Пол и расовая принадлежность (женщины в постменопаузальный период, негроидная раса).
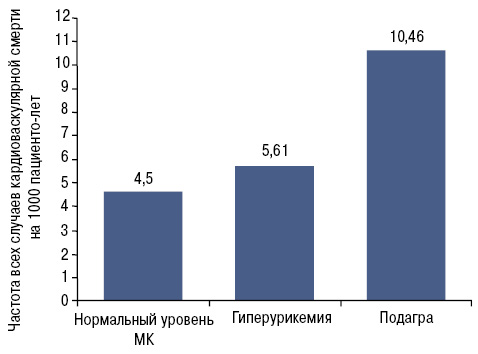
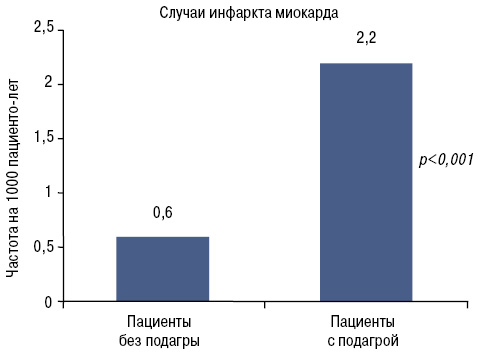
Кроме того, подагра является независимым фактором риска кардиоваскулярной смертности (Kuo C.F. et al. 2010) (рис. 6) и инфаркта миокарда (рис. 7).
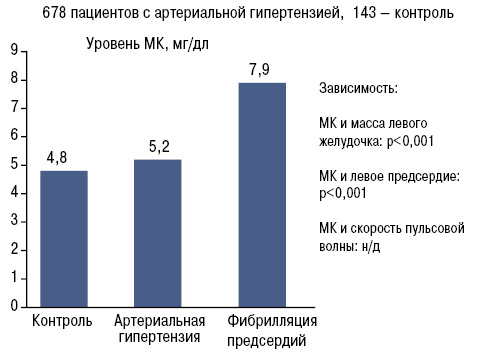
Гиперурикемию отмечают у 26% пациентов с АГ (показатели повышаются до 58% у применяющих антигипертензивную терапию) (Emmerson B.T., 1996). Высокий уровень МК ассоциируется с худшим контролем артериального давления.
Кроме того, гиперурикемия может приводить также к фибрилляции предсердий (Karamanou A. et al. 2015) (рис. 8).
Свободные радикалы, которые образуются при синтезе МК с участием ХО, приводят к развитию и прогрессированию СН за счет уменьшения перфузии миокарда, повышения тонуса сосудов, что, в свою очередь, приводит к повышению постнагрузки и снижению кровотока в коронарных артериях. Высокий уровень свободных радикалов и прогрессирующая на этом фоне эндотелиальная дисфункция приводят к снижению сократимости миокарда, замыкая таким образом данный порочный круг прогрессированием СН (рис. 9).
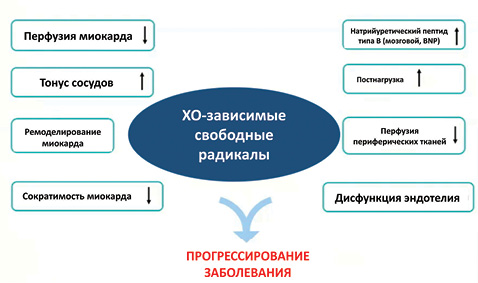
Но прогрессирование СН связано не только с гиперактивностью ХО. В свою очередь, уровень МК определяет выраженность СН. В частности, показано, что с повышением уровня МК коррелирует тяжесть СН по классу NYHA (Doehner W. et al., 2001; Kim S.Y. et al. 2009) (рис. 10, 11).
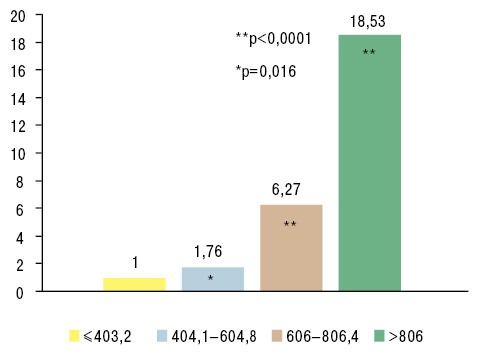
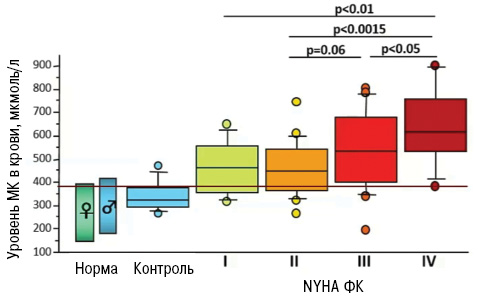
Наибольшее повышение кардиоваскулярной смертности при гиперурикемии >660 мкмоль/л отмечают у пациентов с СН и хроническими заболеваниями сердца (Kuo C.F. et al. 2013).
Следует отметить, что повышение риска развития гиперурикемии при СН может быть вызвано проводимым лечением по поводу самой СН (рис. 12).
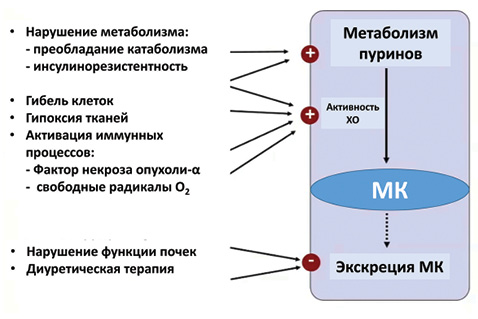
Так, петлевые диуретики, применение ацетилсалициловой кислоты в кардиопротекторных дозах приводит к нарушению (замедлению) экскреции МК почками. Это необходимо учитывать у пациентов с СН, контролировать уровень МК и, в случае превышения его пороговых значений, проводить фармакологическую коррекцию с назначением селективных ингибиторов ХО.
На рис. 13 представлены механизмы развития гипертензии, кардиоваскулярных и почечных осложнений, связанных с повышением МК.
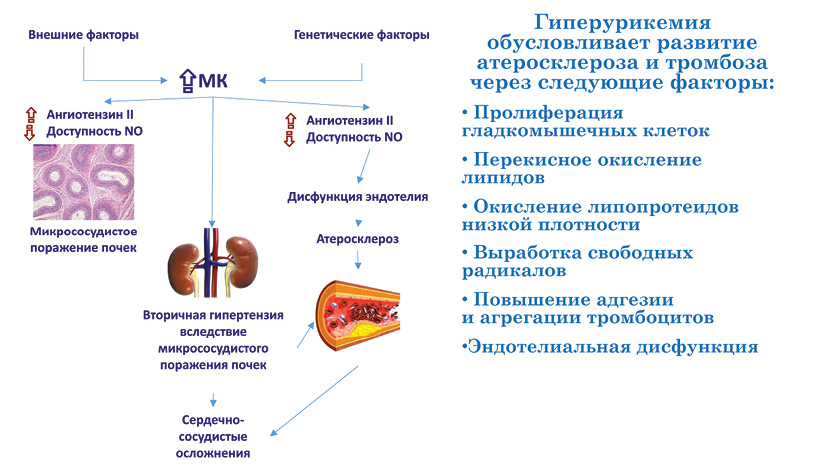
Высокий уровень МК способствует раннему старению сосудов. Таким образом, вовремя начатая коррекция уровня МК приведет к профилактике раннего старения сосудов (таблица) (Nilsson P.M. et al., 2009).
Важный вопрос: Можем ли мы, нормализовав уровень МК, предупредить кардиоваскулярные осложнения?
Доказательством положительного ответа на этот вопрос являются данные, представленные в таблице (Kanbay M. et al., 2013), в которой собраны исследования с установленным положительным влиянием снижения уровня МК на развитие кардиоваскулярных заболеваний, а также связью между нормализацией уровня МК и улучшением эндотелиальной функции.
| Исследуемая популяция | Источник | Выявленные улучшения, % |
|---|---|---|
| Застойная СН | Doehner W. et al., 2001 | 58 |
| Застойная СН | Farquaharson C.A. et al., 2002 | 50 |
| Застойная СН | George J. et al., 2006 | 30 |
| Сахарный диабет II типа с нормальным артериальным давлением | Dogan A. et al., 2011 | 50 |
| Пациенты с сахарным диабетом II типа | Butler R. et al., 2000 | 30 |
| Пациенты с обструктивным апноэ во сне | El Sohl A.A. et al., 2006 | 30 |
| Пациенты с метаболическим синдромом | Yiginer O. et al., 2008 | 50 |
| Асимптомная гиперурикемия | Kanday M. et al., 2012 | 20 |
| Асимптомная гиперурикемия | Mercuro G. et al., 2004 | 30 |
| Асимптомная гиперурикемия | Melendez-Ramirez G. et al., 2012 | 40 |
| Пациенты с ХБП* | Yelken B. et al., 2012 | 100 |
| Пациенты с ХБП | Kuo C.F. et al., 2011 | 25 |
*ХБП — хроническая болезнь почек.
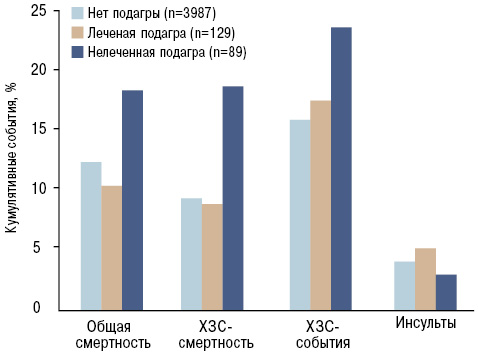
Сравнительная оценка развития общей, кардиоваскулярной смертности, а также хронических заболеваний сердца у пациентов при отсутствии подагры и адекватной терапии, направленной на гиперурикемию, показала существенно меньшую частоту развития указанных событий по сравнению с группой пациентов, не принимавших лечение. Однако в отношении частоты развития инсультов подобной динамики не наблюдалось (Krishnan E. et al. 2012) (рис. 14).
Установлено, что аллопуринол способен не только тормозить действие ХО, но и улучшать эндотелийзависимую сосудистую релаксацию, замедлять процесс гипертрофии левого желудочка (Kuo C.F. et al., 2010).
В исследовании EXACT-HF показано, что адекватный контроль гиперурикемии у пациентов с СН позволяет на 25% снизить регоспитализацию (Givertz M.M. et al., 2015).
Имеет ли клиническое значение селективность ингибирования ХО?
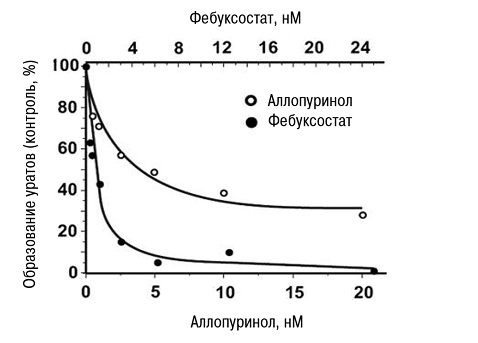
В экспериментальных исследованиях показано, что селективное ингибирование ХО (фебуксостатом) значительно (практически до 0) снижало образование кристаллов МК уже в минимальных терапевтических дозах, в то время как при применении аллопуринола даже в максимальных терапевтических дозах образование кристаллов МК снижалось только на 60% (Malik U.Z. et al., 2011) (рис. 15).
Важными преимуществами фебуксостата, имеющими особенное значение у пациентов с кардиоваскулярными рисками, являются:
- отсутствие необходимости коррекции дозы у пациентов пожилого возраста;
- отсутствие необходимости коррекции дозы у пациентов с ХБП 1–3-й стадии;
- отсутствие межлекарственного взаимодействия с кардиологическими препаратами и дезагрегантами.
Что касается эффективности фебуксостата в плане гипоурикемического действия, то в исследованиях установлено, что применение фебуксостата в терапевтических дозах в три раза эффективнее в достижении целевого уровня МК в сравнении с аллопуринолом в терапевтических дозах (Шуба Н.М., Воронова Т.Д., 2015).
При этом прослеживается очень важная особенность фебуксостата: его эффективность повышается с увеличением уровня МК. Так, в исследовании APEX и FACT у пациентов с высокими уровнями МК (>600 мкмоль/л) эффективность фебуксостата была в 5 раз выше таковой аллопуринола (Шуба Н.М., 2013).
Целесообразно перед началом урикемической терапии оценить функцию почек пациента. Так как, например, уже при ХБП 1-й стадии назначение аллопуринола будет противопоказано.
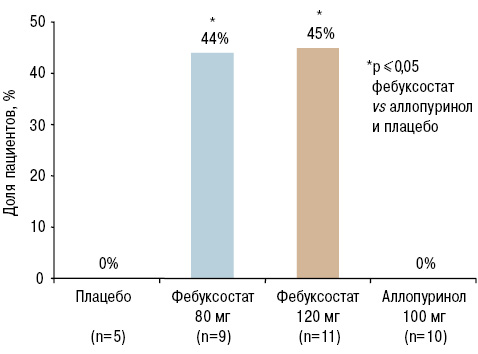
В исследовании APEX (6 мес) определяли соотношение пациентов с нарушением функции почек (1,5–2 мг/дл креатинина в сыворотке крови [>133–177 мкмоль/л]) и уровнем МК <6,0 мг/дл (<360 мкмоль/л) при трех последних контрольных замерах. Показано, что фебуксостат в обычных терапевтических дозах эффективен у пациентов с нарушением функции почек в отличие от аллопуринола (Schumacher H.R. et al., 2008) (рис. 16).
Вашему вниманию предлагаются современные рекомендации по терапии у пациентов с гиперурикемией (рис. 17) и подагрой.
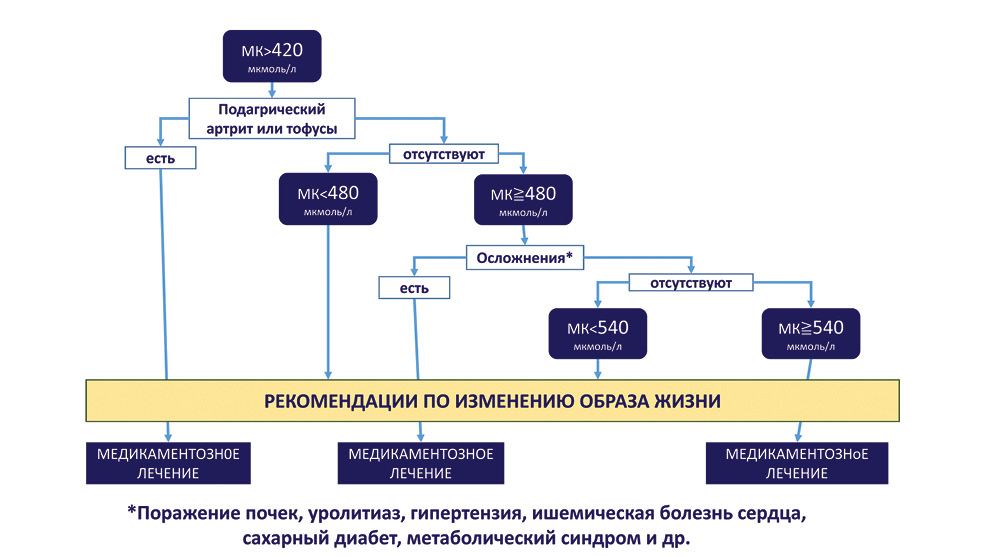
На сегодняшний день данный алгоритм разработан Японским обществом по подагре и нуклеиновому обмену (Hisashi Yamanaka, 2012).
Обновленные рекомендации EULAR 2016 по лечению подагры
A. Каждого пациента с подагрой необходимо информировать о патофизиологии болезни, наличии эффективных методов лечения, сопутствующих заболеваниях, а также о способах купирования острых атак и элиминации кристаллов уратов путем пожизненного снижения уровня МК ниже целевого.
B. Каждый пациент с подагрой должен получить рекомендации относительно образа жизни: уменьшение массы тела, если это уместно, и отказ от употребления алкоголя (особенно пива и спиртных напитков) и подслащенных напитков, тяжелой пищи, исключить чрезмерное потребление мяса и морепродуктов. Обезжиренные молочные продукты поощряются. Регулярные физические упражнения рекомендованы.
C. Каждый пациент с подагрой нуждается в систематическом наблюдении для выявления ассоциированных и сопутствующих заболеваний, сердечно-сосудистых факторов риска, в том числе нарушением функции почек, ишемической болезни сердца, СН, инсульта, заболеваний периферических артерий, ожирения, гиперлипидемии, артериальной гипертензии, сахарного диабета и курения, которые должны быть рассмотрены в качестве неотъемлемой части менеджмента подагры.
1. Острые приступы подагры следует купировать как можно раньше. Пациенты должны быть полностью информированы о способах самолечения и оказания первой помощи при первых симптомах. Выбор препарата(-ов) должен быть основан на наличии противопоказаний, предыдущего опыта лечения, времени старта лечения после начала приступа и от количества и типа вовлеченных сустава(-ов).
2. Рекомендуемым препаратом первой линии для купирования острых приступов подагры являются колхицин (в течение 12 ч после начала приступа) в стартовой дозе 1 мг с последующим назначением 0,5 мг через 1 ч в 1-й день и/или нестероидные противовоспалительные препараты (НПВП) (плюс ингибиторы протонной помпы при необходимости), пероральные глюкокортикоиды (30–35 мг/сут по преднизолону в течение 3–5 дней) или суставной аспирации и инъекции глюкокортикоидов. Колхицина и НПВП следует избегать у пациентов с тяжелой почечной недостаточностью. Колхицин не следует назначать больным, принимающим мощные Р-гликопротеины и/или ингибиторы CYP 3A4, такие как циклоспорин или кларитромицин.
3. У больных с частыми приступами и противопоказаниями к колхицину, НПВП и глюкокортикоидам (пероральным и инъекционным) следует рассматривать блокаторы IL-1 для купирования приступов. Текущая инфекция является противопоказанием к применению блокаторов IL-1. Уратснижающая терапия (УСТ) должна быть скорригирована для достижения целевого уровня урикемии после проведения купирования приступа блокаторами IL-1.
4. Профилактика приступов должна полностью объясняться и обсуждаться с пациентом. Профилактика рекомендуется в течение первых 6 мес уратснижающей терапии. Рекомендуется профилактическое лечение колхицином, 0,5–1 мг/сут, доза которого должна быть снижена у больных с почечной недостаточностью. В случаях почечной недостаточности или лечения статинами пациенты и врачи должны быть осведомлены о потенциальной нейротоксичности и/или мышечной токсичности колхицина. Сочетанного применения колхицина с мощными Р-гликопротеинами и/или ингибиторами CYP 3A4 следует избегать. При непереносимости колхицина или его противопоказаниях показана профилактика НПВП в низких дозах.
5. УСТ необходимо рассмотреть и обсудить с каждым пациентом с верифицированным диагнозом подагры при первом обращении. УСТ показана всем пациентам с рецидивирующими атаками, тофусами, уратной артропатией и/или камнями в почках. Инициирование УСТ рекомендуется как можно раньше с момента установления диагноза, особенно у пациентов молодого возраста (<40 лет) или с очень высоким уровнем МК (>8,0 мг/дл; 480 мкмоль/л), и/или сопутствующими заболеваниями (нарушением функции почек, артериальной гипертензией, ишемической болезнью сердца, СН). Пациенты с подагрой должны получать подробную информацию и быть в полной мере вовлечены в принятие решений, касающихся применения УСТ.
6. Для пациентов, находящихся на УСТ, уровень МК необходимо контролировать и поддерживать до <6 мг/дл (360 мкмоль/л). Более низкий уровень МК (<5 мг/дл; 300 мкмоль/л) для обеспечения быстрого растворения кристаллов рекомендуется пациентам с тяжелой подагрой (тофусами, хронической артропатией, частыми приступами) до полного растворения кристаллов и разрешения подагры. Уровень МК <3 мг/дл (180 мкмоль/л) не рекомендуется в долгосрочной перспективе.
7. Каждую УСТ следует начинать с низкой дозы, а затем повышать ее, пока целевой уровень МК не будет достигнут. МК <6 мг/дл (360 мкмоль/л), следует поддерживать в течение всей жизни.
8. У пациентов с нормальной функцией почек аллопуринол рекомендуется для первой линии УСТ, начиная с низкой дозы (100 мг/сут) и повышением с шагом 100 мг каждые 2–4 нед, если требуется достижение целевого уровня МК. Если цель МК не может быть достигнута с помощью соответствующей дозы аллопуринола, его требуется заменить на фебуксостат или урикозурики, или фебуксостат с урикозуриками. Фебуксостат также назначают при противопоказаниях к аллопуринолу.
В рекомендациях ACR 2012 г. пункт по выбору уратснижающей терапии (9) звучит следующим образом:
Ингибиторы ХО (аллопуринол или фебуксостат) являются препаратами выбора для УСТ и достижения целевого уровня МК в плазме крови <360 мкМоль/л. Доза должна титроваться с учетом безопасности препарата и одновременно со снижением частоты развития приступов подагры. Уровень МК необходимо постоянно мониторировать. Также следует проводить соответствующий мониторинг токсичности (сила рекомендации 95 (94–96)).
9. У пациентов с нарушением функции почек, максимальная доза аллопуринола должна быть скорригирована с учетом клиренса креатинина. Если целевой уровень МК не может быть достигнут в этой дозе, пациента необходимо перевести на фебуксостат или бензбромарон с/без аллопуринола, за исключением больных с расчетной скоростью клубочковой фильтрации <30 мл/мин.
10. У больных с верифицированной тяжелой, изнурительной хронической подагрой и низким качестве жизни, у которых целевой уровень МК не может быть достигнут любым препаратом при максимальной дозировке (включая комбинации), рекомендуется пеглотиказа.
11. Если подагра отмечается у пациентов, применяющих петлевые или тиазидные диуретики, необходимо заменить мочегонное, если это возможно; при артериальной гипертензии предпочтение отдается лозартану или блокаторам кальциевых каналов; при гиперлипидемии рекомендуются статин или фенофибрат.
Выводы
1. Гиперурикемия — ведущий фактор риска развития подагры и кардиоваскулярных заболеваний.
2. Эффективный контроль гиперурикемии оказывает ряд благоприятных клинических эффектов, включая кардиопротекцию.
3. Рутинные исследования доказали, что блокирование ХО является эффективной стратегией в лечении пациентов с гиперурикемией.
4. Степень селективности блокирования ХО может дополнительно повысить эффективность лечения пациентов с гиперурикемией.
Список использованной литературы
- Шуба Н.М. (2013) Гіперурикемія — мультиморбідна патологія в ревматології. Укр. ревматол. журн., 2(52): 14–22.
- Шуба Н.М., Воронова Т.Д. (2015) Подагра — мультиморбидная патология. Укр. ревматол. журн., 59(1): 72–83.
- Butler R., Morris A.D., Belch J.J. et al. (2000) Allopurinol normalizes endothelial dysfunction in type 2 diabetics with mild hypertension. Hypertension, 35: 746–751.
- Doehner W., Rauchhaus M., Florea V.G. et al. (2001) Uric acid in cachectic and non-cachectic CHF patients—relation to leg vascular resistance. Am. Heart J., 141: 792–799.
- Doehner W., Schoene N., Rauchhaus M. et al. (2002) Effects of xanthine oxidase inhibition with allopurinol on endothelial function and peripheral blood flow in hyperuricemic patients with chronic heart failure: results from two placebo-controlled studies. Circulation, 105: 2619–2624.
- Dogan A., Yarlioglues M., Kaya M.G. et al. (2011) Effect of long-term and high-dose allopurinol therapy on endothelial function in normotensive diabetic patients. Blood Press, 20(3): 182–187.
- El Solh A.A., Saliba R., Bosinski T. et al. (2006) Allopurinol improves endothelial function in sleep apnoea: a randomised controlled study. Eur. Respir. J., 27: 997–1002.
- Emmerson B.T. (1996) The management of gout. N. Engl. J. Med., 334(7): 445–451.
- Farquharson C.A., Butler R., Hill A. et al. (2002) Allopurinol improves endothelial dysfunction in chronic heart failure. Circulation, 106: 221–226.
- George J., Carr E., Davies J. et al. (2006) High-dose allopurinol improves endothelial function by profoundly reducing vascular oxidative stress and not by lowering uric acid. Circulation, 114: 2508–2516.
- Givertz M.M., Anstrom K.J., Redfield M.M. et al. (2015) Effects of xanthine oxidase inhibition in hyperuricemic heart failure patients: The Xanthine Oxidase Inhibition for Hyperuricemic Heart Failure Patients (EXACT-HF) Study. NHLBI Heart Failure Clinical Research Network. Circulation., 131(20): 1763–71.
- Hisashi Yamanaka (2012) Essence of the Revised Guideline for the Management of Hyperuricemia and Gout. JMAJ, 55(4): 324–329.
- Kanbay M., Segal M., Afsar B. et al. (2013) The role of uric acid in the pathogenesis of human cardiovascular disease. Heart, 99: 759–766.
- Kanbay M., Yilmaz M.I., Sonmez A. et al. (2012) Serum uric acid independently predicts cardiovascular events in advanced nephropathy. Am. J. Nephrol., 36: 324–331.
- Karamanou A., Kallistratos M.S., Poulimenos L.E. et al.(2015) Associations between serum uric acid levels and the incidence of hypertension and atrial fibrillation. J. Hypertension, 33(Supp. 1): 372–373.
- Khanna D., Khanna P.P., FitzGerald J.D. et al. (2012) American College of Rheumatology Guidelines for Management of Gout. Arthritis Care Res., 64(10): 1447–1461.
- Kim S.Y., Guevara J.P., Kim K.M. et al. (2009) Hyperuricemia and risk of stroke: A systematic review and meta-analysis. Arthritis Care Res., 61(7): 885–892.
- Krishnan E., Pandya B.J., Lingala B. et al. (2012) Hyperuricaemia and untreated gout arepoor prognostic markers among those with a recent acute myocardial infarction. Arthritis Res. Ther., 14: R10.
- Kuo C.F., Luo S.F., See L.C. et al. (2011) Hyperuricaemia and accelerated reduction in renal function. Scand. J. Rheumatol., 40(2): 116–121.
- Kuo C.F., See L.C., Luo S.F. et al. (2010) Gout: an independent risk factor for all-cause and cardiovascular mortality. Rheumatology (Oxford), 49: 141–146.
- Kuo C.F., See L.C., Yu K.H. et al. (2013) Significance of serum uric acid levels on the risk of all-cause and cardiovascular mortality. Rheumatology (Oxford), 52: 127–134.
- Malik U.Z., Hundley N.J., Romero G. et al. (2011) Febuxostat inhibition of endothelial-bound XO: implications for targeting vascular ROS production. Free Radic. Biol. Med., 51: 179–184.
- Martinon F., Mayor A., Tschopp J. (2009) The inflammasomes: guardians of the body. Ann. Rev. Immunol., 27: 229–265.
- Melendez-Ramirez G., Perez-Mendez O., Lopez-Osorio C. et al. (2012) Effect of the treatment with allopurinol on the endothelial function in patients with hyperuricemia. Endocr. Res., 37: 1–6.
- Mercuro G., Vitale C., Cerquetani E. et al. (2004) Effect of hyperuricemia upon endothelial function in patients at increased cardiovascular risk. Am. J. Cardiol., 94: 932–935.
- Nilsson P.M., Boutouyrie P., Laurent S. et al. (2009) Vascular aging: A tale of EVA and ADAM in cardiovascular risk assessment and prevention. Hypertension, 54(1): 3–10.
- Richette P., Doherty M., Pascual E. et al. (2016) 2016 updated EULAR evidence-based recommendations for the management of gout. Ann. Rheum. Dis., 0: 1–14 (doi:10.1136/annrheumdis-2016-209707).
- Schumacher H.R.Jr., Becker M.A., Wortmann R.L. et al. (2008) Effects of febuxostat versus allopurinol and placebo in reducing serum urate in subjects with hyperuricemia and gout: A 28-week, phase III, randomized, double-blind, parallel-group trial. Arthritis Rheum., 59: 1540–1548.
- Sivera F., Andres M., Carmona L. et al. (2014) Multinational evidence-based recommendations for the diagnosis and management of gout: integrating systematic literature review and expert opinion of a broad panel of rheumatologists in the 3e initiative. Ann. Rheum. Dis., 73(2): 328–335.
- Yelken B., Caliskan Y., Gorgulu N. et al. (2012) Reduction of uric acid levels with allopurinol treatment improves endothelial function in patients with chronic kidney disease. Clin. Nephrol., 77: 275–282.
- Yiginer O., Ozcelik F., Inanc T. et al. (2008) Allopurinol improves endothelial function and reduces oxidant-inflammatory enzyme of myeloperoxidase in metabolic syndrome. Clin. Res. Cardiol., 97: 334–340.
- Zhu Y., Pandya B.J., Choi H.K. (2011) Prevalence of gout and hyperuricemia in the US general population. Arthritis Rheum., 63: 3136–3141.
Адрес для переписки:
Шуба Неонила Михайловна
04112, Киев, ул. Дорогожицкая, 9
Национальная медицинская академия
последипломного образования
им. П.Л. Шупика

Leave a comment