Увеїт у хворих на ювенільний ідіопатичний артрит
Резюме. Увеїт — найчастіше позасуглобове ускладнення у хворих на ювенільний ідіопатичний артрит. Тяжкість хвороби залежить від ступеня активності запального процесу на момент встановлення діагнозу, наявності ускладнень та від можливості отримання терапевтичної відповіді на існуючі методи лікування. Несвоєчасне діагностування увеїту призводить до ускладнень, пов'язаних зі зниженням гостроти зору, тому важливі раннє діагностування та своєчасне лікування цього захворювання. На сьогодні продовжуються активні дослідження новітніх методів лікування при увеїті у дітей, хворих на ювенільний ідіопатичний артрит.
Вступ
До найпоширеніших позасуглобових ускладнень у хворих на ювенільний ідіопатичний артрит (ЮІА) належить увеїт. Хронічний передній увеїт найчастіше діагностують у хворих на олігоартикулярний і поліартикулярний ЮІА із від’ємним ревматоїдним фактором та перебігом без клінічних проявів. Гострий передній увеїт, який є симптоматичним, часто буває однобічним і епізодичним та спостерігається у хворих на ентезитасоційований ЮІА. Тяжкість увеїту залежить від ступеня активності запального процесу на момент установлення діагнозу, наявності ускладнень та від можливості отримання терапевтичної відповіді на існуючі методи лікування. Несвоєчасна діагностика увеїту в дитячому віці призводить до появи ускладнень у молодому віці та створює серйозні клінічні проблеми. Раннє виявлення та лікування при увеїті у хворих на ЮІА має важливе значення для запобігання його ускладненням, які можуть призвести до втрати зору.
Класифікація увеїту
Увеїт — це запалення судинної оболонки ока (райдужна оболонка, хоріоїдея та сітківка ока). Класифікують увеїт за анатомічною локалізацією запального процесу як передній, проміжний та задній увеїт (табл. 1) [74].
|
Тип |
Місце запалення |
Включає |
|
Передній увеїт |
Передня камера |
Ірит |
|
Проміжний увеїт |
Склоподібне тіло |
Pars planitis Задній цикліт Гіаліт |
|
Задній увеїт |
Сітківка |
Фокальний, мультифокальний, або дифузний хоріоїдит Ретинохоріоїдит |
Standardization of Uveitis Nomenclature (SUN) Working Group.
SUN Working Group розрізняє увеїт із раптовим та поступовим початком і поділяє увеїт за тривалістю на обмежений (<3 міс) та персистуючий (≥3 міс). Розрізняють гострий, рецидивуючий та хронічний варіанти перебігу увеїту (табл. 2) [74]. Увеїт у дітей із олігоартритом, поліартритом, псоріатичним артритом найчастіше має поступовий початок із хронічним і часто рецидивуючим перебігом. Часом у хворих на ЮІА виявляють проміжний увеїт із запаленням у склоподібному тілі. Увеїт у хворих на ЮІА може бути одностороннім або двостороннім.
|
Категорія |
Дескриптор |
Коментар |
|
Початок |
Раптовий Поступовий |
|
|
Тривалість |
Обмежена |
<3 міс |
|
Персистуюча |
≥3 міс |
|
|
Перебіг |
Гострий |
Епізод, який характеризується раптовим початком і обмеженою тривалістю |
|
Рецидивуючий |
Повторні епізоди, розділені періодами безмедикаментозної ремісії, тривалістю ≥3 міс |
|
|
Хронічний |
Персистуючий увеїт із загостренням, яке виникає через <3 міс з моменту припинення лікування |
Епідеміологія
Загальна захворюваність на увеїт у педіатричній популяції, згідно з результатами дослідження, проведеного у Фінляндії, становить 4,3 на 100 тис. на рік, а поширеність — 27,9 на 100 тис. осіб [73]. Поширеність увеїту у хворих на ЮІА, за даними досліджень профільних центрів Європи, Північної Америки та Ізраїлю, коливається у межах від 15 до 67% [6, 24, 30, 47, 60]. Частота хронічного увеїту у дітей із хронічним артритом значно відрізняється: від 2% у Коста-Ріці до 11,6% — у США, 13% — у Канаді та 16%— у країнах Північної Європи [74]. Ці показники частково залежать від когорти досліджуваних хворих. Так, у хворих на ЮІА дітей увеїт, який передував появі артриту, виявляли у 3–7% випадків [41]. Частота увеїту у пацієнтів із раніше діагностованим ЮІА становить від 11,6% [4] до 30% [69]. Загалом частота виявлення увеїту впродовж останнього десятиліття знижується. У більшості дітей увеїт розвивається під час першого року хвороби і лише у 7–10% хворих на ЮІА увеїт розвинувся через 4 роки від початку захворювання.
При дослідженні 1081 пацієнта з ЮІА увеїт розвинувся у 13,1% випадків, при цьому переважав хронічний передній увеїт (68,3%), гострий передній увеїт виявлено у 16,2%, рецидивуючий передній увеїт — у 12%, а панувеїт — у 3,5% пацієнтів [81].
Сьогодні ідентифіковано фактори ризику розвитку увеїту у хворих на ЮІА. До них належать стать, варіант перебігу ЮІА, вік початку, наявність антинуклеарних антитіл (АНА) і позитивність за HLA-B27 (HLA — від англ. human leucocyte antigen — головний комплекс гістосумісності) [12, 41, 69, 75]. Молодший вік, жіноча стать, олігоартикулярний варіант хвороби та наявність АНА вважають факторами ризику розвитку хронічного переднього увеїту. В осіб чоловічої статі з наявністю HLA-B27, з ентезитасоційованим артритом частіше розвивається гострий передній увеїт. Вплив етнічної приналежності на розвиток увеїту у дітей із ЮІА залишається нез’ясованим. У попередніх дослідженнях щодо ідентифікації увеїту у представників різних етнічних груп не виявлено етнічної залежності [80]. Однак пізніші дослідження показали, що особи європейського походження мають підвищений ризик розвитку увеїту при ЮІА [86].
Патогенез
Незважаючи на відомий зв’язок ЮІА з увеїтом, причина розвитку увеального запалення досі незрозуміла. Цілком ймовірно, що патофізіологія увеїту при ЮІА поєднує як генетичні, так і навколишньосередовищні впливи. Генетична основа розвитку увеїту при ЮІА складна. Незважаючи на сімейні випадки [51], у хворих на ЮІА не виявлено моногенного типу успадкування увеїту [107].
Більшість випадків увеїту при ЮІА мають зв’язок із HLA, що й підтверджує автоімунне походження увеїту. Хронічний передній увеїт у пацієнтів із олігоартикулярним ЮІА пов’язаний із HLA-DR5-гаплотипом [37] і HLA-DRB1*1104-алеллю [67]. Поєднання HLA-DRB1*1104- і HLA-A*0201-алелі DPB1 пов’язане із 7,7-кратним підвищенням ризику розвитку хронічного увеїту. HLA-B27 відіграє важливу роль у патогенезі ентезитасоційованого артриту. У цій групі пацієнтів існує підвищений ризик розвитку гострого переднього увеїту [26]. Неодноразово показано, що HLA-DR1 — єдина алель HLA, яка має протекторний зв’язок із розвитком хронічного переднього увеїту, асоційованого з ЮІА [53].
У хворих на ЮІА для формування імунної відповіді проти нативних інтраокулярних антигенів залучаються Т- і В-лімфоцити. Докази участі обох Т- і В-лімфоцитів отримано в імуногістохімічному обстеженні біоптатів ока у пацієнтів із ЮІА, в яких виявляють переважання CD4+, а не CD8+ Т-лімфоцитів, а також наявність CD20+-лімфоцитів. Крім адаптивного імунітету, в патогенезі увеїту у хворих на ЮІА бере участь вроджена імунна система [53].
Ризик розвитку хронічного переднього увеїту у хворих на ЮІА із позитивними АНА — високий [85]. Однак залишається незрозумілою роль АНА у патогенезі увеїту. Цілком можливо, що підвищення рівня АНА має не патогенетичне значення, а є епіфеноменом.
Клінічні прояви
Типові клінічні прояви гострого переднього увеїту включають біль в очах, почервоніння, біль голови, світлобоязнь і погіршення зору, однак їх виявляють лише у половини хворих на ЮІА (табл. 3) [74]. У хворих на ЮІА частіше відзначають хронічний передній увеїт, перебіг якого у 80% випадків відбувається без клінічних проявів та суб’єктивних відчуттів. Пошкоджене око зазвичай залишається білим та незміненим (див. табл. 3) [48]. У дітей єдиним проявом переднього увеїту може бути зниження гостроти зору. Поступовий початок із хронічним перебігом — це класичні клінічні прояви увеїту, які спостерігають у хворих на олігоартикулярний ЮІА (персистуючий та поширений), псоріатичний артрит або RF-негативний поліартрит (табл. 4). Тому для виявлення безсимптомного увеїту у пацієнтів із ЮІА важливе значення мають регулярні офтальмологічні обстеження. Наявність проміжного, заднього увеїту та панувеїту є нетиповими для хворих на ЮІА. Захворювання є двобічним у 70–80% дітей із ЮІА [74]. У пацієнтів із ЮІА, які мають однобічний увеїт, малоімовірний розвиток двобічного пошкодження очей після першого року захворювання.
|
Характеристика |
Показник, % |
|
Двобічний увеїт |
25–89 |
|
Симптоми |
|
|
Очний біль і/або почервоніння |
0–25 |
|
Погіршення зору |
0–20 |
|
Світлобоязнь |
0–8 |
|
Головний біль |
0–6 |
|
Немає |
51–97 |
|
Варіант ЮІА |
Симптоматика |
Ускладнення |
|
Олігоартрит |
– |
– |
|
Персистуючий |
Переважно безсимптомно |
Часто |
|
Поширений |
Переважно безсимптомно |
Часто |
|
Серонегативний |
Переважно безсимптомно |
Часто |
|
Псоріатичний артрит |
Переважно безсимптомно |
Часто |
|
Ентезитасоційований |
Переважно безсимптомно |
Рідко |
|
Інші артрити |
Переважно безсимптомно |
Часто |
|
Серопозитивний |
– |
– |
|
Системний артрит |
– |
– |
|
Усі пацієнти* |
80% безсимптомно* |
56%* |
Адаптовано за: Horneff G., 2009 [48]; *дані Heligenhaus А. et al., 2007 [44].
Встановлено, що середній час від дебюту ЮІА до початку увеїту становить 1,8 року [81]. Увеїт може залишатися непоміченим у хворих на ЮІА впродовж значного періоду. Крім того, недавнє дослідження показало двофазний перебіг увеїту, де другий пік активності захворювання відбувається у період статевого дозрівання дитини [46]. Це дослідження свідчить про необхідність пильності та моніторингу щодо перебігу увеїту в пацієнта впродовж тривалогочасу.
Діагностика
Обстеження дітей, хворих на ЮІА, з метою виявлення увеїту потребує огляду за допомогою щілинної лампи, біомікроскопії передньої камери ока, вимірювання внутрішньоочного тиску та визначення гостроти зору. Використання щілинної лампи дозволяє обстежувати передній та задній відділи ока, а також сітківку. SUN-критерії поділяють увеїти за тяжкістю внутрішньоочного запалення на підставі підрахунку кількості клітин та концентрації білка у передній камері ока, скупчення клітин (преципітатів) на задній поверхні рогівки, виявлення клітин та помутніння у склоподібному тілі (табл. 5, 6) [20]. Критерії активності дозволяють оцінювати ступінь активності увеїту та здійснювати моніторинг його перебігу (табл. 7) [20].
|
Ступінь активності |
Кількість клітини у передній камері* |
|
0 |
<1 |
|
0,5+ |
1–5 |
|
1+ |
6–15 |
|
2+ |
16–25 |
|
3+ |
26–50 |
|
4+ |
>50 |
*Поле розміром 1 мм х 1 мм. У табл. 5–7: Standardisation of Uveitis Nomenclature (адаптовано за: Jabs D.A. et al., 2005 [50]).
|
Ступінь активності |
Опис |
|
0 |
Немає |
|
1+ |
Тьмяні преципітати |
|
2+ |
Помірні преципітати (райдужна оболонка й деталі кришталика прозорі) |
|
3+ |
Помітні преципітати (райдужна оболонка й деталі кришталика каламутні) |
|
4+ |
Інтенсивні преципітати (фібрин або желеподібна рідина) |
Моніторинг ступеня активності увеїту ока
|
Термін |
Визначення |
|
Неактивний |
0 клітин у передній камері** |
|
Погіршення |
Підвищення ступеня запалення на два кроки (наприклад кількість клітин у передній камері, помутніння скловидного тіла) чи підвищення від ступеня 3+ до ступеня 4+ |
|
Поліпшення |
Зниження ступеня запалення на два кроки (наприклад кількість клітин у передній камері, помутніння скловидного тіла) чи зниження до ступеня 0 |
|
Ремісія |
Неактивне захворювання >3 міс після припинення лікування хвороби ока |
**Належить до запалень передньої камери.
У пацієнтів із увеїтом важливо вимірювати внутрішньоочний тиск, оскільки існує ризик появи внутрішньоочної гіпертензії та глаукоми. Цей ризик утримується навіть незважаючи на контрольовану активність запального процесу при увеїті [45].
Різні анатомічні форми увеїту передбачають можливість розвитку певного спектра ускладнень, що розвиваються при хронічному перебігу увеїту (табл. 8) [48].
при різних анатомічних формах увеїту
|
Форма увеїту |
Симптоми |
Ускладнення |
|
Передній |
|
|
|
Проміжний |
|
|
|
Задній |
|
|
|
Панувеїт |
|
|
Усі пацієнти, хворі на ЮІА, які мають ризик розвитку увеїту, мають проходити скринінг для виявлення цього ускладнення. Перше офтальмологічне обстеження необхідно проводити впродовж перших 6 тиж після встановлення діагнозу ЮІА або у разі підозри щодо увеїту [22]. Наступні офтальмологічні обстеження повторюються через конкретні періоди впродовж перших кількох років хвороби. ACR-рекомендації офтальмологічного скринінгу дітей із ЮІА наведено у табл. 9. Рекомендована частота офтальмологічних оглядів залежить від ступеня ризику увеїту (див. табл. 9).
Рекомендовано обстежувати за допомогою щілинної лампи кожних 3 міс впродовж перших 2 років дітей групи високого ризику (ранній вік початку захворювання, олігоартрит або поліартрит, ANA позитивність), а потім кожні 4–6 міс впродовж 7 років. У дітей із АНА-негативною хворобою обстеження за допомогою щілинної лампи необхідно проводити із 4–6-місячними інтервалами. У дітей із псоріатичним артритом є значний ризик розвитку увеїту, тому слід дотримуватися тих самих рекомендацій щодо частоти офтальмологічного обстеження, як у хворих на олігоартикулярний або поліартикулярний ЮІА. У дітей зі системним початком ЮІА офтальмологічне обстеження можна проводити один раз на рік. Тривалість проведення офтальмологічного скринінгу залежить від віку початку хвороби та варіанта ЮІА (див. табл. 9).
що базуються на ILAR-класифікації ЮІА
|
Варіант ЮІА |
ANA |
Вік початку ЮІА, років |
Тривалість ЮІА, років |
Скринінг, міс |
|
Олігоартрит |
+ |
<7 |
<5 |
3 |
|
RF-негативний поліартрит |
||||
|
Псоріатичний артрит |
||||
|
Недиференційований артрит |
||||
|
+ |
<7 |
>4 |
6 |
|
|
+ |
<7 |
>7 |
12 |
|
|
+ |
>6 |
<3 |
6 |
|
|
+ |
>6 |
>2 |
12 |
|
|
— |
<7 |
<5 |
6 |
|
|
— |
<7 |
>4 |
12 |
|
|
— |
>6 |
NA |
12 |
|
|
Ентезитасоційований артрит |
NA |
NA |
12 |
|
|
RF-позитивний поліартрит |
NA |
NA |
12 |
|
|
Системний артрит |
NA |
NA |
12 |
|
|
Пацієнти з будь-яким варіантом із увеїтом |
NA |
NA |
Відповідно до перебігу увеїту |
Адаптовано за: Heiligenhaus А. et al. [42].
Ризик розвитку увеїту у хворих із ЮІАє різним та залежить від варіанта перебігу хвороби [68]. У дітей із олігоартритом увеїт спостерігають у 20–25% випадків (до 30% при олігоартриті поширеному), у 10% хворих із псоріатичним артритом та у 14% — із серонегативним поліартритом. Надзвичайно рідко виявляють увеїт у дітей із системним артритом та серопозитивним поліатритом (табл. 10).
залежно від варіанта перебігу
|
Характеристика |
Середній показник |
|
Ж:Ч |
4,4:1 |
|
Середній вік початку артриту, років |
4 |
|
Варіант артриту (% з увеїтом) |
|
|
30 |
|
15 |
|
10 |
|
<1 |
|
<1 |
|
<1 |
|
Серологія, % |
|
|
<1 |
|
80 |
|
Гострий увеїт ≈7% |
|
Підсумкові дані опублікованих досліджень. Адаптовано за: Heiligenhaus А. et al. [42].
Ускладнення у пацієнтів, хворих на ЮІА
Ускладнення хронічного переднього увеїту виникають часто і вираженість їх збільшується із тривалістю активного захворювання. Типовими ускладненнями увеїту у хворих на ЮІА є стрічкоподібна кератопатія, синехії, катаракта, глаукома і макулярний набряк (табл. 11) [48]. Задні синехії, запальні спайки між райдужною оболонкою і передньою поверхнею кришталика призводять до поганої рухомості зіниці. Ці зміни, які часто виявляють вже при першому офтальмологічному обстеженні, є свідченням наявності тривалого і тяжкого увеїту. Кератопатія, викликана відкладенням солей кальцію в епітелій рогівки, виникає при хронічному перебігу хвороби. Катаракта є наслідком запального захворювання чи застосування кортикостероїдів. Глаукома і гіпотонія — серйозні ускладнення. Згідно з даними літератури, катаракту виявляли у 64% дітей, глаукому — у 25%, стрічкоподібну кератопатію — у 59% [74]. Проте у 66% цих дітей гострота зору була нормальною. У табл. 11 представлена частота розвитку ускладнень увеїту у дітей із ЮІА за результатами метааналізу 26 публікацій 1980–2004 рр. [12] та німецького реєстру [44].
|
Ускладнення |
Дані метааналізу |
Дані німецького реєстру |
|
Катаракта |
20,5 |
26 |
|
Глаукома |
18,9 |
8 |
|
Стрічкоподібна кератопатія |
15,7 |
29 |
|
Синехії |
– |
26 |
|
Набряк макули |
– |
6 |
|
Зниження зору |
9,2 |
32 |
Лікування
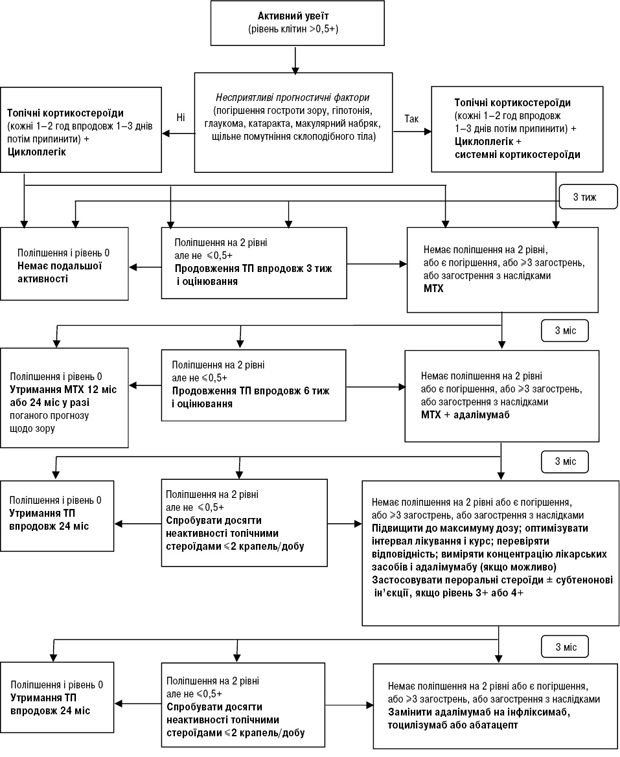
Важливим у лікуванні при увеїті у хворих на ЮІА є раннє виявлення та оцінка активності захворювання. Це потребує ефективної співпраці дитячих ревматологів і офтальмологів. Мета лікування пацієнтів із класичним ЮІА-асоційованим увеїтом —досягнення відсутності клітин у передній камері ока [9, 10]. Модифікований алгоритм представлений на рис. 1 [20], передбачається ескалація лікування залежно від ступеня активності увеїту, наявності несприятливих прогностичних факторів і терапевтичної відповіді на терапію.
Лікування має розпочинатися при увеїті з активністю 0,5+ (1–5 клітин у передній камері ока) [14, 104]. Утворення фібрину у передній камері, наявність преципітатів із набряком рогівки і втрата зору є підставою для початку лікування. Увеїт лікують із урахуванням ступеня запальної активності, ускладнень та факторів ризику втрати зору. За наявності факторів ризику втрати зору, таких як поганий вихідний зір, очна гіпотонія, глаукома, макулярний набряк, помутніння склоподібного тіла, лікування має бути інтенсивним [11, 13, 17, 21, 56–58, 70, 97].
Наявність синехій, стрічкоподібної кератопатії, катаракти чи глаукоми при неактивному увеїті не є показаннями до проведення протизапального лікування. Однак асоціація цих симптомів із персистуючим запаленням свідчить про тяжкість хвороби, яка потребує імуносупресивного лікування. Водночас такі прояви, як макулярний набряк, очна гіпотонія чи почервоніння райдужної оболонки потребують початку інтенсивної терапії навіть за відсутності клітин у передній камері ока, оскільки ці прояви асоційовані із хронічним запаленням у пошкоджених тканинах [42].
Топічні кортикостероїди
Застосування місцевих кортикостероїдів є першим вибором у лікуванні пацієнтів із увеїтом. Більшість клінічних та експериментальних досліджень підтвердили їхню ефективність для контролю за запальним процесом [23, 27, 28, 35, 70]. Перевага місцевих глюкокортикостероїдів полягає в їхній високій проникності у тканини ока та швидкому початку протизапальної дії. Однак слід пам’ятати, що при застосуванні стероїдів у високих дозах можуть розвиватися системні побічні ефекти, особливо при двобічному використанні чи при застосуванні препарату в лікуванні маленьких дітей. В окремих випадках відзначали синдром Кушинга [59, 72].
Зазвичай очні краплі рекомендують застосовувати у гоcтрий період увеїту чи під час загострення хронічного увеїту тривалістю від 1 до 3 днів, щопівгодини або щогодини у денну пору доби. Впродовж наступних тижнів дозу кортикостероїдних крапель поволі знижують із урахуванням ступеня запального процесу. Доза, частота, інтервали і тривалість лікування підбираються індивідуально для кожного пацієнта та залежать від перебігу запального процесу і наявності ускладнень. У гострий період необхідно щоденно застосовувати очні краплі та гелі, а на ніч — аплікувати очні мазі. У гострий період використовують глюкокортикостероїди, зокрема 1% ацетату преднізолону з подальшим зниженням дозування, можна використовувати римексолон або 0,1% флуорометолон чи 0,12% ацетат преднізолону (табл. 12).
асоційованого з ЮІА (кортикостероїди)
|
Лікарські засоби |
Дозування |
Коментар |
|
Топічні |
||
|
Ацетат преднізолону 1% |
1 крапля щогодини |
Висока ефективність, високий ризик глаукоми |
|
Фосфат дексаметазону 0,1% |
1 крапля щогодини |
Висока ефективність, високий ризик глаукоми |
|
Римексолон 1% |
1–5 крапель |
Помірно ефективний |
|
Субкон’юнктивальні ін’єкції чи ін’єкції орбітального дна |
||
|
Фосфат дексаметазону |
2–4 мг |
Ефективний 1–3 дні |
|
Ацетонід тріамцинолону |
20–40 мг |
Ефективний 1–2 міс |
|
Інтравітреальні ін’єкції |
||
|
Ацетонід тріамцинолону |
2–4 мг |
Ефективний 1–2 міс |
|
Системні |
||
|
Пероральна високодозова |
≥1–2 мг/кг маси тіла на добу еквівалентно преднізолону |
При лікуванні тривалістю кілька тижнів із накопиченням дози лікарських засобів завжди можна очікувати відповідних побічних ефектів |
|
Пероральна середньодозова терапія |
0,2 і <1,0 мг/кг маси тіла на добу еквівалентно преднізолону |
При лікуванні тривалістю кілька тижнів із накопиченням дози лікарських засобів завжди можна очікувати відповідних побічних ефектів |
|
Пероральна низькодозова |
≤0,15 мг/кг маси тіла на добу еквівалентно преднізолону |
Нечасто довготривалі побічні ефекти; індивідуальні різні побічні ефекти, рідко уповільнення росту |
|
Внутрішньовенна пульс-терапія |
Стандартно 20–30 мг/кг внутрішньовенно метилпреднізолон (максимум — 1 г/доза) впродовж 1–3 днів |
У періоді ≥4 тиж нижчий довгостроковий ризик розвитку побічних ефектів, ніж для пероральної середньої чи високодозової терапії; можлива поява очної гіпотонії, помутніння склоподібного тіла і набряк макули |
Heiligenhaus A. et al., 2012 [42].
Багатомісячне чи високодозове застосування місцевих кортикостероїдів (>3 аплікацій на добу) підвищує ризик спричинених ними класичних ускладнень. При тяжкому однобічному іридоцикліті зі щільною інфільтрацією склоподібного тіла чи набряком макули можна застосовувати парабульбарні ін’єкції короткодіючого метилпреднізолону (16–32 мг), або дексаметазону (2–4 мг, діє 1–2 дні), або тривалодіючого ацетотоніду тріамцинолону (20–40 мг, діє 3–8 тиж).
Нестероїдні протизапальні препарати
Застосування місцевих та системних нестероїдних протизапальних препаратів (НПЗП) дає можливість стабілізувати лише легкий запальний процес та знизити дозу кортикостероїдів [27, 83, 111]. Тому для лікування у разі загострення увеїту не рекомендоване застосування лише НПЗП. Системні НПЗП мають низьку ефективність порівняно із топічними стероїдами [21, 38, 71]. Застосовувати НПЗП слід лише як ад’ювантну терапію за наявності невеликої кількості клітин у передній камері ока.
Системні кортикостероїди
Системні кортикостероїди не зумовлюють кращого впливу на перебіг іридоцикліту, оскільки топічні кортикостероїди мають хорошу і швидку проникність у тканини ока [19, 21]. Системні кортикостероїди застосовують при щільній інфільтрації склоподібного тіла, гіпотонії чи макулярному набряку. Рекомендована стартова доза становить 1–2 мг/кг маси тіла, яка через 4 тиж має бути на половину знижена. Довенне застосування пульс-терапії кортикостероїдами (наприклад метилпреднізолон 10–30 мг/кг впродовж 3 днів) можна використовувати при тяжкому загостренні увеїту для досягнення швидкого поліпшення [35, 108]. Якщо дитина отримує системні кортикостероїди, слід пам’ятати про ускладнення, які можуть розвинутися: підвищення очного тиску, катаракта, ожиріння, діабет. Доза кортикостероїдів має бути знижена до 0,15 мг/кг через 4 тиж лікування, а тривалість прийому глюкокортикостероїдів не має перевищувати 3 міс [35, 105, 110]. Розвиток внутрішньоочної гіпертензії залежить від дози системних глюкокортикостероїдів, а розвиток катаракти є індивідуальною особливістю організму [35, 105, 110].
Класичні імунодепресанти
Системні імунодепресанти відіграють значну роль у лікуванні дітей з увеїтом. Показаннями до інтенсифікації лікування за допомогою імунодепресантів чи біологічних препаратів є персистенція запального процесу впродовж 12 тиж при застосуванні топічних стероїдів 3 рази на добу або при рецидивуючому перебігу увеїту на тлі застосування системних кортикостероїдів у дозуванні >0,15 мг/кг або поява ускладнень терапії [42]. За сучасними рекомендаціями використання біологічних препаратів перед імунодепресантами недоцільне (табл. 13) [20].
|
Препарат |
Механізм |
Доза і тривалість |
Побічні ефекти |
|
Метотрексат |
Вивільнення клітинного |
10–15 мг/м2 поверхні тіла (або 0,3–0,6 мг/кг маси тіла) перорально чи підшкірно 1 раз на тиждень |
Гастроінтестинальний дискомфорт, нудота, підвищення активності печінкових ферментів |
|
Азатіоприн |
Аналог нуклеозиду пурину, |
1 мг/кг 1 раз на добу, підвищуючи до максимум 3 мг/кг 1 раз на добу |
Гастроінтестинальний дискомфорт, здавлення кісткового мозку, печінкова недостатність |
|
Мікофенолату мофетил |
Інгібітор |
300 мг/м2 2 рази на добу, підвищуючи до 600 мг/м2 2 рази на добу |
Гастроінтестинальний дискомфорт, лейкопенія, випадіння волосся |
|
Циклоспорин |
Інгібітор кальциневрину блокує проліферацію Т-клітин |
2,5–5 мг/кг/добу у двох дозах |
Гастроінтестинальні порушення, артеріальна гіпертензія, дисфункція нирок та печінки, ліпідні порушення |
|
Такролімус |
Інгібітор кальциневрину блокує проліферацію Т-клітин |
50–150 мкг/кг 2 рази на добу |
Гастроінтестинальні порушення, артеріальна гіпертензія, дисфункція нирок та печінки, ліпідні порушення, захворювання крові |
На сьогодні не проведено рандомізованих контрольованих або порівняльних досліджень щодо застосування імунодепресантів/базових препаратів у лікуванні дітей із увеїтом при ЮІА, а чинні у світі рекомендації ґрунтуються на оглядових повідомленнях [42]. У табл. 14 представлені небіологічні імунодепресанти, які застосовують для лікування увеїту у хворих на ЮІА.
|
Ціль |
Препарат |
Клас препарату |
Дозування та курс |
|
ФНП-α |
Етанерцепт |
Розчинний рецептор |
Не рекомендується для лікування увеїту, пов’язаного з ЮІА |
|
Інфліксимаб |
Химерні (миша-людина) моноклональні антитіла |
Спочатку 6 мг/кг внутрішньовенно, потім 3–10 мг/кг, 2-га доза через 2 тиж, а потім — кожні 4–8 тиж залежно від відповіді* |
|
|
Адалімумаб |
Повністю людські моноклональні антитіла |
24 мг/м2 підшкірно кожні 2 тиж |
|
|
На практиці часто 20 мг підшкірно кожні 2 тиж (маса тіла <30 кг), 40 підшкірно кожні 2 тиж (маса тіла ≥30 кг)* |
|||
|
Голімумаб |
Повністю людські моноклональні антитіла |
50 мг підшкірно кожні 4 тиж* |
|
|
Інтерлейкін-6 |
Тоцилізумаб |
Гуманізовані моноклональні антитіла |
10 мг/кг (маса тіла <30 кг), 8 мг/кг (маса тіла >30 кг) внутрішньовенно кожні 4 тиж* |
|
CD80/86 (CTLA4) |
Абатацепт |
Розчинний білок CTLA-4 |
10 мг/кг внутрішньовенно у 0; 2; 4 тиж, потім кожні 4 тиж* |
|
CD20 |
Ритуксимаб |
Химерні (миша-людина) моноклональні антитіла |
375 мг/м2 або 750 мг/м2 внутрішньовенно, дві дози за 2 тиж* |
CTLA-4 — цитотоксичний T-лімфоцитасоційований антиген 4; *в Україні не дозволено.
Ефективністьметотрексату в лікуванні при ЮІА підтверджена багатьма дослідженнями [36]. Позитивний ефект при лікуванні увеїту метотрексатом у хворих на ЮІА підтверджений у численних повідомленнях [15, 16, 33, 44, 61, 66, 82, 90, 109]. Метотрексат — препарат першого вибору після неефективного застосування топічних глюкокортикостероїдів. Показаннями до його призначення є 12-тижневе застосування без поліпшення топічних глюкокортикостероїдів, утримання у передній камері ока кількості клітин, що відповідає активності 0,5+, або необхідність використання топічних глюкокортикостероїдів у кількості >2 крапель/добу, або при прогресуванні запального процесу чи розвитку ускладнень лікування [38, 111]. Найчастіше застосовують метотрексат у дозуванні 15 мг/м2 1 раз на тиждень [32]. Середній час до досягнення індукованої метотрексатом ремісії становив 25,4 міс із середньою тривалістю ремісії 10,3 міс [32]. У систематизованому огляді показано, що поліпшення внутрішньоочного запалення спостерігали у 73% хворих із увеїтом на тлі ЮІА, які отримували метотрексат. У 19,6% пацієнтів виявляли побічні ефекти при застосуванні метотрексату, а саме: шлунково-кишковий дискомфорт, нудоту і підвищення рівня печінкових ферментів [94]. Лікування метотрексатом давало можливість зменшувати потребу у проведенні екстракції катаракти. Така необхідність виникала у близько 29% пацієнтів порівняно з 64% хворих, які ніколи не отримували метотрексат [91].
Серед 22 пацієнтів із увеїтом та ЮІА, які лікувалися метотрексатом, терапію було припинено у зв’язку з досягненням стану неактивного захворювання у 59% хворих із середньою тривалістю неактивної хвороби 1,5 року та загальною тривалістю лікування близько 3,1 року [55]. До факторів, пов’язаних із довшою ремісією увеїту, належать тривалість лікування >3 років, вік >8 років, неактивний увеїт тривалістю >2 років на момент відміни метотрексату. Продовження на один рік тривалості лікування неактивного увеїту перед відміною метотрексату знижує ризику рецидиву на 93%. Тому рекомендовано застосування метотрексату впродовж 12 міс лікування у разі неактивного увеїту, а у пацієнтів із поганим прогнозом щодо зору — впродовж 24 міс [9].
Інші імунодепресанти, такі як мікофенолату мофетил, такролімус, азатіоприн і циклоспорин, для лікування увеїту у хворих на ЮІА застосовують рідше [89, 92] (див. табл. 13). Застосування при увеїті лефлуноміду не знижувало ризику розвитку увеїту у хворих на ЮІА [7]. Комбінації двох імунодепресантів (таких як метотрексат і мікофенолату мофетил) були випробувані у лікуванні хворих із рефрактерним перебігом увеїту. Додавання третього імунодепресанту має обмежену ефективність і пов’язане з підвищенням ризику розвитку інфекційних ускладнень [65]. Серед інших імунодепресантів, які можна застосовувати для лікування увеїту, є циклоспорин А [31, 49, 64, 84, 87, 103,106], азатіоприн [ 2, 7, 25, 32, 43, 55, 63, 65, 79, 88, 89, 91, 93–95], циклофосфамід [3, 39, 77]. Сульфасалазин зменшував кількість загострень у хворих із HLA B27-асоційованим переднім увеїтом у дорослих [5]. Існуючі алгоритми лікування рекомендують призначати біологічний препарат при погіршенні хвороби чи недосягненні нульового рівня клітин у передній камері ока через 3–4 міс лікування метотрексатом [9, 43].
Біологічні препарати
За останнє десятиліття у рандомізованих контрольованих дослідженнях біологічних препаратів підтверджено їхню ефективність у лікуванні артритів у хворих на ЮІА [88]. Біологічні препарати застосовані для лікування увеїту у хворих на ЮІА (табл. 14). Результати когортних і рандомізованих контрольованих досліджень демонструють найвищу ефективність адалімумабу в лікуванні увеїту при ЮІА [79].
На відміну від адалімумабу, застосування етанерцепту в лікуванні пацієнтів із увеїтом при ЮІА не зумовило різниці між його застосуванням і плацебо [98]. Результати метааналізу 229 дітей із ЮІА-асоційованим увеїтом свідчать, що інфліксимаб і адалімумаб мають подібну ефективність і обидва перевершують за ефективністю етанерцепт [93, 95]. В окремих дослідженнях показано, що перехід від одного інгібітора фактора некрозу пухлини (ФНП) до іншого, зокрема від інфліксимабу до адалімумабу, може бути ефективним для контролю за активністю увеїту [25]. Існує досвід ефективного застосування абатацепту, тоцилізумабу і ритуксимабу для лікування увеїту при ЮІА (табл. 15). Тривалість лікування біологічними препаратами не визначена, хоча рекомендують його продовження впродовж 24 міс неактивного увеїту [9].
Сучасні дослідження свідчать про безпеку застосування біологічних препаратів та нечасті побічні ефекти при лікуванні увеїту у хворих на ЮІА. Результати деяких досліджень свідчать про загострення чи появу нового випадку увеїту під час лікування етанерцептом [84, 87, 106]. Дані національних реєстрів свідчать про те, що застосування етанерцепту у хворих на ЮІА пов’язане із частішими епізодами появи увеїту, аніж при терапії адалімумабом або інфліксимабом [64]. Згідно з даними німецького реєстру (n=3467) у пацієнтів із відсутністю увеїту в анамнезі ймовірність його розвитку становила 3,2/1000 людино-років у групі, де проводили терапію метотрексатом, 1,9/1000 людино-років — у групі застосування монотерапії етанерцептом і 0,9/1000 людино-років — у групі, де використовували комбінацію обох препаратів [31].
Циклоплегія
У гострий період увеїту зазвичай використовують циклоплегію для запобігання утворенню синехій. З цією метою застосовують очні краплі тропікаміду або 0,5–1% циклопентолату [9, 40].
Хірургічне лікування
При деяких тяжких ускладненнях увеїту, таких як катаракта і глаукома, може бути потрібне хірургічне лікування. Видалення кришталика шляхом факоемульсифікації є звичайним хірургічним лікуванням при катаракті, яке покращує гостроту зору [3]. З метою уникнення ускладнень після видалення катаракти оперативне втручання необхідно проводити за умови багатомісячного абсолютного контролю запального процесу в оці, що досягається при застосуванні імуносупресантів чи біологічних препаратів. Повний контроль за внутрішньоочним запаленням впродовж принаймні 3 міс до операції пов’язаний із кращими наслідками [39, 77]. У низці випадків для оптимізації результатів лікування необхідна імуносупресивна терапія у до- та післяопераційний час [40]. Хірургічне лікування також може бути необхідним для лікування глаукоми, пов’язаної з увеїтом у хворих на ЮІА, лікування якої не дало відповіді на застосування медикаментозних препаратів [8, 34, 52].
Прогноз
Хронічний передній увеїт, пов’язаний із ЮІА, має потенційні загрози, зумовлені як перебігом хвороби, так і її лікуванням. Систематичний огляд літератури свідчить про несприятливий результат внаслідок втрати зору у 9,2% пацієнтів із увеїтом, а такі ускладнення, як катаракту, глаукому і кератопатію, виявлено відповідно у 20,5; 18,9 і 15,7% хворих на ЮІА з увеїтом [12].
Декілька досліджень представили відтерміновані наслідки увеїту у 55 пацієнтів із ЮІА у 1973–1982 рр. [96]. Через 7 років після початку увеїту у 42% хворих діагностовано катаракту, у 5% — глаукому. Через 24 роки у 51% хворих розвинулася катаракта, у 22% — глаукома, а у 49% хворих залишилися прояви активного увеїту та потреба у застосуванні топічних глюкокортикоїдів для запобігання подальшому загостренню увеїту.
Ідентифіковано деякі фактори, пов’язані з тяжчим перебігом увеїту і ризиком розвитку ускладнень [5, 18, 29]. До факторів ризику несприятливого прогнозу належать: чоловіча стать, молодший вік початку увеїту; короткий період між початком артриту й розвитком увеїту та наявність синехій при першій діагностиці увеїту [54]. Показано, що коротший період між початком артриту й увеїтом є основним показником тяжкості перебігу увеїту [112].
Є припущення, що ризик розвитку увеїту у хворих на ЮІА і частота розвитку ускладнень із плином часу знижуються [101]. Доведено, що раннє застосування метотрексату, тобто впродовж першого року перебігу ЮІА, пов’язане зі зниженим ризиком розвитку увеїту порівняно з пізнім застосуванням метотрексату (4,8% проти 8,5% відповідно) [102].
Майбутні дослідження
Краще розуміння патогенезу увеїту у хворих на ЮІА зможе допомогти визначати біомаркери чи генетичні фактори, які дозволять проводити стратифікацію пацієнтів на групи ризику щодо розвитку увеїту. Це дасть можливість верифікувати пацієнтів, які потребують раннього і більш агресивного лікування. Удосконалення методів лікування полягає в ефективній трансляції новітніх досліджень у практичну діяльність [62], а для цього необхідні доказові дослідження новітніх препаратів у популяції дітей із ЮІА-асоційованим увеїтом. На сьогодні вже завершилося рандомізоване плацебо-контрольоване багатоцентрове дослідження SYCAMORE щодо застосування адалімумабу при увеїті, асоційованому з ЮІА [78, 79]. Інше велике дослідження завершується у Франції [76]. У Великобританії розпочинається дослідження APTITUDE з визначення ефективності тоцилізумабу із підшкірним введенням у пацієнтів з увеїтом, рефрактерним до терапії інгібіторами ФНП [1]. Заплановані інші невеликі дослідження з вивчення ефективності тоцилізумабу і абатацепту у хворих на ЮІА-асоційований увеїт [99, 100].
Висновки
Увеїт у дітей із ЮІА — найчастіший позасуглобовий прояв ЮІА, який може загрожувати втратою зору для хворого. Тісна співпраця між дитячими ревматологами і офтальмологами, регулярний скринінг із використанням щілинної лампи мають важливе значення для ранньої діагностики увеїту у хворих на ЮІА. Раннє застосування системної імуносупресії дає можливість контролювати внутрішньоочне запалення і запобігти побічним ефектам, пов’язаним із використанням глюкокортикостероїдів. У хворих на увеїт, резистентних до терапії метотрексатом, успішно застосовують біологічні препарати. Подальші дослідження з вивчення ефективності адалімумабу і тоцилізумабу допоможуть визначитися щодо ефективності та безпеки застосування цих препаратів у лікуванні увеїту у дітей із ЮІА. Розуміння імунопатогенезу та ідентифікації прогностичних біомаркерів як предикторів терапевтичної відповіді є ключовим завданням у найближчі роки.
Список використаної літератури
- A phase II trial of tocilizumab in anti-TNF refractory patients with JIA associated uveitis (APTITUDE study) [Internet]. BioMed Central, 2015 [cited 22 Dec 2015]. Available from: http://www.isrctn.com/ISRCTN95363507.
- Amin R.M., Miserocchi E., Thorne J.E.et al. (2016) Treatment options for juvenile idiopathic arthritis (JIA) associated uveitis. Ocul. Immunol. Inflamm., 24(1): 81–90.
- Angeles-Han S., Yeh S. (2012) Prevention and management of cataracts in children with juvenile idiopathic arthritis-associated uveitis. Curr. Rheumatol. Rep., 14(2): 142–149.
- Angeles-Han S.T., Pelajo C.F., Vogler L.B. et al. (2013) Risk markers of juvenile idiopathic arthritis-associated uveitis in the Childhood Arthritis and Rheumatology Research Alliance (CARRA) Registry. J. Rheumatol., 40(12): 2088–2096.
- Angeles-Han S.T., Yeh S., Vogler L.B. (2013) Updates on the risk markers and outcomes of severe juvenile idiopathic arthritis-associated uveitis. Int. J. Clin. Rheumtol., 8(1): 109–121.
- BenEzra D., Cohen E., Maftzir G. (2005) Uveitis in children and adolescents. Br. J. Ophthalmol., 89(4): 444–448.
- Bichler J., Benseler S.M., Krumrey-Langkammerer M. et al. (2015) Leflunomide is associated with a higher flare rate compared to methotrexate in the treatment of chronic uveitis in juvenile idiopathic arthritis. Scand. J. Rheumatol., 44(4): 280–283.
- Bohnsack B.L., Freedman S.F. (2013) Surgical outcomes in childhood uveitic glaucoma. Am. J. Ophthalmol., 155(1): 134–142.
- Bou R., Adan A., Borras F. et al. (2015) Clinical management algorithm of uveitis associated with juvenile idiopathic arthritis: interdisciplinary panel consensus. Rheumatol. Int., 35(5): 777–785.
- British Society for Paediatric and Adolescent Rheumatology, Royal College of Ophthalmology (2006) Guidelines for screening for Uveitis in Juvenile idiopathic arthritis.
- Cabral D.A., Petty R.E., Malleson P.N. et al. (1994) Visual prognosis in children with chronic anterior uveitis and arthritis. J. Rheumatol., 21: 2370–2375.
- Carvounis P.E., Herman D.C., Cha S., Burke J.P. (2006) Incidence and outcomes of uveitis in juvenile rheumatoid arthritis, a synthesis of the literature. Graef. Arch. Clin. Exp. Ophthalmol., 244(3): 281–290.
- Carvounis P.E., El Barr M.A., Albini T.A., Holz E.R. (2006) Effects of intravitreous injection of preserved and nonpreserved triamcinolone in rabbit retina. Arch. Ophthalmol., 124(11).
- Cassidy J., Kivlin J., Lindsley C., Nocton J.; The Section on Rheumatology and the Section on Ophthalmology (2006) Ophthalmic examinations in children with juvenile rheumatoid arthritis. Pediatrics, 117: 1843–1845.
- Chan A.Y., Liu D.T. (2006) Methotrexate and chronic uveitis associated with juvenile idiopathic arthritis. J. Rheumatol., 33: 198.
- Chan E.S., Cronstein B.N. (2010) Methotrexate — how does it really work? Nat. Rev. Rheumatol., 6(3): 175–178.
- Chia A., Lee V., Graham E.M. et al. (2003) Factors related to severe uveitis at diagnosis in children with juvenile idiopathic arthritis in a screening program. Am. J. Ophthalmol., 35: 757–762.
- Chia A., Lee V., Graham E.M., Edelsten C. (2003) Factors related to severe uveitis at diagnosis in children with juvenile idiopathic arthritis in a screening program. Am. J. Ophthalmol., 135(6): 757–762.
- Chylack L.T.Jr., Bienfang D.C., Bellows A.R., Stillman J.S. (1975) Ocular manifestations of juvenile rheumatoid arthritis. Am. J. Ophthalmol., 79: 1026–1033.
- Clarke S.L.N., Sen E.S., Ramanan A.V. (2016) Juvenile idiopathic arthritis-associated uveitis.Pediatric. Rheumatology, 14: 27.
- Dana M.R., Merayo-Lloves J., Schaumberg D.A., Foster C.S. (1997)Visual outcomes prognosticators in juvenile rheumatoid arthritis-associated uveitis. Ophthalmology, 104: 236–244.
- Davies K., Cleary G., Foster H. et al.; British Society of Paediatric and Adolescent Rheumatology (2010) BSPAR standards of care for children and young people with juvenile idiopathic arthritis. Rheumatology, 49(7): 1406–1408.
- Davis J.L., Davis J.L., Dacanay L.M. et al. (2003) Laser flare photometry and complications of chronic uveitis in children. Am. J. Ophthalmol., 135: 763–771.
- de Boer J., Wulffraat N., Rothova A. (2003) Visual loss in uveitis of childhood. Br. J. Ophthalmol., 87(7): 879–884.
- Dhingra N., Morgan J., Dick A.D. (2009) Switching biologic agents for uveitis. Eye (Lond.), 23(9): 1868–1870.
- Du L., Kijlstra A., Yang P. (2009) Immune response genes in uveitis. Ocul. Immunol. Inflamm., 17(4): 249–256.
- Dunne J.A., Jacobs N., Morrison A., Gilbert D.J. (1985) Efficacy in anterior uveitis of two known steroids and topical tolmetin. Br. J. Ophthalmol., 69: 120–125.
- Dunne J.A., Travers J.P. (1979) Double-blind clinical trial of topical steroids in anterior uveitis. Br. J. Ophthalmol., 63: 762–767.
- Edelsten C., Lee V., Bentley C.R. et al. (2002) An evaluation of baseline risk factors predicting severity in juvenile idiopathic arthritis associated uveitis and other chronic anterior uveitis in early childhood. Br. J. Ophthalmol., 86(1): 51–56.
- Edelsten C., Reddy M.A., Stanford M.R., Graham E.M. (2003) Visual loss associated with pediatric uveitis in english primary and referral centers. Am. J. Ophthalmol., 135(5): 676–680.
- Foeldvari I., Becker I., Horneff G. (2015) Uveitis events during adalimumab, etanercept, and methotrexate therapy in juvenile idiopathic arthritis: data from the biologics in pediatric rheumatology registry. Arthritis Care Res., 67(11): 1529–1535.
- Foeldvari I., Wierk A. (2005) Methotrexate is an effective treatment for chronic uveitis associated with juvenile idiopathic arthritis. J. Rheumatol., 32(2): 362–365.
- Foeldvari I., Wierk A. (2005) Methotrexate is an effective treatment for chronic uveitis associated with juvenile idiopathic arthritis. J. Rheumatol., 32: 362–365.
- Freedman S.F., Rodriguez-Rosa R.E., Rojas M.C., Enyedi L.B. (2002) Goniotomy for glaucoma secondary to chronic childhood uveitis. Am. J. Ophthalmol., 133(5): 617–621.
- Gaudio P.A. (2004) A review of evidence guiding the use of corticosteroids in the treatment of intraocular inflammation. Ocul. Immunol. Inflamm., 12: 169–192.
- Giannini E.H., Brewer E.J., Kuzmina N. et al. (1992) Methotrexate in resistant juvenile rheumatoid arthritis. Results of the U.S.A.—U.S.S.R. double-blind, placebo-controlled trial. The Pediatric Rheumatology Collaborative Study Group and The Cooperative Children’s Study Group. N. Engl. J. Med., 326: 1043–1049.
- Giannini E.H., Malagon C.N., van Kerckhove C. et al. (1991) Longitudinal analysis of HLA associated risks for iridocyclitis in juvenile rheumatoid arthritis. J. Rheumatol., 18(9): 1394–1397.
- Giordano M. (1983) Dauerprophylaxe der rezidivierenden spondylitischen Iridozyklitis durch Antimalarika und nichtsteroidale Antiphogistika. Z. Rheumatol., 41: 105–106.
- Grajewski R.S., Zurek-Imhoff B., Roesel M. et al. (2012) Favourable outcome after cataract surgery with IOL implantation in uveitis associated with juvenile idiopathic arthritis. Acta Ophthalmol., 90(7): 657–662.
- Hawkins M.J., Dick A.D., Lee R.J. et al. (2016) Managing juvenile idiopathic arthritis-associated uveitis. Surv. Ophthalmol., 61(2): 197–210.
- Heiligenhaus A., Heinz C., Edelsten C. et al. (2013) Review for disease of the year: epidemiology of juvenile idiopathic arthritis and its associated uveitis: the probable risk factors. Ocul. Immunol. Inflamm., 21(3): 180–191.
- Heiligenhaus A., Michels H., Schumacher C. et al. (2012) Evidence-based, interdisciplinary guidelines for anti-inflammatory treatment of uveitis associated with juvenile idiopathic arthritis. Rheumatol. Int., 32(5): 1121–1133.
- Heiligenhaus A., Minden K., Foll D., Pleyer U. (2015) Uveitis in juvenile idiopathic arthritis. Dtsch. Arztebl. Int., 112(6): 92–100.
- Heiligenhaus A., Mingels A., Heinz C., Ganser G. (2007) Methotrexate for uveitis associated with juvenile idiopathic arthritis: value and requirement for additional anti-inflammatory medication. Eur. J. Ophthalmol., 17: 743–748.
- Heinz C., Schumacher C., Roesel M., Heiligenhaus A. (2012) Elevated intraocular pressure in uveitis associated with juvenile idiopathic arthritis-associated uveitis, often detected after achieving inactivity. Br. J. Ophthalmol., 96(1): 140–141.
- Hoeve M., Kalinina Ayuso V., Schalij-Delfos N.E. et al. (2012) The clinical course of juvenile idiopathic arthritis-associated uveitis in childhood and puberty. Br. J. Ophthalmol., 96(6): 852–856.
- Holland G.N., Stiehm E.R. (2003) Special considerations in the evaluation and management of uveitis in children. Am. J. Ophthalmol., 135(6): 867–878.
- Horneff G. (2009) Uveitis bei entzündlich-rheumatischen Erkrankungen im Kindes- und Jugendalter. In: Gerd Horneff. Juvenile idiopathische Arthritis [Gebundene Ausgabe] UNI-MED; Auflage: 1 (1. Mai 2009): 109–120 (144 Seiten).
- Horneff G. (2015) Safety of biologic therapies for the treatment of juvenile idiopathic arthritis. Expert. Opi.n Drug Saf., 14(7): 1111–1126.
- Jabs D.A., Nussenblatt R.B., Rosenbaum J.T.; Standardization of Uveitis Nomenclature (SUN) Working Group (2005) Standardization of uveitis nomenclature for reporting clinical data. Results of the First International Workshop. Am. J. Ophthalmol., 140(3): 509–516.
- Julián K., Terrada C., Quartier P. et al. (2010) Uveitis related to juvenile idiopathic arthritis: familial cases and possible genetic implication in the pathogenesis. Ocul. Immunol. Inflam., 18(3): 172–177.
- Kafkala C., Hynes A., Choi J. et al. (2005) Ahmed valve implantation for uncontrolled pediatric uveitic glaucoma. J. AAPOS, 9(4): 336–340.
- Kalinina Ayuso V., Makhotkina N., van Tent-Hoeve M. et al. (2014) Pathogenesis of juvenile idiopathic arthritis associated uveitis: the known and unknown. Surv. Ophthalmol., 59(5): 517–531.
- Kalinina Ayuso V., Ten Cate H.A., van der Does P. et al. (2010) Male gender and poor visual outcome in uveitis associated with juvenile idiopathic arthritis. Am. J. Ophthalmol., 149(6): 987–993.
- Kalinina Ayuso V., van de Winkel E.L., Rothova A., de Boer J.H. (2011) Relapse rate of uveitis post-methotrexate treatment in juvenile idiopathic arthritis. Am. J. Ophthalmol., 151(2): 217–222.
- Kanski J.J. (1977) Anterior uveitis in juvenile rheumatoid arthritis. Arch. Ophthalmol., 95: 1794–1797.
- Kanski J.J. (1990) Juvenile arthritis and uveitis. Surv. Ophthalmol., 34: 253–267.
- Kotaniemi K., Aho K., Kotaniemi A. (2001) Uveitis as a cause of visual loss in arthritides and comparable conditions. J. Rheumatol., 28: 309–312.
- Kroger L., Kotaniemi K., Jaaskelainen J. (2009) Topical treatment of uveitis resulting in adrenal insufficiency. Acta Paediatr., 98: 584–585.
- Kump L.I., Cervantes-Castañeda R.A., Androudi S.N., Foster C.S. (2005) Analysis of pediatric uveitis cases at a tertiary referral center. Ophthalmology, 112(7): 1287–1292.
- Lazar M., Weiner M.J., Leopold I.H. (1969) Treatment of uveitis with methotrexate. Am. J. Ophthalmol., 67: 383–387.
- Lee R.W., Nicholson L.B., Sen H.N. et al. (2014) Autoimmune and autoinflammatory mechanisms in uveitis. Semin. Immunopathol., 36(5): 581–594.
- Lerman M.A., Lewen M.D., Kempen J.H., Mills M.D. (2015) Uveitis reactivation in children treated with tumor necrosis factor alpha inhibitors. Am. J. Ophthalmol., 160(1): 193–200.
- Lim L.L., Fraunfelder F.W., Rosenbaum J.T. (2007) Do tumor necrosis factor inhibitors cause uveitis? A registry-based study. Arthritis Rheum., 56(10): 3248–3252.
- Little J.A., Sen E.S., Strike H. (2014) The safety and efficacy of noncorticosteroid triple immunosuppressive therapy in the treatment of refractory chronic noninfectious uveitis in childhood. J. Rheumatol., 41(1): 136–139.
- Malik A.R., Pavesio C. (2005) The use of low dose methotrexate in children with chronic anterior and intermediate uveitis. Br. J. Ophthalmol., 89: 806–808.
- Melin-Aldana H., Giannini E.H., Taylor J. et al. (1992) Human leukocyte antigen-DRB1*1104 in the chronic iridocyclitis of pauciarticular juvenile rheumatoid arthritis. J. Pediatr., 121(1): 56–60.
- Minden K., Mingels A., Niewerth M., Heiligenhaus A. (2007) Juvenile idiopatische Arthritis und Uveitis: Epidemiologie einschliesslichder Daten aus Kerndokumentation. Klein. Monatsbl. Augenhilk., 224: 469–472.
- Moradi A., Amin R.M., Thorne J.E. (2014) The role of gender in juvenile idiopathic arthritis-associated uveitis. J. Ophthalmol., 2014: 461078.
- Nussenblatt R.B., Palestine A.G., Chan C.C., Roberge F. (1985) Standardization of vitreal inflammatory activity in intermediate and posterior uveitis. Ophthalmology, 1992: 467–471.
- Olson N.Y., Lindsley C.B., Godfrey W.A. (1988) Nonsteroidal antiinflammatory drug therapy in chronic childhood iridocyclitis. Am. J. Dis. Child., 142: 1289–1292.
- Ozerdem U., Levi L., Cheng L. et al. (2000) Systemic toxicity of topical and periocular corticosteroid therapy in an 11-year-old male with posterior uveitis. Am. J. Ophthalmol., 130: 240–241.
- Paivonsalo-Hietanen T., Tuominen J., Saari K.M. (2000) Uveitis in children: population-based study in Finland. Acta Ophthalmol. Scand., 78(1): 84–88.
- Petty R.E., Rosenbaum J.T. (2016) Uveitis in juvenile idiopathic arthritis. In: Petty R.E., Laxer R.M., Lindsley C.B., Wedderburn L.R. Textbook of pediatric rheumatology. 7th edn., Elsevier, p. 305–314.
- Qian Y., Acharya N.R. (2010) Juvenile idiopathic arthritis-associated uveitis. Curr. Opin. Ophthalmol., 21(6): 468–472.
- Quartier P. (2015) Evaluation of the efficacy of adalimumab for the treatment of uveitis in juvenile idiopathic arthritis: randomized double-blind placebo-controlled trial. ClinicalTrials.gov [Internet]. Bethesda: National Library of Medicine (US), 2015. Available from: http://www.clinicaltrials.gov/show/NCT01385826. Accessed 4 Jan 2016.
- Quiñones K., Cervantes-Castañeda R.A., Hynes A.Y. et al. (2009) Outcomes of cataract surgery in children with chronic uveitis. J. Cataract. Refract. Surg., 35(4): 725–731.
- Ramanan A.V., Dick A.D., Benton D. et al. (2014) A randomised controlled trial of the clinical effectiveness, safety and cost-effectiveness of adalimumab in combination with methotrexate for the treatment of juvenile idiopathic arthritis associated uveitis (SYCAMORE Trial). Trials., 15: 14.
- Ramanan A.V., Dick A.D., McKay A. et al. (2015) A randomised controlled trial of the clinical effectiveness, safety and cost-effectiveness of adalimumab in combination with Methotrexate for the treatment of juvenile idiopathic arthritis associated uveitis [abstract]. Arthritis. Rheumatol., 67(Suppl. 10): 3931–3933.
- Rosenberg A.M. (1987) Uveitis associated with juvenile rheumatoid arthritis. Semin. Arthritis. Rheum., 16(3): 158–173.
- Sabri K., Saurenmann R.K., Silverman E.D., Levin A.V. (2008) Course, complications, and outcome of juvenile arthritis-related uveitis. J. AAPOS, 12(6): 539–545.
- Samson C.M., Waheed N., Baltatzis S., Foster C.S. (2001) Methotrexate therapy for chronic noninfectious uveitis: analysis of a case series of 160 patients. Ophthalmology, 108: 1134–1139.
- Sand B.B., Krogh E. (1991) Topical indometacin, a prostaglandin inhibitor, in acute anterior uveitis. A controlled clinical trial of non-steroid versus steroid anti-inflammatory treatment. Acta Ophthalmol. (Copenh), 69: 145–148.
- Saurenmann R.K., Levin A.V., Feldman B.M. et al. (2006) Risk of new-onset uveitis in patients with juvenile idiopathic arthritis treated with anti-TNF-alpha agents. J. Pediatr., 149(6): 833–836.
- Saurenmann R.K., Levin A.V., Feldman B.M. et al. (2007) Prevalence, risk factors, and outcome of uveitis in juvenile idiopathic arthritis: a long-term followup study. Arthritis Rheum., 56(2): 647–657.
- Saurenmann R.K., Rose J.B., Tyrrell P. et al. (2007) Epidemiology of juvenile idiopathic arthritis in a multiethnic cohort: ethnicity as a risk factor. Arthritis Rheum., 56(6): 1974–1984.
- Schmeling H., Horneff G. (2005) Etanercept and uveitis in patients with juvenile idiopathic arthritis. Rheumatology, 44(8): 1008–1011.
- Sen E.S., Ramanan A.V. (2014) New age of biological therapies in paediatric rheumatology. Arch. Dis. Child., 99(7): 679–685.
- Sharma S.M., Dick A.D., Ramanan A.V. (2009) Non-infectious pediatric uveitis: an update on immunomodulatory management. Paediatr. Drugs, 11(4): 229–241.
- Shetty A.K., Zganjar B.E., Ellis G.S.Jr. et al. (1999) Low-dose methotrexate in the treatment of severe juvenile rheumatoid arthritis and sarcoid iritis. J. Pediatr. Ophthalmol. Strabismus, 36: 125–128.
- Sijssens K.M., Rothova A., van De Vijver D.A. et al. (2007) Risk factors for the development of cataract requiring surgery in uveitis associated with juvenile idiopathic arthritis. Am. J. Ophthalmol., 144(4): 574–579.
- Simonini G., Cantarini L., Bresci C. et al. (2010) Current therapeutic approaches to autoimmune chronic uveitis in children. Autoimmun. Rev., 9(10): 674–683.
- Simonini G., Druce K., Cimaz R. et al. (2014) Current evidence of anti-tumor necrosis factor α treatment efficacy in childhood chronic uveitis: a systematic review and meta-analysis approach of individual drugs. Arthritis Care Res., 66(7): 1073–1084.
- Simonini G., Paudyal P., Jones G.T. et al. (2013) Current evidence of methotrexate efficacy in childhood chronic uveitis: a systematic review and meta-analysis approach. Rheumatology, 52(5): 825–831.
- Simonini G., Taddio A., Cattalini M. et al. (2011) Prevention of flare recurrences in childhood-refractory chronic uveitis: an open-label comparative study of adalimumab versus infliximab. Arthritis Care Res., 63(4): 612–618.
- Skarin A., Elborgh R., Edlund E., Bengtsson-Stigmar E. (2009) Long-term follow-up of patients with uveitis associated with juvenile idiopathic arthritis: a cohort study. Ocul. Immunol. Inflamm., 17(2): 104–108.
- Smith J.A., Mackensen F., Sen H.N. et al. (2009) Epidemiology and course of disease in childhood uveitis. Ophthalmology, 116: 1544–1551.
- Smith J.A., Thompson D.J., Whitcup S.M. et al. (2005) A randomized, placebo-controlled, double-masked clinical trial of etanercept for the treatment of uveitis associated with juvenile idiopathic arthritis. Arthritis Rheum., 53(1): 18–23.
- Suhler E.B. (2015) An open-label trial to assess the efficacy and safety of Tocilizumab in the management of juvenile idiopathic arthritis associated vision-threatening uveitis that is refractory to other modes of systemic immunosuppression. ClinicalTrials.gov [Internet]. Bethesda: National Library of Medicine (US), 2015. Available from: http://www.clinicaltrials.gov/show/NCT01603355. Accessed 4 Jan 2016.
- Suhler E.B. (2015) An openlabel, phase II trial of Abatacept (Orencia) in the treatment of refractory non-infectious uveitis. ClinicalTrials.gov [Internet]. Bethesda: National Library of Medicine (US), 2015. Available from: http://www.clinicaltrials.gov/show/NCT01279954. Accessed 4 Jan 2016.
- Tappeiner C., Klotsche J., Schenck S. et al. (2015) Temporal change in prevalence and complications of uveitis associated with juvenile idiopathic arthritis:data from a cross-sectional analysis of a prospective nationwide study. Clin. Exp. Rheumatol., 33(6): 936–944.
- Tappeiner C., Schenck S., Niewerth M. et al. (2016) Impact of anti-inflammatory treatment on the onset of uveitis in juvenile idiopathic arthritis: Longitudinal analysis from a nation-wide paediatric rheumatological database. Arthritis Care Res., 68(1): 46–54.
- Tarkiainen M., Tynjala P., Vahasalo P., Lahdenne P. (2015) Occurrence of adverse events in patients with JIA receiving biologic agents: long-term follow-up in a real-life setting. Rheumatology, 54(7): 1170–1176.
- Thorne J.E., Woreta F., Kedhar S.R. et al. (2007) Juvenile idiopathic arthritis-associated uveitis: incidence of ocular complications and visual acuity loss. Am. J. Ophthalmol., 143: 840–846.
- Thurau S.R., Frosch M., Zierhut M. et al. (2007) Topical and systemic corticosteroid therapy for uveitis in childhood. Klin. Monatsbl. Augenheilkd., 224: 516–519.
- Tynjälä P., Lindahl P., Honkanen V. et al. (2007) Infliximab and etanercept in the treatment of chronic uveitis associated with refractory juvenile idiopathic arthritis. Ann. Rheum. Dis., 66(4): 548–550.
- Vastert S.J., Bhat P., Goldstein D.A. (2014) Pathophysiology of JIA-associated uveitis. Ocul. Immunol. Inflamm., 22(5): 414–423.
- Wakefield D., McCluskey P., Penny R. (1986) Intravenous pulse methylprednisolone therapy in severe inflammatory eye disease. Arch. Ophthalmol., 104: 847–851.
- Weiss A.H., Wallace C.A., Sherry D.D. (1998) Methotrexate for resistant chronic uveitis in children with juvenile rheumatoid arthritis. J. Pediatr., 133: 266–268.
- Wolf M.D., Lichter P.R., Ragsdale C.G. (1987) Prognostic factors in the uveitis of juvenile rheumatoid arthritis. Ophthalmology, 94: 1242–1248.
- Young B.J., Cunningham W.F., Akingbehin T. (1982) Doublemasked controlled clinical trial of 5% tolmetin versus 0.5% prednisolone versus 0.9% saline in acute endogenous nongranulomatous anterior uveitis. Br. J. Ophthalmol., 66: 389–391.
- Zannin M.E., Buscain I., Vittadello F. et al. (2012) Timing of uveitis onset in oligoarticular juvenile idiopathic arthritis (JIA) is the main predictor of severe course uveitis. Acta Ophthalmol., 90(1): 91–95.
Увеит у больных ювенильным идиопатическим артритом
Резюме. Увеит — наиболее частое внесуставное осложнение у больных ювенильным идиопатическим артритом. Тяжесть болезни зависит от степени активности воспалительного процесса на момент установления диагноза, наличия осложнений и от возможности получения терапевтического ответа на существующие методы лечения. Несвоевременное диагностирование увеита приводит к осложнениям, связанным со снижением остроты зрения, поэтому так важны раннее диагностирование и своевременное лечение этого заболевания. В данный момент продолжаются активные исследования новейших методов лечения при увеите у больных ювенильным идиопатическим артритом детей.
увеит, ювенильный идиопатический артрит, диагностика, лечение.
Бойко Ярина Євгенівна
79035, Львів, вул. Дністерська, 27
Комунальний заклад Львівської обласної ради «Західноукраїнський спеціалізований дитячий медичний центр»
Е-mail: jboyko@ukr.net

Leave a comment