Досвід застосування монотерапії тоцилізумабом і метилпреднізолоном у хворих на ревматоїдний артрит (клінічні випадки)
Шуба Н.М.1, Воронова Т.Д.1, Сугак О.И.2
- 1Національна медична академія післядипломної освіти ім. П.Л.Шупика
- 27-я Клиническая больница г. Киева
Резюме. Резюме. У статті розглянуто показання для призначення біологічних агентів, зокрема тоцілізумабу, з попереднім застосуванням метилпреднізолону. Спочатку у вигляді міні-пульс-терапії, потім — перорально з подальшим зниженням дози метилпреднізолону при настанні ефективності монотерапії тоцілізумабом, що дозволило досягти тривалої та стійкої ремісії ревматоїдного артриту.
Ревматоидный артрит (РА) — аутоиммунное заболевание с неизвестной этиологией, для которого характерно наличие симметричного эрозивного артрита (синовит) и широкий спектр внесуставных (системных) проявлений. Распространенность РА составляет около 1% населения в мире, а экономические затраты от РА можно сопоставить с таковыми от ишемической болезни сердца. Через 5 лет от начала заболевания, несмотря на лечение синтетическими базисными препаратами (sDMARD), 16% пациентов теряют трудоспособность, а через 20 лет — 90%, треть из которых становятся полными инвалидами (Krishnan E. et al., 2012). В Украине насчитывается более 118 тыс. больных РА, среди них около 54 тыс. — трудоспособного возраста и находятся на диспансерном учете (Концепція Державної цільової програми лікування хворих на ревматоїдний артрит на 2011–2015 роки).
В исследовании J.J. Anderson и соавторов (2000) с участием 1435 больных выявлено, что раннее установление диагноза (ранний РА — до 6 мес) и раннее лечение приводят к более благоприятному течению заболевания.
Классификация РА по длительности заболевания ACR, (2008)
- Очень ранний — до 3 мес
- Ранний — до 6 мес
- Средней длительности — 6–24 мес
- Длительный — >24 мес
Маркеры воспаления и тяжести течения РА и классификационные критерии РА ACR/EULAR (2010) — в табл. 1 и 2.
| Маркер | Комментарии |
|---|---|
| С-реактивный белок (СРБ) | Уровень СРБ изменяется с изменением активности течения заболевания. Повышение СРБ коррелирует с эрозивными процессами в костях |
| Скорость оседания эритроцитов (СОЭ) | Неспецифический маркер воспаления. Повышение СОЭ часто связано с эрозивными процессами в костях |
| Ревматоидный фактор (РФ) | Иммуноглобулины (Ig) всех изотипов, активных относительно частицы Fc молекулы IgG. Диагностируют у 75% пациентов. Чаще измеряют IgM-РФ. Высокие титры РФ относительно специфические для РА и являются предвестниками эрозивных процессов, плохого функционального исхода, возникновения васкулита и других экстраартикулярных симптомов |
| Антитела к циклическому цитруллинированному пептиду (АЦЦП) | Могут быть полезны в ранней диагностике с низкими титрами РФ. Определяют у 80% РФ-позитивных пациентов. Связаны с костными эрозиями |
| КОЛИЧЕСТВО ВОВЛЕЧЕННЫХ СУСТАВОВ (0–5) | |
|---|---|
| 1 крупный сустав | 0 |
| 2–10 крупных суставов | 1 |
| 1–3 мелких сустава (крупные суставы не учитываются) | 2 |
| 4–10 мелких суставов (крупные суставы не учитываются) | 3 |
| >10 суставов (по крайней мере 1 мелкий) | 5 |
| СЕРОЛОГИЯ (0–3) | |
| Отрицательный РФ и отрицательный к АЦЦП | 0 |
| Слабо + РФ или слабо + АЦЦП | 2 |
| Резко + РФ или резко + АЦЦП | 3 |
| ПРОДОЛЖИТЕЛЬНОСТЬ СИМПТОМОВ (0–1) | |
| <6 нед | 0 |
| ≥6 нед | 1 |
| ОСТРОФАЗОВЫЕ ПОКАЗАТЕЛИ (0–1) | |
| Нормальный CРБ и нормальная СОЭ | 0 |
| Положительный CРБ и повышение СОЭ | 1 |
≥6 верифицированный РА
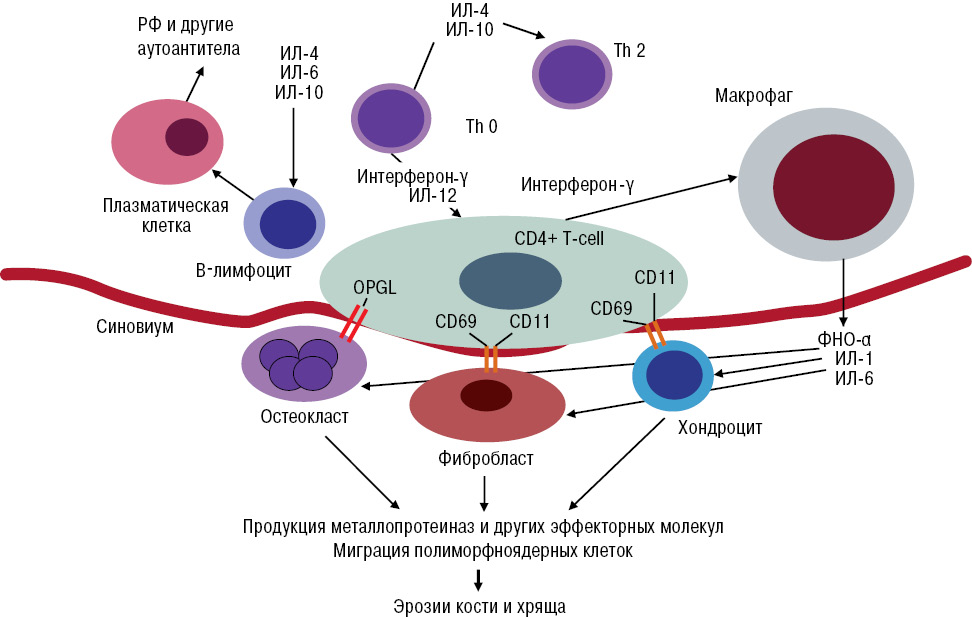
Рис. 1. Патогенез РА
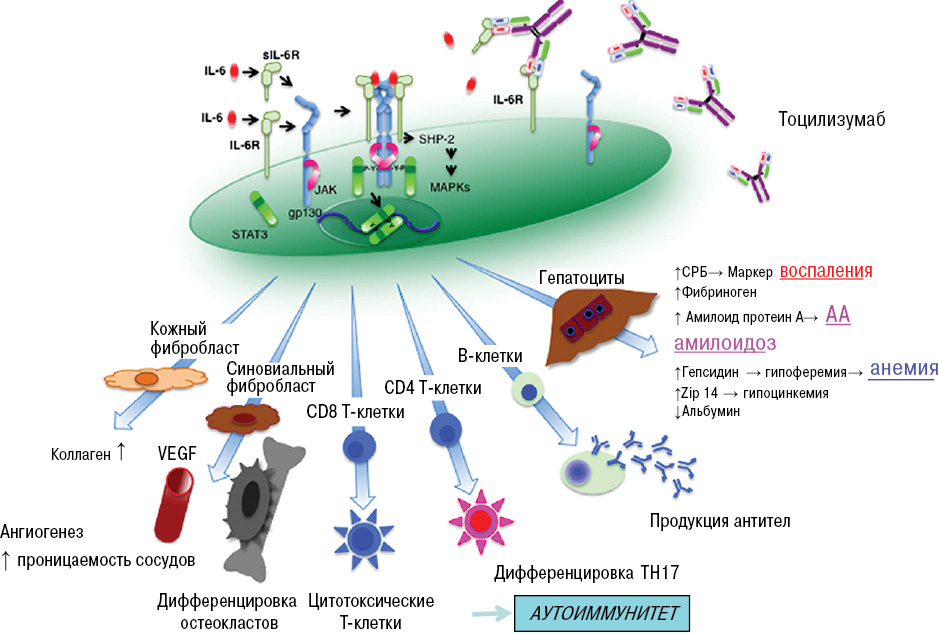
Рис. 2. Плейотропные эффекты ИЛ-6
Как видно из рис. 1, в патогенезе РА играют роль как клеточная цитотоксичность, за счет цитокинов: фактора некроза опухоли (ФНО)-α, интерлейкина (ИЛ)-1, ИЛ-6, так и гуморальный иммунный ответ, за счет ИЛ-4, -6, -10, то есть ИЛ-6 в развитии РА участвует как в клеточном, так и в гуморальном иммунном ответе (Olsen N.J. et al., 2014). В связи с чем можно предположить, что его блокирование может привести к более существенному снижению активности и прогрессирования заболевания.
На рис. 2 убедительно показано влияние ИЛ-6 на реагенты воспаления: СРБ и фибриноген (увеличение их) и увеличение синтеза амилоида АА, гепсидина, что приводит к развитию анемии, увеличение синтеза аутоантител, развитие остеопороза, развитие ангиогенеза за счет увеличения сосудистого эндотелиального фактора роста, коллагенообразования — за счет повышения синтеза фибробластов и др. Поэтому в настоящее время ингибиторам ИЛ-6 в лечении РА уделяется большое внимание.
Повышение уровня в сыворотке крови ИЛ-6 и растворимых рецепторов ИЛ-6 коррелирует с активностью процесса при РА. Успешное лечение тоцилизумабом (блокатор рецепторов к ИЛ-6) РА способствовало развитию исследований новых биологических агентов, нацеленных на ИЛ-6 и ИЛ-6R. Проведение сравнительных исследований по эффективности новых биологических агентов, нацеленных на ИЛ-6 и ИЛ-6R, с тоцилизумабом показало аналогичный клинический эффект по АСR20. Как видно из представленной табл. 3, проходят клиническое испытание четыре новых блокатора ИЛ-6.
| Биологические DMARD | |
|---|---|
| Ustekinumab (anti-IL12/IL23) | Secukinumab (anti-IL7) |
| Briakinumab (anti-IL12/IL23) | Ixekizumab (anti-IL17) |
| Brodalumab (anti-IL17 AR) | |
| Sirukumab (anti-IL6) | |
| Olakizumab (anti-IL6) | |
| Sarilumab (anti-IL6 R) | |
| Clazakizumab (anti-IL6) | |
| Tabalumab (anti-BAFF) | |
| Atacicept (anti-APRIL/BLYSS) | |
| Mavrilimumab (anti-GM-CSF R) | |
| Eculizumab (anti-C5 mab) | |
Клинические исследования показали, что применение блокаторов ФНО в комбинации с sDMARD позволило достичь ремиссии у 20–50% пациентов.
Известно, что ИЛ-6 играет центральную роль в патогенезе РА, вносит вклад в активацию Т- и В-лимфоцитов, синовиоцитов, васкулярного эндотелиального фактора роста, в развитие остеопороза через активацию остеокластов и продукцию провоспалительных белков.
С другой стороны, ингибиторы ФНО превосходят тоцилизумаб при лечении анкилозирующего спондилита (АС) и воспалительных заболеваний кишечника (ВЗК), что указывает на возможное дифференциальное применение ингибиторов ФНО при АС и ВЗК, а ингибиторов ИЛ-6 — при РА.
Агрессивное применение традиционных болезнь-модифицирующих препаратов и внедрение биологических агентов привело к жесткому контролю воспаления, а следовательно — к снижению инвалидности и нетрудоспособности, что является желательной терапевтической стратегией. В рекомендациях EULAR 2013 отмечается отсутствие предпочтений одного биологического агента над другим в лечении при РА.
Ни для ингибиторов ФНО, ни для ритуксимаба или абатацепта не было достоверно установлено, что монотерапия ими была более эффективна по сравнению с метотрексатом (МТ). Только тоцилизумаб многократно продемонстрировал более высокую эффективность в качестве монотерапии по сравнению с МТ или другими sDMARD.
Прямое сравнительное исследование среди пациентов с РА, прекративших применение МТ, продемонстрировало, что монотерапия тоцилизумабом более эффективна по сравнению с монотерапией адалимумабом по большинству конечных точек.
В обновленном Консенсусе 2012 г. показана возможность (по FDA) начинать терапию тоцилизумабом с 4 мг/кг массы тела, а при необходимости — повышать дозу до 8 мг/кг.
При наличии неблагоприятных факторов при РА по рекомендациям обновленного Консенсуса терапию РА можно начинать с биологических агентов без предшествующего назначения sDMARD (Saag K.G. et al., 2008). Однако ранний прием биологического препарата у пациентов, ранее не принимавших sDMARD, следует рассматривать в исключительных случаях по последним рекомендациям EULAR 2013 (Smolen J.S. et al., 2013).
Результаты исследования ACT-RAY (Dougados M. et al., 2013) у 556 пациентов с РА через 24 нед показали отсутствие клинического превосходства терапии тоцилизумабом + МТ по сравнению с монотерапией тоцилизумабом. На фоне комбинированного лечения тоцилизумабом + МТ чаще отмечали повышенный уровень трансаминаз. Значимого клинического и рентгенологического ответа удалось достигнуть на фоне обеих схем лечения, что указывает на возможную ценность монотерапии тоцилизумабом у данной категории пациентов с РА.
Переход на тоцилизумаб и добавление его к MT у пациентов с непереносимостью MT имеют одинаковую эффективность. По данным исследования SURPRISE (Takeuchi T. et al., 2013), в течение 52 нед у пациентов с непереносимостью МТ комбинация тоцилизумаб + МТ (115 пациентов) и монотерапия тоцилизумабом (111 пациентов) показали одинаковую эффективность в обеих группах по DAS28, CDAI, ACR70, счету эрозий Шарпа. Однако в группе монотерапии тоцилизумабом частота тяжелых инфекций и серьезных нежелательных явлений была 4,5 и 8,1% соответственно, а в группе комбинации тоцилизумаб + МТ — 5,2 и 14,0%.
В исследовании DREAM по изучению эффективности монотерапии тоцилизумабом (Nishimoto N. et al., 2014) показано, что монотерапия тоцилизумабом может вызвать безбиологическую ремиссию без сопутствующего применения sDMARD, а уровни ИЛ-6 и матриксной металлопротеиназы-3 в сыворотке крови могут быть полезными маркерами для идентификации пациентов, которые могли бы прекратить прием тоцилизумаба без обострения заболевания.
Результаты исследований, проведенных по изучению эффективности тоцилизумаба (SAMURAI, SATORI и т.д.) (Nishimoto N. et al., 2007; 2009), показали возможность применения тоцилизумаба в монотерапии, что безусловно уменьшает количество побочных эффектов, обусловленных применением МТ в комбинации.
МТ на протяжении десятилетий применяют в стандартной терапии при злокачественных новообразованиях и РА. Несмотря на многолетний опыт, механизмы действия МТ пока остаются не вполне изученными. Сообщается об иммунологических эффектах МТ, включая повышенную продукцию некоторых цитокинов, не соответствующих общим противовоспалительным эффектам МТ при таком заболевании, как РА. МТ индуцирует экспрессию провоспалительных цитокинов, таких как ИЛ-1, ИЛ-6 и ФНО-α. Эти эффекты могут приводить к известным токсическим влияниям МТ, включая пневмонит, воспаление слизистой оболочки и снижение минеральной плотности кости.
Учитывая вышеизложенное, актуальность темы, поиск эффективных и безопасных методов терапии, проведено исследование по лечению при РА тоцилизумабом с предшествующим введением глюкокортикоидов (ГК). В исследование были включены 14 пациентов с РА. Среди них — 12 женщин и 2 мужчин в возрасте 18–68 лет, с длительностью заболевания от 3 мес до 10 лет. 2 пациента с длительным течением РА были исключены из исследования в связи с низкой эффективностью тоцилизумаба у одной пациентки и побочными эффектами — у второй.
С ранним РА наблюдалось 5 больных, среди них 2 серопозитивных с умеренной степенью активности и 3 серонегативных с высокой степенью активности.
Среди пациентов с длительным РА — 9 больных. Из них 6 серопозитивных с высокой и умеренной степенью активности и 3 — серонегативных.
Для верификации диагноза использованы классификационные критерии ACR/EULAR 2010. Для определения активности процесса учитывали количество вовлеченных суставов, выраженность боли, скованность и нарушение функции по ВАШ, СОЭ, СРБ, РФ.
Всем больным перед включением в терапию тоцилизумабом проводили общеклинические исследования, исследования на наличие маркеров вирусных гепатитов, оценку почечных и печеночных тестов, пробу Манту или диаскин-тест, рентгенографию легких и рентгенографическое исследование наиболее пораженных суставов. Всем пациентам, леченным тоцилизумабом, проводили в динамике общеклинические исследования, обращая внимание на содержание гемоглобина, количество эритроцитов, количество лейкоцитов, СОЭ, а также СРБ и РФ (исследования проводились перед каждым введением тоцилизумаба).
Важность монотерапии биологическими агентами при РА связана прежде всего с тем, что комбинация биологических препаратов с МТ вызывает более частое развитие инфекционных осложнений, чем монотерапия. Во избежание дополнительного токсического влияния синтетических базисных препаратов, а также, учитывая более высокую эффективность тоцилизумаба по сравнению с ними, у больных в данной группе синтетические базисные препараты не применяли.
С целью быстрого устранения активности процесса были выбраны самые безопасные дозы ГК (табл. 4–6), а именно — метилпреднизолона, изначально мини-пульс-терапия метилпреднизоло-ном 250 мг внутривенно № 4, с последующим переходом на пероральный прием метилпреднизолона в дозе 8 мг /сут и только у 1 пациента — 12 мг/сут.
| Термин | Низкая доза | Средняя доза | Высокая доза | Очень высокая доза | Пульс-терапия |
|---|---|---|---|---|---|
| Суточная доза в преднизолоновом эквиваленте (per os), мг | ≤7,5 | >7,5—≤30 | >30—≤100 | >100 мг | ≥250 мг |
| Насыщение рецепторов, % |
<50 | ≥50—<100 | <100 | 100 | 100 |
| Негеномные эффекты |
≈0 | Незначимы | + | +++ | ++++ |
| Побочные эффекты |
Относительно мало | Значительные и дозозависимые |
Серьезные при длительном (1,5–2 мес) лечении | Серьезные. Длительное (>4 нед) лечение недопустимо | Относительно мало при лечении ≤5 дней |
| Применение | Обычно поддерживающая терапия | Первоначальное лечение при первичных хронических ревматических болезнях | Начальное лечение при подострых болезнях, не угрожающих жизни обострениях или висцеральных поражениях при РА и др. Смешанная болезнь соединительной ткани (СБСТ) | Начальное лечение при острых болезнях или угрожающих жизни обострениях СБСТ, системном васкулите и РА | Подавляющая терапия при остром или угрожающем жизни течении СБСТ, системном васкулите и РА |
| Побочный эффект | Гидрокортизон | Преднизолон | Метилпреднизолон | Дексаметазон | Триамцинолон |
|---|---|---|---|---|---|
| Остеопороз | ++ | ++ | ++ | +++ | ++ |
| Стероидная язва желудка | ++ | +++ | +/- | ++ | ++ |
| Ингибиция функции коры надпочечников | ++ | ++ | ++ | +++ | ++ |
| Задержка натрия, отеки | +++ | + | +/- | + | +/- |
| Артериальная гипертензия | ++ | + | +/- | + | +/- |
| Потеря калия | ++ | + | +/- | ++ | + |
| Миопатия | ++ | +/- | +/- | ++ | +++ |
| Активация инфекции | ++ | ++ | ++ | +++ | +++ |
| Психотропный эффект | ++ | ++ | ++ | +++ | +/- |
| Кушингоид | ++ | ++ | +/- | +++ | +++ |
| Гирсутизм | ++ | ++ | +/- | ++ | ++ |
| Пурпура | ++ | ++ | ++ | +++ | +++ |
| Стрии | + | + | – | + | ++ |
| Угри | ++ | ++ | + | + | ++ |
| Повышение аппетита | ++ | ++ | + | +++ | +/- |
| Стероидный диабет | ++ | ++ | + | +++ | + |
Применение метилпреднизолона позволило избежать развития лейкопении у больных, применявших тоцилизумаб. Хороший ответ на применение ГК был благоприятным прогностическим тестом в лечении при РА.
После получения результатов исследования, а именно отрицательных тестов на вирусные гепатиты, туберкулез, нормальные показатели почечных и печеночных проб, отсутствие очагов инфекции, отсутствие изменений при рентгенологическом исследовании легких, данной группе пациентов проводили терапию тоцилизумабом в дозе из расчета 8–4 мг/кг 1 раз в 4 нед.
Результаты лечения больных с ранним РА
В группу было включено 5 пациентов, из них — 4 женщины и 1 мужчина в возрасте от 31 года до 54 лет с длительностью заболевания до 6 мес. 2 пациента с серонегативным РА. Содержание лейкоцитов как до лечения тоцилизумабом, так и в динамике терапии было нормальное в пределах 4,1–7⋅10⁹ л. В данной группе больных изначально у троих наблюдалось снижение гемоглобина — 96–110 г/л; повышение СОЭ — 45–39 мм/ч. СРБ у всех пациентов был повышенный от 23 до 93.
В процессе лечения, уже перед вторым введением тоцилизумаба (Актемры), содержание гемоглобина повысилось до 120–127 г/л, то есть нормализовалось, СОЭ снизилось до 3–6 мм/ч. СРБ перед вторым введением был отрицательный. По РФ динамики не выявлено. Клинически у всех пациентов отмечали отсутствие суставного синдрома как перед вторым введением, так и перед последующими. Терапию тоцилизумабом в этой группе пациентов у 4 женщин проводили в течение 4 мес, а у 1 пациента-мужчины — в течение 6 мес с последующим снижением дозы.
Следует отметить, что после прекращения терапии тоцилизумабом у пациентов наступила полная длительная безлекарственная ремиссия, которая длится до настоящего времени (у 3 пациентов — 3,5 года, 1 пациента — 3 года, 1 пациентки — 10 мес). Дозу ГК снижали постепенно с 8 мг до отмены в течение 2 мес.
Результаты лечения больных с длительным РА
В группу было включено 9 пациентов, 2 из которых выбыло в связи с побочными эффектами. Среди пациентов наблюдали 6 женщин и 1 мужчину в возрасте от 18 до 68 лет с длительностью заболевания от 4 до 11 лет. 5 пациентов с серонегативным РА.
В данной группе больных изначально только у двоих отмечали снижение гемоглобина — 100; 116 г/л; который в процессе терапии тоцилизумабом повысился до 130; 131 г/л. Содержание лейкоцитов как до лечения тоцилизумабом, так и в динамике терапии было нормальное в пределах 5,1–7,6⋅10⁹ л.
Повышенное СОЭ выявляли у всех пациентов в среднем от 19 до 55 мм/ч; во время терапии СОЭ снижалось до нормы (до 1–7 мм/ч). СРБ у всех пациентов был повышен от 15 до 202. Нормализация СРБ наблюдалась уже перед вторым введением тоцилизумаба. Это очень важно, поскольку снижение СРБ является критерием эффективности тоцилизумаба. По РФ динамики не выявлено.
Клиническая симптоматика, на которую прежде всего обращают внимание пациенты, так же имела положительную динамику ко второму введению тоцилизумаба и практически полностью исчезала к третьему введению. Снижение дозы ГК в данной группе отмечалось более постепенным, в течение 3–4 мес. Один пациент продолжал принимать ГК в дозе 6–4 мг/сут.
Следует отметить особенности течения РА у отдельных пациентов и их ответ на терапию тоцилизумабом. Особого внимания заслуживает пациентка В., возраст — 22 года, с длительным РА, которая поступила в стационар с высокими показателями активности воспалительного процесса. Гемоглобин 97 г/л, СОЭ — 51 мм/ч, СРБ >200.
Кроме того, особенностью данной пациентки было поражение суставов стоп и коленных суставов при отсутствии поражения суставов кистей, лучезапястных суставов.
Уже через 1 мес после введения тоцилизумаба у больной отмечали: гемоглобин — 130 г/л, СОЭ — 4 мм/ч, лейкоциты 6,8; отрицательный СРБ. Суставной синдром значительно уменьшился. Сохранялись лишь припухлость и незначительная боль в левом коленном суставе и суставах стоп. Больной проведено лечение в течение 12 мес. В это время СОЭ сохранялось на уровне 3–6 мм/ч, отрицательный СРБ, гемоглобин — в пределах нормы. Через 6 мес лечения суставной синдром практически отсутствовал. У пациентки выявлена положительная рентгенологическая динамика при исследовании стоп. Больной были отменены ГК, поскольку отмечена полная ремиссия.
Через 3 мес после отмены терапии больная забеременела и через 9 мес наступили благополучные роды. В период беременности, после рождения ребенка (в течение 4 лет и 3 мес) — безлекарственная ремиссия. На сегодняшний день больная вновь беременна (срок — 4 мес).
Пациентка Л., возраст — 18 лет, с ювенильным артритом. Болеет в течение 13 лет. Активность процесса умеренная, длительное применение ГК, в результате чего сниженный рост. Больной проведено лечение тоцилизумабом в течение 8 мес в дозе 200 мг 1 раз в месяц. Ввиду наличия анкилозов тазобедренных суставов пациентка была прооперирована: левый сустав в 13.02.2014 г., правый сустав — в 6.05.2014 г., после чего уже в течение года у пациентки сохраняется безлекарственная ремиссия.
Пациентка С., возраст — 27 лет, с длительным РА с 2006 г. РА серопозитивный (РФ ≈100 МЕд/мл, СРБ — 15 мг/л, СОЭ — 27 мм/ч). До поступления в клинику пациентка принимала МТ в дозе 10–15 мг/нед. Несмотря на применение МТ, у больной сохранялась активность процесса и наблюдалась отрицательная рентгенологическая динамика (12.2012–12.2013).
В процессе лечения тоцилизумабом перед третьим введением у больной нормализовалась СОЭ, отсутствовала лейкопения, отрицательный СРБ, отсутствовал суставной синдром, однако незначительная динамика уменьшения РФ. Через год лечения тоцилизумабом проведена рентгенография кистей, где отсутствовала динамика прогрессирования поражения (12.2013–12.2014).
Применение тоцилизумаба у больных с ранним РА показало высокую эффективность, быстрое купирование активности процесса и наступление длительной безлекарственной ремиссии.
У больных с длительным течением РА применение тоцилизумаба у всех пациентов оказало положительный клинико-лабораторный и рентгенологический эффект.
Обоснование монотерапии Тоцилизумабом
1. Невозможность применения традиционных базисных препаратов:
- из-за побочных эффектов (нарушения функции почек, поражения печени, гастроинтестинальной патологии, лейкопении, анемии, тромбоцитопении и др.);
- из-за очень высокой активности РА.
2. Отсутствие эффективности МТ, других традиционных базисных препаратов, блокаторов ФНО-α, ритуксимаба.
3. Планируемая беременность.
4. Желание больного получить быстрый эффект без предварительного применения традиционных базисных препаратов, особенно при раннем РА.
Список использованной литературы
- Концепція Державної цільової програми лікування хворих на ревматоїдний артрит на 2011–2015 роки.
- Anderson J.J., Wells G., Verhoeven A.C. et al. (2000) Factors predicting response to treatment in rheumatoid arthritis: the importance of disease duration. Arthritis Rheum., 43(1): 22–29.
- Dougados M., Kissel K., Sheeran T. et al. (2013) Adding tocilizumab or switching to tocilizumab monotherapy in methotrexate inadequate responders: 24-week symptomatic and structural results of a 2-year randomised controlled strategy trial in rheumatoid arthritis (ACT-RAY) Ann. Rheum. Dis., 72(1): 43–50.
- Krishnan E., Lingala B., Bruce B. et al. (2012) Disability in rheumatoid arthritis in the era of biological treatments. Ann. Rheum. Dis., 71: 213–218.
- Nishimoto N., Hashimoto J., Miyasaka N. et al. (2007) Study of active controlled monotherapy used for rheumatoid arthritis, an IL-6 inhibitor (SAMURAI): evidence of clinical and radiographic benefit from an x ray reader-blinded randomised controlled trial of tocilizumab Ann. Rheum. Dis., 66(9): 1162–1167.
- Nishimoto N., Miyasaka N., Yamamoto K. et al. (2009) Study of active controlled tocilizumab monotherapy for rheumatoid arthritis patients with an inadequate response to methotrexate (SATORI): significant reduction in disease activity and serum vascular endothelial growth factor by IL-6 receptor inhibition therapy. Mod. Rheumatol., 19: 12–9.
- Nishimoto N. et al. (2014) Drug free REmission/low disease activity after cessation of tocilizumab (Actemra) Monotherapy (DREAM) study. Mod. Rheumatol., 24(1): 17–25.
- Olsen N.J. et al. (2014) Methotrexate induces production of IL-1 and IL-6 in the monocytic cell line U937. Arthr. Res. Ther., 16: R17.
- Saag K.G. et al. (2008) American College of Rheumatology 2008 recommendations for the use of nonbiologic and biologic disease-modifying antirheumatic drugs in rheumatoid arthritis. Arthr. Rheumatism (Arthritis Care & Research), 59(6): 762–784.
- Smolen J.S. et al. (2013) EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs: 2013 update. ARD Online First, published on October 25, 2013 as 10.1136/annrheumdis-2013–204573.
- Takeuchi T. et al. (2013) Adding tocilizumab or switching to tocilizumab monotherapy in RA patients with inadequate response to methotrexate: 24-week results from a randomized controlled study (SURPRISE study). Ann. Rheum. Dis., 7262.
Адрес для переписки:
Шуба Неонила Михайловна
04112, Киев, ул. Дорогожицкая, 9
Национальная медицинская академия
последипломного образования им. П.Л. Шупика

Leave a comment