Особливості перебігу гастропатії, індукованої застосуванням нестероїдних протизапальних препаратів у хворих на остеоартроз
Антоненко А.В. 1, Берегова Т.В.2, Свінціцький А.С. 1
- 1Національний медичний університет ім. О.О. Богомольця, Київ
- 2Київський національний університет ім. Тараса Шевченка
Резюме. До найчастіших побічних ефектів, спричинених застосуванням нестероїдних протизапальних препаратів (НПЗП), належать НПЗП-гастропатія та НПЗП-ентеропатія. Мета роботи — дослідити особливості перебігу гастропатії, індукованої застосуванням НПЗП, у хворих на остеоартроз та оптимізувати лікування при НПЗП-гастропатії. У роботі обстежено 90 пацієнтів із остеоартрозом, які застосовували неселективні НПЗП >1 міс. У ході дослідження в усіх пацієнтів виявлено наявність суттєвих змін у мікрофлорі кишечнику, вираженість яких корелювала з інтенсивністю уражень слизової оболонки шлунка. Доцільність включення пробіотиків у стандартні схеми лікування при гастропатії зумовлена їх гастропротекторними властивостями, що доведено в ряді експериментальних робіт. 28-денний курс лікування пантопразолом (20 мг 2 рази на добу) спричинює посилення дисбіозу. Мультипробіотик, застосовуваний у комбінації з пантопразолом впродовж 20 днів, запобігав розвитку дисбіозу та зумовлював більш швидке загоєння слизової оболонки шлунка порівняно з пацієнтами, які отримували монотерапію пантопразолом.
Вступ
З-поміж усіх ревматичних захворювань найпоширенішим є остеоартроз (ОА) (Шуба Н.М. та співавт., 2012). Від інтенсивності болю залежить прогресування основного захворювання, що впливає на якість і тривалість життя пацієнта. Так, у популяції похилого віку смертність протягом 5 років за наявності больового синдрому суттєво підвищується порівняно з іншими хворими (Ding C., 2002; Pincus T., Sokka T., 2005).
У світлі останніх міжнародних рекомендацій кристалізується нова концепція лікування ОА, що засвідчує суттєву перевагу в ефективності постійного прийому нестероїдних протизапальних препаратів (НПЗП): частота рецидивів на місяць — 0,54, порівняно з 0,93 при прийомі за вимогою (Zhang W. et al., 2008). Тож з урахуванням цієї нової фармакотерапевтичної концепції, що передбачає тривалий безперервний прийом, клінічна проблема безпеки НПЗП як класу набуває ще більшої актуальності.
Прийом НПЗП супроводжується підвищеним ризиком гастродуоденальних побічних ефектів, перше місце серед яких посідають дистрофічні й запальні зміни слизової оболонки травного каналу (Свінціцький А.С. та співавт., 2006).
Гастродуоденальна токсичність НПЗП пояснюється пригніченням синтезу цитопротекторних простаноїдів, опосередкованих циклооксигеназою (ЦОГ) 1-го типу, таких як простагландин Е2 і простациклін (Paulose-Ram R. et al., 2003). Високоселективні інгібітори ЦОГ 2-го типу викликають менш виражені гастродуоденальні ушкодження, ніж неселективні НПЗП (н-НПЗП), які пригнічують одночасно ЦОГ-1 і -2, однак повністю не вирішують проблеми. Криза коксибів, що виникла у 2004 р., гостро поставила питання про кардіоваскулярну безпеку селективних НПЗП (Lanza F.L. et al., 2005; Perry L.A. et al., 2014).
Згідно з рекомендаціями Американської колегії гастроентерологів та положеннями Маастрихту IV, пацієнтам групи високого ризику рекомендовано застосовувати селективні блокатори ЦОГ-2 з інгібіторами протонної помпи (ІПП). Враховуючи результати клінічних досліджень OMNIUM (порівняння ефективності омепразолу і мізопростолу в лікуванні при ерозивно-виразкових дефектах, спричинених НПЗП) і ASTRONAUT (порівняння ефективності омепразолу і ранітидину), препаратами вибору для лікування при гастропатії, спричиненій прийомом НПЗП, є ІПП. Однак пригнічення кислотності під впливом ІПП призводить до порушення мікрофлори кишечнику, вмісту протизапальних цитокінів та пригнічення процесів деградації протекторних білків слизу (Syer S., Wallace J.L., 2014).
Вперше важливість симбіотичної мікрофлори у підтримці фізичного і психічного здоров’я спрогнозував наш відомий співвітчизник, лауреат Нобелівської премії І.І. Мечников. Концепція мікробіологічної терапії І.І. Мечникова, заснована на наявності тісного зв’язку між здоров’ям людини, станом його кишкової мікрофлори та імунітетом, виявилася потужним імпульсом для прогресу знань в галузі мікробної екології людини і розробки широкого спектра мікробних препаратів, які застосовуються для усунення мікроекологічних порушень (Широбоков В.П. та співавт., 2014).
Слід враховувати, що в будь-якому біоценозі завжди домінують характерні групи мікроорганізмів, кількість яких незначна, однак в числовому співвідношенні саме вони становлять основу біоценозу. Це домінантна мікрофлора, яка регулює взаємовідношення з макроорганізмом, бере участь у процесах синтезу, детоксикації та імуностимуляції. Мікрофлора біотопа товстого кишечнику представлена переважно грампозитивними і грамнегативними анаеробними цукролітичними бактеріями (Bifidobacterium, Lactobacillus, Bacteroides, Propionibacterium тощо). Серед них найбільш фізіологічними для організму людини є представники роду Bifidobacterium і Lactobacillus. Цукролітичні мікроорганізми беруть активну участь у ферментації вуглеводів, які надходять у кишечник з їжею, та олігосахаридів слизу (муцинів), що синтезуються бокаловидними епітеліоцитами кишечнику.
Пробіотики — препарати з живих мікроорганізмів, які зумовлюють позитивний ефект на всі системи організму за рахунок поліпшення мікрофлори кишечнику. Доцільність включення пробіотиків у стандартні схеми лікування при НПЗП-гастропатії зумовлена їх гастропротекторними властивостями, що доведено в ряді експериментальних робіт. Так, за даними P.C. Konturek та співавторів (2009), пробіотики володіють протизапальною, антиапоптичною та вазодилататорною дією. Встановлено, що протизапальна дія пробіотиків зумовлена декількома механізмами. Пробіотики знижують у сироватці крові щурів концентрацію прозапальних цитокінів інтерлейкін (ІЛ)-1β та -12В р40, яка зростає за умов ушкоджень слизової оболонки шлунка, та підвищують у сироватці крові концентрацію протизапальних цитокінів ІЛ-4 та -10. Пробіотики зменшують перекисне окиснення ліпідів, яке зростає за умов розвитку запальних процесів у шлунку. Також пробіотики запобігають деградації фукопротеїнів сполучної тканини слизово-епітеліального бар’єру шлунка та ефективно захищають слизову оболонку шлунка від деградації глікозаміногліканів (Вірченко О.В., 2013).
Як відомо, НПЗП-гастропатія розвивається не у всіх пацієнтів, які застосовують для лікування ці препарати протягом тривалого часу. Це можна пояснити так званим феноменом адаптації слизової оболонки шлунка до токсичної дії НПЗП, який вперше було описано видатним фізіологом А. Робертом у 1979 р. (Brzozowski T. et al., 2005; Свінціцький А.С. та співавт., 2012).
Матеріали і методи дослідження
Мета проведеного дослідження — в порівняльному аспекті вивчити кількісні показники фекальної мікрофлори, морфологічні та гематологічні особливості перебігу гастропатії, індукованої НПЗП у хворих на ОА, які протягом тривалого часу (>1 міс) лікувалися НПЗП, та оцінити ефективність застосування комплексної терапії ІПП та мультипробіотика в лікуванні при ерозивно-виразкових ураженнях, асоційованих із застосуванням НПЗП.
Дослідження проводили на базі кафедри внутрішньої медицини № 3 Національного медичного університету імені О.О. Богомольця. Під спостереженням перебували 90 пацієнтів (Helicobacter pylori-негативних) з ОА віком 55–79 років, які проходили лікування в Республіканській клінічній лікарні Міністерства охорони здоров’я України.
Верифікацію клінічного діагнозу проводили за оцінкою скарг, анамнестичних даних, клінічної картини, лабораторних показників (загальноклінічних), інструментальних методів дослідження (езофагогастродуоденоскопія), гістологічних досліджень. Критеріями діагнозу НПЗП-гастропатії слугували: ендоскопічно виявлені ураження гастродуоденальної ділянки шлунково-кишкового тракту (ШКТ) на фоні прийому НПЗП >1 міс (з терапевтичною метою, враховуючи основний діагноз ОА), відсутність захворювань ШКТ в анамнезі. Крім того, усім пацієнтам проведено аналіз мікрофлори кишечнику.
Для кількісного аналізу мікрофлори кишечнику з 1 г фекалій, доставлених без консервантів, готували робоче розведення (1:10), з якого робили ряд серійних розведень (1010). Кількісний аналіз мікрофлори кишечнику вивчали шляхом висіву 1 смз кожного серійного розведення на диференційно-діагностичні середовища:
- Сабуро та жовтково-сольовий агар для визначення грибів роду Candida та стафілококів;
- Ендо та Сіменса для визначення кишкової палички та умовно-патогенних ентеробактерій;
- на 5% кров’яний агар та на середовище ЕДДС для визначення ентерококів;
- регенероване середовище Блаурока для визначення біфідумбактерій,
- МRS для лактобактерій.
Із робочого розведення 1:10 робили висів на щільні поживні середовища (Плоскірєва, вісмут-сульфіт-агар) для виявлення патогенних ентеробактерій. Кількісні показники росту бактерій перераховували в десяткові логарифми.
Отримані у процесі дослідження числові дані обробляли методами математичної статистики з розрахунком середніх величин (М), помилок середніх величин (m). Для аналізу виду розподілу даних використано критерій Шапіро — Уїлка. Оскільки отримані дані розподілено за нормальним законом, то використано параметричні методи порівняння вибірок. Отримані дані піддавали варіаційному статистичному аналізу з використанням параметричного t-критерію Стьюдента. Відмінності вважали достовірними при р<0,05.
Пацієнтів із НПЗП-гастропатією (60 осіб) рандомізовано розподілили на дві рівні групи. Пацієнти 1-ї (контрольної) групи впродовж 28 днів застосовували препарат пантопразол у дозі 20 мг 2 рази на добу щоденно. Пацієнти 2-ї (основної) групи одночасно з пантопразолом 20 мг 2 рази на добу щоденно приймали мультипробіотик у дозі 0,14 мл/кг маси тіла на добу протягом 20 днів.
Через 1 міс після призначеного лікування всі вищенаведені аналізи були проведені повторно.
Результати дослідження
Серед 90 учасників дослідження, які застосовували НПЗП, ерозивно-виразкові ураження діагностовано у 60 (66,7%) пацієнтів. У групі осіб із НПЗП-гастропатією в загальному аналізі крові відзначають зниження показників гематокриту, середніх розмірів еритроцитів (MCV), середніх об’ємів тромбоцитів (MPV), ширини розподілу тромбоцитів (PDW) та підвищення ширини розподілу еритроцитів (RDW), що є ознаками розвитку геморагічного синдрому (рис. 1) і можуть бути непрямими ознаками вірогідності розвитку ерозій та виразок у пацієнтів, які тривалий час приймають НПЗП.
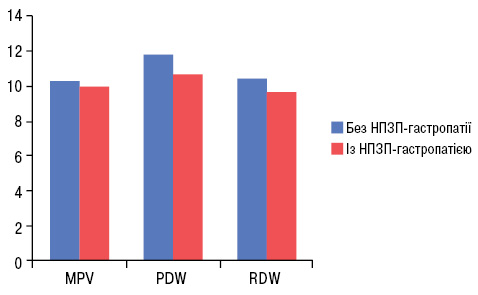
На ці непрямі ознаки слід звертати увагу у зв’язку з можливими незначними, субклінічними втратами крові через ерозивну поверхню слизової оболонки або виразковий дефект.
Гістологічна картина слизової оболонки шлунка у разі НПЗП-гастропатії характеризувалася повнокров’ям слизової оболонки, наявністю клиновидних ерозій, фовеолярною гіперплазією поверхневого епітелію, набряком та проліферацією гладком’язових клітин у власній пластинці слизової оболонки. Вираженість морфологічних змін оцінювалась відповідно до Сіднейської класифікації хронічних гастритів.
У групі учасників із НПЗП-гастропатією переважав хронічний помірно виражений поверхневий гастрит II ступеня активності (65%), на відміну від пацієнтів без НПЗП-гастропатій, де частіше спостерігали хронічний слабовиражений поверхневий гастрит I ступеня активності (73,3%). Основна роль у розвитку процесу адаптації слизової оболонки шлунка до несприятливого впливу НПЗП належить ростовим факторам: епідермальному фактору росту (EGF), трансформуючому фактору росту (TGF)-альфа, основному фактору росту фібробластів (bFGF), тромбоцитарному фактору росту (PDGF) (Wilder-Smith C.H. et al., 2004).
У дослідженнях останніх десятиріч встановлено надзвичайно важливу роль симбіотичної мікрофлори у функціонуванні організму (Вірченко О.В., Берегова Т.В., 2010). Оскільки найбільшим резервуаром мікробіоти людини є товста кишка, саме цей орган привертає найбільший інтерес щодо вивчення впливу симбіотичних бактерій на організм. Нами проаналізовано вплив мікрофлори кишечнику на інтенсивність ушкодження слизової оболонки шлунка. Зміни в аналізі калу на дисбактеріоз відзначали в усіх пацієнтів, які застосовували НПЗП, однак у групі з НПЗП-гастропатією — більш виражені зміни в мікрофлорі кишечнику, на відміну від пацієнтів без ерозивних змін у слизовій оболонці шлунка (рис. 2 і 3).
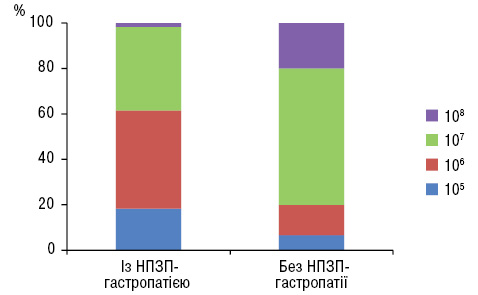
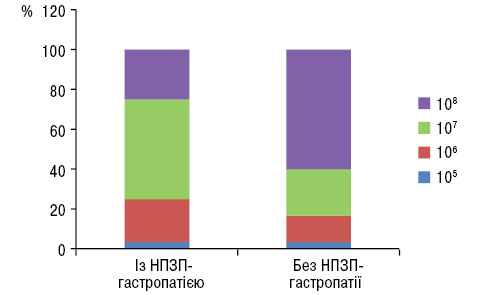
У проведеному нами дослідженні порівнювали ефективність застосування комбінованого лікування (пантопразол 20 мг 2 рази на добу з мультипробіотиком 0,14 мг/кг щоденно впродовж 20 днів). Відповідно до отриманих даних (таблиця), через 1 міс у контрольній групі ерозивні ушкодження виявляли у 16 пацієнтів (кількість ерозій у таких пацієнтів була суттєво менша, однак вони все ж таки залишалися). В основній групі ерозивні зміни слизової оболонки шлунка були відсутні.
| Кількість ерозій | Кількість пацієнтів (n) у групі | |||||
|---|---|---|---|---|---|---|
| контрольній (n=30) | основній (n=30) | |||||
| До лікування | Після лікування | P | До лікування | Після лікування | P | |
| Відсутні | – | 14 | x=30,1 p<0,0001 |
– | 30 | x=60,0 p<0,0001 |
| <3 | 14 | 16 | 22 | – | ||
| >3 | 16 | – | 8 | – | ||
Висновки
Враховуючи, частий безсимптомний перебіг НПЗП-гастропатії, лікарям слід звертати особливу увагу на гематологічні показники в аналізах пацієнтів (гематокрит, MCV, PDW, MPV, RDW) для прогнозування ерозивно-виразкових уражень слизової оболонки шлунка. Отримані результати свідчать про наявність дисбіозу у всіх пацієнтів, які застосовують НПЗП протягом тривалого часу, незалежно від наявності чи відсутності ерозивно-виразкових уражень. Враховуючи, що у хворих відзначають порушення різних штамів, мікроорганізмів, саме мультипробіотик, до складу якого входять найбільш наближені до властивостей фізіологічного комплексу людини штами, патогенетично показаний таким хворим. Дані літератури свідчать, що пробіотики після всмоктування у кров знижують тонічну активність блукаючих нервів, внаслідок чого знижується секреція кислоти у шлунку. Це створює сприятливі умови для загоєння ерозивно-виразкових уражень слизової оболонки шлунка (Берегова Т.В., Фалалєєва Т.М., 2006). При ендоскопічному спостереженні за динамікою епітелізації ерозивно-виразкових уражень слизової оболонки шлунка відзначали достовірно швидке загоєння у групі пацієнтів, які отримували у складі комплексного лікування мультипробіотик (p<0,0001).
Список використаної літератури
- Берегова Т.В., Фалалєєва Т.М. (2006) Значення коротколанцюгових жирних кислот і лактату в регуляції шлункової секреції. Фізіологічний журнал, 52(3): 41–50.
- Вірченко О.В., Берегова Т.В. (2010) Дослідження лікувально-профілактичного впливу мультипробіотика «Симбітер» при розвитку гострих уражень в слизовій оболонці шлунка щурів. Вісн. проблем біології і медицини, 1: 41–46.
- Вірченко О.В., Фалалєєва Т.М., Берегова Т.В. та ін. (2013) Дослідження антисекреторних властивостей мультиштамного пробіотика за умов дії стресу. Вчені записки Таврійського національного університету ім. В.І. Вернадського, 26 (65): 22–29.
- Свінціцький А.С., Антоненко А.В., Гладчук А.Б. (2012) Роль фізіологічних медіаторів в адаптивних процесах слизової оболонки шлунка. Суч. гастроентерологія, 2(64): 95–99.
- Свінціцький А.С., Яременко О.Б., Пузанова О.Г. та ін. (2006) Ревматичні хвороби і синдроми. Книга плюс, Київ, 680 с.
- Широбоков В.П., Янковский Д.С., Дымент Г.С. (2014) Микробы в биогеохимических процессах, эволюции биосферы и существования человечества. ФОП Верес О.И., Киев, 464 с.
- Шуба Н.М., Воронова Т.Д., Тарасенко Т.М. та ін. (2012) Нові аспекти патогенезу остеоартрозу та шляхи корекції. Укр. ревматол. журн., 47(1): 51–58.
- Brzozowski T., Konturek P.C., Konturek S.J. et aI. (2005) Role of prostaglandins in gastroprotection and gastric adaptation. J. Physiol. Pharmacol., 56(5): 33–55.
- Ding C. (2002) Do NSAIDs affect the progression of osteoarthritis? Inflammation, 26(3): 139–149.
- Konturek P.C., Brzozowski T., Loffler K. (2009) Gastroprotective effects of probiotics: myth or reality? In Fiziol. Zh. — 5 International symposium on cell/tissue injury and cytoprotection/organoprotection. September 17–19, 2008, Yalta, 55(1), p. 85.
- Lanza F.L., Chan F.K.L., Quigley E.M.M. (2009) Guidelines for prevention of NSAID-related ulcer complications. Am. J. Gastroenterol., 104: 728–738.
- Paulose-Ram R., Hirsch R., Dillon C. et aI. (2003) Prescription and non-prescription analgesic use among the US adult population: results from the third National Health and Nutrition Examination Survey (NHANES III). Pharmacoepidemiol. Drug Saf., 12(4): 315–326.
- Perry L.A., Mosler C., Atkins A. et aI. (2014) Cardiovascular risk associated with NSAIds and COX-2 inhibitors. US Pharm., 39(3): 35–38.
- Pincus T., Sokka T. (2005) Complexities in the quantitative assessment of patients with rheumatic diseases in clinical trials and clinical care. Clin.Exper.Rheum., 23(5): 1–9.
- Syer S., Wallace J.L. (2014) Environmental and NSAID-enteropathy: dysbiosis as a common factor. Curr. Gastroenterol. Rep., 16: 377–391.
- Wilder-Smith C.H., Robert J., Schindler D. (2004) Upper gastrointestinal tract mucosal injury by AZD3582. A COX-inhibiting nitric oxide donor (cinod) and naproxen: a randomized, double-blind, crossover study in healthy subjects. Gut, 53(6): 36–40.
- Zhang W., Moskowitz R.W., Nuki G. et aI. (2008) OARSI recommendations for the management of hip and knee osteoarthritis, Part II: OARSI evidence-based, expert consensus guidelines. Osteoarthritis and Cartilage, 16: 137–162.
ОСОБЕННОСТИ ТЕЧЕНИЯ ГАСТРОПАТИи, ИНДУЦИРОВАННой ПРИмЕнениеМ НЕСТЕРОИДНЫХ ПРОТИВОВОСПАЛИТЕЛЬНЫХ ПРЕПАРАТОВ У БоЛЬНЫХ ОСТЕОАРТРОЗОМ
Резюме. К наиболее частым побочным эффектам, вызванным применением нестероидных противовоспалительных препаратов (НПВП), относятся НПВП-гастропатия и НПВП-энтеропатия. Цель работы — исследовать особенности течения гастропатии, индуцированной применением НПВП у больных остеоартрозом и оптимизировать лечение при НПВП-гастропатии. В работе обследованы 90 пациентов с остеоартрозом, применявших неселективные НПВП >1 мес. В ходе исследования у всех пациентов выявлено наличие существенных изменений в микрофлоре кишечника, выраженность которых коррелировала с интенсивностью поражений слизистой оболочки желудка. Целесообразность включения пробиотиков в стандартные схемы лечения при гастропатии обусловлена их гастропротекторными свойствами, что доказано в ряде экспериментальных работ. 28-дневный курс лечения пантопразолом (20 мг 2 раза в сутки) вызывает усиление дисбиоза. Мультипробиотик, принимаемый в комбинации с пантопразолом в течение 20 дней, предупреждал развитие дисбиоза и приводил к более быстрому заживлению слизистой оболочки желудка по сравнению с пациентами, получавшими для лечения только пантопразол.
остеоартроз, нестероидные противовоспалительные препараты, НПВП-гастропатия, гастропротекция, дисбиоз, ингибиторы протонной помпы, мультипробиотик.
Адреса для листування:
Свінціцький Анатолій Станіславович
01601, Київ, бульв. Шевченка, 13
Національний медичний університет
ім. О.О. Богомольця

Leave a comment