Актуальні питання лікування хворих на остеоартрит на фоні комбінованої дисліпідемії
Мітченко О.І. , Проценко Г.О., Іванова К.А. , Козлюк А.С.
Резюме. У статті наведено дані дослідження клінічної ефективності та переносимості препаратів набуметон, диклофенак натрію та фенофібрат у комплексному застосуванні у пацієнтів з остеоартритом та дисліпідемією. Виявлено позитивний вплив лікування на перебіг остеоартриту та комбінованої дисліпідемії. Через 12 тиж терапії в обох групах встановлено вірогідне зменшення синовіального випоту, зниження швидкості осідання еритроцитів, С-реактивного протеїну, а також значне покращання клінічного перебігу остеоартриту з дисліпідемією. При однаковій клінічній ефективності набуметону та диклофенаку натрію в групі, де застосовували диклофенак натрію, встановлено вищу частоту таких ефектів, гіпертензивних кризів, набряків на нижніх кінцівках, підвищення рівня аланінамінотрансферази та дискомфорт в епігастральній ділянці порівняно з набуметоном.
Вступ
Остеоартрит (ОА), що визначається як «гетерогенна група захворювань різної етіології зі схожими біологічними, морфологічними, клінічними проявами і результатами, при яких до патологічного процесу залучаються суглобовий хрящ, субхондральна кістка, зв’язки, капсула, синовіальна оболонка і навколосуглобові м’язи», є найпоширенішим ревматичним захворюванням [9]. В середньому на ОА хворіє ≈10% усього населення та майже 50% усіх пацієнтів у світі віком старше 50 років. Основні клінічні прояви ОА колінних суглобів (КС) — хронічний біль різної інтенсивності та обмеження рухливості суглобів, що значно погіршує якість життя пацієнтів [1].
Раніше ОА розглядали як ізольоване захворювання суглобів, пов’язане з дегенерацією хряща в результаті природного старіння організму людини, проте нині відомо, що в основі розвитку дегенеративно-деструктивних змін у суглобах лежить багато взаємодіючих причин та механізмів. При дослідженні коморбідності у хворих на ОА відзначено переважання серцево-судинної патології (80%), зокрема високу поширеність порушення ліпідного обміну — дисліпідемії, що погіршує прогноз у цих пацієнтів [3]. У хворих на ОА підвищується кардіометаболічний ризик за рахунок формування кластера факторів — зниження холестерину (ХС) ліпопротеїдів високої щільності (ЛПВЩ), підвищення тригліцеридів (ТГ), С-реактивного протеїну (СРП) [7].
Сучасні наукові дослідження спрямовані на вивчення складних взаємозв’язків між захворюваннями, що найчастіше поєднуються в одного і того ж хворого, що ускладнює перебіг кожного з них, передбачає застосування різноспрямованих медикаментозних засобів.
Актуальним питанням є поєднання порушень ліпідного обміну і ревматичних захворювань, у тому числі ОА [6]. Коморбідність цих захворювань може призводити до розвитку серцево-судинної патології. Цей факт зумовлює необхідність жорсткої оцінки прогнозованої користі й можливого ризику протиартрозної терапії, що призначається [11]. На фоні коморбідності надмірне та нераціональне призначення ліків без урахування особливостей їх взаємодії призводить до різкого зростання вірогідності розвитку небажаних ефектів терапії та погіршення перебігу захворювань [12].
На першому етапі одним з основних діагностичних заходів у хворих на ОА є оцінка активності синовіту, що має включати ортопедичне обстеження, загальноклінічні лабораторні дослідження, а також інструментальне обстеження — рентгенографію, магнітно-резонансну томографію чи ультразвукове дослідження суглобів. Лабораторні дослідження мають бути спрямовані на виявлення системності, активності запального процесу: загальний аналіз крові з оцінкою лейкоцитарної формули, швидкості осідання еритроцитів (ШОЕ), біохімічний аналіз крові з акцентом на виявлення підвищення рівня показників запалення, зокрема СРП [8].
Лікування пацієнтів з ОА є складною проблемою і базується на сучасних даних про патогенез цього захворювання. На цьому етапі кожна схема лікування ОА має включати разом з нестероїдними протизапальними препаратами (НПЗП) також структурно-модифікуючі препарати, оскільки позитивний вплив останніх на метаболізм внутрішньосуглобових тканин, перш за все на хрящ, не викликає сумнівів. На сьогодні маємо доказову базу для застосування структурно-модифікуючих препаратів у вигляді: Рекомендацій Європейської антиревматичної ліги (EULAR) 2003, Рекомендацій Американського коледжу ревматологів (ACR, 2012), Рекомендацій OARSI щодо ведення пацієнтів із коксартрозом та гонартрозом, 2010 [4, 9, 13].
При порівнянні доказової бази практичних рекомендацій щодо медикаментозного лікування ОА КС можна знайти відмінності підходів до лікування в різних країнах світу. Жодна із запропонованих методик не має статусу безумовно показаної в усіх без винятків випадках. Водночас НПЗП названі препаратами вибору для купірування больового синдрому при ОА [9, 13]. За останній час на фармацевтичному ринку з’явилося багато нових представників цієї групи лікарських засобів, проте золотим стандартом серед НПЗП вважається диклофенак натрію, з яким щодо ефективності й переносимості нині порівнюються всі нові НПЗП, що вводяться у клінічну практику [2, 7].
Раніше вважалося, що пригнічення утворення прозапальних простагландинів, цитокінів, вільних кисневих радикалів, протеаз (тобто пригнічення синовіту) при застосуванні НПЗП може мати і деяку хондропротекторну дію. Пізніше з’явилися нові дані, які висвітлюють вплив неселективних НПЗП на синтез матриксу хряща. Деякі НПЗП (ібупрофен, фенопрофен) при систематичному застосуванні протягом 4–6 міс пришвидшують деструкцію хряща, пригнічуючи синтез простагландинів, проліферацію хондроцитів, інгібуючі ферменти, необхідні для синтезу глікозаміногліканів. Застосування неселективних НПЗП призводить до вираженого зниження вмісту гіалуронату в хрящі при експериментальному ОА і в хрящі людини, що не залежить від віку пацієнтів. Для окремих неселективних НПЗП показана залежна від дози різниця впливу на катаболічні та анаболічні процеси у хрящі [10, 12].
Окрім того, для хворих із підвищеним серцево-судинним ризиком, зокрема гіперліпідемією, слід вибирати ті НПЗП, які меншою мірою підвищують частоту розвитку інфаркту та інсульту [3]. Набуметон щодо цього має перевагу, оскільки метаболізується печінкою з утворенням активного метаболіту.
Для оцінки ефективності лікування хворих на ОА головною метою є покращання якості життя, що також відображено в сучасних рекомендаціях. Тому актуальним у динаміці лікування є аналіз функціональних можливостей пацієнта за візуальною аналоговою шкалою (ВАШ), за індексами якості життя Westren Ontario and McMaster Universities (WOMAC) та M. Lequesne. Важливою також є оцінка рівня гострофазових показників та деяких біомаркерів, наприклад СРП.
Мета дослідження — порівняти клінічну ефективність і переносимість набуметону з ефективністю і переносимістю диклофенаку натрію у хворих на ОА з дисліпідемією на основі оцінки динаміки показників ліпідограми, даних ВАШ, індексів WOMAC та M. Lequesne, змін ШОЕ та СРП.
Об’єкт і методи дослідження
Робота виконана на базі відділення некоронарогенних хвороб серця та клінічної ревматології ДУ «Національного наукового центру «Інститут кардіології ім. М.Д. Стражеска» НАМН України». Усі пацієнти перебували на стаціонарному лікуванні у 2011–2013 рр. Клінічний діагноз ОА встановлювали згідно з критеріями EULAR та ACR 2012 р. перегляду [9, 13]. При об’єктивному огляді визначали індекс маси тіла (ІМТ) Кетле за формулою:
![]()
Контроль рівня артеріального тиску проводили за стандартною методикою. Рентгенологічну стадію визначали за допомогою класифікації, запропонованої J.H. Kellgren.
Обстежено 100 жінок з ОА на тлі гіпертонічної хвороби та комбінованої дисліпідемії без клінічної маніфестації ІХС. Причому перша стадія артеріальної гіпертензії спостерігалася у 31,3%, друга — у 52,9%, третя — у 15,8% відповідно. Середній вік обстежуваних становив 56,2±5,2 року. Тривалість захворювання на ОА — 5,44±1,55 року.
Із них 50 (1-ша група) хворих отримували набуметон в рекомендованій дозі — 1000 мг/добу (по 500 мг 2 рази на добу), 50 пацієнтів (2-га група) — диклофенак натрію в дозі 150 мг/добу (75 мг 2 рази на добу). Враховуючи тривалість захворювання, попередній прийом НПЗП, що супроводжувався зростанням трансаміназ (аспартатамінотрансферази, аланінамінотрансферази (АлАТ)), а також наявність підвищеного рівня ТГ і низького рівня ЛПВЩ, при комплексному лікуванні хворих надали перевагу призначенню фібратів над статинами. В обох групах, окрім протизапальної терапії, застосовували фенофібрат (200 мг). Тривалість лікування становила 12 тиж. По мірі необхідності всі пацієнти отримували антигіпертензивні препарати.
Лабораторне обстеження проводили з урахуванням показників загального аналізу крові, ШОЕ, біохімічного дослідження із визначенням рівня креатиніну (ммоль/л), глюкози крові (ммоль/л), показників ліпідограми (ммоль/л), СРП. Рівні загального ХС, ТГ, ХС ЛПВЩ, ХС ліпопротеїдів низької щільності (ЛПНЩ) вираховували за формулою Фрідвальда:
![]()
Для дослідження ефективності лікування пацієнтів з ОА та з метою аналізу якості життя застосовували шкалу WOMAC, оцінку тяжкості гонартрозу за індексом M. Lequesne, за ВАШ. Зважаючи на те що учасники дослідження страждали на поєднаний перебіг ОА та комбінованої дисліпідемії, аналізу піддавали також рівень загального ХС, ХС ЛПНЩ, ХС ліпопротеїдів дуже низької щільності (ЛПДНЩ), ХС ЛПВЩ і ТГ. Окрім того, проводили аналіз лабораторних гострофазових показників в динаміці лікування (ШОЕ, СРП). Важливим питанням у процесі дослідження було порівняння показників загальної ефективності та переносимості препаратів.
Ключовим у визначенні ефективності протизапальної дії комплексної терапії було проведення УЗД суглобів до лікування та через 12 тиж після проведеної терапії. Обстеження проводили на апараті SONOLINE Omnia (Siemens) з лінійним датчиком 7,5L70 (частота 7,5 мгц) в режимі «ortho», причому для кожного оцінюваного суглоба застосовували стандартні позиціонування датчика. Аналізували кісткові суглобові поверхні (зміни поверхні субхондральної кістки — наявність кист, ерозій, інших дефектів), суглобові щілини, стан синовіальних оболонок, навколосуглобові м’які тканини, наявність випоту, зміни зв’язкового апарату.
Статистичну обробку результатів досліджень проводили за допомогою пакета прикладних програм STATISTICA 7.0 (StatSoft. Inc., США). Кількісні показники представлені у вигляді M±m, де М — середнє, m — стандартне відхилення. Достовірність різниці визначали за допомогою t-критерію Стьюдента для параметричних даних. Вірогідність різниці частотного розподілу визначали за критерієм χ2 з поправкою Фішера. Оцінку частоти побічних явищ проводили з урахуванням абсолютного (АЕ, %) та відносного (ВЕ) ефектів, а також відношення шансів (ВШ) препаратів, з розрахунком довірчих інтервалів та критерію достовірності щодо ВЕ та ВШ. При р<0,05 розбіжності вважали статистично вірогідними [5].
Результати дослідження та їх обговорення
За оцінки змін ліпідного спектра крові в динаміці лікування хворих на ОА та дисліпідемію через 12 тиж були отримані дані, наведені в табл. 1.
Таблиця 1. Показники ліпідного профілю в динаміці лікування у хворих на ОА та дисліпідемію
| Показник | 1-ша група | 2-га група | р | ||
|---|---|---|---|---|---|
| до лікування | після лікування | до лікування | після лікування | ||
| Загальний ХС | 5,88±1,11 | 5,29±0,74* | 5,84±0,97 | 5,26±0,79* | >0,05 |
| ХС ЛПНЩ | 5,11±0,89 | 4,54±0,59* | 5,16±0,35 | 4,56±0,43* | >0,05 |
| ХС ЛПДНЩ | 0,89±0,14 | 0,62±0,13* | 1,15±0,12 | 0,87±0,14* | <0,05 |
| ХС ЛПВЩ | 1,10±0,23 | 1,37±0,27* | 1,12±0,18 | 1,27±0,11* | <0,05 |
| ТГ | 2,37±0,87 | 2,10±0,19* | 2,51±0,23 | 2,11±0,17* | >0,05 |
| Індекс атерогенності | 3,95±0,45 | 3,02±0,10* | 3,87±0,41 | 3,12±0,13* | <0,05 |
У табл. 1–3: *вірогідність різниці показників у динаміці лікування; р — вірогідність різниці показників після лікування між 1-ю та 2-ю групами.
Встановлено вірогідне зниження рівня загального ХС (р<0,05), ХС ЛПНЩ (р<0,05), ХС ЛПДНЩ (р<0,05), ТГ з (р<0,05) та індексу атерогенності (р<0,05) як у 1-й групі (набуметон + фенофібрат), так і у 2-й групі (диклофенак натрію + фенофібрат). За результатами лікування не було достовірної різниці щодо рівня загального ХС — 5,29±0,74 проти 5,26±0,79 (р>0,05), ХС ЛПНЩ — 4,54±0,59 проти 4,56±0,43 (р>0,05), ТГ — 2,10±0,19 та 2,11±0,17 (р>0,05) між хворими, які застосовували набуметон, та пацієнтами, які отримували диклофенак натрію. Водночас відзначено більш вірогідне зниження ХС ЛПДНЩ — 0,62±0,13 проти 0,87±0,14 (р<0,05), більш високий показник ХС ЛПВЩ — 1,37±0,27 проти 1,27±0,11 (р<0,05) та нижчий показник індексу атерогенності — 3,02±0,10 проти 3,12±0,13 (р<0,05) у групі, де застосовували набуметон (див. табл. 1).
За даними шкали ВАШ (рис. 1) встановлено вірогідне зменшення вираженості больового синдрому як в учасників 1-ї групи (з 60,1±13,7 до 44,5±9,82; р<0,05), так і в 2-й групі (з 65,7±11,9 до 34,2±8,41; р<0,05). Слід також відзначити той факт, що в групі, де застосовували диклофенак натрію, спостерігалося більш значуще зменшення вираженості больового синдрому (р<0,05).
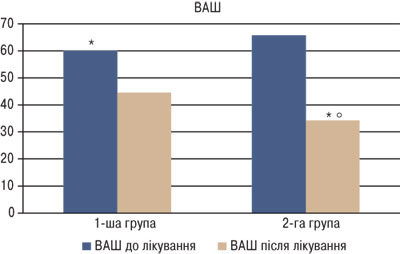
Рис. 1. ВАШ оцінки хронічного болю в динаміці лікування. *Вірогідність різниці показників в динаміці лікування; о вірогідність різниці показників після лікування між 1-ю та 2-ю групами
Зменшення вираженості болючості та ранкової скутості у пацієнтів з ОА та дисліпідемією отримано за індексом тяжкості гонартрозу та коксатрозу M. Lequesne (рис. 2).
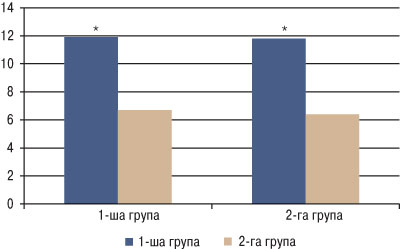
Рис. 2. Індекс тяжкості M. Lequesne в динаміці лікування. *Вірогідність різниці показників у динаміці лікування
В обох групах спостерігалося вірогідне зниження індексу M. Lequesne: з 11,9±3,75 до 6,7±1,41 бала (1-ша група; р<0,05), з 11,8±2,91 до 6,4±1,37 бала (2-га група; р<0,05). Таким чином, за результатами лікування між хворими, які отримували набуметон, та пацієнтами, які застосовували диклофенак натрію, достовірної різниці не було (р>0,05).
При аналізі симптомів захворювання хворими на ОА та дисліпідемію встановлено вірогідне зниження вираженості больової симптоматики (WOMAC А; р<0,05), вираженості ригідності суглобів (WOMAC Б; р<0,05) та зменшення обмеження рухомості КС (WOMAC В; р<0,05) у 1-й та 2-й групах (табл. 2).
Відповідно знижувався також сумарний показник шкали WOMAC, що дозволяє зробити висновок про покращання функціонального стану, а також якості життя хворих на ОА з дисліпідемією в динаміці лікування набуметоном із фенофібратом, так і в динаміці лікування диклофенаком натрію з фенофібратом (див. табл. 2). При порівнянні результатів шкали WOMAC між групами встановлено більш вагоме зниження складової WOMAC Б при застосуванні диклофенаку натрію (р<0,05).
Таблиця 2. Показники шкали WOMAC у динаміці лікування у пацієнтів із ОА та дисліпідемією
| Шкала | Набуметон | Диклофенак натрію | р | ||
|---|---|---|---|---|---|
| до лікування | після лікування | до лікування | після лікування | ||
| WOMAC загальна | 322,5±123,2 | 172,8±106,1 | 326,8±100,1 | 162,9±52,1 | >0,05 |
| WOMAC А | 71,6±12,1 | 45,5±8,7 | 72,1±8,9 | 36,7±8,7* | >0,05 |
| WOMAC Б | 17,6±13,6 | 5,0±0,9* | 18,1±9,20 | 2,78±1,87 | <0,05 |
| WOMAC В | 240,5±12,5 | 122,1±10,5 | 233,2±22,1 | 121,8±39,7 | >0,05 |
Щодо показників лабораторної активності запального процесу (лейкоцитоз, ШОЕ, СРП), було відзначено достовірне зниження рівня лейкоцитів (р<0,05), ШОЕ (р<0,05) та СРП (р<0,05) у динаміці лікування в обох групах, при цьому щодо ефективності впливу набуметону та диклофенаку натрію на гострофазові показники вірогідної різниці не встановлено (р>0,05) (табл. 3).
Таблиця 3. Лабораторні гострофазові показники в динаміці лікування у пацієнтів з ОА та дисліпідемією
| Показник | Набуметон | Диклофенак натрію | Р | ||
|---|---|---|---|---|---|
| до лікування | після лікування |
до лікування | після лікування |
||
| ШОЕ, мм/год | 19,7±5,1 | 9,79±2,7* | 18,7±4,61 | 8,85±3,97 | <0,05 |
| СРП, мг/л | 5,61±0,91 | 2,42±0,61* | 5,79±0,87 | 2,47±0,91 | <0,05 |
Достовірне зменшення об’єму синовіального випоту справа та зліва виявлено в динаміці лікування у пацієнтів з ОА та дисліпідемією у 1-й групі (з 18,9±9,11 до 5,60±2,13 мл справа, з 18,50±8,87 до 6,35±2,11 мл — зліва; р<0,05) та 2-й групі (з 18,60±8,71 до 6,58±2,18 мл справа, з 17,5±7,78 до 5,90±2,91 мл — зліва; р<0,05) (рис. 3).
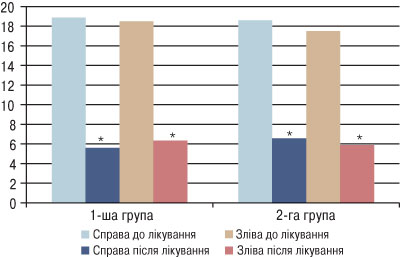
Рис. 3. Вираженість синовіального випоту в динаміці лікування у пацієнтів з ОА та дисліпідемією. *Вірогідність різниці показників у динаміці лікування
Між пацієнтами, в яких застосовували набуметон, та тими, які отримували диклофенак натрію, за результатами вираженості синовіального випоту в динаміці лікування достовірної різниці не встановлено (р>0,05) (див. рис. 3).
Наступне завдання нашого дослідження — оцінити частоту побічних ефектів у хворих, які застосовували набуметон у поєднанні з фенофібратом, та серед пацієнтів, які отримували диклофенак натрію в комбінації з фенофібратом. Аналізу піддавалися такі показники — вірогідність виникнення гіпертензивного кризу, вірогідність виникнення набряків на нижніх кінцівках, частота підвищення АлАТ і частота виникнення дискомфорту в епігастрії. Абсолютний ризик (absolute risk — AR) гіпертензивного кризу на фоні застосування набуметону був вірогідно нижчим, ніж на фоні диклофенаку натрію — 8,0% проти 17,0%, відносний ризик (relative risk — RR) — 1,11 [1,0–1,23] (табл. 4).
Таблиця 4. Вірогідність коливання артеріального тиску на фоні лікування у пацієнтів із ОА та дисліпідемією
| Терапія | АR, % | RR [95% ДI] |
|---|---|---|
| Набуметон + фенофібрат | 8,0 | 1,11 [1,0–1,23] |
| Диклофенак натрію + фенофібрат | 17,0 |
Вірогідність набряків нижніх кінцівок у групі, де застосовували набуметон, була нижчою, ніж у пацієнтів, які отримували диклофенак натрію — AR 5,0% проти 17,0%, RR — 1,15 [1,05–1,26] (табл. 5).
Таблиця 5. Вірогідність набряків нижніх кінцівок на фоні лікування у пацієнтів із ОА та дисліпідемією
| Терапія | АR, % | RR [95% ДI] |
|---|---|---|
| Набуметон + фенофібрат | 5,0 | 1,15 [1,05–1,26] |
| Диклофенак натрію + фенофібрат | 17,0 |
AR щодо підвищення рівня АлАТ у 1-й групі становив 7,0%, що є вірогідно нижчим показником, ніж цей показник у 2-й групі — 19,0%, RR — 1,11 [1,01–1,22] (табл. 6).
Таблиця 6. Вірогідність підвищення трансамінази на фоні лікування у пацієнтів із ОА та дисліпідемією
| Терапія | АR, % | RR [95% ДI] |
|---|---|---|
| Набуметон + фенофібрат | 7,0 | 1,11 [1,01–1,22] |
| Диклофенак натрію + фенофібрат | 19,0 |
Про дискомфорт в епігастрії зазначив 1 хворий групи, в якій застосовували набуметон (1,0%), та 12 пацієнтів групи диклофенаку натрію (12,0%), з достовірною різницею RR — 1,11 [1,04–1,19] (табл. 7).
Таблиця 7. Вірогідність виникнення дискомфорту в епігастрії на фоні лікування у пацієнтів із ОА та дисліпідемією
| Терапія | АR, % | RR [95% ДI] |
|---|---|---|
| Набуметон + фенофібрат | 1,0 | 1,11 [1,04–1,19] |
| Диклофенак натрію + фенофібрат | 12,0 |
Таким чином, за результатами аналізу ефективності лікування у пацієнтів із ОА з дисліпідемією отримано вірогідні зміни відносно показників ліпідограми, ВАШ оцінки хронічного болю та шкали WOMAC, індексу M. Lequesne, динаміки синовіального випоту і гострофазових показників через 12 тиж застосування як набуметону, так і диклофенаку натрію. При оцінці переносимості препаратів у пацієнтів, які застосовували набуметон, був вірогідно нижчий ризик побічних ефектів, ніж у групі диклофенаку натрію.
Висновки
1. У пацієнтів із ОА та дисліпідемією встановлено позитивний вплив комплексного лікування набуметоном та диклофенаком натрію з фенофібратом щодо комбінованої дисліпідемії, а саме оптимізація показників ТГ, ЛПВЩ.
2. Набуметон та диклофенак натрію при тривалому застосуванні спричиняють вірогідне зменшення синовіального випоту на фоні зниження активності лабораторних гострофазових показників — ШОЕ, СРП.
3. Через 12 тиж лікування, за оцінками пацієнтами власного стану за ВАШ, шкалою WOMAC та індексом Lequesne, відзначено значне покращання перебігу ОА з дисліпідемією.
4. При однаковій клінічній ефективності набуметону та диклофенаку натрію впродовж 12 тиж у групі пацієнтів із ОА та дисліпідемією, які приймали диклофенак натрію, встановлено вищу частоту таких ефектів, як гіпертензивний криз, набряки на нижніх кінцівках, підвищення рівня АлАТ та дискомфорт в епігастрії порівняно з групою набуметону.
Список використаної літератури
- Коваленко В.М., Корнацький В.М. (2011) Регіональні особливості рівня здоров’я народу України: Аналіт.-статист. посібник. Київ, 165 с.
- Насонова В.А. (2004) Вольтарен (диклофенак натрия) в ревматологии в начале XXI века. (РМЖ) Русский медицинский журнал, 12(6): 1380–1385.
- Мендель О.И., Наумов А.В., Алексеева Л.И. и др. (2011) Остеоартроз как фактор риска кардиоваскулярных катастроф, Ліки України, 2: 64–70.
- Проценко Г.О. (2009) Алгоритм діагностики та лікування хворих на остеоартроз. Укр. ревматол. журн., 3: 91–94.
- Реброва О.Ю. (2004) Статистический анализ медицинских данных. Применение пакета прикладных программ STATISTICA. Медиа-сфера, Москва, 312 с.
- Якименко Е.А., Ефременкова Л.Н. (2012) Ожирение, остеоартроз и сопутствующие заболевания. Актуальные проблемы транспортной медицины., 2: 51–54.
- Артеменко Н.А., Чвамания М.О. (2009) Клинические и лабораторные особенности различных форм остеоартроза. Клин. медицина, 2: 45–50.
- Altman R.D. (2010) New guidelines for topical NSAIDs in the osteoarthritis treatment paradigm Curr. Med. Res. Opin., 26(12): 2871–2876.
- Hochberg M.C., Altman R.D., April K.T. et al. (2012) American College of Rheumatology 2012 recommendations for the use of non-pharmacologic and pharmacologic therapies in osteoarthritis of the hand, hip, and knee. Arthritis Care Res., 64: 465–474.
- Baraf H.S. (2011) Safety and efficacy of topical diclofenac sodium gel for knee osteoarthritis in elderly and younger patients: pooled data from three randomized, double-blind, parallel-group, placebo-controlled, multicentre trials / H.S. Baraf, F.M. Gloth, H.R. Barthel et al. Drugs Aging., 28(1): 27–40.
- Fakhari A., Berkland С. (2013) Applications and emerging trends of hyaluronic acid in tissue engineering, as a dermal filler and in osteoarthritis treatment. Acta Biomater., 9(7): 7081–7092.
- Makris U.E., Kohler M.J., Fraenkel L. (2010) Adverse effects of topical non-steroidal antiinflammatory drugs in older adults with osteoarthritis: a systematic literature review. J. Rheumatol., 37(6): 1236–1243.
- Stanos S.P. (2013) Osteoarthritis guidelines: a progressive role for topical nonsteroidal anti-inflammatory drugs. J. Multidiscip. Healthc., 6: 133–137.
Актуальные вопросы лечения больных остеоартритом на фоне комбинированной дислипидемии
Резюме. В статье представлены данные исследования клинической эффективности и переносимости набуметона, диклофенака натрия и фенофибрата в комплексном применении у пациентов с остеоартритом и комбинированной дислипидемией. Выявлено позитивное влияние лечения на течение остеоартрита и комбинированной дислипидемии. Через 12 нед терапии в обеих группах установлено достоверное уменьшение синовиального выпота, снижение скорости оседания эритроцитов, С-реактивного протеина, а также значительное улучшение клинического течения остеоартрита с дислипидемией. При одинаковой клинической эффективности набуметона и диклофенака в группе, где применяли диклофенак, установлена более высокая частота таких эффектов, гипертензивных кризов, отеков нижних конечностей, повышения аланинаминотрансферазы и дискомфорт в эпигастральной области по сравнению с набуметоном.
Ключевые слова: остеоартрит, комбинированная дислипидемия, набуметон, диклофенак натрия, клиническая эффективность, переносимость.
Адреса для листування:
Проценко Галина Олександрівна
03680, Київ, вул. Народного ополчення, 5
ДУ «ННЦ «Інститут кардіології ім. М.Д. Стражеска» НАМН України»

Leave a comment