Підвищення цінності шкали CHA2DS2-VASc у визначенні ризику тромбоемболічних подій у пацієнтів із хронічною ревматичною хворобою серця
Кузьміна А.П. 1, Сміян С.І.2, Хакімова Т.В.1
- 1ДЗ «Дніпропетровська медична академія МОЗ України»
- 2Тернопільський державний медичний університет ім. І.Я. Горбачевського
Резюме. Розглянуто окремі показники гемокоагуляції, які дозволяють підвищити прогнозовану цінність шкали ризику негативних системних тромбоемболічних подій CHA2DS2-VASc у пацієнтів із хронічною ревматичною хворобою серця.
Актуальність
Незважаючи на суттєві успіхи, досягнуті у ХХ ст. в лікуванні та профілактиці гострої ревматичної лихоманки (ГРЛ), останнім часом стало очевидно, що ця проблема далека від вирішення і продовжує зберігати актуальність. У світі у майже 15,6 млн осіб діагностовано хронічну ревматичну хворобу серця (ХРХС), причому щороку реєструють 470 тис. випадків ГРЛ і 233 тис. летальних випадків, зумовлених ГРЛ і ХРХС. В Українi ХРХС констатовано у близько 150 тис. пацієнтів, захворюванiсть становить 14,8 на 100 тис. населення, iнвалiднiсть — 88,1%, а лiкарняна летальнiсть — 1,6%. Спостерігається збiльшення медико-соцiального навантаження на суспiльство внаслідок ХРХС, ускладнення якої є причиною передчасної летальності.
Всесвітня організація охорони здоров’я і Всесвітня федерація серця фінансують проект «RHD», cпрямований на профілактику і лікування ревматичної хвороби в Беніні, Бразилії, Румунії, В’єтнамі, Вануату, на Кубі, а також у країнах Тихого океану та Африки. Для контролю захворюваності на ХРХС у світі створено суспільний ресурс World Heart Federation, на якому представлена інформація як для лікаря, так і для пацієнта щодо діагностики і лікування цієї хвороби (http://www.world-heart-federation.org).
Відомими причинами, що мають несприятливий вплив на перебіг ХРХС, навіть за умов хірургічної корекції вад серця, вважають серцеву недостатність, легеневу гіпертензію, миготливу аритмію, інфекційний ендокардит, які, в свою чергу, підвищують ризик смерті внаслідок тромбемболії легеневої артерії, ішемічного інсульту (Akinwusi P.O. et al., 2013). Так, за даними P.O. Akinwusi та співавторів (2013), серцева недостатність — найбільш поширене ускладнення, що констатується у 90,9%, вторинна легенева гіпертензія — у 36,4%, інфекційний ендокардит у 27,3%, миготлива аритмія — у 27,3%, кардіоемболічний цереброваскулярний інсульт — у 18,2% випадків, при цьому летальність становить 9,1% (Mirhosseini S.J. et al., 2012). Як продемонстровано в дослідженні S.J. Mirhosseini та співавторів (2012), етіологія вади серця має вагоме значення для прогнозу післяопереційних ускладнень, оскільки за умов ревматичного захворювання частота несприятливих подій достовірно зростає, що зумовлено впливом системного запалення на процеси гемокоагуляції (Rehman S. et al., 2013). Це підтверджено і в інших дослідженнях, зокрема S. Rehman та співавтори (2013) стверджують, що превентивні заходи за умов ХРХС — це перш за все запобігання смертності пацієнтів цієї когорти (Gungor B. et al., 2013).
Мета дослідження — встановити роль окремих показників гемокоагуляції, які підвищують прогнозовану цінність шкали ризику негативних системних тромбоемболічних подій CHA2DS2-VASc у пацієнтів із ХРХС.
ОБ’ЄКТ І МЕТОДИ ДОСЛІДЖЕННЯ
Під спостереженням перебували 100 пацієнтів із ХРХС віком від 27 до 63 років, тривалість набутої вади серця становила в середньому 18,1±1,45 року. Недостатність мітрального клапана констатовано у 90% хворих, стеноз лівого атріовентрикулярного отвору — у 46%, недостатність півмісяцевих клапанів аорти — у 62%, стеноз гирла аорти — у 18%, недостатність тристулкового клапана — у 8%. Комбіновану мітральну ваду визначали майже у половини пацієнтів, а аортальну — у 10%. Поєднану ваду визначали у 62% (мітрально-аортальну), мітрально-трикуспідальну і аортально-трикуспідальну — у 1%, мітрально-аортально-трикуспідальну — у 8%. На попередніх етапах 16% хворим виконано мітральну комісуротомію, 11% — протезування мітрального клапана, 5% — аортального. У 20% хворих діагностовано 1 ваду; у 35% — 2; 45% — 3. Майже у 90% активність ревматичного процесу була низькою чи відсутньою. Згідно з класифікацією Нью-Йорської асоціації серця (NYHA), I функцiональний класс серцевої недостатності констатовано у 23% пацієнтів, II — 45%, III — 32%. Серед загальноприйнятих методів дослідження, визначали стандартні й гематологічні показники, які віддзеркалюють стан гемокоагуляції. Усім хворим проводили електрокардіографію, трансторакальну й за необхідності — черезстравохідну ехокардіографію (ехоКГ). Ступінь активності ревматичного процесу оцінювали за загальноклінічним та біохімічним аналізами крові (брали до увагу — індекси еритроцитів і тромбоцитів, концентрацію високочутливого С-реактивного білка (вчСРБ), сіалових кислот, антистрептолізину О, параметри протеїнограми, імунограми з врахуванням рівня імуноглобулінів A,M,G та фактора некрозу пухлин (TNF), інтерлейкіну (ІL)-4, -6, -8, -10). Серед індексів периферичної крові нами проаналізовано зміни показника ширини розподілу (RDW), який є показником гетерогенності еритроцитів і розраховується як коефіцієнт варіації середнього об’єму еритроцитів. Оцiнювали низку гемокоагуляцiйних показникiв із метою визначення найбiльш інформативних для підвищення цінності шкали ризику негативних системних тромбоемболічних подій за шкалою CHA2DS2-VASc.
Для оцінки ризиків у пацієнтів із ХРХС нами вибрано шкалу CHA2DS2-VASс (2010) (табл. 1).
| Фактор ризику | Бали | |
|---|---|---|
| Вік, років | <65 65–74 ≥75 |
+0 +1 +2 |
| Застійна серцева недостатність або дисфункція лівого шлуночка? | Так | +1 |
| Артеріальна гіпертензія? | Так | +1 |
| Інсульт? Транзиторна ішемічна атака? Тромбоемболія легеневої артерії в анамнезі? |
Так | +2 |
| Захворювання судин? Перенесений інфаркт міокарда? |
Так | +1 |
| Цукровий діабет? | Так | +1 |
| Жіноча стать? | Так | +1 |
РЕЗУЛЬТАТИ ДОСЛІДЖЕННЯ
Серед 82 пацієнтів із ХРХС, які перебували під спостереженням, у 19 (з прогресуючим фіброзом клапанів серця) визначено високі рівні прозапальних та протизапальних цитокінів. Результати отриманих даних свідчать, що провідна роль у формуванні вади серця належала TNF (124,67±21,30 пг/мл). При цьому рівень IL-4 становив 182,12±29,25 пг/мл, IL-8 — 82,45±25,16 пг/мл та IL-10 — 140,33±22,09 пг/мл, що підтверджує гіпотезу щодо ролі прозапальних та протизапальних цитокінів у прогресуванні фіброзу клапанів серця внаслідок їх ревматичного запалення. Разом із тим нами встановлено помірну кореляцію між рівнями TNF, IL-4, -8, -10, вчСРБ та RDW (r=0,132; r=0,166; r=0,218; r=0,141; r=0,233; р<0,05 відповідно). Як відомо, окремі маркери запалення — вчСРБ, TNF, IL-6 — пов’язані в першу чергу з миготливою аритмією (Roldán V. et al., 2011). Вважають, що підвищення рівня вчСРБ супроводжується зростанням в’язкісних властивостей крові та рівня фібриногену, а підвищення рівня IL-6 — експресією фактора тканини.
Для визначення прогностичного значення RDW проведено аналіз результатів, за даними якого встановлена кореляція між рівнем індексу RDW і значенням індексу CHADS (р<0,05). Визначена прогностична цінність підвищеного рівня RDW, який є незалежним від значення індексів CHADS2 і CHA2DS2-VASc. RDW позитивно корелює з предикторами кардіоваскулярних подій, такими як гомоцистеїн (р<0,05), вчСРБ (р<0,05), креатинін (р<0,05), та зворотно — зі швидкістю клубочкової фільтрації (р>0,05). Крім того, RDW показав помірну кореляцію з рівнем гемоглобіну (r=–0,138; р<0,05) та індексом середнього об’єму еритроцитів (МСV) (86,1–92,5 fl), (r=–0,298; р<0,05). Визначено, що медіальне значення RDW позитивно корелює з віком — (r=0,167; р<0,001), класом NYHA (r=0,272; р=0,001), наявністю фібриляції передсердь (ФП) (r=0,141; р<0,01). Нещодавно при субаналізі програми дослідження «CHARM» запропоновано враховувати RDW як новий прогностичний маркер (навіть при довготривалому спостереженні) при хронічній серцевій недостатності у пацієнтів з ішемічною хворобою серця. Згідно з висновками дослідження «CHARM», RDW корисно визначати для стратифікації ризику в популяції госпіталізованих пацієнтів із серцевою недостатністю й аналізу прогнозу на тривалий термін. RDW не залежить від статі, гематологічних показників. RDW може бути раннім маркером прогнозу, на відміну від гемоглобіну, оскільки він може відтворювати приховані процеси, пов’язані з анемічним синдромом, коли відбувається неефективна продукція чи зростає руйнування еритроцитів за умов нормального рiвня гемоглобіну. Значення RDW може впливати на смертність, спричинену механізмами, не зумовленими анемією, наприклад за умов хронічних захворювань. Прогностичне значення RDW не асоціюється зі статусом анемічного синдрому. Зростаючий рівень індексу RDW на момент виписки пацієнтів зі стаціонару (незважаючи на проведену терапію) є свідченням небажаних віддалених подій у майбутньому. RDW є раннім маркером прогнозу, на відміну від гемоглобіну, оскільки він демонструє приховані процеси, пов’язані з анемічним синдромом, а саме неефективною продукцією чи зростаючим руйнуванням еритроцитів (при нормальному рiвнi гемоглобіну). Індекс RDW не залежить від рівня гемоглобіну й анемічного статусу. RDW також може віддзеркалювати дисфункцію кісткового мозку, системне запалення чи становити собою інтегровану міру патологічного процесу у хворих. Зростання RDW на фоні терапії є свідченням неефективності останньої.
З іншого боку, гострофазові запальні реакції, що супроводжують будь-яке ревматичне захворювання, суттєво активують синтез окремих факторів гемостазу. В численних наукових роботах висвітлено та встановлено зв’язок між рівнем Д-димеру і ризиком розвитку тромбоемболічних ускладнень (ТЕУ) у хворих на миготливу аритмію (які отримують антикоагулянти) (Hart R.G. et al., 2000; Gurlertop Y. et al., 2004a). Аналогічний зв’язок продемонстровано й для фактора фон Вілебранда (ФфВ) — у дослідженні SPAF ІІІ, де його рівень показано як незалежний предиктор розвитку ТЕУ. Крім того, продемонстрована кореляція між рівнем ФфВ зі значенням індекса CHADS і рівнем маркерів запалення та гіперкоагуляції. У дослідженні V. Roldán та співавторів (2011) встановлено, що зростання ФфВ >22,1 МЕ/л є незалежним фактором розвитку серцево-судинних ускладнень (ВШ 2,47; 95% ДІ 1,78–4,13; р<0,001), загальної смертності (ВШ 2,03; 95% ДІ 1,24–3,32; р<0,005) і смертності від серцево-судинних хвороб (ВШ 3,05; 95% ДІ 1,30–7,17; р<0,011). Прогнозована цінність підвищеного рівня ФфВ, що не залежить від значення індексу CHADS2 і CHA2DS2-VASc. Тому додавання до шкали CHADS2 значення ФфВ дозволяє підвищити її прогностичну цінність. У групах високого та низького ризику цей параметр має незначний вплив, що неможливо позначити у групі проміжного ризику, де він був принципово важливим. Так, у групі хворих із рівнем ФфВ <22 МЕ/л ризик розвитку тромбоемболії становить 2,2%; >22 МЕ/л — 8% (ВШ 3,64; 95% ДІ 1,87–7,06; р<0,001) (Зотова И.В. и соавт., 2013). Тому додавання цього параметра до стратифікаційної шкали дозволяє перевести частину хворих із групи проміжного ризику в групу високого ризику. І навпаки, при проведенні коригувальної терапії антикоагулянтами та у разі досягнення керованої гіпокоагуляції усувається негативний вплив ФфВ.
До факторів, що також підвищують ризик ТЕУ у хворих із ФП, відносять велику кількість безсимптомних пароксизмів. Крім того, загальна тривалість епізодів аритмії, оціненої за даними тривалого моніторингу електрокардіограми, є важливим фактором ризику розвитку ТЕУ. За даними G. Borianі та співавторів (2011), встановлено, що найвищий ризик розвитку тромбоемболії за рік спостереження констатовано у тих хворих, у яких протягом року епізоди миготливої аритмії були тривалістю ≥24 год (частота ускладнень — 4%). Якщо максимальна загальна тривалість миготливої аритмії була <1 доби, але >5 хв, то частота ускладнень становила 1,7%, а при максимальній загальній тривалості миготливої аритмії <5 хв — 1,2%. Додавання параметра ФфВ до шкали CHADS2 і CHA2DS2-VASc дозволило підвищити специфічність із 24 до 42%, а чутливість CHADS2 і CHA2DS2-VASc — до 100% (Gurlertop Y. et al., 2004b; Okello E. et al., 2013). Ризик інсульту при пароксизмальній миготливій аритмії нижчий, ніж при постійній формі і вищий, ніж при синусовому ритмі. Однак, коли було враховано всі фактори ризику, то з’ясувалося, що при пароксизмальній миготливій аритмії спостерігається такий же відносний ризик інсульту, як за умов постійної (Hart R.G. et al., 2000). Ендотеліальна дисфункція, яка супроводжується підвищеним рівнем ФфВ, також сприяє зростанню ризику інсульту при миготливій аритмії.
Шкалу CHA2DS2-VASc доповнює і спонтанне контрастування. Відомо, що у хворих із мітральним стенозом і після протезування клапанів при проведенні черезстравохідної ехоКГ у 87,5% випадків відзначають спонтанне контрастування (Gurlertop Y. et al., 2004a, b). Спонтанне контрастування описують як контрастні повільно рухомі в порожнинах серця хмароподібні ехосигнали, що є феноменом ризику тромбозу вушка лівого передсердя (ЛП) та ТЕУ в цієї когорти пацієнтів. У розвитку спонтанного контрастування відіграють роль не лише агрегаційні здібності тромбоцитів і еритроцитів (у тому числі фібриноген), а й активація симпатичної нервової системи. При обстеженні хворих із ревматичною вадою мітрального клапана у 50% виявили спонтанне контрастування. Значення стандартного відхилення інтервалів R–R <90 мс із високою специфічністю (90%) передбачало наявність спонтанного контрастування. При цьому відношення потужності в діапазоні високих частот (LFnu/HFnu) >3,7 передбачало наявність спонтанного контрастування з чутливістю 96% і специфічністю 90% (відношення характеризує баланс симпатичних і парасимпатичних впливів). Якщо передньозадній розмір ЛП >4,3 см, частота спонтанного контрастування зростає у 3 рази, якщо стандартне відхилення інтервалів R–R <90 мс — в 9,2 раза, при відношенні LFnu/HFnu, що >3,7 — в 6,4 раза. В ретроспективному дослiдженнi доведено, що ризик ТЕУ у хворих із миготливою аритмiєю і спонтанним контрастуванням >22%, незважаючи на терапiю антикоагулянтами ТЕУ при миготливiй аритмiї. Водночас вона призводить до зростання тиску у ЛП i його дилатацiї. У хворих із ревматичними вадами серця і пароксизмальною формою миготливої аритмії показано, що чим вищий ступінь мітральної недостатності, тим менше частота тромбозу вушка ЛП. Чим вищим був рівень вчСРБ, тим більш вираженим було спонтанне контрастування ЛП (р<0,05). Підвищення рівня вчСРБ корелювало зі зростанням ризику ТЕУ за критеріями CHADS2. В окремих випадках зростання значення за шкалою CHA2DS2-VASc корелювало зi зниженням фракцiї викиду лiвого шлуночка та зростанням передньозаднього розмiру ЛП (р<0,05). Обмеження у проведеннi черезстравохідної ехоКГ при миготливiй аритмiї, на жаль, зменшує нашi можливості для того, щоб зробити остаточний висновок із цього приводу.
Прогностична цінність модифікованої бірмінгемської схеми вища у разі додаткового розгляду параметрів системи гемостазу (ФфВ, RDW), ехокардіографічних факторів ризику (спонтанне контрастування). Завдяки поєднаному оцінюванню шкали CHA2DS2-VASc і наведених параметрів посилюється потужність першої. Крім того, пацієнти групи проміжного ризику переходять на більш високий. Так, при аналізі групи 82 пацієнтів із ХРХС в групу проміжного ризику за шкалою CHA2DS2-VASc потрапили >30%, тоді як оцінювання рівня RDW та ФфВ посилювало визначеність цієї схеми. Від суми балів залежав ризик ТЕУ. У пацієнтів із ХРХС при сумі балів 1–4 ризик ТЕУ коливався від 1,4 до 4%; 5–7 — 5,4 до 9,8%; >7 — 7,4 до 14,8%.
Застосування шкали CHA2DS2-VASc надає можливість розширити профілактичні та лікувальні заходив, у тому числі й у пацієнтів із ХРХС. У осіб із ХРХС без ураження клапанів серця, але ускладненою ФП профілактика ТЕУ залежить від суми балів за шкалою CHA2DS2-VASс (табл. 2).
| Сума балів за шкалоюCHA2DS2-VASс | Антитромботична терапія | Препарат вибору |
|---|---|---|
| ≥2 | Пероральні антикоагулянти |
Якщо сума балів за шкалою HAS-BLED ≤2 Дабігатран 150 мг 2 рази на добу Якщо сума балів за шкалою HAS-BLED ≥3 Дабігатран 110 мг 2 рази на добу |
| 1 | Пероральні антикоагулянти |
Якщо сума балів за шкалою HAS-BLED ≤2 Дабігатран 150 мг 2 рази на добу Якщо сума балів за шкалою HAS-BLED ≥3 Дабігатран 110 мг 2 рази на добу |
| 0 | Без тромботичної терапії | Без тромботичної терапії |
У разі ФП керувалися алгоритмом на підставі рекомендацій ESC (2012) щодо застосування антикоагулянтної терапії (включаючи ревматичну ваду серця) з урахуванням ризику кровотеч за шкалою HAS-BLED (рисунок).
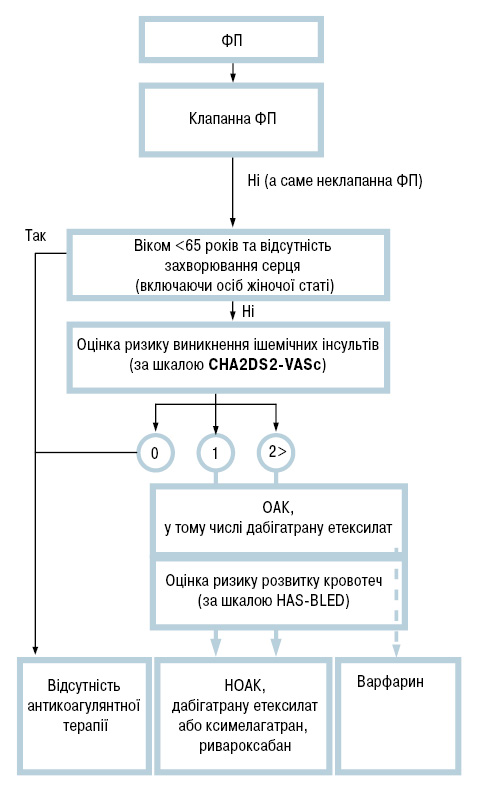
Таким чином, у пацієнтів із ХРХС набуває чинності шкала CHA2DS2-VASc (модифікована бірмінгемська схема, 2009), яка з високою ймовірністю оцінює ризик негативних системних тромбоемболічних подій. У сучасні шкали стратифікації не включена ціла низка додаткових факторів ризику ТЕУ, наприклад параметри системи гемостазу, ехокардіографічні фактори ризику, тривалість, причому серед цих параметрiв існують такi, що модифiкуються. До прогнознегативних параметрів у пацієнтів із ХРХС належить зростання ширини розподілу еритроцитів (RDW), а також рівня ФфВ. Прогностична цінність модифікованої бiрмiнгемської схеми вища, якщо додатково враховуються індекс RDW і рівень ФфВ. Не викликає сумніву вагоме значення індексу RDW у розвитку тромбоемболічних подій у пацiєнтiв із ХРХС, про що свідчать встановлені кореляційні взаємозв’язки з параметрами крові. Потужність шкали CHA2DS2-VASc у цьому випадку посилюється параметром ФфВ. Тому додавання цього параметра до стратифікаційної шкали дозволяє перевести частину хворих із групи проміжного ризику в групу високого ризику. Крім того, цей параметр суттєво модифікується антикоагулянтами у поєднанні з засобами, що впливають на запалення.
список використаної Літератури
- Зотова И.В., Затейщиков Д.А., Сидоренко Б.А (2013) Механизмы развития тромбоэмболических осложнений у больных с мерцательной аритмией. Кардиология, 3: 72–80.
- Akinwusi P.O., Peter J.O., Oyedeji A.T. et al. (2013) The new face of rheumatic heart disease in South West Nigeria. Int. J. Gen. Med., 23(6): 375–381.
- Boriani G., Biffi M., Diemberg I. (2011) The Challenge of Preventing Stroke in Elderly Patients With Atrial Fibrillation. J. Cardiovasc. Electrophysiol., 22: 31–33.
- Gungor B., Ekmekci A., Arman A. et al. (2013) Assessment of Interleukin-1 Gene Cluster Polymorphisms in Lone Atrial Fibrillation: New Insight into the Role ofInflammation in Atrial Fibrillation. Pacing Clin. Electrophysiol., 2013 May 28 (doi: 10.1111/pace.12182) [Epub ahead of print].
- Gurlertop Y., Yilmaz M., Acicel M. et al. (2004a) Predictors of left atrial appendage clot: a transesofageal echocardiographic study of left atrial appendage function in patient with severe mitral stenosis. Indian Heart J., 56(6): 628–635.
- Gurlertop Y., Yilmaz M., Acikel M. et al. (2004b) Tissue Doppler properties of the left atrial appendage in patients with mitral valve disease. Echocardiography., 21(4): 319–324.
- Hart R.G., Pearce L.A., Rothbart R.M. et al. (2000) Stroke with intermittent atrial fibrillation: incidence and predictors during aspirin therapy. J. Am. Coll. Cardiol., 35: 183–187.
- Mirhosseini S.J., Ali-Hassan-Sayegh S., Hadadzadeh M. et al. (2012)Atrial Fibrillation and Early Clinical Outcomes After Mitral Valve Surgery in Patients with Rheumatic vs. Non-Rheumatic Mitral Stenosis. Heart Views.,13(4): 136–138.
- Okello E., Wanzhu Z., Musoke C. et al. (2013) Cardiovascular complications in newly diagnosed rheumatic heart disease patients at Mulago Hospital, Uganda. Cardiovasc. J. Afr., 24(3): 82–87.
- Rehman S., Akhtar N., Saba N. et al. (2013) A study on the association of TNF-α (-308), IL-6 (-174), IL-10 (-1082) and IL-1Ra (VNTR) gene polymorphisms withrheumatic heart disease in Pakistani patients. Cytokine., 61(2): 527–531.
- Roldán V., Marín F., Muiña В. et al. (2011) Plasma von Willebrand Factor Levels Are an Independent Risk Factor for Adverse Events Including Mortality and Major Bleeding in Anticoagulated Atrial Fibrillation Patients FREE. Am. Coll. Cardiol., 57(25): 2496–2504.
ПОВЫШЕНИЕ ЦЕННОСТИ ШКАЛЫ CHA2DS2-VASc В ОПРЕДЕЛЕНИИ РИСКА ТРОМБОЭМБОЛИЧЕСКИХ СОБЫТИЙ У пациентов с ХРОНИЧЕСКОЙ РЕВМАТИЧЕСКОЙ БОЛЕЗНЬЮ СЕРДЦА
Резюме. Рассмотрены отдельные показатели гемокоагуляции, позволяющие повысить предполагаемую ценность шкалы риска негативных системных тромбоэмболических событий CHA2DS2-VASc у пациентов с хронической ревматической болезнью сердца.
гемокоагуляция, тромбоэмболизм, ревматическая болезнь сердца.
Адреса для листування:
Кузьміна Анна Петрівна
50084, Кривий Ріг, пл. Незалежності, 2
2-га Міська лікарня,
кафедра терапії, кардіології
і сімейної медицини

Leave a comment