ІНДИВІДУАЛІЗАЦІЯ ЛІКУВАННЯ РЕВМАТОЇДНОГО АРТРИТУ: КУРС НА ДОСЯГНЕННЯ ОПТИМАЛЬНИХ РЕЗУЛЬТАТІВ
Коваленко В.Н., Борткевич О.П.
Резюме. У статті узагальнено і представлено сучасні тенденції у стратегії ведення пацієнтів з ревматоїдним артритом, спрямовані на досягнення клінічної ремісії в найближчі строки. Найголовнішим принципом ведення пацієнтів з ревматоїдним артритом практикуючими ревматологами вважається рання діагностика захворювання, негайний початок терапії із застосуванням традиційних базисних протиревматичних препаратів або біологічної терапії, постійний частий моніторинг активності запалення і лікування, що враховує індивідуальні особливості пацієнта. Наведено дані останніх досліджень щодо вибору тактики лікування при ревматоїдному артриті та ефективності препаратів біологічної та небіологічної терапії. Розкрито сучасні підходи до вибору препаратів біологічної терапії на підставі аналізу проведених досліджень, результати яких лягли в основу сучасного менеджменту ревматоїдного артриту. Детально проаналізовані останні клінічні випробування біологічних препаратів у лікуванні ревматоїдного артриту, що стосуються стратегії ведення пацієнтів і вибору найоптимальнішого методу лікування, спрямованого на досягнення ремісії ревматоїдного артриту.
Ревматоидный артрит (РА) представляет собой заболевание, в изучение и терапию которого вовлечено большинство основных общемедицинских проблем — закономерности развития иммунитета, аутоиммунные реакции, воспаление, медицинская генетика, костный метаболизм, остеопороз и др. Поэтому успехи в данных сферах медицины и в исследованиях РА как конкретной нозологической единицы оказывают взаимное положительное и развивающее влияние. В частности крупный прогресс в расшифровке общих закономерностей иммунных реакций и в установлении важнейшей роли цитокинов обусловил покорение принципиально новых вершин в лечении РА [3, 7, 41, 48]. В основе этих достижений лежит вмешательство в главные звенья патогенеза заболевания, что приводит к торможению основного патологического процесса при РА — аутоиммунного воспаления [2]. При этом исследователи не только использовали естественные биологические системы в качестве объектов воздействия, но и имитировали эти системы для создания средств терапии. Не случайно этот новый подход к лечению РА в конце XX в. получил название биологической терапии.
Термины «биологическая терапия» или «методы биологической терапии» в ревматологии начали применяться недавно и еще не имеют пока унифицированного определения. Предполагается, что их можно определить как использование в терапевтических целях активных веществ и механизмов, которые играют существенную роль в естественном функционировании основных биологических систем организма, — антител, цитокинов, клеточных рецепторов, их антагонистов и т.д.
Современное ведение больных РА основано на ранней диагностике и активном (агрессивном) лечении [4, 40]. В связи с расширившимися терапевтическими возможностями выбор оптимальной схемы терапии становится все более сложным. Драматическое улучшение прогноза РА связано преимущественно с внедрением в практику за последнее десятилетие нового класса иммуносупрессивных медикаментозных средств — биологических препаратов, в первую очередь, ингибиторов фактора некроза опухоли (ФНО)-α. Именно эти агенты, несмотря на появление препаратов с другими механизмами действия, остаются наиболее часто назначаемой группой препаратов биологического действия [2, 45].
Появление генно-инженерной биологической терапии произвело революцию в РА. Еще десятилетие назад лечение пациентов с РА было ограничено только базисными противоревматическими препаратами, что создавало определенные трудности в курации больных с выраженным эрозивным поражением суставов и активным прогрессирующим течением.
За последнее десятилетие в целом изменился взгляд на проблему РА [11, 48]. Показано, что раннее применение базисных противовоспалительных препаратов (БПВП) позволяет эффективно сдерживать формирование необратимых изменений суставов и улучшать функциональный статус [4]. Принцип «пирамиды», на котором базировалось лечение РА в 90-е годы прошлого века и в начале XXI ст., канул в Лету. Также забыта пословица «идем низко, двигаемся медленно» («go low and go slow»), которая касалась медленного наращивания доз базисных препаратов. Разработка суммарных показателей на основе базового набора наиболее информативных признаков обеспечила возможность надежного определения уровня активности РА. Появились новые высокоэффективные препараты, в первую очередь, биологические, позволяющие значительно улучшить качество медицинской помощи. Установлено, что лечение, направленное на достижение низкой активности болезни, обеспечивает гораздо более благоприятные результаты, чем традиционный способ ведения больных. Наконец, ремиссия РА на сегодняшний день может рассматриваться как вполне реальная и достижимая цель [15, 40, 41].
Если еще 10–15 лет назад 20% улучшение состояния больного могло считаться терапевтическим успехом, а достижение клинической ремиссии — редкой удачей, то в настоящее время [41] реальными задачами лечения стали:
- купирование симптомов заболевания;
- достижение клинической ремиссии или как минимум низкой активности болезни;
- торможение прогрессирования деструкции и нормализация функции суставов;
- улучшение качества жизни больных, сохранение трудоспособности;
- увеличение продолжительности жизни до популяционного уровня.
Поэтому врачи стремятся получить наилучшие результаты, что требует дополнительных усилий: новые эффективные препараты, тактика лечения, своевременный мониторинг, ранняя диагностика с помощью новых технологий и т.д.
Существенным образом изменилась и тактика лечения РА, и набор медикаментозных средств [7, 10]. В 90-е года ХХ ст. метотрексат стал активно вытеснять другие БПВП, такие как парентеральные препараты золота и аминохинолиновые препараты; немного позже расширение знаний и понимания патогенеза РА привело к появлению биологических препаратов. Сегодня менеджмент РА регулируется принципами ранней диагностики, немедленного начала терапии БПВП или биологическими агентами, частыми оценками эффективности терапии по достижению ремиссии и мониторинга побочных эффектов (табл. 1).
В настоящее время усилия научных работников в сфере ревматологии направлены на выявление генетических маркеров риска и биомаркеров, что в будущем сможет обеспечить индивидуализацию и персонализацию лечения больных.
Одновременно установленным фактом является то, что комбинационная терапия позволяет быстрее достичь ответа на лечение и поддержать это преимущество, что делает достижение ремиссии при РА вполне реальной целью.
| Цель | – МИНИМИЗАЦИЯ КУМУЛЯТИВНОГО ВОСПАЛЕНИЯ | ||
|---|---|---|---|
| ОСНОВНЫЕ ПРИНЦИПЫ | Раннее выявление РА | ||
| 1. Немедленное назначение лечения2. Поддержание высокого уровня контроля за воспалением для улучшения последствий РА3. Индивидуализация лечения РА, что базируется на соотношении преимущество/риск для каждого пациента | НАПРАВЛЕНИЯ ЛЕЧЕНИЯ |
1. Раннее применение БПВП2. Мониторинг ответа на лечение, пересмотр графика последующих визитов с целью учащения3. Эскалационная (наращивающая) терапия — подбор максимально эффективной дозы БПВП
4. Использования комбинированной терапии 5. Использование биологической терапии в случае неадекватного ответа на препараты небиологической терапии (БПВП) 6. Применение препаратов второй линии биологической терапии в случае неэффективности препаратов первой линии |
|
Несколько крупных исследований (например BeST, PREMIER, TEMPO, SWEFOT, TEAR, OPTIMA, другие) продемонстрировали улучшение результатов лечения пациентов, в том числе торможение рентгенологической прогрессии РА и предупреждение развития осложнений, при использовании комбинаций БПВП с биологическими препаратами, позволяющих добиться более значимых результатов в достижении более низкой активности РА и ремиссии [47]. Тем не менее, неоднородность РА является общепризнанным фактом, что затрудняет, с одной стороны, контроль заболевания, а с другой, обусловливает гетерогенность ответа на БПВП и биологическую терапию [2, 10]. Если одному пациенту для достижения низкой активности РА достаточно монотерапии одним из стандартных БПВП, то другому требуется комбинированная терапия с ранним включением препаратов биологического действия. Еще в 80-х годах XX в. стало очевидным, что проблема гетерогенности РА и индивидуализации стратегии имеет первостепенную важность, ибо в зависимости от их трактовки решаются вопросы прогнозирования заболевания и оценки эффективности применяемой терапии [9]. Оценка активности болезни на ранней стадии и ее дальнейшее тщательное мониторирование — один из ключевых моментов для индивидуализации лечения и улучшения его результатов [31].
Перед практикующими врачами встает вопрос выбора оптимальной стратегии лечения для каждого конкретного пациента, выбор наиболее подходящего препарата и время перехода на новый этап терапии, когда ответ на предыдущее лечение является неполным или неадекватным. Поэтому сейчас основные усилия фокусируются на индивидуализацию лечения РА, основанные на особенностях клинического течения РА и ответа на терапию.
Сегодня врачам-ревматологам доступно 9 биологических препаратов для лечения РА [45], в том числе 5 блокаторов ФНО-α (инфликсимаб, адалимумаб, этанерцепт, голимумаб, цертолизумаб), модулятор Т-клеточной костимуляции (абатацепт), блокатор рецепторов интерлейкина (ИЛ)-1 (анакинра), блокатор рецепторов ИЛ-6 (тоцилизумаб), В-клеточный агент (ритуксимаб) (табл. 2). К сожалению, некоторые их этих препаратов еще не зарегистрированы в Украине, однако, учитывая темпы роста фармацевтического рынка и международных связей, это дело недалекого будущего. Основные патофизиологические пути, на которые направлена биологическая активность этих препаратов при РА в сравнении с базисными противоревматическими препаратами, схематически представлена на рис. 1.
| Препарат, действие | Структура | Показания | Доза |
|---|---|---|---|
| Абатацепт — модулятор Т-клеточной костимуляции | Растворимая гибридная белковая молекула, состоящая из внеклеточного домена человеческого СTLA4 (Cytotoxic T-Lymphocyte-associated Antigen 4), сцепленного с модифицированным Fc фрагментом человеческого IgG |
Уменьшает признаки и симптомы, ингибирует прогрессию структурных повреждений, улучшает физическую функцию у пациентов со средним и тяжелым течением РА | 500–1000 мг внутривенно на 2-й и 4-й неделе после инициальной инфузии и каждую 4-ю неделю после этого |
| Ритуксимаб — анти–В-клеточный агент | Химерные моноклональные антитела к молекулеCD20 на мембране В-клеток | В комбинации с метотрексатом для лечения среднетяжелого и тяжелого активного РА у взрослых, имеющих неадекватный ответ на ≥1 анти-ФНО-препаратов |
1000 мг внутривенно 1 раз в 2 нед, курс — 2 инфузии; повторное применение возможно через 6–12 мес и более после первого курса |
| Адалимумаб — блокатор ФНО-α | Человеческие моноклональные антитела, пептидная последовательность которых идентична IgG1 человека | Уменьшает признаки и симптомы, ингибирует прогрессию структурных повреждений, улучшает физическую функцию у пациентов со средним и тяжелым течением РА | 40 мг подкожно 1 раз в 2 нед, при необходимости — 1 раз в неделю |
| Тоцилизумаб — блокатор рецептора ИЛ-6 | Рекомбинантное гуманизированное моноклональное антитело к человеческому рецептору ИЛ-6, подавляющее растворимые и мембранные рецепторы цитокина |
Лечение среднетяжелого и тяжелого активного РА у взрослых, имеющих неадекватный ответ на ≥1 анти-ФНО-препаратов |
4 мг/кг массы тела внутривенно (60-минутная инфузия), 1 раз каждые 4 нед; после этого при необходимости доза может быть повышена до 8 мг/кг с учетом клинического ответа |
| Анакинра — блокатор рецептора ИЛ-1 | Рекомбинатный антагонист рецептора ИЛ-1 | Редуцирует признаки и симптомы и замедляет прогрессирование структурных повреждений при среднем и тяжелым течением РА у пациентов в возрасте ≥18 лет при неэффективности предшествующей терапи | 100 мг подкожно ежедневно |
| Цертолизумаб — блокатор ФНО-α | Пегилированный фрагмент (FAb) антитела против ФНО-α | Лечение среднетяжелого и тяжелого РА в активной фазе | 200 мг подкожно, на 2-й и 4-й неделе после инициальной дозы и каждую следующую неделю после этого, 400 мг подкожно каждую 4-ю неделю, необходимость дальнейшего применения обсуждается |
| Этанерцепт — блокатор ФНО-α | Гибридная димерная белковая молекула, состоящая из рекомбинантного ФНО-рецептора, соединенная с Fc-фрагментом человеческого IgG1 |
Уменьшает признаки и симптомы, ингибирует прогрессию структурных повреждений, улучшает физическую функцию у пациентов со средним и тяжелым течением РА | 50 мг подкожно еженедельно |
| Голимумаб — блокатор ФНО-α | Человеческие моноклональные антитела к ФНО-α | В комбинации с метотрексатом для лечения среднетяжелого и тяжелого РА в активной фазе у взрослых | 50 мг подкожно 1 раз в месяц |
| Инфликсимаб — блокатор ФНО-α | Химерические моноклональные IgG1-антитела на основе гибридных мышиных и человеческих | В комбинации с метотрексатом для уменьшения выраженности симптомов и признаков, ингибирования структурных повреждений и улучшения физической функции у пациентов со среднетяжелым и тяжелым активным РА | 3 мг/кг массы тела внутривенно, на 2-й и 6-й неделе после инициальной инфузии, и каждые 8 нед в последующем; если ответ неполный, доза может быть повышена до 10 мг/кг или применяться каждые 4 нед |
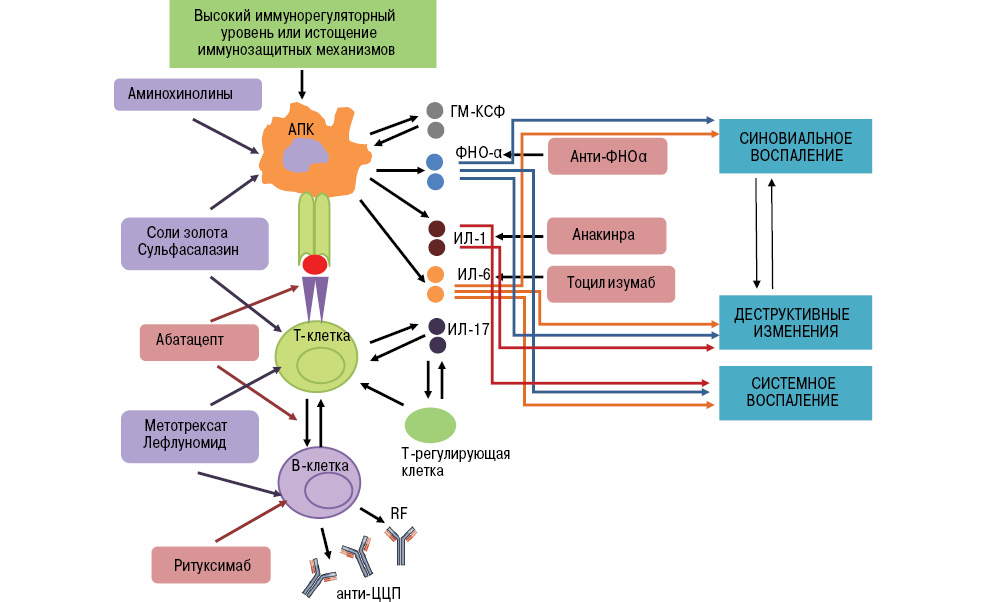
Примечание: АПК — антиген-презентирующая клетка, ГМ-КСФ — гранулоцитарно-макрофагальный колониестимулирующий фактор, RF — ревматоидный фактор, анти-ЦЦП — антитела к циклическому цитруллированному пептиду.
Рис. 1. Различные патофизиологические цели базисных антиревматических и биологических препаратов при РА (адаптировано нами по: van Vollenhoven R.F., 2009 [48]).
Наиболее широкое признание среди методов биологического лечения РА в наши дни нашла антицитокиновая терапия и, прежде всего, нейтрализация ФНО-α, роль которого в патогенезе этого заболевания не вызывает сомнений [1, 3, 7]. Использование данного принципа лечения позволило достичь результатов, значительно превосходящих результаты применения классических базисных средств. Внедрение в клиническую практику моноклональных антител к ФНО-α, особенно гуманизированных, рассматривается как одно из наиболее крупных достижений в лечении РА за последнее десятилетие.
Активно исследовалась роль и других цитокинов в патогенезе РА. Так, было установлено существенное самостоятельное значение ИЛ-1 не только для развития ревматоидного синовита, но и особенно для возникновения суставной деструкции, во многом определяющей исходы РА [10]. В ряде работ показано, что разрушение кости и суставного хряща зависит в большей степени от действия ИЛ-1, чем от влияния ФНО-α. Поэтому создание антагониста рецептора ИЛ-1 (анакинра) также считается революционным событием. Почти одновременно был создан тоцилизумаб — первое гуманизированное моноклональное антитело к рецепторам ИЛ-6 [6, 19]. Еще одним аспектом биологической терапии РА является попытка блокирования функций главной иммунокомпетентной клетки — CD4+ Т-лимфоцита с помощью соответствующих моноклональных антител (абатацепт).
Одним из ярких инновационных препаратов в ревматологии считается анти-В-клеточный препарат (ритуксимаб), который активно применяется в гематологии с 90-х годов ХХ ст. Известно, что основной механизм действия ритуксимаба при РА связан с деплецией (подавлением) клона В-лимфоцитов, несущих на поверхности клетки антиген CD20 (CD20+ В-клетки) [5]. Ритуксимаб, представляющий собой химерное моноклональное антитело к CD20, осуществляет подавляющее воздействие на В-лимфоциты с помощью трех основных механизмов [8]:
- антителозависимая клеточная цитотоксичность, в которой участвуют естественные киллеры, моноциты и макрофаги;
- комплементзависимая клеточная цитотоксичность, при которой формирование на поверхности В-лимфоцита иммунного комплекса (ритуксимаб — CD 20) приводит к активации комплемента и образованию мембраноатакующего комплекса, что в итоге вызывает лизис клетки;
- стимуляция апоптоза CD20+ В-клеток.
Эффективность биологической терапии продемонстрирована в крупных рандомизированных клинических испытаниях, где их противоревматическая активность сравнивалась с плацебо или с золотым стандартом БПВП — метотрексатом. Однако известны несколько крупных рандомизированных исследований, в которых непосредственно сравнивались биологические агенты. Именно такие исследования представляют особую ценность, поскольку высокая стоимость препаратов, различные пути введения, разные профили безопасности, достаточно высокий риск потенциальных осложнений всегда вызывают сомнения у практикующих врачей в правильности выбора биологических препаратов. Знания о преимуществах того или иного лекарственного средства будут способствовать быстрому принятию верных решений.
Недавний анализ датской базы биологической терапии позволил сравнить три ингибитора ФНО-α — адалимумаб, этанерцепт и инфликсимаб — относительно влияние на такие показатели, как ответ ACR70, динамику индексов DAS28 и CDAI (клинический индекс активности болезни), а также приверженность пациентов лечению [24]. В исследование было отобрано 2326 пациентов с РА, получавших ранее терапию БПВП, но не применявших лечение биологическими препаратами. Через 6 мес ответ на лечение по критериям ACR70, а также динамика индексов DAS28 и CDAI была достоверно лучшей в группе пациентов, принимавших адалимумаб — 19; 26 и 15% соответственно. Вторую позицию занял этанерцепт — 17; 21 и 10% соответственно; инфликсимаб продемонстрировал более скромные достижения — 11; 17 и 8%. Приверженность лечению через 48 мес терапии была наиболее высокой у этанерцепта, на второй позиции — адалимумаб, наименьшая приверженность лечению наблюдалась при применении инфликсимаба.
В метаанализе Кокрановской базы косвенно сравнивались преимущества и безопасность 6 биологических препаратов — абатацепта, адалимумаба, анакиры, этанерцепта, инфликсимаба и ритуксимаба [39]. Более современные голимумаб, цертолизумаб и тоцилизумаб не были включены в этот метаанализ, хотя и получили одобрение FDA. В метаанализ были включены все исследования по биологической терапии при РА, доступные Кокрановской библиотеке и выполненные в соответствии с их требованиями. Преимущества терапии оценивались по критериям ACR50 в оценке пациента и врача, безопасность — по количеству сообщений об отмене препаратов вследствие развития побочных реакций. Результаты продемонстрировали, что анакинра была менее эффективна, чем другие биологические агенты, хотя статистически достоверные отличия установлены только по сравнению с адалимумабом и этанерцептом. Наибольшее количество побочных эффектов зарегистрировано у пациентов, применявших инфликсимаб и анакинру [39].
Общий спектр возможных побочных эффектов, потенциальных осложнений и рисков при применении препаратов биологической терапии представлен в табл. 3.
| Биологический препарат (класс) | Побочные эффекты, потенциальные осложнения и риски |
|---|---|
| Анти-В-клеточный препарат (ритуксимаб) | Скрининг:гепатит В (возможна реактивация вируса)Предупреждения:прогрессирующая мультифокальная лейкоэнцефалопатия, запрещение введения живых вакцинПотенциальные осложнения: инфузионные реакции, инфекции, сердечные аритмии, стенокардия, панцитопения, слизисто-кожный синдром |
| Блокатор рецептора ИЛ-1 (анакинра) | Скрининг:уровень тромбоцитов и нейтрофиловПредупреждения:не применять сочетанно с блокаторами ФНО-α, запрещение введения живых вакцинПотенциальные осложнения: гиперчувствительность, местные реакции, нейтропения, серьезные инфекции |
| Блокатор рецептора ИЛ-6 (тоцилизумаб) | Скрининг: уровень печеночных ферментов (не применять препарат, если уровень АлАТ и АсАТ повышен более чем в 1,5 раза от нормы), количество тромбоцитов и нейтрофилов (не применять препарат при уровне тромбоцитов <100 · 10/л и нейтроцилов <2,0 · 10/л), латентная туберкулезная инфекцияПредупреждения:случаи демиелинизирующих заболеваний, гастроинтестинальные перфорации, вирусные инфекции, запрещение комбинации с другими биологическими агентами, запрещение введения живых вакцин.Потенциальные осложнения: анафилаксия, инфекции, глубокие микозы, нейтропения, тромбоцитопения, повышение уровня печеночных ферментов, повышение уровня липидов |
| БлокаторТ-клеточной костимуляции (абатацепт) |
Скрининг:латентная туберкулезная инфекция, вирусные гепатиты (возможна реактивация у носителей)Предупреждение:избегать сочетанного применения с анакинрой и анти-ФНО-α, возможные респираторные осложнения у пациентов с хронической обструктивной болезнью легких (ХОБЛ), не применять живые вакцины во время и через 3 мес после лечения, риск тяжелых инфекцийПотенциальные осложнения: анафилаксия, ложное повышение уровня глюкозы, злокачественные опухоли (риск развития лимфомы с высоким уровнем активности), серьезные инфекции |
| Блокаторы ФНО-α (анти-ФНО-α) (адалимумаб, этанерцепт, голимумаб, цертолизумаб, инфликсимаб) |
Скрининг:латентная туберкулезная инфекция, вирусные гепатиты (возможна реактивация у носителей гепатита В)Предупреждение:повышение риска развития серьезных инфекций вплоть до сепсиса, что требует скрининга на этапе отбора пациентов для терапии и постоянного мониторинга во время лечения, частота развития лимфомы превышает показатели в общей популяции, возможно ухудшение течения сердечной недостаточности или ее развитие, не употреблять живые вакцины.Потенциальные осложнения: анафилаксия, обострение или появление новых случаев демиелинизирующих заболеваний, люпус-подобный синдром, панцитопения. Необходим также контроль этих возможных осложнений.
Необходимость контроля: адалимубаб — кровотечения, местные реакции в месте введения, лимфома, глубокие микозы, инфекции нижних дыхательных путей; цертолизумаб — кровотечения, инфекции, местные реакции в месте введения, синдром Стивена — Джонсона, глубокие микозы; этанерцепт — аутоиммунный гепатит, гипогликемия при диабете, глубокие микозы, местные реакции в месте введения препарата; голимумаб — кровотечения, инфекции, местные реакции в месте введения, глубокие микозы; инфликсимаб — анемия, кровотечения, гипер- или гипотензия, повышение риска развития рака у пациентов с ХОБЛ, инфузионные реакции, инфекции |
Метотрексат сегодня считается препаратом первой линии в лечении РА и золотым стандартом базисной терапии. Огромный опыт его применения подтвердил его эффективность и хорошую переносимость у миллионов пациентов с РА. Согласно рекомендациям EULAR и ACR метотрексат применяется как стартовый препарат в монотерапии или в сочетании с другими базисными противоревматическими средствами. Тем не менее, становится очевидной эффективность метотрексата только у части (15–40%) пациентов с РА в достижении полной ремиссии болезни [13, 17, 44]. В оценке эффективности метотрексата также играют важную роль гетерогенность течения РА и индивидуальные особенности переносимости препарата. Поэтому все чаще рекомендуется назначение биологических препаратов как первой линии у пациентов с ранним агрессивным течением РА и высокой активностью. У пациентов с менее активным течением РА или более длительным сроком болезни биологические препараты могут рассматриваться как препараты второй линии в случае неадекватного ответа на метотрексат или другие небиологические препараты [35, 37].
Общеизвестно, что метотрексат в дозе 25 мг/нед является эффективным препаратом, но обычно стартовой дозой является 7,5 мг/нед с постепенным медленным повышением дозы до той, которую позволяет соблюдение безопасности. Хорошо известно также то, что достижение высоких эффективных доз препарата ограничено страхом врачей перед развитием побочных эффектов и плохой комлаентностью пациентов. В исследовании S.E.J. Medley и соавторов (2009) [30] продемонстрирована безопасность применения метотрексата у 86 пациентов с РА в высокой стартовой дозе. Так, около 30% больных получали изначально 25 мг/нед, остальные — ≤15 мг/нед метотрексата. Зафиксировано 4 эпизода нейтропении: 1 — в группе, получавшей 25 мг/нед, 3 — в группе низких доз метотрексата. Повышенные уровни печеночных ферментов выявлены у 60% пациентов, получавших метотрексат в высоких дозах, и у 44% — в низких (р<0,02). В группе высокой дозы метотрексата (25 мг/нед) у 32% пациентов отмечено повышенную активность АлАТ, однако более чем трехкратное повышение активности зарегистрировано только у 1 больного. Для сравнения: у 31% пациентов с применением низких доз метотрексата также отмечено повышение активности АлАТ, при этом у 2 пациентов — более чем 3-разовое повышение. Эти данные демонстрируют безопасность стартовой дозы 25 мг/нед метотрексата, а количество побочных эффектов сопоставимо с таковыми у тех, кто получал более низкие дозы [30]. Необходимо еще раз подчеркнуть, что именно применение высоких доз метотрексата (25 мг/нед) позволяет достичь контроля над прогрессированием РА.
Применение биологических агентов в качестве стартовых препаратов является спорным. Последние данные показали лучшие результаты у пациентов с ранним РА (1–3 года), применявших комбинацию метотрексата и биологического препарата (инфликсимаб, адалимумаб, этанерцепт, абатацепт или ритуксимаб) по сравнению с монотерапией метотрексатом [13, 44, 50]. Однако в этих исследованиях у 15–40% пациентов, получавших монотерапию метотрексатом, достигнута ремиссия и приостановлено рентгенологическое прогрессирование РА. Таким образом, выявление пациентов, нуждающихся в биологической терапии с самого начала заболевания, а также тех, которые достигают ремиссии при монотерапии метотрексатом и комбинированной терапии с биологическими препаратами, является основной проблемой в менеджменте РА [48]. К сожалению, на сегодняшний день не удалось идентифицировать клинически важных и полезных предикторов эффективности тех или иных биологических препаратов, что создает трудности в определении возможной резистентности и неадекватности ответа перед выбором лечения. Создание таких маркеров-предикторов представляет важное направление клинической ревматологии.
Раннее применение БПВП с быстрым наращиванием дозы (эскалация дозы) до максимально эффективной общепризнанно является первым шагом в ведении пациентов с установленным РА. При неадекватном ответе на лечение следующим шагом является переход на комбинированную терапию [15, 40]. Превосходство комбинированной терапии на основе метотрексата и биологических препаратов продемонстрировано во многочисленных исследованиях: TICORA [23], BeST [22], SWEFOT[47], GUEPARD [43] и др. Все эти исследования демонстрируют важность постоянного мониторинга течения РА, когда клинические решения базируются на строгих и рутинных клинических измерениях, что в результате приводит к улучшению физических функций, приостановке рентгенологической прогрессии и активности болезни, включая ремиссию РА.
И хотя преимущества комбинированной терапии РА хорошо оценены и подтверждены многочисленными клиническими исследования, не определен порядок и оптимальные сроки «переключения» на альтернативные БПВП и биологические препараты [11, 48]. В обновленных рекомендациях ACR не указывает решения относительно перехода или добавления альтернативных БПВП у пациентов, ранее получавших терапию БПВП [37]. Единственным исключением является рекомендация перейти на биологический препарат только после неэффективности небиологической терапии. Однако не уточнено, сколько должно быть таких неудач, чтобы начать терапию биологическими препаратами.
Поэтому в современной стратегии лечения РА четко прослеживается два вопроса, на которые предстоит ответить в будущем, поскольку это определяет тактику ведения пациентов. Во-первых, как долго клиницист может ждать перед принятием решения о неэффективности терапии и необходимости перехода на другие препараты? Во-вторых, является ли время принятия решения одинаковым по длительности независимо от применяемого лечения?
Только лишь в одном исследовании нами выявлена калькуляция сроков перехода на другие схемы терапии [16]. Используя данные исследования PREMIER, рассчитаны вероятности достижения ремиссии в течение 1 года в зависимости от уровня DAS28 (<2,6; от 2,6 до <3,2; от 3,2 до <5,1; и ≥5,1) и улучшения этого показателя (≤0,6 и >0,6) у пациентов, получавших комбинированную терапию метотрексатом и адалимумабом или только монотерапию метотрексатом. Пациенты, применявшие монотерапию метотрексатом, которые демонстрировали недостоверное улучшение DAS28 через 8 нед терапии (улучшение на <0,6) или DAS28 ≥5,1 через 12 нед лечения или DAS28 ≥3,2 через 26 нед, являются кандидатами для смены терапии как имеющие очень низкую вероятность достижения ремиссии в течение 1 года терапии. У пациентов, получавших комбинированную терапию метотрексатом и адалимумабом, период ожидания для смены лечения составляет ≥6 мес [16].
Анти-ФНО-α-терапия была первым биологическим направлением в лечении пациентов со среднетяжелым и тяжелым РА и первым реальным прорывом в лечении за последние 30 лет [3, 10, 15, 22, 43, 48]. Однако в реальной клинической практике около 30% пациентов отменяют блокаторы ФНО-α из-за недостаточной эффективности или побочных эффектов [33]. Возможности последующей терапии таких больных включают переход на другой анти-ФНО-α-препарат или переход на другой класс биологических препаратов. Существует достаточно доказательств, что «неответчики» на первый анти-ФНО-α-препарат, независимо от причины прекращения лечения, могут хорошо ответить на второй препарат этого класса.
В Голландском регистре пациенты с РА были разделены на три группы, в зависимости от причин отмены первого анти-ФНО-α-препарата: «неответчики» (n=49), недостаточный ответ на терапию (n=75), возникновение побочных эффектов (n=73); исследовался эффект применения второго анти-ФНО-α-агента. Через 6 мес после изменения терапии в каждой группе пациентов были сопоставимые улучшения DAS28 по сравнению с исходными данными и хороший эффект по критериям EULAR [12].
Еще одно исследование также подтвердило, что второй анти-ФНО-α-препарат может быть эффективным после отмены первого препарата вследствие неэффективности, низкой эффективности или нежелательных эффектов. При этом клинический ответ на второй анти-ФНО-α-препарат был достаточно высоким в случае возникновении побочных эффектов на первый препарат или же в случае недостаточного ответа. Если на второй анти-ФНО-α-препарат переводили «неответчиков» на первый препарат этого класса, то сила клинического эффекта также была низкой. Так, среди пациентов, которые былы переведены на второй препарат из-за отсутствия ответа, низкого ответа или нежелательных реакций, средний/хороший ответ по критериям EULAR зарегистрирован у 38,4; 66,6 и 88,8% пациентов соответственно [38]. Таким образом, при отсутствии ответа на первый анти-ФНО-α-препарат (группа «неответчиков») можно предположить существование общей резистентности к блокаторам ФНО-α и низкий (недостаточный) ответ на второй анти-ФНО-α-препарат.
Хотя пациенты, переведенные на второй анти-ФНО-α-препарат, могут лучше или также хорошо ответить на лечение, всегда остается риск прерывания терапии по тем же причинам, что и в случае отмены первого анти-ФНО-α-препарата [25]. Остается открытым вопрос, какой должна быть тактика в случае недостаточного ответа, отсутствия ответа или побочных реакций на второй анти-ФНО-α-препарат: переход на третий препарат этого класса или переход на биологический препарат другого класса?
Ученые, проводившие проспективное наблюдательное шведское исследование, попытались ответить на этот вопрос путем мониторинга ответов по критериям ACR20, ACR50, ACR70, DAS28<3,2, DAS28<2,6, EULAR в целом и хорошо у 337 больных, переведенных на второй анти-ФНО-α-препарат, и 36 пациентов, которые переведены на третий анти-ФНО-α-препарат («вторые переводчики») по сравнению с теми, кому впервые назначали блокаторы ФНО-α [26]. Исследование подемонстрировало, что ответ на лечение тех, кто впервые был переведен на другой анти-ФНО-α-препарат — «первые переводчики», был несколько ниже, но статистически недостоверный, чем ответ тех, кому впервые назначили биологическую терапию — «начинающие пользователи». Ответ «вторых переводчиков» был значительно ниже, чем у «первых переводчиков» и «начинающих пользователей». Так, у «начинающих пользователей», «первых переводчиков» и «вторых переводчиков» ответ ACR70 составил 13; 7 и 3% соответственно; 34; 25 и 9% достигли хорошего ответа по критериям EULAR, ремиссии по данным DAS28 достигли 23; 16 и 6% пациентов соответственно [26]. В отличие от шведского исследования, многоцентровое рандомизированное двойное слепое плацебо-контролируемое исследование GO-AFTER установило, что пациенты с недостаточным ответом на один/два предыдущих анти-ФНО-α-препарата могут иметь успех при переводе на второй/третий анти-ФНО-α-препарат — голимумаб [42]. Больные, у которых голимумаб был вторым или третьим препаратом биологической терапии, продемонстрировали достижение ACR20 в сравнении с плацебо.
В то же время практика свидетельствует, что использование даже такой мощной схемы терапии, как комбинация полной дозы метотрексата и антагониста ФНО-α, не всегда позволяет удовлетворительно контролировать активность РА. Существует также немало больных с непереносимостью блокаторов ФНО-α [1]. На сегодняшний день считается, что гетерогенность течения РА проявляется существованием ФНО-независимых механизмов воспаления, которые преобладают у некоторых пациентов и формируют патогенетическую основу неэффективности или резистентности к анти-ФНО-α-терапии [8].
Судя по данным национальных регистров биологических препаратов [25], первичная или вторичная неэффективность либо непереносимость ингибиторов ФНО-α заставляла менять схему лечения у 20–30% больных, которые их применяли [34]. Появление препаратов с новым механизмом действия, не связанным с блокадой ФНО-α, значительно расширило терапевтические возможности при РА, особенно в случае недостаточного ответа на анти-ФНО-α-терапию. Сегодня это тоцилизумаб, ритуксимаб, абатацепт и анакинра.
Ритуксимаб рекомендован Европейской противоревматической лигой (EULAR) для лечения РА, резистентного к ингибиторам ФНО-α. Ритуксимаб показан при тяжелом и среднетяжелом течении РА в случае недостаточного ответа на ингибиторы ФНО-α, а также при невозможности их назначения. Клиническая эффективность ритуксимаба у больных с неэффективностью как синтетических БПВП, так и ингибиторов ФНО-α подтверждена во многочисленных исследованиях, включая такие крупные, как DANCER и REFLEX, и в длительных открытых исследованиях [14, 18, 27]. В указанных рандомизированных клинических испытаниях ответ на лечение по критериям ACR составил [29]: ACR20 — от 51 до 54%, ACR50 — от 27 до 34%, ACR70 — от 12 до 20%. Тем не менее, эффективность ритуксимаба была выше при применении его у пациентов после первой неудачи с использованием анти-ФНО-α-препарата, чем при переходе на ритуксимаб после смены двух или трех блокаторов ФНО-α [28].
Использование стартовой комбинации метотрексата и ритуксимаба у пациентов с ранним РА гарантирует улучшение клинического ответа по сравнению с монотерапией метотрексатом. 30% пациентов с РА при такой комбинации достигли ремиссии в течение 1 года, 18% — достигли улучшения по ACR70 через 6 мес и у 64% — остановлена рентгенологическая прогрессия РА [44].
В последние годы внимание исследователей привлек ИЛ-6 — плейотропный цитокин, который синтезируется многими клетками (Т- и В-лимфоцитами, фибробластами, эндотелиальными клетками, моноцитами и др.), участвующими в развитии воспаления, и проявляет широкий спектр провоспалительных биологических эффектов [6, 32]. Первый гуманизированный блокатор рецептора ИЛ-6 тоцилизумаб одобрен для применения в Европе после длительного изучения и нескольких исследований, продемонстрировавших клиническую эффективность у пациентов с недостаточным ответом на БПВП и анти-ФНО-α-препараты.
Исследование AMBITION было предпринято для оценки эффективности и безопасности тоцилизумаба (в дозе 8 мг/кг) по сравнению с метотрексатом у пациентов с активным РА. Исследование показало, что при лечении тоцилизумабом значительно больше пациентов достигли критериев эффективности ACR20 после 24-й недели лечения, чем при применении метотрексата (70% против 53%). Другие биологические препараты не демонстрируют преимуществ по сравнению с метотрексатом по этому важному клиническому параметру. Кроме того, при лечении тоцилизумабом в режиме монотерапии ремиссия достигалась примерно в 3 раза чаще (34% против 12% случаев), чем у пациентов, применявших только метотрексат [10].
RADIATE (Research on Actemra Determining effIcacy after Anti-TNF FailurEs) — двойное слепое плацебо-контролируемое исследование III фазы по оценке эффективности и безопасности применения тоцилизумаба (в дозех 8 или 4 мг/кг массы тела) в комбинации с метотрексатом у пациентов с умеренным или тяжелым РА, у которых ранее наблюдалась неадекватная эффективность или непереносимость предшествующей терапии по меньшей мере одним блокатором ФНО. В исследовании RADIATE 50; 29 и 12% пациентов, получавших лечение тоцилизумабом (в дозе 8 мг/кг) в сочетании с метотрексатом, достигли критериев эффективности ACR20, ACR50 и ACR70 соответственно. Те же показатели для пациентов, получавших еженедельно только метотрексат, составили 10; 4 и 1%. Тоцилизумаб в сочетании с метотрексатом продемонстрировал значительный клинический эффект даже у тех пациентов, которые ранее получили три ингибитора ФНО-α без эффекта. Более того, ремиссия (DAS28 <2,6) достигнута у 30% пациентов, получавших тоцилизумаб (в контрольной группе — у 1,6% пациентов) [19].
Еще одним перспективным направлением биологической терапии является применение препаратов с направленным действием на Т-клетки. При исследовании абатацепта в крупных международных исследованиях установлено, что добавление абатацепта к БПВП в случае неадекватного ответа на анти-ФНО-α-препарат у пациентов с РА демонстрирует эффект значительно выше, чем плацебо. Через 6 мес в группе абатацепта ответ по критериям ACR20, ACR50, ACR70 составил 50,4; 20,3 и 10,2% соответственно, превосходя значительно группу плацебо (19,5; 3,08 и 1,5% соответственно) [20]. Это улучшение стойко поддерживалось в течение 2 лет терапии абатацептом [21].
Еще одно исследование AGREE (Abatacept Study to Gauge Remission and Joint Damage Progression in Methotrexate-Naпve Patients With Early Erosive Rheumatoid Arthritis) убедительно продемонстрировало значительное клиническое улучшение при добавлении абатацепта к метотрексату у пациентов с ранним РА. 55,2% пациента достигли ремиссии по критерию DAS28 <2,6 через 2 года; среди тех, кто применял только метотрексат, ремиссии достигли 45% пациентов. Серьезные побочные эффекты в обеих группах были сравнимы и составили 6,42 (в группе метотрексата) и 8,35 (в группе метотрексат + абатацепт) серьезных побочных эффектов/100 пациенто-лет [49].
Таким образом, результаты исследований REFLEX, AMBITION, RADIATE, ATTAINE, AGREE свидетельствуют о том, что добавление биологических агентов с различными механизмами действия пациентам с неадекватным ответом на анти-ФНО-α-терапию является оправданным шагом в достижении клинической ремиссии у пациентов с РА. Однако вопрос о сроках перехода остается открытым и требует дальнейших исследований и разработок [11, 36, 41].
Таким образом, ранняя агрессивная терапия, направленная на контроль симптомов РА, позволяет достичь ремиссии — главной цели при лечении РА. Достижение ремиссии чрезвычайно важно с позиции предупреждения структурной деструкции суставов, сохранения физической активности и предупреждения инвалидности. Благодаря существующим биологическим агентам и традиционным БПВП достижение ремиссии вполне реальная задача. Появление биологической терапии обеспечило решение этой задачи у 50% пациентов в течение 1-го года заболевания. У других 50% невозможность достижения ремиссии связана с неадекватным ответом на терапию, противопоказаниями к агрессивному лечению, резистентностью к препаратам, серьезными побочными нежелательными реакциями [46].
В лечении РА наш взгляд устремлен в будущее, возможно, в скором будущем будут созданы новые биологические препараты на основании новых молекул и новых, недавно открытых, патофизиологических путей, что сделает возможным индивидуализировать терапию РА и реально достичь ремиссии у всех пациентов.
Как вывод можно сформулировать следующие положения стратегии лечения РА:
- Цель лечения РА — сведение к минимуму симптомов кумулятивного воспаления на основании ранней диагностики и раннего агрессивного лечения БПВП.
- Биологические препараты, как правило, показаны в качестве препаратов второй линии для лечения РА у пациентов, не ответивших на лечение метотрексатом или на комбинацию небиологических препаратов (БПВП).
- Биологические препараты могут быть применены как первая линия терапии у пациентов с высокой активностью на момент установления диагноза и с неблагоприятными прогностическими факторами.
- Комбинированная терапия метотрексатом и биологическими препаратами предпочтительнее для достижения ремиссии, чем монотерапия метотрексатом.
- Определение того, какие пациенты выиграют от более агрессивного режима терапии, остается основной проблемой в менеджменте РА.
- Пациенты с неадекватным ответом на первый анти-ФНО-α-препарат (или побочными эффектами) могут хорошо поддаться лечению вторым анти-ФНО-α-агентом, однако не существует четкого консенсуса относительно того, сколько ингибиторов ФНО-α следует применять до момента отказа от этого класса препаратов и перехода на биологические препараты с альтернативным механизмом действия.
- Применение биологических препаратов с независимыми от ФНО-α механизмами (блокаторы рецепторов ИЛ-1, ИЛ-6, блокаторы Т-клеточной костимуляции, анти-В-клеточные агенты) эффективны в достижении клинической ремиссии при РА и могут активно применяться в лечении РА.
Литература
1. Каратеев Д.Е. (2009) Вопросы безопасности терапии ингибиторами ФНО. Соврем. ревматол., 3: 33–38.
2. Каратеев Д.Е. (2010) Современный взгляд на проблему быстропрогрессирующего ревматоидного артрита. Соврем. ревматол., 2: 37–42.
3. Коваленко В.М., Шуба Н.М., Борткевич О.П. та ін. (2008) Застосування антагоністів фактора некрозу пухлин в лікуванні хворих на ревматичні захворювання суглобів (ревматоїдний артрит, анкілозивний спондилоартрит, псоріатична артропатія). Метод. рекомендації, Київ, 40 с.
4. Коваленко В.М., Борткевич О.П., Білявська Ю.В. (2010) Сучасні аспекти діагностики ревматоїдного артриту. Здоров’я України: 1 (березень): 74–77.
5. Лучихина Е.Л. (2008) Ритуксимаб в современной терапии ревматоидного артрита. Соврем. ревматол., 2: 74–79.
6. Насонов Е.Л. (2008) Новые возможности фармакотерапии ревматических болезней — ингибирование интерлейкина-6. Клин. фармакол. тер., 1: 60–67.
7. Насонов Е.Л. (2007) Фармакотерапия ревматоидного артрита в эру генно-инженерных биологических препаратов. Терапевт. арх., 5: 5–8.
8. Насонов Е.Л. (2008) Ритуксимаб в лечении ревматических болезней. Науч.-практич. ревматол., 2 (прил. 1): 3–10.
9. Пяй Л.Т. (1982) Проблема цикличности течения ревматоидного артрита в свете долгосрочных клинико-амбулаторных наблюдений. Терапевт. арх., 6: 27–29.
10. Сигидин Я.А., Лукина Г.В. (2009) Биологическая терапия в ревматологии. 2-е изд., доп. Практическая медицина, Москва, 245 с.
11. Bergman M., Furfaro N. (2010) Individualizing therapy for rheumatoid arthritis: New strategies for maximizing treatment outcomes. 2010 PCE Updates in Rheumatology., 3(2): 1–12.
12. Blom M., Kievit W., Fransen J. et al. (2009) The reason for discontinuation of the first tumor necrosis factor (TNF) blocking agent does not influence the effect of a second TNF blocking agent in patients with rheumatoid arthritis. J. Rheumatol., 36: 2171–2177.
13. Breedveld F.C., Weisman M.H., Kavanaugh A.F. et al. (2006) The PREMIER Study: a multicenter, randomized, double-blind clinical trial of combination therapy with adalimumab plus methotrexate versus methotrexate alone or adalimumab alone in patients with early, aggressive rheumatoid arthritis who have not had previous methotrexate treatment. Arthritis Rheum., 54: 26–37.
14. Cohen S.B., Emery P., Greenwald M.W. et al. (2006) REFLEX Trial Group. Rituximab for rheumatoid arthritis refractory to antitumor necrosis factor therapy: results of a multicenter, randomized, double-blind, placebo-controlled, phase III trial evaluating primary efficacy and safety at twenty-four weeks. Arthritis Rheum., 54: 2793–2806.
15. Deighton C., O’Mahony R., Tosh J. et al. (2009) Management of rheumatoid arthritis: summary of NICE guidance. BMJ, 338: b702.
16. Dougados M., Keystone E.C., Guerette B. et al. (2009) How early can we predict remission at 1 year in early rheumatoid arthritis? A subanalysis of PREMIER [abstract]. Arthritis Rheum., 60(Suppl. 10): 1607.
17. Emery P., Breedveld F.C., Hall S. et al. (2008) Comparison of methotrexate monotherapy with a combination of methotrexate and etanercept in active, early, moderate to severe rheumatoid arthritis (COMET): a randomised, double-blind, parallel treatment trial. Lancet, 372: 375–382.
18. Emery P., Fleischmann R., Fillipowicz-Sosnowska A. et al. (2006) The Efficacy and Safety of Rituximab in Patients With Active Rheumatoid Arthritis Despite Methotrexate Treatment Results of a Phase IIb Randomized, Double-Blind, Placebo-Controlled, Dose-Ranging Trial. Arthritis Rheum., 54(5): 1390–1400.
19. Emery P., Keystone E., Tony H.P. et al. (2008) IL-6 receptor inhibition with tocilizumab improves treatment outcomes in patients with rheumatoid arthritis refractory to anti-tumour necrosis factor biologicals: results from a 24-week multicentre randomised placebo-controlled trial.Ann. Rheum. Dis., 67: 1516–1523.
20. Genovese M.C., Becker J.C., Schiff M. et al. (2005) Abatacept for rheumatoid arthritis refractory to tumor necrosis factor alpha inhibition. N. Engl. J. Med., 353: 1114–1123.
21. Genovese M.C., Schiff M., Luggen M. et al. (2008) Efficacy and safety of the selective co-stimulation modulator abatacept following 2 years of treatment in patients with rheumatoid arthritis and an inadequate response to anti-tumour necrosis factor therapy. Ann. Rheum. Dis., 67: 547–554.
22. Goekoop-Ruiterman Y.P.M., de Vries-Bouwstra J.K., Allaart C.F. et al. (2005) Clinical and radiographic outcomes of four different treatment strategies in patients with early rheumatoid arthritis (the BeSt study): a randomized, controlled trial. Arthritis Rheum., 52: 3381–3390.
23. Grigor C., Capell H., Stirling A. et al. (2004) Effect of a treatment strategy of tight control for rheumatoid arthritis (the TICORA study): a single-blind randomised controlled trial. Lancet, 364: 263–269.
24. Hetland M.L., Christensen I.J., Tarp U. et al. (2010) All Departments of Rheumatology in Denmark. Direct comparison of treatment responses, remission rates, and drug adherence in patients with rheumatoid arthritis treated with adalimumab, etanercept, or infliximab: results from eight years of surveillance of clinical practice in the nationwide Danish DANBIO registry. Arthritis Rheum., 62: 22–32.
25. Hyrich K.L., Lunt M., Watson K.D. et al. (2007) British Society for Rheumatology Biologics Register. Outcomes after switching from one anti-tumor necrosis factor alpha agent to a second anti-tumor necrosis factor alpha agent in patients with rheumatoid arthritis: results from a large UK national cohort study. Arthritis Rheum., 56: 13–20.
26. Karlsson J.A., Kristensen L.E., Kapetanovic M.C. et al. (2008) Treatment response to a second or third TNF-inhibitor in RA: results from the South Swedish Arthritis Treatment Group Register. Rheumatology (Oxford)., 47: 507–513.
27. Keystone E., Fleischmann R., Emery P. (2007) Safety and Efficacy of Additional Courses of Rituximab in Patients With Active Rheumatoid Arthritis. An Open-Label Extension Analysis. Arthritis Rheum., 56(12): 3896–3908.
28. Kremer J.M., Tony H.P., Genovese M.C. et al. (2007) Repeat treatment with rituximab in active RA patients: long-term efficacy in patients with one versus two or more prior TNF inhibitors. Ann. Rheum. Dis., 66(Suppl): 432.
29. Mease P.J. (2008) B Cell-Targeted Therapy in Autoimmune Disease: Rationale, Mechanisms, and Clinical Application. J. Rheumatol., 35: 1245–1255.
30. Medley S.E.J., Dolan A.L., Coakley G. (2009) How safe is starting high dose methotrexate? [abstract]. Ann. Rheum. Dis., 68(Suppl. 3): 591.
31. Nam J., Villeneuve E., Emery P. (2009) The role of biomarkers in the management of patients with rheumatoid arthritis. Curr. Rheumatol.Rep., 11: 371–377.
32. Nishimoto N., Kishimoto T. (2006) Interleukin 6, from bench to bedside. Nat. Clin. Praс. Rheumatol., 11: 619–626.
33. Østergaard M., Unkerskov J., Linde L. et al. (2007) Low remission rates but long drug survival in rheumatoid arthritis patients treated with infliximab or etanercept: results from the nationwide Danish DANBIOdatabase. Scand J. Rheumatol., 36: 151–154.
34. Pincus T., Yazici Y., van Vollenhoven R. (2006) Why are only 50% of courses of anti-tumor necrosis factor agents continued for only 2 years in some setting? Need for longterm observations in standart care to complement clinical trials. J. Rheumatol., 33: 2372–2375.
35. Rantalaiho V., Korpela M., Hannonen P. et al; FIN-RACo Trial Group (2009) The good initial response to therapy with a combination of traditional disease-modifying antirheumatic drugs is sustained over time: the eleven-year results of the Finnish rheumatoid arthritis combination therapy trial. Arthritis Rheum., 60: 1222–1231.
36. Rubbert-Roth A., Finckh A. (2009) Treatment options in patients with rheumatoid arthritis failing initial TNF inhibitor therapy: a critical review. Arthritis Res. Ther., 11(Suppl. 1): S1.
37. Saag K.G., Teng G.G., Patkar N.M. et al. (2008) American College of Rheumatology. American College of Rheumatology 2008 recommendations for the use of nonbiologic and biologic disease-modifying antirheumatic drugs in rheumatoid arthritis. Arthritis Rheum., 59: 762–784.
38. Scrivo R., Conti F., Spinelli F.R. et al. (2009) Switching between TNFalpha antagonists in rheumatoid arthritis: personal experience and review of the literature. Reumatismo., 61: 107–117.
39. Singh J.A., Christensen R., Wells G.A. et al. (2009) Biologics for rheumatoid arthritis: an overview of Cochrane reviews. Cochrane Database Syst. Rev., CD007848.
40. Smolen J., Aletaha D., Bijlsma J.W.J. et al. (2010) Treating rheumatoid arthritis to target: recommendations of an international task force. Ann. Rheum. Dis., 69: 631–637.
41. Smolen J.S., Aletaha D., Machold K.P. (2005) Therapeutic strategies in early rheumatoid arthritis. Best Pract. Res. Clin. Rheumatol., 19(1): 163–177.
42. Smolen J.S., Kay J., Doyle M.K. et al.; GO-AFTER study investigators (2009) Golimumab in patients with active rheumatoid arthritis after treatment with tumour necrosisin patients with active rheumatoid arthritis after treatment with tumour necrosis factor alpha inhibitors (GO-AFTER study): a multicentre, randomised, double-blind, placebo-controlled, phase III trial. Lancet, 374: 210–221.
43. Soubrier M., Puechal X., Sibilia J. et al. (2009) Evaluation of two strategies (initial methotrexate monotherapy vs its combination with adalimumab) in management of early active rheumatoid arthritis: data from the GUEPARD trial. Rheumatology (Oxford), 48: 1429–1434.
44. Tak P.P., Rigby W., Rubbert A. et al. (2009) Inhibition of joint damage and improved clinical outcomes with a combination of rituximab (RTX) and methotrexate (MTX) in patients (pts) with early active rheumatoid arthritis (RA) who are naïve to MTX: a randomised active comparator placebo-controlled trial [abstract]. Ann. Rheum. Dis., 68(Suppl. 3): 75.
45. U.S. Food and Drug Administration. Medication Guides. Retrieved August 3, 2010 from http://www.fda.gov/Drugs/DrugSafety/ucm085729.htm
46. Valesini G., Di Franco M., Spinelli F.R. et al. (2008) Induction of remission in rheumatoid arthritis: criteria and opportunities. Rheumatol. Int., 29: 131–139.
47. van Vollenhoven R.F., Ernestam S., Geborek P. et al. (2009) Addition of infliximab compared with addition of sulfasalazine and hydroxychloroquine to methotrexate in patients with early rheumatoid arthritis (SWEFOT trial): 1-year results of a randomised trial. Lancet, 374: 459–466.
48. van Vollenhoven R.F. (2009) Treatment of rheumatoid arthritis: state of the art 2009. Nat. Rev. Rheumatol., 5: 531–541.
49. Westhovens R., Robles M., Nayiager S. et al. (2009) Disease remission is achieved within two years in over half of methotrexate naïve patients with early erosive rheumatoid arthritis (RA) treated with abatacept plus MTX: results from the AGREE Trial [abstract]. Arthritis Rheum., 60(Suppl. 10): 638.
50. Westhovens R., Robles M., Ximenes A.C. et al. (2009) Clinical efficacy and safety of abatacept in methotrexate-naпve patients with early rheumatoid arthritis and poor prognostic factors. Ann Rheum Dis., 68: 1870–1877.
Адрес для переписки:
Коваленко Владимир Николаевич
03680, Киев, ул. Народного ополчения, 5
ННЦ «Институт кардиологии им. Н.Д. Стражеско»
НАМН Украины

Leave a comment