Альфакальцидол (альфа д3-тева) в профилактике глюкокортикоидинду-цированного остеопороза
Резюме. Одним из серьезнейших недостатков длительной терапии глю-кокортикоидами является развитие тяжелых форм остеопороза. Снижение кишечной абсорбции Са — одна из основных причин остеопороза на фоне приема глюкокортикоидов, — может привести к вторичному гипер-паратиреозу. Было установлено, что й-гормон (кальцитриол) и его аналоги (альфакальцидол (Альфа Д3-Тева)) значительно улучшают абсорбцию Са в кишечнике, что обусловливает снижение плазменного уровня пара-тиреоидного гормона, обеспечивая нормализацию процессов костного ремоделирования. В данном исследовании оценивали эффективность влияния на минеральную плотность костной ткани в поясничном отделе позвоночника альфакальцидола (Альфа Д3-Тева) в дозе 1 мкг/сут в сравнении с плацебо у 145 пациентов, получающих длительную терапию глю-кокортикостероидами. Результаты данного исследования были сходными с данными других исследований, демонстрирующими преимущество альфакальцидола (Альфа Д3-Тева) в профилактике потери костной массы и вертебральных переломов по сравнению с пациентами, получавшими терапию этидронатами. На сегодня имеется достаточно большое количество исследований, показывающих, что альфакальцидол (Альфа Д3-Тева) является обоснованным, безопасным и эффективным препаратом выбора для профилактики остеопороза, вызванного приемом глюкокортикои-дов, при условии периодического контроля уровня кальция в плазме крови.
Глюкокортикоиды — важные и высокоэффективные препараты, применяемые при большом количестве заболеваний, в том числе угрожающих жизни пациента и/или значительно снижающих ее качество. Многие из этих заболеваний имеют тенденцию к хро-низации и требуют проведения длительной терапии. Значительным недостатком интенсивной и/или длительной терапии глюкокортикоидами является их отрицательное воздействие на состояние костной ткани. Их прием приводит к значительному повышению риска нетравматических переломов. Наиболее яркий пример — компрессионные вертебральные переломы, появляющиеся уже через несколько недель после начала лечения глюкокортикоидами [1].
ВИТАМИН D, D-ГОРМОН И ЕГО АНАЛОГИ И ПАТОГЕНЕЗ ГЛЮКОКОРТИКОИДИНДУЦИРОВАННОГО ОСТЕОПОРОЗА
Глюкокортикоидиндуцированный остеопороз представляет собой результат отрицательного воздействия многочисленных факторов на гомеостаз spy landline phone кальция и костный метаболизм [2]. Наиболее существенные из них — ингибирование кишечной абсорбции Са, снижение его канальцевой реабсорб-ции с гиперкальциурией, подавление секреции половых гормонов и ингибирование синтеза и активности остеобластов [3]. Синергичное отрицательное воздействие глюкокортикоидов на кишечную абсорб-
цию и реабсорбцию кальция в почках приводит к вторичной гиперпродукции паратиреоидного гормона (ПТГ). Отрицательное воздействие повышения эндогенного уровня ПТГ на костную ткань описано достаточно хорошо [4]. Высокие уровни ПТГ обусловливают снижение плотности костной ткани в позвонках [5], уменьшение толщины кортикального слоя трубчатых костей [6], ускорение костного метаболизма [7] и повышение риска переломов шейки бедренной кости [8, 9]. Использование витамина й и Са в виде пищевой добавки у лиц пожилого возраста позволяло снизить число невертебральных переломов [10], однако только в ряде случаев это сопровождалось снижением плазменного уровня ПТГ [11]. По данным ряда авторов, использование вместо витамина й его активных метаболитов (й-гормона и его аналогов) позволяет повысить эффективность профилактики и терапии остеопороза, вызванного приемом глюкокортикоидов [12].
Абсорбция Са из кишечника и транспорт его во внеклеточное пространство осуществляется в 90% случаев активно при непосредственном участии й-гормона, кальцитриола (1,25 (ОН)2й3) [13]. Ввиду прямой стимуляции абсорбции кальция в кишечнике и узким терапевтическим окном, кальцитриол достаточно активно влияет на абсорбцию Са, но в то же время высок риск гиперкальциемии, что следует учитывать при использовании его в терапевтических целях [12].
В одном из исследований, проведенных с участием пациенток пожилого возраста с вертебральными
переломами, альфакальцидол (Альфа Д3-Тева) значительно более эффективно, чем витамин D, усиливал абсорбцию Са в кишечнике [14]. Кроме того, альфакальцидол (1a(OH)2D3), в отличие от уже готового кальцитриола (D-гормона), должен пройти трансформацию в печени до 1,25 (OH)2D3, а затем уже транспортируется кровотоком к органам-мишеням. Так, по данным исследования Y Seino et al. (1987), при сравнении пика плазменного уровня 1,25 (OH)2D3 на фоне однократного приема терапевтической дозы кальцитриола (1,25 (OH)2D3) или альфакаль-цидола (1 (OH)2D3) у здоровых мужчин, было установлено, что прием альфакальцидола приводит к медленному подъему уровня 1,25 (OH)2D3 в сыворотке крови с относительно низким пиковым уровнем [15].
Это, очевидно, значительно снижает риск гипер-кальциемии и гиперкальциурии при использовании альфакальцидола вместо кальцитриола.
Также было установлено, что при сходном повышении уровня кальция в сыворотке крови, полученном после приема D-гормона и альфакальцидола (Альфа Д3-Тева), уровень ПТГ более эффективно снижается на фоне приема альфакальцидола [12].
У пациентов с ревматоидным артритом [16], бронхиальной астмой [17], принимающих глюкокорти-коиды, прием альфакальцидола (2 мкг/сут) показал четкое улучшение кальциевого баланса вследствие значительного увеличения фракционной абсорбции кальция. Этот «кишечный» эффект альфакальцидола привел к редукции глюкокортикоидиндуцированного гиперпаратиреоза, что, в свою очередь, обеспечило нормализацию костной резорбции [3, 18].
В эксперименте на молодых крысах терапия альфакальцидолом обусловила постоянное повышение прочности кости и улучшение ее биомеханических показателей (прочность на излом, скручивание и т.д.), что сопровождалось значительным снижением концентрации инсулиноподобного фактора роста-I в костной матрице [23]. У здоровых людей было выявлено, что D-гормоны препятствуют снижению уровня остеокальцина в сыворотке крови на фоне приема преднизолона [26].
ОБЗОР КЛИНИЧЕСКИХ ИССЛЕДОВАНИЙ ЭФФЕКТИВНОСТИ ИСПОЛЬЗОВАНИЯ АЛЬФАКАЛЬЦИДОЛА (АЛЬФА Д3-ТЕВА) В ПРЕДОТВРАЩЕНИИ ОСТЕОПОРОЗА, ВЫЗВАННОГО ПРИЕМОМ ГЛЮКОКОРТИКОСТЕРОИДОВ
Данное исследование проводилось с целью оценки эффективности альфакальцидола в профилактике остеопороза, вызванного приемом глюкокорти-костероидов. Исследование было двойным слепым проспективным многоцентровым и включало 145 пациентов с заболеваниями, требующими длительной терапии глюкокортикостероидами в высоких дозах (>30 мг/сут преднизолона) [27]. Все пациенты до начала включения в исследование не получали терапию глюкокортикостероидами, что позволило оценить профилактическую роль приема альфакальцидола. Пациенты были рандомизированы на 2 группы, которые получали в течение 12 мес либо 1 мкг альфакальци-дола (Альфа Д3-Тева) в сутки (74 пациента), либо капсулы плацебо (71 пациент). Минеральную плотность костей поясничного отдела позвоночника оценивали посредством двухфотонной абсорбциометрии в начале исследования и на 3, б и 12-й месяц лечения. Безопасность контролировали с помощью записи всех побочных действий, о которых сообщали пациенты, регулярной проверки общего анализа крови и биохимического исследования сыворотки крови.
Средняя эквивалентная thesis statement examples for world war 2 доза преднизолона на исходном уровне составляла 4б,б мг/сут и 4б,3 мг/сут в группах, получающих альфакальцидол и плацебо соответственно. Процент изменений минеральной плотности костей после б мес лечения составил -2,11% в группе, получавшей альфакальцидол, и -4,00% в группе, получавшей плацебо (р=0,39). Через 12 мес процент минеральной плотности костей составлял +0,39% (ДИ: от -4,2В до 4,81) в группе, free essay marked by teachers получавшей альфакальцидол, и -Б,б7% (ДИ: от -8,13 до -3,21) в группе, получавшей плацебо; это различие — б,0б (ДИ: от 0,88 до 11,24) было статистически значимым (р =0,02) (рисунок).
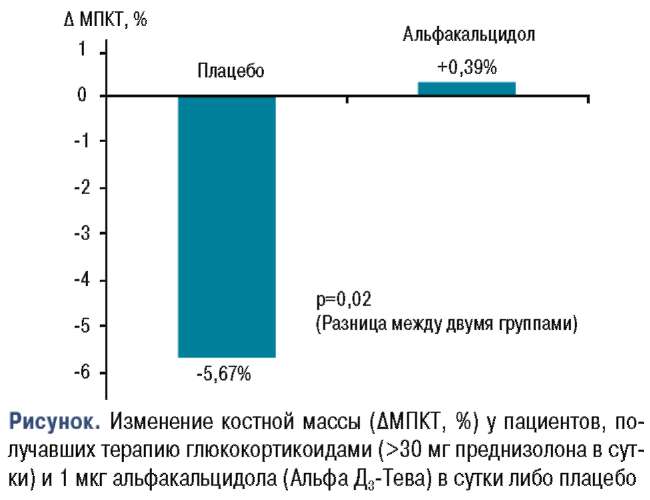
Анализ эффективности лечения также показал значительную разницу между двумя группами в пользу альфакальцидола (3,81%, р=0,01; ДИ: от cell phone spy photos 0,92 до б,70). На протяжении всего исследования между двумя группами не было значительной разницы в дозе кортикостероидов. Прием альфа-кальцидола в процессе терапии не сопровождался выраженными побочными эффектами [27].
Это первое проспективное плацебо-контролиру-емое исследование с участием сравнительно большой рандомизированной популяции с целью изучения эффективности альфакальцидола в профилактике развития глюкокортикоидиндуцированного остеопо-роза. В предыдущих исследованиях использовали слишком низкие дозировки глюкокортикостероидов, кроме того, длительность лечения была слишком короткой [28, 29]. Также в предыдущие исследования неизменно включались пациенты, которые принимали кортикостероиды в течение различных периодов перед началом исследования, а так как вызванная кор-тикостероидами потеря костной массы наиболее выражена в течение первых б-12 мес лечения, эти исследования не позволяли оценить профилактический характер использования альфакальцидола [27-29].
Наши результаты подтверждают данные предыдущих исследований о значительном преимуществе альфакальцидола по сравнению с на-тивным витамином D в предотвращении глюкокор-тикоидиндуцированного остеопороза.
Так, прием 50 000 ЕД витамина D раз в неделю и 1 г кальция в сутки 62 пациентами, получавшими глюко-кортикоиды при нескольких заболеваниях, не имел преимуществ по сравнению с приемом кальция и плацебо спустя 36 мес [30]. В предыдущем исследовании с меньшим количеством пациентов также сообщалось, что терапия альфакальцидолом (начальная доза 0,25 мкг/сут повышена до 1 мкг/сут) обеспечивала более эффективное предотвращение потери костной массы у пациентов после трансплантации сердца по сравнению с этидронатом [31]. Показатель экскреции Са с мочой, выявляемый при приеме кальцитриола, был, как и ожидалось, намного выше, чем у популяции, получавшей лечение альфакальцидолом [27, 33].
Таким образом, данные многочисленных исследований свидетельствуют о том, что альфакальцидол (Альфа Д3-Тева) является обоснованным, безопасным и эффективным средством в предотвращении остеопороза, вызванного приемом глюкокортикостероидов, при условии, что уровень кальция в сыворотке крови контролируется на регулярной основе.
ЛИТЕРАТУРА
1. Reid I.R., Grey A.B. (1993) Corticosteroid osteoporosis. Bailleres Clin. Rheumatol., 7: 573-587.
2. Reginster J.Y., Lecart M.P., Fontaine M.A. et al. (1989) Corticosteroi’des et tissu osseux. Rev. Med. Liege, 10: 365-373.
3. Ringe J.D. (1997) Active vitamin D metabolites in glucocorticoid-induced osteoporosis. Calcif. Tissue Int., 60: 124-127.
4. Reginster J.Y., Taquet A.N., Fraikin G. et al. (1997) Parathyroid hormone in the treatment of involutional osteoporosis: back to the future. Calcif Tissue Int., 7 (3): 163-168.
5. Villareal D.T., Civitelli R., Chines A. et al. (1991) Subclinical vitamin D deficiency in postmenopausal women with low vertebral bone mass. J. Clin. Endocrinol. Metab., 72: 628-634.
6. Fonseca V., Agnew J.E., Nag D. et al. (1988) Bone den sity and cortical thickness in nutritional vitamin D deficiency: effect of a secondary hyperparathyroidism. Ann. Clin. Biochera., 25: 271-274.
7. Garaero P., Sornay-Rendu E., Chapuy M.C. et al. (1996) Increased bone turnover in late postmenopausal women is a major determinant of osteoporosis. J. Bone Miner. Res., 11: 337-339.
8. Compston J.E., Silver A.C., Croucher P.I. et al. (1989) Elevated serum intact parathyroid hormone levels in elderly patients with hip fracture. Clin. Endocrinol., 31: 667-672.
9. Reginster J.Y., Deroisy R., Pirenne H. et al. (1998) High preva lence of low femoral bone mineral density in elderly women living in nursing homes or community dwelling. A plausible role of increased parathyroid hormone secretion. Osteoporosis Int. (in press).
10. Chapuy M.C., Arlot M.E., Delmas P. et al. (1994) Effect of calcium and cholecalciferol treatment for three years on hip fractures in elderly women. Bone Miner. J., 308: 1081-1082.
11. Lips P., Graafmans W.C., Ooms M.E. et al. (1996) Vitamin D supplementation and fracture incidence in elderly persons: a randomized, placebo-controlled clinical trial. Ann. Intern. Med., 124: 400-406.
12. Baylinck D.J., Libanati C.R. (1994) The actions and therapeutic applications of 1a-hydroxylated derivatives of vitamin D. Akt. Rheumatol., 19: 10-18.
13. Reichel H., Koeffler H.P., Norman A.W. (1989) The role of the vitamin D endocrine system in health and disease. N. Engl. J. Med., 320 (15): 980-991.
14. Francis R.M., Boyle I.T., Moniz C. et al. (1996) A comparison of the effects of alfacalcidol treatment and vitamin D2 supple mentation on calcium absorption in elderly women with vertebral fractures. Osteoporosis Int., 6: 284-290.
15. Seino Y., Tanaka H., Yamakoa K. et al. (І9В7) Circulating І£і, 25-dihydroxyvitamin D levels after a single dose of 25-dihydroxy vitamin D3 or 1a-hydroxyvitamin D3 in normal men. Bone Miner., 2: 479-4B5.
16. Lund B., Andersen R.B., Friis T. et al. (І977) Effect of 1a-hydroxyvitamin D3 and 1,25-dihydroxyvitamin D3 on intestine and bone in glucocorticoid-treated patients. Clin. Endocrinol., 7: І77-ІВІ.
17. Lindgren U., Lindholm S., Sarby В. (І97В) Short-term effects of І-aIpha-hydroxy-vitamin D3 in patients on corticosteroid treatment and in patients with senile osteoporosis. Atfa Med. Scand., 204: 29-92.
18. Hahn T.J., Halstead L.R., Teitelbaum S.L. (І979) Altered mineral metabolism in glucocorticoid-induced osteopenia. Effect of 25-hydroxyvitamin D administration. J. Clin. Invest., 64: 655-665.
19. Baran D.T. (І994) Nongenomic actions of the steroid hormone 25-dihydroxyvitamin D3. J. Cell. Biochem., 56: 303-306.
20. Baran D.T., Sorensen A.M., Shalhoub V. et al. (І99І) І£і, 25-dihydroxyvitamin D3 rapidly increases cytosolic calcium in clonal rat osteosarcoma cells lacking the vitamin D receptor. J. Bone Miner. Res., 6: І269-І275.
21. Jenis L.G., Lian J.B., Stein G.S. et al. (І993) І£і, 25-dihydroxyvitamin D3-induced changes in intracellular pH in osteoblast-like cells modulate gene expression. J. Cell. Biochem., 53: 234-239.
22. Baran D.T., Sorensen A.M., Shalhoub V. et al. (І992) The rapid nongenomic actions of 25-dihydroxyvitamin D3 modulate the hormone-induced incre ments in osteocalcin gene transcription in osteoblast-like cells. J. Cell. Biochem., 50: І24-І29.
23. Aerssens J., van Audekercke R., Talalaj M. et al. (І994) Effect of ^-/^(1™ D3 on bone strength and composition in growing rats with and without corticosteroid treatment. Calcif. Tissue Int., 55: 443-450.
24. Geusens P., Dequeker J., Nijs J. et al. (І99І) Prevention and treatment of osteopenia in the ovariectomized rat: effect of combined therapy with estrogens, І-aIpha vitamin D, and prednisolone. Calcif. Tissue Int., 4B: І27-І37.
25. Tanaka Y., Nakumara T., Nishida S. et al. (І996) Effects of synthetic vitamin D analog, on bone online writing like word dynamics and strength in cancellous and cortical bone in prednisolone-treated rats. J. Bone Miner. Res., ІІ: 325-336.
26. Nielsen H.K., Brixen K., Kassem M. et al. (І99І) Acute effect of 1,25-dihydroxyvitamin D3, prednisone, and 1,25-dihydroxyvitamin D3 plus prednisone on serum osteocalcin in normal individuals. J. Bone Miner. Res.,
6: 435-440.
27. Reginster J.Y., Kuntze D., Verdikt W. et al. (І999) Prophylactic use of alfacalcidol in corticosteroid-induced osteoporosis. Osteoporosis Int., 9: 75-ВІ.
2B. Schaat O., Bohr R. (І9В6) Alfacalcidol in prednisolone treatment: a controlled study of the effect on bone mineral density in lumbar spine, femoral neck and shaft. Calcif. Tissue Int., 39 (S): A5B.
29. Braun J.J., Birkenhaeer-Frenkel D.H., Rietveld A.H. et al. (І9В3) Influence of Іa-(OH)D3 administration on bone and bone mineral metabolism in patients on chronic glucocorticoid treatment: a double-blind controlled study. Clin. Endocrinol., ІВ: 265-273.
30. Adachi J.D., Bensen W.G., Bianchi F. et al. (І996) Vitamin D and calcium in prevention of corticosteroid-induced osteoporosis: a 3-year follow-up. J. Rheumatol., 23: 995-І000.
31. van Cleemput J., Daenen W., Geusens P. et al. (І996) Prevention of bone loss in cardiac transplant recipients. A comparison of bisphosphonates and vitamin D. Transplantation, 6І: І495-І499.
32. Lakatos P., Kiss L., Horvath C. et al. (І996) Effect of alphacalcidol on bone in patients treated with glucocorticoids. JBMR, ІІ (І): S545.
33. Sambrook P., Birmingham J., Kelly P. et al. (І993) Prevention of corticosteroid os teoporosis. A comparison of calcium, calcitriol and calcitonin. N. Engl. J. Med., 32B: І747-І752.
34. Di Munno O., Beghe F., Favini P. et al. (І9В9) Prevention of glucocorticoid-induced osteopenia: effect of oral 25-hydroxyvitamin D and calcium. Clin. Rheumatol., B (2): iphone spy 202-207.

Leave a comment