Преимущества комбинированной фармакотерапии при лечении комплексного регионального болевого синдрома
Резюме. 19–21 ноября 2013 г. в Киеве состоялся VI Национальный конгресс ревматологов Украины. Среди его основных научно-практических направлений — актуальность болевого синдрома в ревматологии, механизмы формирования боли, а также поиск клинически эффективных, безопасных и этиопатогенетически обоснованных подходов к анальгетической терапии. Данной проблеме в рамках Конгресса был посвящен ряд докладов отечественных и зарубежных ученых.
Актуальность проблемы
 Болевой синдром занимает центральное место в клинике большинства ревматологических заболеваний. Особый интерес у участников Конгресса вызвал доклад Александра Бурьянова, доктора медицинских наук, профессора, заведующего кафедрой травматологии и ортопедии Национального медицинского университета имени А.А. Богомольца, в котором представлен исчерпывающий материал о современном видении проблемы комплексного регионарного болевого синдрома (КРБС) — одного из наименее изученных и наиболее клинически тяжелых вариантов хронической периферической нейропатической боли. В докладе рассмотрены особенности патогенеза, современные аспекты диагностики и лечения данной патологии, представлены также результаты собственного клинического исследования по оценке эффективности применения патогенетически обоснованной, комбинированной фармакотерапии КРБС, разработанной автором и коллегами, в сравнении с традиционными терапевтическими подходами.
Болевой синдром занимает центральное место в клинике большинства ревматологических заболеваний. Особый интерес у участников Конгресса вызвал доклад Александра Бурьянова, доктора медицинских наук, профессора, заведующего кафедрой травматологии и ортопедии Национального медицинского университета имени А.А. Богомольца, в котором представлен исчерпывающий материал о современном видении проблемы комплексного регионарного болевого синдрома (КРБС) — одного из наименее изученных и наиболее клинически тяжелых вариантов хронической периферической нейропатической боли. В докладе рассмотрены особенности патогенеза, современные аспекты диагностики и лечения данной патологии, представлены также результаты собственного клинического исследования по оценке эффективности применения патогенетически обоснованной, комбинированной фармакотерапии КРБС, разработанной автором и коллегами, в сравнении с традиционными терапевтическими подходами.
КРБС — термин, применяемый для обозначения целого ряда расстройств, для которых характерно наличие спонтанной или стимулзависимой боли, диспропорциональной интенсивности воздействия болевого фактора и сопровождающейся множеством автономных, трофических и двигательных нарушений в различных комбинациях. КРБС также может быть определен как артикулярный и периартикулярный болевой синдром, сопровождающийся вазомоторной дисрегуляцией в результате воздействия различных факторов с отсутствием взаимосвязи между интенсивностью инициального повреждения, выраженностью и продолжительностью болевого синдрома.
Заболевание может возникнуть после перенесенной травмы любого характера. Данные ретроспективного когортного исследования за 1996–2005 гг. свидетельствуют, что заболеваемость КРБС составляет в среднем 26,2 случая на 100 тыс. населения, женщины поражаются, по меньшей мере, в 3 раза чаще мужчин, наиболее уязвимый возраст для развития данной патологии у женщин — 61 год–70 лет, средний возраст развития КРБС в общей популяции — 41,8 года. Верхние конечности поражаются значительно чаще, в 44% случаев причиной развития КРБС являются костные переломы.
Последние данные свидетельствуют, что в настоящее время, к сожалению, не существует стандартов диагностики данной патологии, в полной мере соответствующих требованиям доказательной медицины. В действительности, диагностические критерии также многочисленны, как и термины, обозначающие данное заболевание. Зонтичный термин КРБС объединяет синдромы І и ІІ типа.
КРБС І типа включает рефлекторную симпатическую дистрофию и сходные расстройства без повреждения нервных стволов, которые обычно развиваются после микротравмы или длительной иммобилизации (наложение лонгеты, гипса, yшиб, травма мягких тканей конечности и др.).
КРБС ІІ типа развивается в результате повреждения периферического нерва или одной из его ветвей, которое часто сопровождается явлениями каузалгии.
В этиопатогенез КРБС вовлечено множество факторов, в том числе воспаление, аутоиммунный ответ, патологическая продукция цитокинов, симпатико-сенсорные нарушения, нарушение регионального кровоснабжения и перестройка центральных корковых структур. Вместе с тем количество клинических исследований по изучению данной патологии с необходимым уровнем доказательности критически недостаточно. Это способствует гипердиагностике заболевания с применением неоправданно избыточной фармакотерапии и часто ненужных хирургических вмешательств.
КРБС имеет как ноцицептивный/воспалительный, так и нейропатический элементы патогенеза и всегда (по определению) ассоциируется с патологической активностью симпатической нервной системы. Имеются убедительные данные, свидетельствующие, что в патогенез и клиническую картину КРБС неизбежно вовлекаются центральная сенситизация и развитие двигательных нарушений.
И хотя развернутый клинический вариант КРБС диагностируют достаточно легко, варианты течения заболевания с менее ярко выраженной симптоматикой часто остаются недиагностированными.
Кроме того, в связи с недостаточным количеством клинических исследований соответствующего дизайна наиболее проблемным вопросом в отношении КРБС остается доказательный уровень эффективных схем лечения. В данной ситуации эксперты вынуждены прибегать к результатам рандомизированных контролируемых исследований (РКИ), в ходе которых изучали эффективность лечения при различных вариантах нейропатической боли, и экстраполировать результаты на возможность клинического применения у пациентов с КРБС.
Наиболее современные данные относительно критериев диагностики и терапевтических подходов соответствующего уровня доказательности представлены в 4-м издании Американских клинических рекомендаций по диагностике и лечению КРБС 2013 г. (Complex Regional Pain Syndrome: Practical Diagnostic and Treatment Guidelines, 4 Edition).
Критерии диагностики: полуторавековая история вопроса
Исторически среди множества названий, имеющих отношение к КРБС, «рефлекторная симпатическая дистрофия» и «каузалгия» являются наиболее известными и часто употребляемыми терминами. Существование таксономической путаницы в вариантах КРБС частично обусловлено множеством нестандартизированных, несистематизированных диагностических схем, используемых в течение более полутора века такими экспертами в данной клинической области, как J. Bonica, F. Kozin, H. Blumberg, J. Gibbons и R. Wilson.
В 1851 г. Клод Бернар (Claude Bernard) впервые упомянул болевой синдром, связанный с дисфункцией симпатической нервной системы. Позже, в 1864 г. ученик К. Бернара Сайлас Уэйр-Митчел (Silas Weir-Mitchell) в работе «Огнестрельные раны и другие повреждения нервов» ввел термин «каузалгия» с целью описания боли, развивавшейся у солдат во время гражданской войны в США (греч. kausos — жар; algos — боль). В 1946 г. Джеймс Эванс (James A. Evans) впервые ввел термин «рефлекторная симпатическая дистрофия (РСД)».
Хотя «РСД» стал наиболее употребляемым термином для обозначения данной патологии в ХХ в., он является несколько проблемным по ряду причин: если в действительности в патогенез вовлечен рефлекс, он должен быть достаточно сложным/мультисинаптическим, кроме того, он не объясняет патогенез синдрома в полной мере. Показано также, что предполагаемые симпатические (автономные) изменения могут не быть постоянным или причинным компонентом боли и, кроме того, они могут физиологически не вовлекаться в патогенез заболевания у всех пациентов. Реальные признаки дистрофии выявляют лишь в 15% случаев.
Исторические пробелы в разработке стандартизации нозологии и унифицированных диагностических критериев КРБС/РСД стали существенным препятствием научного и клинического прогресса в данном направлении. Одним из негативных последствий стал существенный недостаток сравнительных клинических исследований эффективности методов лечения при данном синдроме, обусловивший задержку в разработке и утверждении оптимальных схем лечения больных с КРБС.
Первоначально попытки систематизации диагностических критериев данного синдрома включали эмпирический клинический опыт определения специфических признаков и симптомов КРБС, представленных, в частности, в работах Джона Боника (John Bonica), хотя серьезные попытки унифицировать критерии диагностики синдрома обозначились десятилетиями позже.
Несмотря на востребованность, данные усилия лишь увеличили число бессистемных, непоследовательных диагностических схем. Для упорядочивания такого диагностического хаоса был предпринят ряд попыток формализовать определение синдрома на уровне согласительных конференций. Конференция в Шлесс-Реттерсгоф (Schloss-Rettershof), Келькхайм, Германия, в 1988 г. и более значимая конференция в Орландо (Orlando), США, в 1994 г. стали отражением международных консенсусных усилий по разработке научно обоснованных диагностических критериев, соответствующих всем необходимым требованиям.
Системно продуманная таксономия и диагностические критерии были утверждены Комитетом по классификации хронической боли (Committee for Classification of Chronic Pain) Международной ассоциации по изучению боли (International Association for the Study of Pain — IASP). Таким образом, критерии, утвержденные на конференции в Орландо в 1994 г., стали первыми международными критериями диагностики КРБС. Материалы конференции внесли существенный вклад в более глубокое понимание патогенеза данного болевого синдрома, создали фундамент для развития эффективной коммуникации клиницистов и унифицировали подходы в научно-исследовательской работе.
Несмотря на свою ценность и необходимость, критерии, принятые на конференции в Орландо, нуждались в клинической валидации и модификации. Невалидированные консенсусные критерии могли стать причиной гипердиагностики или гиподиагностики КРБС и ограничения возможности проведения своевременного и эффективного лечения.
В 2004 г. в Будапеште (Венгрия) согласительная рабочая группа Международной ассоциации изучения боли в рамках пересмотра критериев Орландо утвердила и кодифицировала эмпирически разработанные критерии 1994 г. с учетом данных валидационных клинических исследований. Чувствительность новых критериев КРБС составила 85%, специфичность — 69%. Таксономический комитет IASP недавно утвердил и кодифицировал Будапештские критерии в качестве новых критериев IASP.
Согласно определению Будапештских критериев, КРБС — синдром, который характеризуется продолжительной (спонтанной/или стимулированной) региональной болью, явно несоответствующей по длительности и степени выраженности клинике болевого синдрома вследствие травмы или других повреждений. Боль носит региональный характер (не соответствует специфической зоне иннервации или дерматома) и обычно характеризуется преимущественно дистально выраженными сенсорными, двигательными, судомоторными, вазомоторными и/или трофическими нарушениями. Для синдрома характерна вариабельность прогрессии с течением времени. Диагностические критерии разработаны в двух версиях — клинической и научно-исследовательской (табл. 1).
| №п/п | Критерии | Категория | |||
|---|---|---|---|---|---|
| сенсорная | вазомоторная | судомоторная/отек | двигательная/трофическая | ||
| 1 | Продолжительная боль, не соответствующая интенсивности болевого раздражителя | ||||
| 2 | Жалобы на наличие, по меньшей мере, 1 симптома в 3 из 4 следующих категорий | Гипералгезия и/или аллодиния | Температурная ассимметрия и/или изменение окраски кожных покровов и/или ассимметрия окраски кожных покровов | Отек и/или изменения потоотделения и/или ассимметрия потоотделения | Уменьшение объема движений и/или развитие двигательной дисфункции (слабость, тремор, дистония) и/или трофические изменения (волос, ногтей, кожи) |
| 3 | Выявление на момент обследования, по меньшей мере, 1-го симптома в ≥2 следующих категорий | Признаки гипералгезии (булавочные пробы) и/или аллодинии (при легком прикосновении и/или глубоком нажатии и/или движении сустава) | Признаки температурной ассимметрии и/или изменения окраски кожных покровов и/или ее ассимметрии | Признаки отека и/или изменения потоотделения иили ассимметрии потоотделения | Признаки уменьшения объема движений и/или двигательной дисфункции (слабость, тремор, дистония) и/или трофических изменений (волос, ногтей, кожи) |
| 4 | Отсутствие другого диагноза, патогенез которого более соответствовал бы выявленным признакам и симптомам | ||||
Научно-исследовательская версия, предложенная в качестве инструмента проведения клинических испытаний, отличается от клинической лишь формулировкой 2-го пункта, а именно, «жалобы, на наличие, по меньшей мере, 1 симптома в каждой из 4 следующих категорий» (а не «в 3 из 4 следующих категорий» клинической версии).
Традиционные, эмпирически сформировавшиеся, подходы к стадированию КРБС с выделением 3 основных фаз клинического течения заболевания (начальной фазы с манифестацией болевого синдрома и развитием вазомоторных нарушений; «пика» болезни — дистрофической стадии или стадии трофических нарушений; и исхода заболевания, или стадии устойчивой декомпенсации) не нашли подтверждения при проведении кластерного анализа данных клинического исследования с участием 113 больных с КРБС (согласно критериям IASP).
В противоположность традиционному последовательно-временному стадированию заболевания учеными предложена версия существования трех статистически различных подтипов КРБС:
1) относительно ограниченный вариант синдрома с доминирующими признаками вазомоторных нарушений;
2) относительно ограниченный вариант синдрома с доминирующими признаками нейропатических болевых/сенсорных нарушений;
3) клинически развернутый вариант КРБС, соответствующий признакам классического РСД-синдрома.
Примечательно, что, несмотря на наименьшую продолжительность болевого синдрома в последнем варианте, данный подтип демонстрирует наиболее высокий уровень двигательных и трофических расстройств, а также рентгенологических изменений костной ткани (остеопению). Данные электромиографического исследования (ЭМГ)/тестов исследования скорости проведения нервных импульсов свидетельствуют, что подтип 2 может быть синонимом ІІ типа КРБС (каузалгии).
В 2004 г. в Будапеште указанные данные расценили как слишком преждевременные для включения в стандартизированные диагностические критерии. Вместе с тем согласительная рабочая группа признала существование ряда проблем, требующих разрешения, относительно «старых» подтипов КРБС, представленных на конференции в Орландо и внесенных в критерии IASP 1994 г. В частности, речь шла о необходимости объективизации дифференциальных критериев КРБС І типа (без признаков значительного повреждения нерва) и ІІ типа (с признаками значительного повреждения нерва) в связи с отсутствием четкого определения понятия «значительного повреждения нерва». Проблема усугублена тем, что методы объективизации повреждения нерва, такие как ЭМГ, являются неоправданно болезненными (и даже жестокими) для больных с КРБС. Кроме того, отмечено, что верификация указанных подтипов может не иметь клинической значимости или влияния на выбор специфического метода лечения. Однако, несмотря на указанные проблемы, классификация КРБС по двум подтипам Будапештской рабочей группой была сохранена, повторное рассмотрение данного вопроса отложено до получения дополнительной доказательной базы.
Предварительные данные относительно недостаточного доказательного уровня исторически сложившегося стадирования КРБС, а также предложенная категоризация клинических вариантов КРБС по трем подтипам включены в 4-е издание Американского практического руководства по диагностике и лечению КРБС 2013 г. — Complex Regional Pain Syndrome: Practical Diagnostic and Treatment Guidelines, 4 Edition.
Клинические проявления. Особенности болевого синдрома при КРБС
Основные клинические проявления КРБС, положенные в основу диагностических критериев, включают:
- болевой синдром (ощущение жжения, ноющая или ломящая боль в сочетании с чувствительными нарушениями — гипо- или анестезией, гиперпатией, аллодинией, то есть восприятием стимуляции любой модальности как болевой);
- вегетативно-трофические расстройства (отек, изменение окраски кожных покровов, локальные изменения температуры кожи, нарушение потоотделения, изменение скорости роста ногтей и волос, локальный остеопороз);
- двигательные расстройства в форме различной степени выраженности пареза.
Боль является абсолютным признаком КРБС. Она не соответствует выраженности травмы, сохраняется дольше ожидаемого периода восстановления, имеет ассимметричный характер, более выражена в дистальных отделах конечности.
Болевой синдром при КРБС по своей природе является нейропатической болью, которая представлена двумя основными компонентами: спонтанной (стимулнезависимой) болью и вызванной (стимулзависимой) гипералгезией.
Спонтанная боль
Спонтанная боль делится на два вида: симпатически независимую боль и симпатически поддерживаемую боль. Симпатически независимая боль развивается в результате повреждения периферического нерва, имеет стреляющий, ланцинирующий характер и исчезает или значительно регрессирует после местной блокады поврежденного периферического нерва или пораженного участка кожи с применением анестетика. Симпатически поддерживаемая боль имеет, как правило, жгучий характер, может сочетаться с нарушениями кровотока, терморегуляции и потоотделения, двигательными расстройствами (повышением мышечного тонуса, дистонией, усилением физиологического тремора), трофическими изменениями кожи, ее придатков, подкожных тканей, фасций и костей и регрессирует после проведения симпатической блокады.
Боль является абсолютным признаком для диагностики КРБС. Болевой синдром представлен двумя характерными типами — жгучей болью и ноющей болью, которые отмечаются с одинаковой частотой. Более 75% пациентов с КРБС имеют спонтанную постоянную боль. Боль нередко возникает сразу после перенесенной травмы, обычно не связанной со значительным повреждением нерва — вслед за переломом костей, мягким тканевым повреждением или иммобилизацией, обусловленной висцеральной патологией. Болевой синдром развивается, как правило, в течение месяца после воздействия провоцирующего фактора.
Стимулзависимая боль (гипералгезия)
Вторым компонентом нейропатической боли является гипералгезия. По локализации выделяют первичную и вторичную гипералгезию. Первичная гипералгезия локализуется в зоне иннервации поврежденного нерва или в зоне тканевого повреждения, вторичная гипералгезия имеет более широкое распространение, далеко выходя за зону тканевого повреждения или зону иннервации поврежденного нерва.
Первичная гипералгезия связана с местом повреждения тканей и развивается, как правило, в ответ на раздражение сенсибилизированных в результате повреждения периферических ноцицепторов. Чувствительность ноцицепторов обусловлена действием биологически активных веществ, высвобождающихся или синтезирующихся в месте повреждения. К ним относят серотонин, гистамин, нейроактивные пептиды (вещество Р и кальцитонин-ген-связанный пептид), брадикинин, а также продукты метаболизма арахидоновой кислоты (простагландины и лейкотриены) и цитокины. В процесс вовлекается также категория ноцицепторов, называемых «спящими», которые в норме неактивны, но активируются вследствие тканевого повреждения. Активация спящих ноцицепторов способствует усилению афферентной стимуляции нейронов заднего рога спинного мозга, являющейся основой развития вторичной гипералгезии.
Усиление афферентной стимуляции от сенсибилизированных и активированных спящих ноцицепторов превышает болевой порог и посредством высвобождения активирующих аминокислот (аспартата и глутамата) повышает возбудимость чувствительных нейронов заднего рога с развитием центральной сенситизации. Вследствие повышения возбудимости чувствительных нейронов задних рогов спинного мозга, связанных с зоной иннервации поврежденного нерва, развивается сенсибилизация близлежащих интактных нейронов с расширением рецептивной зоны. Связанное с этим раздражение неповрежденных сенсорных волокон, иннервирующих здоровые ткани, окружающие зону повреждения, вызывает активацию вторично сенсибилизированных нейронов, что проявляется болью — вторичной гипералгезией. Сенсибилизация нейронов задних рогов способствует снижению болевого порога и развитию аллодинии, то есть появлению болевых ощущений на раздражение, которое в норме ими не сопровождается (например тактильное). Изменения возбудимости центральных отделов ноцицептивной системы, лежащие в основе развития вторичной гипералгезии и аллодинии, описывают термином «центральная сенситизация».
Вегетативно-трофические расстройства
Выявлено два характерных комплекса вегетативно-трофических нарушений: первый — с красной или багровой окраской кожных покровов, отеком, гипертермией, гипергидрозом, ускоренным ростом ногтей, ускоренным ростом волос, контрактурами (отмечается в среднем в 60% случаев); второй комплекс — с белой или синюшной окраской кожных покровов, гипотермией, гипо- или ангидрозом, гипотрофией мягких тканей, дисхромией кожных покровов, замедленным ростом ногтей и волос, характерной для всех больных контрактурой. Первый комплекс отмечается при длительности заболевания до 6 мес в среднем в 70% наблюдений, второй может развиться как в ранние, так и в поздние сроки.
Трофические изменения характеризуются различной частотой проявления: развитие остеопороза — в 90% случаев; артрита, артроза мелких суставов — в 93%; изменение скорости роста ногтей — в 42,5%; изменение скорости роста волос — в 27,5%; развитие мышечных контрактур — в 67,5%.
Двигательные нарушения
Проявляются слабостью, тремором, ограничением объема движений, развитием контрактур. К первым симптомам относят повышение мышечного тонуса в пораженной конечности. Объем пассивных движений в конечности на ранней стадии сохранен, активные движения затруднены. Постепенно развивается ограничение пассивных движений. Ограничение активных движений в конечности часто связано также с болевым синдромом, периферическим парезом, отеком. При повышении мышечного тонуса объем пассивных движений сохранен полностью, однако отмечается боль и тугоподвижность при активных движениях. При формировании контрактуры появляется ограничение объема пассивных движений различной степени выраженности.
Патофизиология болевого синдрома при КРБС
Патофизиологические механизмы спонтанной боли
Развитие спонтанной (стимулнезависимой) боли обусловлено активацией первичных С-афферентов. Потенциал действия на мембране нейронов развивается в результате функционирования натриевых каналов. В мембранах чувствительных нейронов выявлено два типа натриевых каналов: 1-й тип — чувствительный к тетродотоксину и 2-й тип — нечувствительный к тетродотоксину (tetrodotoxin resistant — TTX-R). 2-й тип каналов находится только в специфических ноцицептивных нейронах (sensory neuron-specific — SNS). Данные каналы гораздо медленнее активируются и инактивируются в сравнении с каналами 1-го типа, а также медленно вовлекаются в развитие патологического болевого состояния. Выделяют два вида TTX-R каналов: SNS1/PN3 и SNS2/NaN.
При повреждении периферического нерва и развитии персистирующей боли, аллодинии и гипералгезии отмечают увеличение количества SNS1-каналов при неизменном количестве SNS2-каналов. Повышение плотности SNS1-натриевых каналов способствует развитию очагов эктопического возбуждения в аксоне и в самой клетке, которые начинают генерировать усиленные разряды потенциалов действия.
В ряде случаев стимулнезависимая боль является симпатически обусловленной, что связано с двумя механизмами. В частности, с появлением после повреждения периферического нерва на мембранах поврежденных и неповрежденных аксонов С-волокон α-адренорецепторов (в норме отсутствующих), чувствительных к циркулирующим катехоламинам, выделяющимся из постганглионарных окончаний симпатических волокон. А также с прорастанием вследствие повреждения нерва симпатических волокон в узел заднего корешка, где они оплетают в виде корзинок тела чувствительных нейронов. Таким образом, активация симпатических окончаний провоцирует активацию чувствительных волокон.
В основе развития спонтанной боли также участвуют механизмы, связанные с нарушением процессов торможения на уровне заднего рога. Нейроны заднего рога спинного мозга получают информацию от первичных афферентов, активность нейронов определяется не только возбуждающей периферической стимуляцией, но и тормозными влияниями, которые могут быть спинальными или нисходящими центральными. Таким образом, усиление тормозных влияний способствует снижению активности нейронов заднего рога, что лежит в основе воротного контроля поступающей афферентации. Ингибирующий эффект нейронов задних рогов при поражении периферического нерва может снижаться различными путями. Повреждение нерва может способствовать снижению концентрации γ-аминомасляной кислоты (ГАМК), оказывающей тормозное влияние, что вызывает нарушение регуляции ГАМК-ергических и опиатных рецепторов, расположенных на пресинаптических мембранах первичных сенсорных нейронов и на постсинаптических мембранах нейронов заднего рога. Кроме того, в результате развития эксайтотоксических реакций, ведущих к развитию механизмов апоптоза или программируемой смерти клеток, связанных с поражением периферического нерва, погибают вставочные нейроны, локализованные во второй пластине клеток заднего рога, выполняющих в том числе и тормозную функцию. В результате этих процессов вторичные чувствительные афференты лишаются тормозных воздействий, генерируя патологическую импульсацию, передающуюся в центральную нервную систему даже при отсутствии активности в первичных чувствительных афферентах.
Патофизиологические механизмы стимулзависимой боли (гипералгезии)
Механическая гипералгезия является одним из наиболее распространенных проявлений нейропатической боли. Динамическая гипералгезия (аллодиния) — это следствие усиленного ответа чувствительных нейронов заднего рога спинного мозга на стимуляцию, проводимую по миелинизированным Аb-волокнам от низкопороговых механорецепторов. В норме активация низкопороговых механорецепторов не связана с болевыми ощущениями. Развитие аллодинии связано с феноменом центральной сенситизации, в основе которой лежит стойкая деполяризация мембран.
Основным возбуждающим нейротрансмиттером в первичных афферентах является глутамат. Существует два типа глутаматных рецепторов на постсинаптической мембране чувствительных нейронов задних рогов спинного мозга: первый — рецепторы амино-3-гидрокси-5-метилсоксазол-4-пропионовой кислоты (AMPA)-рецепторы, и второй — N-метил-D-аспартат рецепторы. Активация ноцицепторов ведет к высвобождению глутамата из пресинаптических мембран, который, взаимодействуя с постсинаптическими глутаматными AMPA-рецепторами, вызывает быструю деполяризацию мембран нейронов заднего рога и при превышении порога возбуждения генерирует потенциал действия. Этот механизм лежит в основе проведения нормальных ноцицептивных стимулов. Другой тип глутаматных рецепторов — N-метил-D-аспартат (NMDA)-рецепторы, связанные с кальциевыми каналами клеточных мембран, находящихся в неактивном состоянии. Эти каналы неактивны, поскольку их поры, как пробкой, блокированы ионами магния. Когда канал блокирован ионом магния, глутамат не может его активировать. Однако при развитии преходящей деполяризации мембраны, связанной с функцией ноцицепции, эти каналы открываются, обеспечивая транспорт кальция, а после восстановления полярности снова закрываются. В случае поражения периферического нерва процессы поляризации и деполяризации клеточных мембран претерпевают глубокие изменения, в результате которых развивается центральная сенситизация.
Центральная сенситизация характеризуется тремя признаками:
- появлением зоны вторичной гипералгезии;
- усилением ответа на надпороговое раздражение;
- появлением ответа на подпороговое раздражение.
Данные изменения клинически проявляются в виде гипералгезии на болевые стимулы, распространяющейся за пределы зон повреждения, и включают эффект гипералгезии на неболевую стимуляцию. Распространение боли за пределы зоны иннервации пораженного нерва является проявлением не психогенных нарушений, а наиболее общим признаком центральной сенситизации.
Междисциплинарные подходы к лечению больных с КРБС
Несмотря на данные РКИ последних лет, свидетельствующих об эффективности коротких курсов перорального применения глюкокортикоидов, интраназального или внутримышечного введения кальцитонина, внутривенного введения бисфосфонатов, применения антиоксидантов, габапентина, региональных симпатических блокад с бретилием, спинномозговой стимуляции, физиотерапевтических методов, лечение больных с КРБС продолжает оставаться проблематичным, поскольку применяемые лекарственные средства и лечебные методики не обеспечивают адекватного купирования болевого синдрома у значительной части пациентов.
В 1997 г. в Малибу (Калифорния, США) состоялась конференция в формате модели семинаров Далема (Dahlem Workshop Model) — мозгового штурма и свободного обмена идеями — с целью достижения консенсуса в отношении клинических рекомендаций по лечению больных с КРБС.
Консенсус 1997 г., принятый согласительной рабочей группой в Малибу, предусматривал направление основных усилий клиницистов на междисциплинарных терапевтических подходах с целью достижения, прежде всего, функционального восстановления поврежденной конечности. Применение лекарственных препаратов, блокад и психотерапевтических методик обозначено в данном документе в качестве терапии резерва для части больных, у которых неэффективны лечебные методики по функциональному восстановлению либо невозможно их проведение.
Вместе с тем рекомендации, принятые в Малибу, оставили неразрешенными ряд проблем. Во-первых, несмотря на утверждение возможности применения специфических лечебных методик, таких как медикаментозные, физиотерапевтические, анестезиологические и психотерапевтические, отсутствовали рекомендации относительно последовательности и длительности их применения. Во-вторых, принятые алгоритмы постулировали значимость соблюдения этапности лечения, предусматривающую обязательное прохождение всеми пациентами каждой стадии лечения, по меньшей мере, в течение 2 нед. Данные подходы оказались слишком ригидными и трудновыполнимыми в условиях клинической практики. В-третьих, в рекомендациях декларировали сугубо резервный характер применения медикаментозной терапии, интервенционных методик и психотерапии, что отвергало часто возникающую клиническую необходимость применения лекарственных препаратов, блокад и психологической поддержки с самого начала заболевания, а не в качестве терапии резерва в случае неэффективности функционально-восстановительного лечения.
В связи с обозначенными проблемами в августе 2001 г. на конференции в Миннеаполисе (США) второй группой экспертов («Minneapolis Group») были пересмотрены рекомендации, принятые в Малибу. В результате пересмотра утверждены алгоритмы, базирующиеся на платформе реабилитационных мероприятий, купирования болевого синдрома и психологической поддержки, однако либерализирующие подходы к применению медикаментозной анальгетической терапии и нивелирующие приоритеты этапности лечения.
Таким образом, обеими экспертными группами — в Малибу и Миннеаполисе — признана определяющая роль болевого синдрома в выборе вида, интенсивности и последовательности различных видов терапевтических вмешательств с целью достижения основной цели — функционального восстановления. Оптимизированные алгоритмы лечения больных с КРБС представлены на рисунке.
Основные принципы междисциплинарного подхода в лечении больных с КРБС, основанные на данных клинических исследований соответствующего уровня доказательности, изложены в 4-м издании Американского практического руководства по диагностике и лечению КРБС 2013 г.
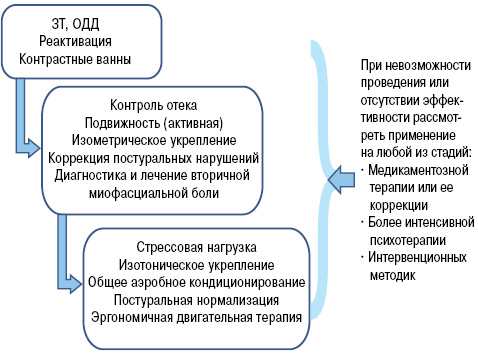
Рисунок. Алгоритмы междисциплинарного подхода к лечению больных с КРБС, экстраполированные и модифицированные согласно трем клиническим консенсусам, принятым в Малибу, Миннеаполисе и Будапеште (модифицировано по: Harden R.N. et al., 2013).
ЗТ — зеркальная терапия — метод, основанный на создании искусственной визуальной обратной связи.
ОДД — образ двигательного действия — метод ступенчатого овладения двигательным навыком, основанный на воздействии зрительных образов.
Медикаментозная терапия при КРБС
Патогенетическая обоснованность полифармакотерапии
Как указано выше, отсутствие в течение довольно продолжительного времени стандартизированных диагностических критериев и эмпирически обоснованных схем диагностики КРБС в значительной мере обусловило имеющийся дефицит клинических исследований соответствующего уровня, лишив тем самым пациентов с КРБС доказательно обоснованных схем лечения. Клиницисты вынуждены экстраполировать в свою практику данные клинических исследований и метаанализов, касающиеся лечения при похожих вариантах нейропатической боли. Вместе с тем следует отметить, что КРБС отличается от многих видов нейропатической боли вовлечением в патологический процесс дополнительных тканей и органов, включая нарушение микроциркуляции, костного обмена и воспаление. Достоверные данные подтверждают также вовлеченность центральной сенситизации, двигательных нарушений и патологической эфферентной импульсации. В настоящее время отсутствуют лекарственные препараты, эффективные в отношении всех вовлеченных в развитие КРБС патофизиологических механизмов.
Фармакологические средства, в отношении которых проводились специфические клинические исследования эффективности при КРБС, включают кальцитонин и бисфосфонаты, глюкокортикоиды и инъекционные формы иммуноглобулина (intravenous immunoglobulin — IVIG).
Лечебные методики, более основательно изученные в клинических исследованиях эффективности терапии при похожих вариантах нейропатической боли, включают применение трициклических антидепрессантов, габапентина и прегабалина, карбамазепина, опиоидных анальгетиков, клонидина, нифедипина, блокаторов α-адренергических рецепторов, лидокаиновых пластырей и капсаицина.
Медикаментозная монотерапия является наилучшим вариантом лечения в смысле минимизации рисков развития побочных эффектов, однако в клинической практике чаще требуется применение рациональной полифармакотерапии, в частности с целью воздействия на все симптомы КРБС. Такая полифармакотерапия должна включать оптимальную комбинацию препаратов разных классов. Кроме того, приоритеты медикаментозной терапии должны быть обозначены в пользу систематического (ежедневного) приема препаратов с целью профилактики — в большей степени, чем их применения по необходимости, в качестве спасающей терапии.
При выборе препаратов следует принимать во внимание ценовый аспект, а также индивидуальные потребности пациента с учетом выявленных коморбидных состояний. Формирование медикаментозных схем лечения должно базироваться на принципах долгосрочной целевой терапии.
Противовоспалительные лекарственные средства в терапии при КРБС
Нестероидные противовоспалительные препараты (НПВП), глюкокортикоиды и антиоксиданты применяют при КРБС с целью воздействия на болевой компонент синдрома и вовлеченный в его развитие процесс воспаления. Однако вследствие широко распространившейся концепции нейрогенной природы воспаления при КРБС (обусловленного медиаторами воспаления, высвобождающимися из окончаний афферентных ноцицепторов), крупные клинические исследования в отношении эффективности противовоспалительных препаратов при данной патологии не проводились. Несмотря на рекомендации Всемирной организации здравоохранения о целесообразности раннего их применения при хронической боли, данная группа лекарственных средств безосновательно недооценена как врачами, так и пациентами в силу убеждения, что это слишком простой класс препаратов для лечения при таком сложном симптомокомплексе, как КРБС. Вместе с тем данные исследований свидетельствуют (уровень доказательности D), что их применение эффективно у значительной части больных с КРБС.
НПВП
НПВП ингибируют действие циклооксигеназы (ЦОГ) и предупреждают синтез простагландинов, опосредующих эффекты воспаления и гипералгезии, кроме того, антипростагландиновый эффект может блокировать спинальную ноцицептивную импульсацию. В противоположность этому, парацетамол, например, обладает лишь центральным механизмом действия, кроме того, особенностью применения парацетамола является высокий риск его передозировки вследствие вхождения в состав множества комбинированных безрецептурных лекарственных средств.
НПВП продемонстрировали неоднозначные результаты в небольших клинических исследованиях. Однако эффекты отдельных НПВП могут быть более выраженными в сравнении с другими представителями этого класса. Кетопрофен, в частности, обладает выраженными антибрадикининовым и антипростациклиновым свойствами в дополнение к типичным антипростагландиновым эффектам НПВП. Имеются единичные эмпирические данные об эффективности применения селективного ингибитора ЦОГ-2 целекоксиба, однако высокая вероятность повышения кардиоваскулярного риска ограничивает широкое применение ЦОГ-2-селективных НПВП.
Препараты класса НПВП различного химического строения обладают различной выраженностью обезболивающего эффекта и различной переносимостью. По выраженности анальгетического эффекта преимущества отдаются производным фенилуксусной кислоты (ацеклофенак, диклофенак) и производным пропионовой кислоты (ибупрофен, кетопрофен) как наиболее безопасным препаратам ЦОГ-неселективного действия.
Глюкокортикоиды
Единственными противовоспалительными препаратами, эффективность которых при КРБС доказана в РКИ (уровень доказательности А), являются глюкокортикоиды. Однако большинство из этих исследований включали острые/ранние случаи КРБС, при которых воспаление является наиболее распространенным симптомом, таким образом остается неясным, могут ли глюкокортикоиды проявлять подобные терапевтические эффекты при применении у больных с хроническими формами КРБС. С учетом имеющихся данных, при лечении больных с КРБС можно рекомендовать применение коротких курсов пероральных глюкокортикоидов на ранних стадиях заболевания, сопровождающихся выраженным воспалительным процессом. Кроме отсутствия доказательной базы данных относительно эффективности длительного применения глюкокортикоидов при КРБС, следует учитывать также наличие многочисленных и серьезных противопоказаний к их длительному приему.
Антиконвульсанты в терапии нейропатической боли при КРБС
Лекарственные препараты, блокирующие поступление ионов кальция или натрия в нейроны, снижают их мембранный потенциал действия. Согласно данным РКИ, метаанализов и систематических обзоров (уровень доказательности А), применяемые в основном в качестве антиконвульсантов некоторые представители данного класса демонстрируют клиническую эффективность при нейропатической боли.
Препарат габапентин, являясь, согласно действующим рекомендациям Европейской федерации неврологических обществ (European Federation of Neurological Societies — EFNS) по фармакотерапии нейропатической боли, препаратом первой линии при различных вариантах нейропатической боли, привлек внимание экспертов в связи с единичными эмпирическими данными об эффективности его применения у больных с КРБС. Габапентин усиливает синтез ГАМК, обладает модулирующим воздействием на NMDA-рецепторы, блокирует α2δ-субъединицу вольтажчувствительных кальциевых каналов, снижает высвобождение моноаминов, уменьшает синтез и транспорт глутамата, способствует снижению порогового возбуждения периферических нервов.
Указанные эффекты обеспечивают высокую терапевтическую эффективность препарата в лечении при нейропатической боли, доказанной в ряде крупных РКИ (уровень доказательности В). Имеются данные (уровень доказательности D) о клинической эффективности применения габапентина у взрослых при КРБС и детей (1 описанный клинический случай). В связи с истечением срока патентной защиты габапентина, компанией-разработчиком на фармацевтический рынок был представлен препарат, являющийся соединением, близким по составу с габапентином, — прегабалин — с аналогичными фармакологическим эффектом. Незначительные преимущества нового препарата, а именно возможность двукратного применения и подбора суточной дозы, требуют адекватной оценки с учетом ценового аспекта данного преимущества.
Лечение при костной боли
Костная ткань плотно иннервирована мелкими ноцицептивными аксонами. Существенное ремоделирование костной архитектоники может вызывать боль, поскольку остеокласты резорбируют клетки костной ткани путем окисления своего внеклеточного матрикса с целью растворения гидроксиапатитных кристаллов, активируя при этом ноцицептивные кислоточувствительные каналы. Ингибирование костной резорбции, таким образом, может уменьшить выраженность болевых ощущений у соответствующей категории пациентов с КРБС. Такое лечение, помимо уменьшения выраженности болевых ощущений в костях, может способствовать сохранению костной массы в пораженной конечности, что является значимым для пациентов с КРБС.
Эффективность в отношении ингибирования костной резорбции подтверждена у таких препаратов, как кальцитонин и бисфосфонаты.
Кальцитонин — полипептидный гормон щитовидной железы — обладает самостоятельным антиноцицептивным эффектом, независимым от его воздействия на минеральный костный обмен, и проявляет эффективность в терапии ряда состояний, сопровождающихся острой и хронической болью. Препарат обычно применяют интраназально, при применении у нормокальцемических пациентов существенные побочные эффекты регистрируют крайне редко.
Бисфосфонаты — производные бисфосфоновых кислот (алендроновой, ибандроновой, ризедроновой, золедроновой, этидроновой, памидроновой) — также способны замедлять процессы костной резорбции и улучшать клинические исходы при лечении больных с КРБС. Клиническая эффективность отдельных — «старых» — представителей данного класса, таких как производные алендроновой и ризедроновой кислот, при лечении КРБС изучена достаточно хорошо, в то время как в отношении новых препаратов данного класса (производных ибандроновой, золедроновой, памидроновой кислот) доказательная база отсутствует. Результаты систематического обзора указывают на два крупных клинических исследования по изучению применения бисфосфонатов при КРБС (уровень доказательности В), подтвердивших выраженную клиническую эффективность внутривенного применения препарата алендроновой кислоты в дозе 7,5 мг/сут в течение 3 дней и препарата клодроновой кислоты в дозе 300 мг/сут в течение 10 дней (не одобренного к применению в США).
Фармакотерапия мышечной дистонии
Нарушение мышечного тонуса — одно из наиболее частых двигательных расстройств при КРБС, часто требующее применения самостоятельных терапевтических подходов. Мышечная дистония, сама по себе являющаяся достаточно болезненным состоянием, может также усилить болезненные ощущения посредством ухудшения тканевого кровоснабжения. Лечение при данном состоянии достаточно сложное, поскольку продолжительное тоническое состояние конечности приводит к укорочению сухожилий с формированием контрактур, что, в свою очередь, в дальнейшем требует проведения ортопедических процедур.
Обычно при КРБС назначают стандартные схемы, применяемые при мышечной дистонии, хотя патогенез нарушения мышечного тонуса при КРБС, равно как и при других формах посттравматической дистонии, существенно отличается от механизмов развития дистонии, опосредованной дисфункцией базальных ганглиев. При допустимости применения тригексифенидила, в настоящее время препаратом первой линии является баклофен — миорелаксант центрального действия; агонист ГАМК(В)-рецепторов. Следует отметить, что при пероральном применении в высоких дозах у большинства пациентов отмечается плохая переносимость препарата вследствие выраженной седации. В случаях очевидной эффективности баклофена, но плохой переносимости, рекомендуют интратекальное применение препарата, хотя и в данном случае регистрируют частые случаи осложнений фармакологического и процедурно-технического характера. В настоящее время отмечают растущую доказательную базу данных относительно обезболивающего эффекта баклофена, независимого от его миорелаксирующего действия. В противоположность этому длительное применение таких миорелаксантов, как бензодиазепины и циклобензаприн (трициклический препарат со структурой, схожей с амитриптилином, но обладающий слабым тимолептическим действием), является клинически неэффективным, к тому же характеризуется плохой переносимостью.
Рекомендации по оптимальной фармакотерапии при КРБС, соответствующие международным консенсусам и включенные в 4-е издание Американского практического руководства по диагностике и лечению КРБС 2013 г., представлены в табл. 2.
Стратегия, предложенная для применения у больных с КРБС с отсутствием эффекта от проводимой терапии функционального восстановления или невозможностью ее проведения (модифицировано по: Harden R.N. et al., 2013)
| Факторы, определяющие начало медикаментозной и интервенционной терапии | Методы лечения |
|---|---|
| Боль мягкой/умеренной интенсивности | Применение неспецифических анальгетиков и/или блокад |
| Мучительная, некупируемая боль | Применение опиоидных анальгетиков и/или блокад или (в более поздний период) дополнительных интервенционных методик |
| Воспаление и отек | Применение НПВП (постоянно) или глюкокортикоидов (системно или локально); иммуномодуляторов |
| Депрессия, тревожное расстройство, диссомния | Применение седативных, анальгезирующих антидепрессантов/анксиолитиков и/или психотерапевтических методик |
| Выраженная аллодиния/гипералгезия | Применение антиконвульсантов и/или других блокаторов натриевых каналов и/или антагонистов NMDA-рецепторов |
| Выраженная остеопения, иммобилизация и трофические нарушения | Применение кальцитонина или бисфосфонатов |
| Выраженные вазомоторные нарушения |
Применение блокаторов кальциевых каналов, симпатолитиков и/или блокад |
| Двигательные расстройства, мышечная дистония, спастические состояния | Миорелаксанты центрального действия (с целью облегчения проведения двигательной терапии) |
Результаты клинического исследования по изучению эффективности оригинальной схемы комбинированной фармакотерапии
Обзор современных представлений о ведущих механизмах патогенеза КРБС, принципах его диагностики и лечения позволил группе ученых, возглавляемой заведующим кафедрой травматологии и ортопедии Национального медицинского университета имени А.А. Богомольца доктором медицинских наук, профессором А. Бурьяновым, разработать оригинальные подходы к комплексному лечению больных с КРБС І типа с применением патогенетически обоснованной комбинированной фармакотерапии, клиническая эффективность которой доказана в рамках проведенного клинического исследования.
У КРБС І типа существует несколько названий: каузалгия, рефлекторная симпатическая дистрофия, синдром плечо-кисть и альгодистрофия. Заболеваемость данной патологией составляет приблизительно 25 случаев на 100 тыс. населения. Предрасполагающими факторами развития синдрома является табакокурение и принадлежность к женскому полу (соотношение женщины/мужчины = 4). Хотя повреждаться могут все конечности, чаще данная патология развивается в области верхних конечностей.
КРБС І типа — классический вариант осложнения, развивающегося после дистального перелома лучевой кости (4–37% случаев) и хирургического вмешательства в области запястного канала (2–4% случаев). Ранняя диагностика данной патологии и своевременное начало лечения — наиболее важные моменты эффективной терапии, поскольку для данного синдрома характерны длительное и инвалидизирующее течение.
С учетом современных клинических рекомендаций по фармакотерапии КРБС, а также данных доказательной медицины в отношении эффективности и рисках развития побочных эффектов при применении отдельных лекарственных препаратов авторами разработана комбинированная схема медикаментозной терапии, предусматривающая максимально эффективное воздействие на все звенья патогенеза КРБС и минимальные риски развития побочных эффектов.
В исследование включили 56 больных с диагнозом КРБС І типа на фоне переломов дистального эпиметафиза лучевой кости со смещением отломков. У всех пациентов диагностирован КРБС средней степени выраженности в І стадии заболевания (<6 мес после перенесенной травмы). Среди участников женщины составили 65%, средний возраст участников — 54,3 года.
При установлении диагноза КРБС с целью дифференциации нейропатической боли перед включением в клинические группы у больных применяли стандартизированный опросник DN4 (Douleur Neuropathique 4).
После установления диагноза больным назначали следующее комбинированное фармакотерапевтическое лечение:
- НПВП — препарат ацеклофенака Аэртал («Рихтер Гедеон», Венгрия), в дозе 100 мг 2 раза в сутки в течение 3 нед, с повторным курсом терапии через 1–2 нед при необходимости.
- Антиконвульсант — препарат габапентина Тебантин («Рихтер Гедеон», Венгрия) путем титрования дозы до достижения адекватной анальгезии (1-й день — 300 мг/сут; 2-й день — 600 мг/сут; 3-й день — 900 мг/сут с дальнейшей поддерживающей дозой 900–1200 мг/сут, в отдельных случаях — 1500 мг/сут).
- Миорелаксант центрального действия — препарат тольперизона Мидокалм («Рихтер Гедеон», Венгрия) в дозе 450 мг/сут в течение 3–4 нед.
- Осталон Кальций-Д («Рихтер Гедеон», Венгрия) — комбинированный препарат в форме таблеток, действующим веществом которых является натрия алендронат — представитель бисфосфонатов, и таблеток, в состав которых входят кальций и витамин D3.
- Зеркальная терапия, контрастные водные процедуры с местным охлаждением, препараты группы В — в период иммобилизации.
- Местное применение капсаицина после прекращения иммобилизации с целью уменьшения первичной гипералгезии.
В группу контроля включили 26 пациентов, у которых применяли традиционные схемы лечения: кеторолак в качестве обезболивающего препарата, диклофенак, спазмолитические препараты, местные противовоспалительные гели и остеотропную терапию.
Эффективность лечения оценивали после 4 и 8 нед терапии. Анализ результатов лечения проводили в динамике с использованием стандартизированных критериев оценки интенсивности болевого синдрома (визуальная аналоговая шкала — ВАШ), выраженности нейропатической боли (опросник DN4), функциональной активности кисти (ABILHAND — Ability of Hand) и субъективной оценки врачом и пациентами.
В течение 8-недельного периода лечения в основной группе больных достигнуто более чем 3-кратное уменьшение выраженности болевого синдрома по шкале ВАШ в сравнении с исходными данными. При этом к концу периода наблюдения интенсивность боли была почти в 2 раза меньше, чем у пациентов контрольной группы. По показателю опросника DN4 через 8 нед терапии у пациентов основной группы нивелирован нейропатический характер боли, в то время как у больных группы сравнения нейропатический компонент боли сохранялся. Функциональная активность кисти и лучезапястного сустава в основной группе после завершения 8-недельного курса терапии в основной группе соответствовала критерию «хорошо», а в контрольной группе — критерию «удовлетворительно». Оценка результатов лечения врачом и пациентом носила субъективный характер, однако продемонстрировала также более высокую эффективность проведенной терапии в основной клинической группе.
Выводы
- Таким образом, патогенетически обоснованная комбинированная фармакотерапия с применением лекарственных препаратов Аэртал, Тебантин, Мидокалм, Осталон Кальций-Д, соответствующая современным международным рекомендациям по лечению больных с КРБС, основанная на данных клинических исследований высокого уровня доказательности, подтвердила свою эффективность и преимущества в условиях клинической практики в рамках проведенного исследования.
- Комплексное применение препаратов ацеклофенака, габапентина, тольперизона, натрия алендроната в сочетании с кальцием и витамином D3 у больных с КРБС І типа является примером оптимального клинического выбора, соответствующего клиническим протоколам лечения с минимизацией риска возникновения побочных эффектов полифармакотерапии.
- Полученные результаты подтверждают необходимость и обоснованность клинической имплементации стандартизированных подходов к лечению данной категории больных, клинические преимущества применения полифармакотерапии, основанные на данных доказательной медицины, а также высокую фармакологическую эффективность препаратов Аэртал, Тебантин, Мидокалм, Осталон Кальций-Д в терапии пациентов с КРБС.
Список использованной литературы
- Бурьянов А.А. (1990) Посттравматическая дистрофия конесностей (синдром Зудека). Вопросы патогенеза, диагностики и лечения: Автореф. … дис. канд. мед.наук, Харьков, 24 с.
- Морозова О.Г. (2009) Комплексный региональный болевой синдром в клинической практике, Здоров’я України, 22(1): 18–21.
- Новиков А.В., Яхно Н.Н. (1994) Синдром рефлекторной симпатической дистрофии. Журн. невропат. и психиатрии им. С.С. Корсакова, 5: 103–107.
- Шостак Н.А., Правдюк Н.Г., Клименко А.А. (2013) Комплексный региональный болевой синдром — клиника, диагностика, лечение. Клиницист, 1: 41–46.
- Attal N., Cruccu G., Baron R. et al. (2010) EFNS guidelines on pharmacological treatment of neuropathic pain. Eur. J. Neurol., 17(9): 1113–e88.
- Chaparro L.E., Wiffen P.J., Moore R.A. et al. (2012) Combination pharmacotherapy for the treatment of neuropathic pain in adults. Cochrane Database Syst. Rev., 7: CD008943.
- de Mos M., de Bruijn A.G., Huygen F.J. et al. (2007). The incidence of complex regional pain syndrome: a population-based study. Pain, 129(1–2): 12–20.
- Eisenberg E., Geller R., Brill S. (2007) Pharmacotherapy options for complex regional pain syndrome. Expert Rev. Neurother., 7(5): 521–531.
- Geisslinger G., Yaksh T. (2000) Spinal actions of cyclooxygenase isoenzyme inhibitors. In: Devor M., Rowbotham M., Wiesenfeld-Halin Z., eds. Proceedings of the 9th World Congress on Pain. IASP Press, Seattle, WA, р. 833–855.
- Gibbons J.J., Wilson P.R. (1992) RSD score: criteria for the diagnosis of reflex sympathetic dystrophy and causalgia. Clin. J. Pain, 8(3): 260–263.
- Harden R.N, Oaklander A.L., Burton A.W. et al. (2013) Complex regional pain syndrome: practical diagnostic and treatment guidelines, 4th edition. Pain Med., 14(2): 180–229.
- Harden R.N. (2005) Pharmacotherapy of complex regional pain syndrome. Am. J. Phys. Med. Rehabil., 84(3 Suppl.): S17–28.
- Harden R.N., Baron R., Janig W. (2001) Preface. In: Harden R.N., Baron R., Janig W., eds. Complex Regional Pain Syndrome. IASP Press, Seattle, 2001: xi–xiii.
- Harden R.N., Bruehl S., Perez R.S. et al. (2010) Validation of proposed diagnostic criteria (the «Budapest Criteria») for Complex Regional Pain Syndrome. Pain, 150(2): 268–274.
- Harden R.N., Swan M., Costa B.R. et al. (2006) Interdisciplinary Management. In: Harden RN, ed. Complex Regional Pain Syndrome: Treatment Guidelines. RSDSA Press, Milford, CT, р. 12–24.
- Jadad A.R., Browman G.P. (1995) The WHO analgesic ladder for cancer pain management. Stepping up the quality of its evaluation. JAMA, 274(23): 1870–1873.
- Kozin F., Ryan L.M., Carerra G.F. et al. (1981) The reflex sympathetic dystrophy syndrome III: Scintigraphic studies, further evidence for the therapeutic efficacy of systemic corticosteroids, and proposed diagnostic criteria. Am. J. Med., 70(1): 23–30.
- Mellick G.A., Mellicy L.B., Mellick L.B. (1995) Gabapentin in the management of reflex sympathetic dystrophy. J. Pain Symptom Manage., 10(4): 265–266.
- Stanton-Hicks M., Baron R., Boas R. et al. (1998) Complex regional pain syndromes: guidelines for therapy. Clin. J. Pain, 14: 155–166.
- Wiffen P.J., McQuay H.J., Edwards J. et al. (2011) WITHDRAWN: Gabapentin for acute and chronic pain. Cochrane Database Syst. Rev., 3: CD005452.
Ольга Федорова
Информация для профессиональной деятельности медицинских и фармацевтических работников
Мидокалм
Р.с. № UA/7535/01/01, № UA/7535/02/01, № UA/7535/02/02 от 14.01.13 г.
Состав. 1 таблетка содержит 50 мг или 150 мг тольперизона гидрохлорида; 1 мл раствора содержит 100 мг тольперизона гидрохлорида и 2,5 мг лидокаина гидрохлорида. Фармакотерапевтическая группа. Миорелаксанты с центральным механизмом действия. Код АТС. М03В Х04. Показания. Таблетки: мышечная спастичность, в том числе постинсультная спастичность, в случае, если инъекционная форма является методом выбора. Раствор для инъекций: симптоматическое лечение при мышечном спазме у взрослых после перенесенного инсульта. Противопоказания. Гиперчувствительность к какому-либо компоненту препарата; миастения гравис; период кормления грудью; раствор для инъекций также не применяют у детей. Побочные реакции. Мышечная слабость, головная боль, головокружение, гипотензия, нарушения сна, тошнота, рвота, ощущение дискомфорта в области живота; реакции гиперчувствительности. Производитель. ОАО «Гедеон Рихтер», Венгрия.
Осталон Кальций-Д
Р.с. № UA/11297/01/01 от 06.01.2011 г. Состав. Таблетки алендроновой кислоты: 1 таблетка, покрытая оболочкой, содержит 70 мг алендроновой кислоты (в виде 91,35 мг алендроната натрия тригидрата). Таблетки кальция и витамина D3: 1 таблетка, покрытая оболочкой, содержит 600 мг кальция (в виде 1500 мг кальция карбоната) и 400 МЕ витамина D3 (в виде 10 мкг колекальциферола). Фармакотерапевтическая группа. Бисфосфонаты, комбинации. Код АТС. M05B B05. Показания. Лечение при остеопорозе, когда показано применение таблеток алендроновой кислоты и когда необходим дополнительный прием таблеток кальция и витамина D. Таблетки алендроновой кислоты: лечение при остеопорозе в постменопаузальный период с целью предупреждения переломов, в том числе, компрессионных переломов позвонков спинного мозга и головки бедренной кости; лечение при остеопорозе у мужчин с целью предупреждения переломов. Таблетки кальция и витамина D3: дополнительная терапия при остеопорозе в сочетании с таблетками алендроновой кислоты. Противопоказания. Применение таблеток Осталон Кальций-Д противопоказано из-за таблеток алендроновой кислоты при повышенной чувствительности к компонентам препарата, аномалиях пищевода и других факторах, затрудняющих его проходимость (ахалазия, стриктуры); неспособности больного оставаться в вертикальном положении (хотя бы сидя) в течение 30 мин; при гипокальциемии; в период беременности и кормления грудью. Детский или подростковый возраст. Таблетки Осталон Кальций-Д противопоказаны из-за таблеток кальция и витамина D при повышенной чувствительности к компонентам препарата; почечной недостаточности; гиперкальциурии; нефролитиазе; применении препаратов, содержащих активный витамин D; при гипервитаминозе, обусловленном витамином D; первичном гиперпаратиреозе; гиперкальциемии любой этиологии. Таблетки Осталон Кальций-Д, покрытые оболочкой, содержат соевое масло, поэтому пациентам, страдающим аллергией на сою или арахис, препарат противопоказан. Побочные реакции. Таблетки алендроновой кислоты по 70 мг: со стороны ЖКТ — боль в области живота, диспепсия; запор; диарея, метеоризм, язва пищевода, дегтеобразный характер испражнений (мелена), дисфагия, вздутие желудка, отрыжка кислым и др.; со стороны опорно-двигательного аппарата — костная, мышечная или суставная боль; со стороны нервной системы — головная боль; общие — кожные высыпания, зуд, покраснение кожи, аллергические реакции, в том числе крапивница и ангионевротический отек; преходящие симптомы, напоминающие фазу острой реакции (миалгия, слабость, плохое самочувствие; редко — гипертермия) и др.; со стороны органов чувств — увеит, склерит и др. Таблетки кальция и витамина D: со стороны обмена веществ — гиперкальциемия, гиперкальциурия; со стороны ЖКТ — запор, метеоризм, тошнота, боль в области живота, диарея; со стороны кожи и подкожной клетчатки — зуд, кожные высыпания, крапивница. Производитель. Таблетки кальция и витамина D3: ЗАО «Берешь Фарма», Н-5005, Солнок, ул. Надьшандор, 39, Венгрия. Таблетки алендроновой кислоты: ООО «Гедеон Рихтер Польша», 05–825, Гродзиск Мазовецкий, ул. Кн. Ю. Понятовского, 5, Польша.
Аэртал
Р.с. № UA/5359/01/01 от 26.10.2011 г. Состав. 1 таблетка содержит 100 мг ацеклофенака. Фармакотерапевтическая группа. Нестероидные противовоспалительные препараты (НПВП). Производные уксусной кислоты и родственные вещества. Код АТС. М01А В16. Показания. Симптоматическая терапия болевого синдрома и воспаления при остеоартрите, ревматоидном артрите и анкилозирующем спондилите, а также при других заболеваниях опорно-двигательного аппарата, сопровождающихся болью (например плечелопаточный периартрит или внесуставной ревматизм). В качестве анальгетика при состояниях, сопровождающихся болевым синдромом (в том числе боль в поясничном отделе позвоночника, зубная боль и первичная (функциональная) дисменорея). Противопоказания. Препарат противопоказан пациентам с НПВП-обусловленными желудочно-кишечным кровотечением или перфорацией язвы в анамнезе; пациентам с активным кровотечением или нарушением свертываемости крови; лицам с тяжелой степенью почечной или печеночной недостаточности; пациентам с сердечной недостаточностью тяжелой степени; лицам с гиперчувствительностью к ацеклофенаку или какому-либо вспомогательному компоненту препарата, а также пациентам с астматическими приступами, острым ринитом, ангионевротическим отеком или крапивницей, обусловленными приемом ацетилсалициловой кислоты или НПВП, а также пациентам с гиперчувствительностью к этим препаратам. Применение препарата в последний триместр беременности противопоказано. Не рекомендован к применению у детей. Побочные реакции. Со стороны ЖКТ — пептическая язва, перфорации или желудочно-кишечные кровотечения; тошнота, рвота, диарея, метеоризм, запор, диспепсия, боль в области живота, мелена, рвота кровью, язвенный стоматит, обострение колита и болезни Крона; гастрит, панкреатит. Реакции гиперчувствительности — неспецифические аллергические реакции и анафилаксия, реактивные реакции со стороны органов дыхания, в том числе бронхиальная астма, ухудшение течения бронхиальной астмы, бронхоспазм и диспноэ или различные кожные проявления, в том числе различные формы кожных высыпаний, зуд, крапивница, пурпура, ангионевротический отек и др. Сердечно-сосудистые и цереброваскулярные нарушения — отеки, артериальная гипертензия, сердечная недостаточность; возможно повышение риска тромбоэмболических осложнений и др. Производитель. ООО «Гедеон Рихтер», Будапешт, Венгрия, по лицензии Алмирал А.Г., Швейцария.
Полная информация о лекарственных средствах содержится в инструкциях по медицинскому применению.

Leave a comment