Вміст метаболітів оксиду азоту та прозапальних цитокінів у пацієнтів із гострою ревматичною лихоманкою та хронічною ревматичною хворобою серця
Резюме. У 74 хворих (44 дітей та 30 дорослих) з різними формами ревматизму визначали вміст прозапальних цитокінів (фактор некрозу пухлини (ФНП)-α, інтерферон (ІФН)-γ), рівень метаболітів оксиду азоту (нітрит- і нітрат-аніонів) та активність супероксиддисмутази. У дітей з гострою ревматичною лихоманкою відзначали підвищення рівня ФНП-α, ІФН-γ, зростання вмісту нітритів і нітратів у сироватці крові у 90,9%, що, очевидно, має компенсаторно-пристосувальне значення. У дітей та дорослих із хронічною ревматичною хворобою серця виявлено зростання середнього показника сумарного вмісту нітритів і нітратів у сироватці крові, при цьому зниження вмісту метаболітів оксиду азоту у 25,0% дітей, що свідчить про напруження в роботі оксид-азотсинтезуючої системи. Активація синтезу оксиду азоту у осіб із хронічною ревматичною хворобою серця на фоні зниженої активності супероксиддисмутази може посилювати оксидативний стрес та призвести до прогресування хвороби.
ВСТУП
Відкриття ролі оксиду азоту як регулятора клітинного метаболізму зіграло вагому роль в розумінні механізмів дисфункції ендотелію судин, за що групі вчених, які зробили великий внесок у це відкриття, — Ф. Мьюреду, Р. Форчготту та Л. Ігнарро було присуджено у 1998 р. Нобелівську премію (Ванин А.Ф., 2001). Оксид азоту (NO) бере участь у роботі багатьох органів та систем організму. Крім того, доведено цитотоксичну та цитостатичну активність NO як одного із стимуляторів системи імунітету. Американський імунолог Джон Хіббс показав, що джерелом NO в активованих макрофагах є амінокислота аргінін. В організмі NO утворюється з аргініну за участю синтази оксиду азоту (Меньшикова Е.Б. и соавт., 2000). Оксид азоту належить до факторів антимікробного захисту організму (Звенигородская Л.А., Нилова Т.В., 2008). Він знищує чи зупиняє ріст багатьох патогенних мікроорганізмів — вірусів, бактерій, грибів, найпростіших. Бактеріальні токсини індукують у макрофагах синтез фактора некрозу пухлини (ФНП)-α . У свою чергу, ФНП-α та інші фактори: ліпополісахариди, інтерферон (ІФН)-γ, інтерлейкін-1, фактор активації тромбоцитів та інші стимулюють синтез NO (Rivier C., 1998; Звягина Т.В. та співавт., 2002). Крім того, оксид азоту посилює антиоксидантний захист, активуючи продукцію глутатіону і супероксиддисмутази (СОД) (Moncada S., 2000; Ernesto L. Schiffrin, 2008). В умовах гіперпродукції вільних радикалів та при дефектах системи антиоксидантного захисту, які пов’язані з дефіцитом СОД, синтез оксиду азоту призводить до утворення пероксинітритів за рахунок конкурентного зв’язування цієї сполуки із супероксидними аніонами (Channon K.M., 2000). На відміну від NO, пероксинітрити виявляють цитотоксичну дію та є сильними вазоконстрикторами.
В останньому десятиріччі інтенсивно вивчалася роль NO в патогенезі ревматичних захворювань у дорослих (Verbuggen A., 2000; Wanchu A., 2000). Доведено роль оксиду азоту як медіатора апоптозу клітин синовіальної рідини при ревматоїдному артриті (Van’T Hof R.J. et al., 2000). Важлива роль NO в патогенезі ревматоїдного артриту у дорослих показана у ряді досліджень (Коваленко В.Н., 2005). Відомі окремі повідомлення про роль дисфункції ендотелію в розвитку ювенільного ревматоїдного артриту у дітей (Иванова М.В. и соавт., 2007). Дослідження щодо ролі NO в патогенезі гострої ревматичної лихоманки та ревматичної хвороби серця поодинокі (Narin F. et al., 2003; Balat A., et al., 2005). Є.Х. Заремба та О.О. Зімба досліджували ендотеліальну дисфункцію у хворих на ревматизм із недиференційованою дисплазією сполучної тканини (2009). Дослідження ролі NO в педіатрії стосуються в основному його ролі при легеневій гіпертензії у дітей із вродженими вадами серця (Введенская Л.С. и соавт., 2006) та як маркера ризику формування артеріальної гіпертензії (Дудчак А.П., 2008).
Мета роботи — дослідити вміст прозапальних цитокінів як факторів активації синтезу оксиду азоту та вміст показників метаболітів NO при гострій ревматичній лихоманці (ГРЛ), хронічній ревматичній хворобі серці (ХРХС) у дітей та дорослих ідати їм діагностичну та прогностичну оцінку при цих захворюваннях.
ОБ’ЄКТ І МЕТОДИ ДОСЛІДЖЕННЯ
Під спостереженням перебували 44 дітей віком від 5 до 17 років та 30 дорослих хворих віком від 24 до 42 років. У 11 дітей діагностовано ГРЛ, у 12 пацієнтів — ХРХС та у 21 дитини в анамнезі була перенесена ГРЛ без формування вади серця, тобто, можна вважати цю групу дітей з ГРЛ, одужання. У всіх дорослих спостерігалася ХРХС. Контрольну групу становили 30 здорових дітей та 15 практично здорових дорослих осіб.
Діагностику ГРЛ проводили за критеріями Киселя — Джонса (у модифікації Асоціації ревматологів України, 2004), ХРХС — за наявності вади серця чи післязапального крайового фіброзу стулок клапанів серця. Усім хворим проведено загальноприйняте клініко-лабораторне обстеження, електрокардіографію та ехокардіографію серця.
Середня тривалість життя оксиду азоту в організмі людини становить декілька секунд. NO, який не взяв участі в хімічних реакціях, швидко окиснюється до неактивних сполук — нітритів і нітратів. Це стабільні метаболіти NO, які слугують методом оцінки інтенсивності синтезу цієї сполуки (Guevara I. et al., 1998). Визначення рівня азотистих сполук (NO та NO) проводили за стандартною методикою з використанням реактиву Грісса. Відновлення нітратів до нітритів проводили металічним цинком в розчині оцтової кислоти. Іони NO виявляли діазореакцією з реактивом Грісса, з подальшим колориметричним визначенням азоз’єднання рожево-червоного кольору (Green L.C. et al., 1982; Кіселик І.О. та співавт., 2001). Розрахунок кількості нітрат-іонів проводили за різницею сумарної кількості нітрат- і нітрит-іонів та кількістю нітрит-іонів з коефіцієнтом перерахунку 1,3. Активність ферменту СОД визначали за його здатністю інгібувати відновлення нітротетразолю синього у присутності коферменту нікотинамідаденіндинуклеотиду (НАДНН) (Гонський Я.І. (ред.), 1992). Результат виражали в умовних одиницях активності. Визначали вміст прозапальних цитокінів (ФНП-α, ІФН-γ у пг/мл) в сироватці крові методом твердофазного імуноферментного аналізу з використанням тест-наборів ТОВ «Укрмед Дон», Донецьк.
Статистичну обробку результатів проводили, використовуючи програми «Microsoft Exel» та «Statistica-6,0». Вірогідність середніх величин визначали за допомогою критерію Стьюдента.
РЕЗУЛЬТАТИ ДОСЛІДЖЕННЯ ТА ЇХ ОБГОВОРЕННЯ
Серед обстежених хворих хлопчики переважали у групі з ГРЛ, вони становили 7 (63,6%), та у групі дітей з перенесеною ГРЛ, у стадії одужання, де вони становили 12 (57,1%) осіб. У пацієнтів із ХРХС дитячого віку хлопчики і дівчатка становили однакову кількість — 6 (по 50,0%). Серед дорослих із ХРХС переважали особи жіночої статі — 19 (63,3%).
Розподіл дітей за віком із ГРЛ та ХРХС (на момент її встановлення) зображено на рис. 1.
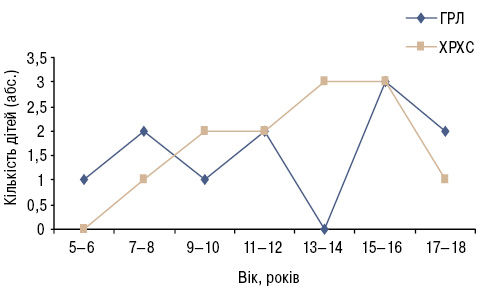
Як видно (див. рис. 1), частота ГРЛ у дітей віком 5–12 років має хвилеподібний характер, пік зростання захворюваності припадає на пубертатний вік — 15–16 років. У групі дітей із ХРХС вперше цей діагноз було встановлено у віці 7 років, підвищення піку формування вад серця чи запального крайового фіброзу стулок клапанів припадає на період з 14 до 16 років. Тобто, у двох групах пік захворюваності припадає на пубертатний період, в чому, очевидно, відіграє роль гормональна перебудова в цьому віці, напруженість адаптивних можливостей організму підлітків.
Найчастішим (у 10 (90,9%) дітей) проявом ГРЛ був кардит, рідше — мігруючий поліартрит — у 5 (45,5%) хворих, мала хорея та ревматичні вузлики — у 2 (18,2%) пацієнтів. Фебрильна лихоманка відзначалася у 10 (90,9%) хворих. Передуюча стрептококова інфекція спостерігалася у 7 (63,6%) дітей, серед яких у 3 хворих була ангіна, у 2 — стрептококовий фарингіт тау 2 — скарлатина.
У дітей із ХРХС частіше спостерігалася недостатність мітрального клапана — у 4 (33,3%) дітей та комбінована недостатність мітрального та аортального клапанів — у 4 (33,3%) хворих. В одного підлітка була мітральна вада з перевагою стенозу та недостатність аортального клапана. У 3 (25,0%) дітей спостерігався краєвий фіброз стулок мітрального та аортального клапанів. У 4 (33,3%) дітей із ХРХС в анамнезі відсутні дані щодо ГРЛ. Тривалість захворювання (від перших проявів ГРЛ) становила від 1 до 10 років. Такою ж була тривалість періоду після ГРЛ у групі дітей, в яких не відзначалося ознак ревматичного ураження серця. Ці діти перебували на диспансерному спостереженні у кардіоревматолога, вони щорічно проходили ретельний огляд, обстеження та отримували вторинну профілактику препаратами пеніциліну пролонгованої дії.
При ХРХС у дорослих найчастіше виявляли комбіновані вади серця. Переважали мітральні вади, зокрема стеноз ІІІ–ІV ступеня — у 18 (60,0%) хворих, у 5 (16,7%) пацієнтів вони поєднувалися з недостатністю аортального клапана та у 7 (23,3%) — з відносною недостатністю трикуспідального клапана. Лише у 4 (13,3%) хворих була мітральна вада з перевагою недостатності. Аортальні вади відзначалися рідше — у 8 (26,7%) хворих, дещо частіше з перевагою недостатності клапана.
| Група | Нітрити, мкмоль/л | Нітрати, мкмоль/л | Нітрити + нітрати, мкмоль/л | СОД, ум.од.акт. |
|---|---|---|---|---|
| Контроль, діти | 0,96±0,03 | 1,13±0,08 | 2,38±0,07 | 63,13±1,50 |
| ГРЛ | 1,18±0,09* | 1,57±0,15* | 3,10±0,13*** | 55,94±1,98* |
| ХРХС, діти | 0,98±0,06 | 1,65±0,22* | 2,92±0,20* | 45,51±4,00** |
| ГРЛ, одужання | 0,99±0,08 | 1,63±0,14* | 2,92±0,17* | 52,46±1,99** |
| Контроль, дорослі | 0,82±0,05 | 1,67±0,06 | 2,74±0,12 | 68,02±2,82 |
| ХРХС, дорослі | 1,04±0,06** | 2,15±0,09*** | 3,50±0,09*** | 46,45±1,68*** |
У табл. 1 і 2: *р<0,05, **р<0,01, ***р<0,001 порівняно з відповідною контрольною групою.
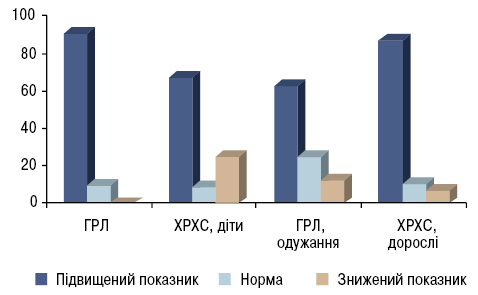
Вміст метаболітів оксиду азоту (NO та NO) наведено в табл. 1. Сумарний вміст метаболітів оксиду азоту був підвищеним у 1,3 раза у дітей з ГРЛ (р<0,001) порівняно з контролем. Зростання цього показника при ГРЛ у дітей виявлено і A. Balat та співавторами (2005). Достовірне підвищення цього показника відзначали у групі дітей і дорослих із ХРХС та у дітей з перенесеною ГРЛ, які були на етапі одужання. Проте встановлено, що підвищення сумарного вмісту метаболітів оксиду азоту спостерігалося у 90,9% дітей з ГРЛ і лише в 1 дитини показник був в межах норми, тоді як у дітей з перенесеною ГРЛ і одужанням підвищення показника виявлено в 62,5%, у 25,0% — він був у межах норми та у 12,5% хворих — показник був знижений (рис. 2). У дорослих із ХРХС зростання сумарного вмісту метаболітів оксиду азоту встановлено у 86,7% пацієнтів, у 10,0% — у межах норми та у 6,7% — рівень був знижений, у дітей із ХРХС — підвищення відзначалося у 66,7% хворих, у 25,0% — показник був знижений (переважно за рахунок низьких показників NO) та у 8,3% — у межах норми. Вірогідне зростання вмісту нітритів відзначено у дітей з ГРЛ (р<0,05) та у дорослих із ХРХС (р<0,01), тоді як вміст нітратів був підвищеним у всіх групах пацієнтів. Водночас нами виявлено вірогідне зниження активності СОД у всіх групах.
Рівень прозапальних цитокінів (ФНП-α, ІФН-γ) у хворих на ревматизм наведено в табл. 2. Відзначено виражене зростання ФНП-α у дітей з ГРЛ та у пацієнтів із ХРХС, що може свідчити про його активацію в макрофагах, очевидно, бактеріальними токсинами β-гемолітичного стрептококу групи А. У дітей з ГРЛ на етапі одужання показник ФНП-α не відрізняється від показника контрольної групи. Встановлено вірогідне підвищення рівня ІФН-γ у дітей з ГРЛ порівняно з контролем (р<0,05). Цей показник був достовірно підвищеним у дітей з ГРЛ на етапі одужання та у дорослих із ХРХС (р<0,05). У дітей з ХРХС вірогідних відхилень не виявлено.
| Група | ФНП-α, пг/мл | ІФН-γ, пг/мл |
|---|---|---|
| Контроль, діти | 11,55±2,62 | 6,52±2,48 |
| ГРЛ | 228,98±88,98* | 32,53±12,63* |
| ХРХС, діти | 128,42±12,65*** | 8,04±0,94 |
| ГРЛ, одужання | 26,13±12,59 | 17,36±4,44* |
| ХРХС, дорослі | 118,31±19,87*** | 18,09±4,68* |
Таким чином, у дітей з ГРЛ встановлено зростання прозапальних цитокінів (ФНП-α, ІФН-γ), які, очевидно, активують синтез NO, про що свідчить зростання його стабільних метаболітів. Активація оксиду азоту при гострих запальних процесах виконує захисну функцію, забезпечуючи максимальну перфузію тканин. Підвищення рівня прозапальних цитокінів та вмісту в сироватці крові нітратів і нітритів виявлено і при інших аутоімунних захворюваннях, зокрема системному червоному вовчаку (Шевчук С.В., 2005). Встановлено зростання вмісту метаболітів NO у дітей із пролапсом мітрального клапана з регургітацією (Кучеренко А.Г., 2005). Позитивний ефект підвищеного вмісту NO в цьому випадку автори вбачають у захисній реакції на сповільнення темпів формування легеневої гіпертензії і запобігання внутрішньосудинним ускладненням. При регургітації на мітральному клапані зменшується серцевий викид, що призводить до активації симпато-адреналової та ренін-ангіотензин-альдостеронової систем. Оскільки у дітей з ГРЛ одним з основних проявів ендокардиту є саме регургітація на мітральному клапані, яка спостерігалася у 70,0% обстежених із кардитом, то очевидно, активація симпато-адреналової системи є ще одним механізмом, який призводить до підвищення рівня NO в сироватці крові.
Джерела літератури стверджують, що NO підвищує антиоксидантний захист, стимулюючи активність СОД (Ernesto L. Schiffrin, 2008). У проведеному нами дослідженні встановлено зниження активності СОД, що може свідчити про гіперпродукцію вільних радикалів, зниження антиоксидантного захисту та підвищення оксидативного стресу. Результати інших досліджень також показали початкове підвищення і подальше зниження активності СОД в експерименті (Hoen P. et al., 2003). Саме при дефіциті СОД підвищений синтез NO може проявляти цитотоксичну дію, пов’язану з утворенням пероксинітритів (Channon K.M., 2000; Ванин А.Ф., 2001), що може мати і негативні наслідки. На опосередковану роль підвищеного вмісту NO у процесі апоптозу кардіоміоцитів вказують й інші автори (Шматкова Ю.В. и соавт., 2006). Надлишок NO інгібує білки-ферменти дихального ланцюжка мітохондрій і циклу Кребса, знижує синтез аденозинтрифосфату, що призводить до некрозу чи апоптозу (Звенигородская Л.А., Нилова Т.В., 2008). Процеси оксидативного стресу в кардіоміоциті запускають каспазний каскад та призводять до прогресування хвороби.
Підвищення вмісту метаболітів NO у групі дітей, які перенесли ГРЛ і на період обстеження в них констатувалося одужання, може бути пов’язано з активацією оксиду азоту ІФН-γ, про що свідчить його підвищений вміст у цій групі. У наших попередніх дослідженнях (Боярчук О.Р., 2010) показано, що антитіла до вірусів родини Herpesviridae виявлені у 88,9% дітей із перенесеною ГРЛ.
ВИСНОВКИ
1. У дітей з ГРЛ спостерігається підвищення рівня прозапальних цитокінів (ФНП-α, ІФН-γ), зростання вмісту нітритів і нітратів у сироватці крові, що, очевидно, має компенсаторно-пристосувальне значення.
2. У дітей із ХРХС відзначається підвищений рівень ФНП-α, зростання середнього показника сумарного вмісту нітритів і нітратів у сироватці крові. Зниження вмісту нітритів та нітратів у 25,0% дітей свідчить про напруження в роботі оксид-азотсинтезуючої системи.
3. Зниження активності СОД у дітей із ГРЛ, хворих із ХРХС може свідчити про зниження антиоксидантного захисту та підвищення оксидативного стресу.
4. Активація синтезу оксиду азоту у дорослих із ХРХС, що відбувається за рахунок підвищеного вмісту ФНП-α та ІФН-γ, в умовах оксидативного стресу може призвести до прогресування хвороби.
ЛІТЕРАТУРА
- Боярчук О.Р. (2010) Частота носійства вірусів родини Herpesviridae у дітей з гострою ревматичною лихоманкою та хронічною ревматичною хворобою серця. Таврический мед.-биол. вестн., 2 (13). Материалы IX Всеукр. науч.-практ. конф. «Актуальні питання дитячої кардіоревматології», 22–23 апреля 2010 г., Евпатория, с. 93.
- Ванин А.Ф. (2001) Оксид азота — регулятор клеточного метаболизма. Соровский образоват. журн., 11(7): 7–12.
- Введенская Л.С., Брегель Л.В., Горбачев В.И. и др. (2006) Изменения и нитроксидергической системе при легечной гипертензии у детей с врожденными пороками сердца. Педиатрия, 2: 21–24.
- Гонський Я.І. (ред.) (1992) Посібник до практичних занять з біологічної хімії. Тернопіль, с. 119–121.
- Дудчак А.П. (2008) Оксид азоту як маркер ризику формування артеріальної гіпертензії у дітей. Здоровье ребенка, 4(13): 59–62.
- Заремба Є.Х., Зімба О.О. (2009) Ендотеліальна дисфункція у хворих на ревматизм із недиференційованою дисплазією сполучної тканини. Укр. ревматол. журн., 4(38): 32–34.
- Звенигородская Л.А., Нилова Т.В. (2008) Оксид азота как маркер воспаления при стеатогепатите у больных с метаболическим синдромом. РМЖ, 2(10): 47–50.
- Звягина Т.В., Гамаюнов И.В., Губанова Е.А. и др. (2002) Изменения метаболизма оксида азота при ревматических заболеваниях. Укр. ревматол. журн., 3 (9): 10–15.
- Иванова М.В., Гармаш О.И., Лебедева Т.Н. (2007) Роль дисфункции эндотелия в развитии ювенильного ревматоидного артрита у детей. Перинатология и педиатрия, 2(30): 85–87.
- Кіселик І.О., Луцик М.Д., Шевченко Л.Ю. (2001) Особливості визначення нітратів та нітритів в периферичній крові у хворих на вірусні гепатити та при синдромі жовтяниці іншої етіології. Лабораторна діагностика, 3: 43–45.
- Коваленко В.Н. (2005) Ревматоидный артрит: этиопатогенез, клиника, диагностика, лечение. Ліки України, 1 (90): 24–27.
- Кучеренко А.Г., Жиркова О.О., Смирнов И.Е. та ін. (2005) Оксид азота у детей з пролапсом митрального клапана. Педиатрия, 2: 13–15.
- Меньшикова Е.Б., Зенков Н.К., Реутов В.П. (2000) Оксид азота и NO-синтазы в организме млекопитающих при различных функциональных состояниях. Биохимия, 4(65): 485–503.
- Шевчук С.В. (2005) Порівняльна характеристика систем оцінки активності запального процесу у хворих на системний червоний вовчак, зв’язок з рівнем цитокінів у крові. Укр. ревматол. журн., 2(20): 23–25.
- Шматкова Ю.В., Бершова Т.В., Басаргина Е.Н. и др. (2006) Особенности энергетического обмела клетки и цитокинового статуса у детей с хронической сердечной недостаточностью. Педиатрия, 2: 17–21.
- Balat A., Kilina M., Cekmen M.B. et al. (2005) Adrenomedullin and total nitrite levels in children with acute rheumatic fever. Clin. Biochen., 38(6): 526–530.
- Channon K.M., Qian H., George S.E. (2000) Nitric oxide synthase in atherosclerosis and vascular injury. Arterioscler. Thromb. Vasc. Biol., 20(8): 1873–1881.
- Ernesto L. Schiffrin (2008) Oxidative Stress, Nitric Oxide Synthase, and Superoxide Dismutase. Hypertention, 51: 31–34.
- Guevara I., Iwanejko J., Dembinska-Kiec A. (1998) Determination of nitrite/nitrate in human biological material by the simple Griess reaction. Clin. Chim. Acta, 274(2): 177–188.
- Green L.C., Wagner D.A., Glogowski J. et al. (1982) Analysis of nitrate, nitrite, and [15N] nitrate in biological fluids. Anal Biochem., 1: 131–138.
- Hoen P.A.C., van der Lans C.A.C., van Eck M. et al. (2003) Aorta of apoE-deficient mice responds to atherogenic stimuli by a prelesional increase and subsequent decrease in the expression of antioxidant enzymes. Circ. Res., 93: 262–269.
- Moncada S. (2000) Nitric oxide and cell. Respiration Physiology and Patology. Verk Kon. Acad. Genelsk Belg., 3(62): 171–179.
- Narin F., Narin F., Pasaoglu H. et al. (2003) Nitric oxide metabolities in acute rheumatic fever. Tohoku J. Exp. Med., 199(3): 135–139.
- Rivier C. (1998) Role of nitric oxide and carbon monoxide in modulating the ACTH response to immune and nonimmune signals. Neuroimmunomodulation, 5: 203–213.
- Van’T Hof R.J., Hocking L., Wright P.K. et al.(2000) Nitric oxide is a mediator of apoptosis in the rheumatoid joint. Rheumatology, 39(9): 1004–1008.
- Verbuggen A., De Clerck L.S., Bridts C.H. et al. (2000) Influence of blood and synovial fluid immune complexes of patients with rheumatoid arthritis on production of nitric oxide and growth and viability of chondrocytes. J. Rheumatol., 27(1): 35–40.
- Wanchu A., Khullar M., Sud A. et al. (2000) Elevated nitric oxide production in patients with primary Sjogren’s syndrome. Clin. Rheumatol., 19(5): 360–364.
СОДЕРЖАНИЕ МЕТАБОЛИТОВ ОКСИДА АЗОТА И ПРОВОСПАЛИТЕЛЬНЫХ ЦИТОКИНОВ У пациентов С ОСТРОЙ РЕВМАТИЧЕСКОЙ ЛИХОРАДКОЙ И ХРОНИЧЕСКОЙ РЕВМАТИЧЕСКОЙ БОЛЕЗНЮ СЕРДЦА
Резюме. У 74 больных (44 детей и 30 взрослых) с разными формами ревматизма изучали содержание провоспалительных цитокинов (фактора некроза опухоли (ФНО)-α и интерферона (ИФН-γ) ), уровень метаболитов оксида азота (нитрат- и нитрит-анионов) и активность супероксиддисмутазы. У детей с острой ревматической лихорадкой отмечали повышение уровня ФНО-α, ИФН-γ, увеличение содержания нитритов и нитратов в сыворотке крови у 90,9%, что, очевидно, имеет компенсаторно-приспособительное значение. У детей и взрослых с хронической ревматической болезню сердца выявлено повышение среднего показателя суммарного содержания нитритов и нитратов в сыроватке крови, при этом — снижение уровня метаболитов азота у 25,0% детей, что свидетельствует о напряжении в роботе оксид-азотсинтезирующей системы. Активация синтеза оксида азота у лиц с хронической ревматической болезнью сердца на фоне сниженной активности супероксиддисмутазы может усиливать оксидативный стресс и привести к прогрессированию болезни.
острая ревматическая лихорадка, хроническая ревматическая болезнь сердца, метаболиты оксида азота, провоспалительные цитокины.
Адреса для листування:
Боярчук Оксана Романівна
46000, Тернопіль, вул. Лесі Українки, 18/134
Тернопільський державний медичний
університет ім. І.Я. Горбачевського
E-mail: boyarchuk_oksana@mail.ru

Leave a comment