ПРОГРЕСУЮЧИЙ ЛЕГЕНЕВИЙ ФІБРОЗ: ЛІКУВАЛЬНО-ДІАГНОСТИЧНА ТАКТИКА ТА ЄДИНИЙ ЦІЛЬОВИЙ ПРЕПАРАТ
Резюме. Науково-практична конференція з міжнародною участю «Всеукраїнський ревматологічний форум–2022», проведена Всеукраїнською асоціацією ревматологів України у жовтні минулого року у Києві, запам’яталася цікавими доповідями та значним інтересом з боку численних учасників. Одна з новітніх концепцій, що обговорювали під час заходу, полягає у ранньому виявленні, моніторингу та лікуванні інтерстиціального захворювання легень — тяжкого ускладнення майже усіх ревматичних захворювань аутоімунного генезу. Інноваційний препарат, спеціально призначений для уповільнення постійно прогресуючого «самодостатнього» фіброзуючого процесу при інтерстиціальному захворюванні легень, — це нещодавно схвалений до застосування за відповідним показанням ОФЕВ® (нінтеданіб) компанії «Берінгер Інгельхайм Інтернешнл ГмбХ» (Німеччина).
DOI: 10.32471/rheumatology.2707-6970.89.17480
У яких дослідженнях та з якою метою вивчали останнім часом препарат нінтеданібу? Про це розповів професор Роман Яцишин, декан медичного факультету Івано-Франківського національного медичного університету у доповіді «Нінтеданіб у лікуванні пацієнтів з системним склерозом та прогреcуючим легеневим фіброзом». Як зазначив доповідач, цей препарат був вперше схвалений лише за одним показанням, а саме — лікування ідіопатичного фіброзу легень (ІФЛ) (табл. 1). Це — справді тяжка патологія, тому на ній було зроблено акцент з самого початку. Далі були інші дослідження, що дозволили розширити спектр клінічного використання нінтеданібу.
Даний препарат, як наголосив доповідач, має одразу декілька точок прикладання:
- є низькомолекулярним інгібітором тирозинкінази, який блокує рецептори, у тому числі фактор росту тромбоцитів (PDGFR) α та β, фактор росту фібробластів (FGFR) 1–3 і фактор росту ендотелію судин (VEGFR) 1–3;
- інгібує нерецепторні кінази Lck (лімфоцитспецифічна білкова тирозинкіназа), Lyn (білкова тирозинкіназа lyn), Src (протоонкогенна білкова тирозинкіназа src) та CSF1R (рецептор колонієстимулюючого фактора 1);
- перешкоджає проліферації та міграції первинних фібробластів у легенях людини.
Важливо, що нінтеданіб не тільки блокує певні інтерлейкіни, усуваючи запалення, але й інгібує вивільнення профіброзних медіаторів з моноцитарних клітин периферичної крові, гальмуючи запалення, ангіогенез, проліферацію, міграцію та виживання фібробластів. Таким чином, нінтеданіб стає на заваді реалізації патофізіологічних механізмів фіброзування.
Таблиця 1. Хронологія схвалення препарату нінтеданібу Управлінням з контролю за харчовими продуктами та лікарськими засобами (Food and Drug Administration — FDA) США за різними показаннями із зазначенням відповідних досліджень (http://www.accessdata.fda.gov)
| Дати схвалення | Показання | Дослідження |
|---|---|---|
| 15/10/2014 | Ідіопатичний легеневий фіброз (ІЛФ) | TOMORROW (II фази) та INPULSIS-1 та INPULSIS-2 (III фази) |
| 06/09/2019 | Інтерстиціальне захворювання легень при системній склеродермії (системному склерозі — ІЗЛ-СС) | SENSCIS (III фази) |
| 09/03/2020 | Інші хронічні фіброзуючі інтерстиціальні захворювання легень (ІЗЛ) з прогресуючим фенотипом у дорослих | INBUILD (III фази) |
Природний розвиток хронічних фіброзуючих ІЗЛ з прогресуючим фенотипом відповідає такому при ІЛФ та є:
- прогресуючим (збільшення вираженості респіраторних симптомів, прогресуюче зниження функції легень, зниження якості життя та рання смерть);
- «самодостатнім», за влучним висловом доповідача, з утворенням хибного кола патофізіологічних реакцій, своєрідного perpetuum mobile (лат.);
- незалежним від клінічної першопричини або стимулу.
Отже, якщо каскад патофізіологічних причин запущено, то навіть повністю усунувши вплив чинника, що його спричинив (наприклад після повного виведення вірусу SARS-CoV-2 з організму), зупинити таке фіброзування неможливо. Доводиться, як підкреслив Р. Яцишин, в обов’язковому порядку відслідковувати динаміку прогресування на основі функціональних легеневих тестів (ФЛТ), для яких притаманні зміни за рестриктивним типом, та комп’ютерної томографії з високою роздільною здатністю (КТВР). З огляду на швидкість прогресування та вираженість патологічних змін, що розвиваються, розробка ефективного препарату, здатного уповільнити прогресування фіброзу у зв’язку з рядом нозологій (табл. 2) відіграє таку важливу роль.
Таблиця 2. Можливі діагнози хворих із фіброзуючим ІЗЛ
| Ідіопатична неспецифічна інтерстиціальна пневмонія | Змішане захворювання сполучної тканини |
| Некласифікована ідіопатична інтерстиціальна пневмонія | ІЗЛ-СС |
| Гіперчутливий пневмоніт | ІЗЛ, пов’язане з експозицією (ліків, іонізуючого випромінювання, хімічних речовин тощо) |
| ІЗЛ, асоційоване з ревматоїдним артритом | Саркоїдоз |
| Інше фіброзуюче ІЗЛ |
Зокрема у дослідженні INBUILD взяли участь провідні країни світу — усього 15. Залучення пацієнтів із країн з високим рівнем доходу свідчить, що навіть для таких пацієнтів є актуальним отримати шанс стримати хворобу. Дизайн, як зазначив доповідач, цікавий тим, що за деякими з учасників, у тому числі тими, хто після закінчення терміну засліплення (52 тиж) перейшов з групи плацебо до активного лікування, спостерігають вже кілька років. Це важливо з огляду на можливість «феномену вислизання», якого у випадку нінтеданібу вдається уникати завдяки інгібуванню нерецепторних кіназ.
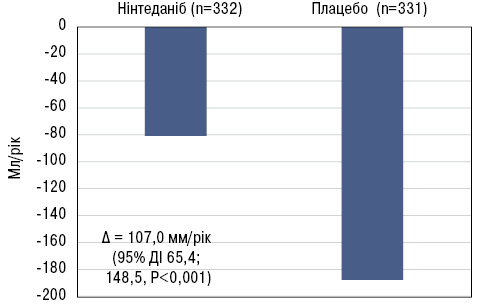
Окрім дослідження ефектів нінтеданібу, дослідження INBUILD дало змогу зрозуміти природну історію прогресуючих фіброзних ІЗЛ. Так, скоригована швидкість зниження функціональної життєвої ємності легень (ФЖЄЛ) протягом 52-тижневого періоду (первинна кінцева точка) становила −80,8 мл на рік у групі нінтеданібу та −187,8 мл на рік у групі плацебо (р<0,001) [1] (рис. 1). Безумовно, це дуже вагома різниця з клінічної точки зору, тим більше, що у пацієнтів також відзначали підвищення якості життя, виміряне за допомогою спеціального опитувальника (King’s Brief Interstitial Lung Disease Questionnaire — K-BILD).
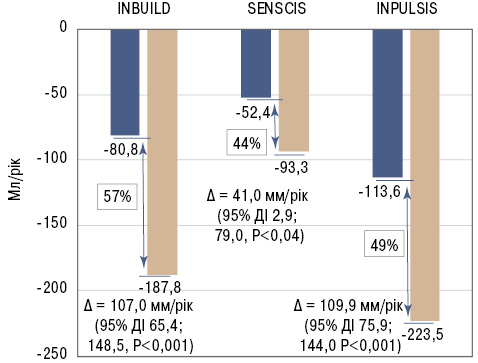
Подібними є темпи зниження функціональної здатності легень в різних популяціях згідно з результатами інших досліджень (рис. 2).
Достовірне зменшення кількості загострень ІЗЛ або випадків смерті на 33% є не менш важливим з клінічної точки зору показником, що свідчить не лише про підвищення якості, але й подовження тривалості життя (табл. 3).
Таблиця 3. Вторинна кінцева точка — загострення ІЗЛ або смерть учасників дослідження INBUILD [4]
| Показник | Нінтеданіб (n=332) | Плацебо (n=331) |
|---|---|---|
| Кількість пацієнтів з подіями, % | 46 (13,9%) | 65 (19,6%) |
| Кількість пацієнтів, що померли, % | 36 (10,8%) | 45 (13,6%) |
| Коефіцієнт ризику (КР) | 0,67, 95% довірчий інтервал (ДI) 0,46–0,98
Зниження на 33% |
|
| Значення р | 0,04 | |
 Профіль побічних ефектів нінтеданібу у пацієнтів із прогресуючою фіброзною ІЗЛ характеризується головним чином шлунково-кишковими явищами, зокрема діареєю [5]. Остання має переважно помірну вираженість та полегшується зі зниженням дози зі 150 до 100 мг. Частота кровотеч та серцево-судинних подій у двох групах майже не відрізнялася. Як наголосив Р. Яцишин, профіль безпеки нінтеданібу вигідно відрізняє його від глюкокортикоїдів. Підсумовуючи, він озвучив основні висновки за результатами INBUILD:
Профіль побічних ефектів нінтеданібу у пацієнтів із прогресуючою фіброзною ІЗЛ характеризується головним чином шлунково-кишковими явищами, зокрема діареєю [5]. Остання має переважно помірну вираженість та полегшується зі зниженням дози зі 150 до 100 мг. Частота кровотеч та серцево-судинних подій у двох групах майже не відрізнялася. Як наголосив Р. Яцишин, профіль безпеки нінтеданібу вигідно відрізняє його від глюкокортикоїдів. Підсумовуючи, він озвучив основні висновки за результатами INBUILD:
1) порівняно з групою плацебо у пацієнтів, що отримували нінтеданіб протягом 52 тиж, відзначено сповільнення прогресування ІЗЛ на 57%;
2) за час спостереження зафіксоване достовірне зниження ризику виникнення загострення ІЗЛ або смерті на 33%;
3) не отримано нових даних щодо побічних явищ, спричинених нінтеданібом.
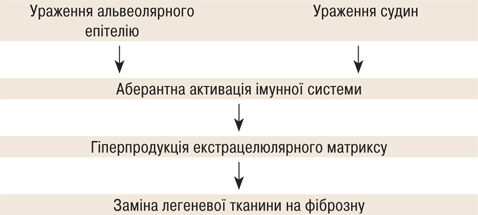
У доповіді «ССД-ІЗЛ: складні питання діагностики та лікування» Олена Гарміш, старший науковий співробітник відділу некоронарних хвороб серця, ревматології та терапії ДУ «ННЦ «Інститут кардіології, клінічної та регенеративної медицини імені академіка М.Д. Стражеска» НАМН України, розповіла про пов’язані із захворюванням складнощі. Отже, на відміну від усіх ревматичних захворювань, при яких основним патогенетичним процесом є запалення, ІЗЛ характеризується переважаючим фіброзом в якості першої та головної ланки. Тож при цій патології доводиться говорити не про терапевтичне вікно, якого фактично немає, а лише про діагностичне. Чим раніше ми діагностуємо захворювання, тим кращими будуть результати.
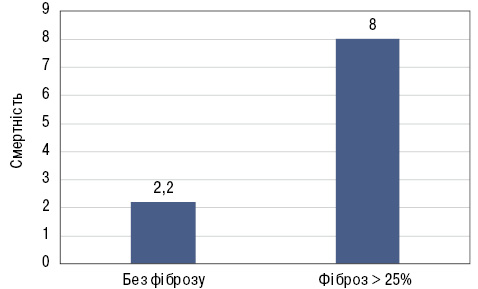
Фіброз є життєзагрозливим станом, який, на жаль, тривалий час залишається асимптомним. Наприклад, коли у пацієнта починається артрит, він поспішає до лікаря через біль та порушення функції. У той же час невелику задишку, характерну для ІЗЛ, часто відносять на рахунок серцево-судинних захворювань чи віку. Фіброз, ключовим механізмом якого є епітеліальне пошкодження, схожий з амілоїдозом за незворотністю та тяжкістю пошкодження, що розвивається. Так, пацієнти із фіброзом помирають у 4 рази частіше, ніж без фіброзу (рис. 3).
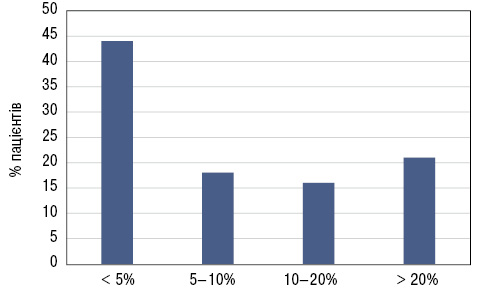
Важливо, що у половини пацієнтів відмічають легеневі ураження вже при первинному обстеженні, за даними багатьох досліджень (рис. 4). При цьому кожен п’ятий пацієнт має поширеність фіброзу >20%, тобто потребує протифіброзного лікування.
У патогенезі ІЗЛ-СС є дві ланки, які можуть бути як послідовними, так і паралельними (рис. 5). Як зазначила доповідач, з огляду на патогенез є доцільним поєднання нінтеданібу із протизапальною терапією імуносупресантами (циклофосфамід, метотрексат, ритуксимаб).
Зміни в інтерстиції легень за даними КТВР діагностують у 80% пацієнтів із системною склеродермією (СС), а при аутопсії — у 90%. Клінічно значуще ІЗЛ виявляють у 30% хворих із зазначеною патологією, при цьому 10-річна смертність становить 40% [7]. Важливо, що у переважній більшості випадків ІЗЛ розвивається у перші 5 років від початку СС. А якщо пацієнт хворіє більше ніж 15 років, вірогідність його розвитку є низькою. У перші 3 роки ІЗЛ має агресивний перебіг. До факторів, що асоційовані з розвитком патології легень при СС, відносять дифузне ураження шкіри, зміни на капіляроскопії, дигітальні виразки та наявність легеневої гіпертензії.
У хворих із СС важливо оцінювати розвиток ураження легень в динаміці:
1) ФЛТ проводити всім пацієнтам із СС, повторюючи їх кожні 3–6 міс протягом 3–5 років;
2) в подальшому пацієнтам без ІЗЛ-СС проводити ФЛТ щорічно, у іншому разі — за клінічної потреби;
3) КТВР проводять первинно та повторюють у разі критично значущого погіршення показників ФЛТ та появи нових симптомів ІЗЛ-СС.
Як і для інших хворих із системними ревматичними захворюваннями, при СС, особливо перед призначенням метотрексату, радять застосовувати тест з 6-хвилинною ходьбою. Варто пам’ятати, що показники ФЛТ можуть знижуватися за рахунок тяжкого фіброзу шкіри грудної клітки, м’язової слабкості, ХОЗЛ тощо. У той же час зниження дифузійної здатності легень (ДЗЛ) свідчить про легеневу гіпертензію.
Дослідження показують, що динаміка ФЛТ та ДЗЛ протягом перших 2 років спостереження є кращим предиктором смертності, ніж базові показники [8]. Тому пацієнтам із ІЗЛ-СС слід ретельно проводити функціональний моніторинг із оцінкою прогресування та своєчасно використовувати більш агресивний підхід до лікування. При цьому для визначення прогресуючого фіброзу використовують одне із визначень (табл. 4).
Таблиця 4. Визначення прогресуючого фіброзу легень [9, 10]
| Проєкт EUSTAR | Настанова США |
|---|---|
| Впродовж попередніх 12 міс | |
|
Зниження ФЖЄЛ на ≥10% або зниження ФЖЄЛ на 5—10% поряд зі зниженням ДЗЛ на 15% |
Зниження ФЖЄЛ на ≥5% або зниження ДЗЛ на ≥10% |
У американській настанові на додаток до результатів функціональної діагностики враховують також збільшення вираженості респіраторних симптомів та рентгенологічні ознаки прогресування (принаймні одна, включаючи нові ділянки матового скла, збільшення площі або тяжкості бронхоектазів, ретикулярних, сотових змін та втрату легеневої тканини). Розширення стравоходу, міокардіальний фіброз, легенева гіпертензія, поряд із більш відомими ознаками, такими як фіброз шкіри та дигітальні виразки, також є маркерами прогресування.
Спроба поєднати два патерни лікування — протифіброзне та протизапальне, тобто нінтеданіб та тоцилізумаб, представлена у нещодавно опублікованій статті авторів з США [11]. Тож якщо маємо ІЗЛ за даними КТВР, хворого слід поінформувати про захворювання, що несе загрозу скорочення тривалості життя. Тоді, як зазначила О. Гарміш, він сам буде зацікавлений у моніторингу. Головним принципом є протифіброзне лікування за наявності фіброзу, поєднання його із протизапальним (тоцилізумаб тощо) у разі високої активності СС, екстрапульмональних проявів. При цьому 6-хвилинний тест можна повторювати навіть щомісяця. Ефективність нінтеданібу не залежить від типу ураження шкіри (дифузна або обмежена СС) [12].
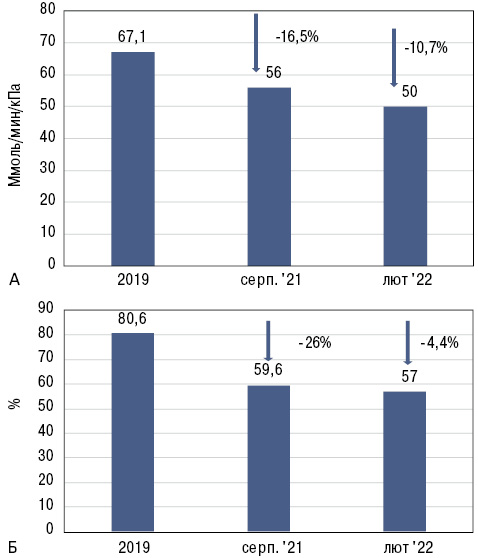
Власні спостереження О. Гарміш свідчать про високу клінічну ефективність нінтеданібу навіть у тяжких випадках. Так, представлено результати спостереження хворої віком 26 років зі швидким прогресуванням ІЗЛ-СС. Протягом 2-го року спостереження, коли пацієнтка приймала нінтеданіб, прогресування значно уповільнилося (рис. 6).
Завершуючи доповідь, О. Гарміш зазначила, що ІЗЛ розвивається не тільки при СС, але й інших аутоімунних захворюваннях: ревматоїдному артриті (7,7–10%), поліміозиті і дерматоміозиті (23,1–40,3%), синдромі Шегрена (10–20%), змішаному захворюванні сполучної тканини (41–78%). Тобто на прийомі в поліклініці ревматолог практично кожного дня може приймати хворих із ІЗЛ. Тому у настанові Американської колегії ревматології (American College of Rheumatology) пацієнтів із захворюванням легень виділено в окрему групу [13]. Замість альтернативних хворобомодифікуючих препаратів таким пацієнтам рекомендований метотрексат, хоча раніше вважали, що цей препарат викликає ураження легень.
За деякими даними, принаймні 14% пацієнтів із ревматоїдним артритом мають ураження легень за 1–5 років до встановлення діагнозу ревматоїдного артриту [14]. Незалежними предикторами погіршення перебігу ІЗЛ при ревматоїдному артриті є [15]:
- звичайна інтерстиціальна пневмонія (КР 2,6; 95% ДІ 1,0–6,7);
- ФЖЄЛ <80% (КР 3,8; 95% ДІ 1,5–6,7);
- титри антитіл до антицитрулінового білка (КР 2,8; 95% ДІ 1,1–6,8);
- куріння (КР 2,5; 95% ДІ 1,1–6,2).
І навпаки, лікування абатацептом, тоцилізумабом або ритуксимабом уповільнювало прогресування ІЗЛ на 50% (КР 0,4; 95% ДІ 0,2–0,8). У той же час інгібітори фактора некрозу пухлин (анти-ФНП, зокрема, інфліксимаб, етанерцепт та адалімумаб) були пов’язані з ризиком ураження легень [16]. Тому хворих при встановленні діагнозу ревматоїдного артриту потрібно дообстежувати, призначивши для початку тест 6-хвилинної ходьби, та не призначати анти-ФНП, якщо діагностовано ІЗЛ.
Тож що треба пам’ятати про ІЗЛ?
1. Воно є життєзагрозливим ускладненням майже всіх ревматичних захворювань.
2. У більшості випадків є клінічно асимптоматичним.
3. У таких пацієнтів раннє встановлення діагнозу поліпшує прогноз.
4. Усім пацієнтам при встановленні діагнозу СС необхідно проводити комп’ютерну томографію та ФЛТ.
5. При прогресуючому фіброзі слід негайно призначати протифіброзне лікування — нінтеданіб.
6. За наявності запальної активності призначають комбінацію протизапальної та протифіброзної терапії.
Лікування нінтеданібом як у моно-, так і у комбінованій терапії є адекватним, ефективним та зі сприятливим профілем безпеки.
Список використаної літератури
- 1. Flaherty K.R., Wells A.U., Cottin V. et al. (2019) Nintedanib in progressive fibrosing interstitial lung diseases. N. Engl. J. Med.; 381: 1718–1727.
- 2. Richeldi L., Cottin V., du Bois R.M. et al. (2016) Nintedanib in patients with idiopathic pulmonary fibrosis: Combined evidence from the TOMORROW and INPULSIS(®) trials. Respir. Med., Apr; 113: 74–9.
- 3. Distler O., Highland K.B., Gahlemann M. et al.; SENSCIS Trial Investigators (2019) Nintedanib for Systemic Sclerosis-Associated Interstitial Lung Disease. N. Engl. J. Med., Jun 27; 380(26): 2518–2528.
- 4. Flaherty K.R., Wells A.U., Cottin V. et al.; INBUILD Trial Investigators (2022) Nintedanib in progressive interstitial lung diseases: data from the whole INBUILD trial. Eur. Respir. J., Mar 17; 59(3): 2004538.
- 5. Cottin V., Martinez F.J., Jenkins R.G. et al. (2022) Safety and tolerability of nintedanib in patients with progressive fibrosing interstitial lung diseases: data from the randomized controlled INBUILD trial. Respir. Res., Apr 7; 23(1): 85.
- 6. Hoffmann-Vold A.M., Fretheim H., Halse A.K. et al. (2019) Tracking Impact of Interstitial Lung Disease in Systemic Sclerosis in a Complete Nationwide Cohort. Am. J. Respir. Crit. Care Med., Nov 15; 200(10): 1258–1266.
- 7. Perelas A., Silver R.M., Arrossi A.V. et al. (2020) Systemic sclerosis-associated interstitial lung disease. Lancet Respir. Med., Mar; 8(3): 304–320.
- 8. Volkmann E.R., Tashkin D.P., Sim M. et al.; SLS I and SLS II study groups (2019) Short-term progression of interstitial lung disease in systemic sclerosis predicts long-term survival in two independent clinical trial cohorts. Ann. Rheum. Dis., Jan; 78(1): 122–130.
- 9. Hoffmann-Vold A.M., Allanore Y., Alves M. et al.; EUSTAR collaborators (2021) Progressive interstitial lung disease in patients with systemic sclerosis-associated interstitial lung disease in the EUSTAR database. Ann. Rheum. Dis., Feb; 80(2): 219–227.
- 10. Raghu G., Remy-Jardin M., Richeldi L. et al. (2022) Idiopathic Pulmonary Fibrosis (an Update) and Progressive Pulmonary Fibrosis in Adults: An Official ATS/ERS/JRS/ALAT Clinical Practice Guideline. Am. J. Respir. Crit. Care Med., May 1; 205(9): e18–e47.
- 11. Khanna D., Lescoat A., Roofeh D. et al. (2022) Systemic Sclerosis-Associated Interstitial Lung Disease: How to Incorporate Two Food and Drug Administration-Approved Therapies in Clinical Practice. Arthritis Rheumatol., Jan; 74(1): 13–27.
- 12. Distler O., Gahlemann M., Maher T.M. (2019) Nintedanib for Systemic Sclerosis-Associated Interstitial Lung Disease. Reply. N. Engl. J. Med., Oct 17; 381(16): 1596–1597.
- 13. Fraenkel L., Bathon J.M., England B.R. et al. (2021) American College of Rheumatology guideline for the treatment of rheumatoid arthritis. Arthritis Rheumatol.; 73: 1108–1123.
- 14. Chen Y.J., Liu S.C., Lai K.L. et al. (2021) Factors associated with risk of major adverse cardiovascular events in patients with rheumatoid arthritis: a nationwide, population-based, case-control study. Ther. Adv. Musculoskelet Dis., Aug 26; 13: 1759720X211030809.
- 15. Mena-Vázquez N., Rojas-Gimenez M., Romero-Barco C.M. et al. (2021) Predictors of Progression and Mortality in Patients with Prevalent Rheumatoid Arthritis and Interstitial Lung Disease: A Prospective Cohort Study. J. Clin. Med., Feb 20; 10(4): 874.
- 16. Carrasco Cubero C., Chamizo Carmona E., Vela Casasempere P. (2021) Systematic review of the impact of drugs on diffuse interstitial lung disease associated with rheumatoid arthritis. Reumatol. Clin. (Engl. Ed.), Nov; 17(9): 504–513.

Leave a comment