ДОКАЗОВІ ДАНІ ПРО БЕЗПЕКУ НІМЕСУЛІДУ — РЕАЛЬНОЇ АЛЬТЕРНАТИВИ КОКСИБАМ
Резюме. Німесулід завдяки швидкому протизапальному та знеболювальному ефекту був і залишається одним з найбільш затребуваних нестероїдних протизапальних препаратів (НПЗП). Так, в Україні за кількістю призначень лікарів поза стаціонарами він займає 4-те місце у своїй групі [1]. При цьому уявлення про різні аспекти фармакологічної дії даного НПЗП продовжують розвиватися, а також стають зрозумілими нові молекулярні механізми, що лежать в основі його протизапальної дії та сприятливого профілю безпеки стосовно шлунково-кишкового тракту та серцево-судинної системи. Враховуючи значно розширені фармакотерапевтичні уявлення, можна краще окреслити сферу застосування німесуліду та навіть намітити для нього нові перспективні терапевтичні напрями.
DOI: 10.32471/rheumatology.2707-6970.89.17400
Німесулід є селективним інгібітором циклооксигенази (ЦОГ)-2, нестероїдним протизапальним препаратом (НПЗП); його відкрито у 1971 р. та вперше комерційно використано в Італії в 1985 р. [2]. Існує багато доказів того, що фармакологічний профіль німесуліду своєрідний і не схожий на такий інших селективних інгібіторів ЦОГ-2, що свідчить про деякі молекулярні механізми, окрім інгібування ЦОГ-2, у реалізації його протизапальної, жарознижувальної та знеболювальної дії.
Подібним чином експериментальні дані щодо профілю шлунково-кишкової безпеки німесуліду є підтвердженням того, що вона не може бути реалізована лише за рахунок ефекту збереження ЦОГ-1 (співвідношення інгібуючої концентрації (IC50) ЦОГ-2/ЦОГ-1 — 0,038 [3]. Ефективність німесуліду при запальному процесі залежить від широкого спектру дії, що зумовлено поєднанням впливу на імунні та неімунні клітини, зазначають дослідники з Неапольського університету (University of Naples), Італія. Навіть синтезований він був для поглинання супероксидних аніонів на основі концепції, що вільні радикали є критичними факторами хронічних запальних захворювань, додають автори [2]. У виконаному ними огляді продемонстровано, що німесулід, на відміну від інших НПЗП, виявляє численні фармакологічні ефекти, досліджені in vivo, серед яких інгібування проліферації ракових клітин [4, 5], захист виразок, спричинених НПЗП [6, 7], а також здатність протидіяти глікозилюванню, що відкриває шлях до потенційного застосування в якості протидіабетичного засобу.
Німесулід і запалення
Після відкриття у 1990-х роках двох ізоформ ЦОГ (ЦОГ-1 і ЦОГ-2) розроблено низку селективних інгібіторів ЦОГ-2 на основі припущення, що простагландини, корисні для шлунково-кишкової та ниркової функції, виробляються виключно через ЦОГ-1, тоді як ті, що опосередковують запалення та біль, — лише через індуцибельну ізоформу ферменту ЦОГ-2.
Згодом цю концепцію було переглянуто. Стало відомо, що ЦОГ-2 експресується не тільки при запаленні, а й конститутивно в деяких тканинах. Простагландини, похідні ЦОГ-1, також беруть участь у запаленні, а захисної дії щодо ЦОГ-1 недостатньо для уникнення шлунково-кишкової токсичності.
Здатність німесуліду впливати на різні медіатори та внутрішньоклітинні шляхи, що зумовлюють виникнення болю при запаленні, забезпечує йому унікальний багатофакторний механізм дії.
Є багато доказів того, що ефективність німесуліду виходить за рамки інгібування ЦОГ-2 завдяки поєднанню впливу на імунні та неімунні клітини та позаклітинний матрикс з біохімічним механізмом, який взагалі не встановлений. У вищезгаданому огляді італійських авторів E. Caiazzo та співавторів [2] процитовано дослідження, згідно з якими німесулід :
- пригнічує поліморфноядерну та еозинофільну активацію і хемотаксис зі зниженням вивільнення цитокінів;
- перешкоджає активації гладких клітин та вивільненню гістаміну;
- захищає від деградації хряща, стимульованої цитокінами, завдяки інгібуванню металопротеїназ;
- пригнічує функцію нейтрофілів in vitro через пряму взаємодію з рецепторами аденозину;
- інгібує синтез лейкотрієну сильніше, ніж сальметерол.
Швидкість розвитку знеболювального ефекту
Німесулід добре всмоктується при пероральному прийомі. Після застосування одноразової дози, що становить 100 мг, максимальна концентрація в плазмі крові у дорослих досягається через 2–3 год. Також відносно високі концентрації німесуліду швидко досягаються в синовіальній рідині, що сприяє зменшенню вираженості запалення у пацієнтів з остеоартритом [8]. До того ж він забезпечує швидкий початок анальгезивної дії, порівнянний лише із НПЗП у розроблених спеціально для прискореного вивільнення лікарських формах. Так, у дослідженні in vivo тільки німесулід був ефективним проти болю через 15 хв після введення, на відміну від диклофенаку, целекоксибу та рофекоксибу [9].
Німесулід виявився дуже ефективним у лікуванні артралгії, а також головного болю та альгодисменореї. Значне зменшення вираженості болю відмічали протягом 15–30 хв після прийому препарату.
За ефективністю німесулід (100 мг 2 рази на добу) забезпечив більш виражене полегшення післяопераційного болю, ніж напроксен (500 мг 2 рази на добу) у багатоцентровому подвійному сліпому рандомізованому дослідженні з паралельними групами. У пацієнтів з остеоартритом колінного суглоба разова доза німесуліду (100 мг) забезпечувала вищу ефективність і більш швидкий початок анальгезивної дії, ніж порівнянна разова доза целекоксибу (200 мг) та рофекоксибу (25 мг) у проспективному рандомізованому подвійному сліпому дослідженні [10].
Німесулід і шлунково-кишковий тракт
Пошкодження слизової оболонки шлунково-кишкового тракту, що призводить до геморагічних уражень і виразок, є поширеним побічним ефектом НПЗП. Його пов’язують із комбінованим пригніченням ЦОГ-1 і ЦОГ-2, що спричиняє дисбаланс у місцевій продукції простагландинів, лейкотрієнів та 5-гідроксиейкозатетраєнової кислоти, зниження кровотоку разом із підвищенням адгезії лейкоцитів.
Ризик ускладнень з боку шлунково-кишкового тракту при застосуванні німесуліду нижчий, ніж при застосуванні багатьох інших НПЗП.
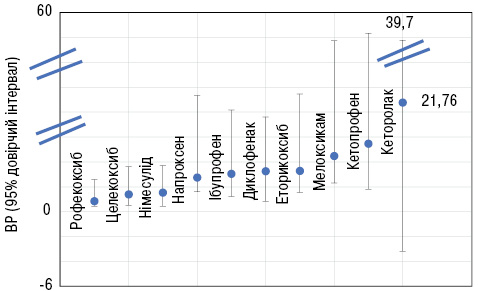
Згідно з результатами епідеміологічного дослідження відносний ризик верхніх відділів шлунково-кишкового тракту (1,53) на фоні застосування німесуліду був порівнянним із таким у найбільш «захищених» в цьому відношенні НПЗП: рофекоксибу (0,84) та целекоксибу (1,38). У напроксену (2,74), ібупрофену (3,04) та диклофенаку (3,24) він був суттєво вищим та дуже високим (≥5) у кетопрофену, піроксикаму та кеторолаку [11].
Переконливі докази додаткового механізму, що лежить в основі фармакологічних ефектів німесуліду, крім відносно селективного інгібування ЦОГ-2, базуються на оцінці його впливу на шлунково-кишковий тракт. Дійсно, німесулід in vivo захищає шлунок від індометацин-індукованих пошкоджень [6] та знижує стимульовану секрецію кислоти. Вірогідно, що антиоксидантний ефект німесуліду та подальше пригнічення вироблення ейкозаноїдів (простагландинів та лейкотрієнів) можуть діяти в синергії з пригніченням ЦОГ-2 для захисту тканин від пошкодження [2].
Німесулід та печінка
Повідомлення про рідкісні та непередбачувані ураження печінки під час терапії німесулідом стали причиною відкликання його з ринків декількох країн. Пов’язану із цим повну оцінку Європейським агентством з лікарських засобів (European Medicines Agency — EMA) користі та ризиків німесуліду було закінчено у 2012 р. із висновком щодо переваг німесуліду, які превалюють над ризиками у пацієнтів із гострим болем і первинною дисменореєю [12]. При цьому тривалість лікування не повинна перевищувати 15 днів поспіль, а добова доза — 200 мг.
Згідно з результатами міжнародного дослідження (SALT) частота печінкової недостатності, що є показанням до трансплантації, на 1 млн років лікування становила 1,59 для всіх НПЗП і 1,88 — для німесуліду [13]. При цьому парацетамол у терапевтичних дозах призводив до печінкової недостатності вдвічі частіше, ніж НПЗП.
Частота спонтанних повідомлень на 10 млн встановлених добових доз (defined daily dose — DDD) свідчить про те, що ризик ураження печінки під час прийому німесуліду вищий, ніж для кетопрофену, ібупрофену, мелоксикаму, диклофенаку та напроксену та подібний до целекоксибу, піроксикаму, парацетамолу та суліндаку, вказано у зазначеному вище звіті EMA.
Щоб убезпечитися від ураження печінки, яке у більшості випадків є зворотним, пацієнтам із анорексією, нудотою, блюванням, болем у животі, втомлюваністю, темним кольором сечі, або у разі відхилення функціональних лабораторних показників, слід припинити терапію. Під час лікування німесулідом рекомендується уникати одночасного застосування гепатотоксичних препаратів та утримуватися від вживання алкоголю.
Сучасне позиціонування
Ретельний аналіз епідеміологічних та клінічних даних, які було виконано з приводу занепокоєння відносно гепатотоксичності, дозволив оновити експертні уявлення щодо профілю ефективності та безпеки німесуліду. Консенсусна міжнародна група (Consensus Meeting Group on the Role of Nimesulide in Acute Pain), що працювала у 2014 р., підтвердила цінність німесуліду в якості безпечної при правильному використанні терапевтичної можливості [14]. На основі оновлених доказів експерти дійшли висновку, що цей НПЗП особливо підходить для лікування різних форм гострого запального болю, такого як скелетно-м’язовий, поперековий, післяопераційний (або травматичний), головний, включаючи мігрень, альгодисменореї та гострого нападу подагри. Належне застосування німесуліду пов’язане з хорошою переносимістю та профілем безпеки, подібним до інших НПЗП, але з нижчим ризиком розвитку шлунково-кишкової токсичності, ніж у багатьох інших препаратів цієї групи. Частота серйозних побічних дій з боку печінки становить близько 0,1 на 100 тис. пролікованих пацієнтів, що знаходиться в діапазоні інших НПЗП, які широко застосовуються в клінічній практиці. Як зазначено в експертному висновку, німесулід можна вважати цінною альтернативою коксибам через його порівнянну ефективність і нижчий серцево-судинний ризик.
Отже, німесулід є швидкодіючим НПЗП, «родзинкою» якого є хондропротекторна дія [15, 16] та порівнянна безпека щодо шлунково-кишкового тракту. До того ж зручність прийому — один із ключових факторів, що визначають прихильність пацієнта до лікування та готовність лікарів до призначення, у препарату в формі гранул для оральної суспензії знаходиться на найвищому рівні.
Список використаної літератури
- 1. Проєкт «Rx test — Моніторинг призначень лікарських засобів» компанії «Proxima Research» (2022) Неопубліковані дані за III кв. 2022 р. стосовно групи АТС M01A.
- 2. Caiazzo E., Ialenti A., Cicala C. (2019) The relatively selective cyclooxygenase-2 inhibitor nimesulide: What’s going on? Eur. J. Pharmacol., Apr 5; 848: 105–111.
- 3. Warner T.D., Giuliano F., Vojnovic I. et al. (1999) Nonsteroid drug selectivities for cyclo-oxygenase-1 rather than cyclo-oxygenase-2 are associated with human gastrointestinal toxicity: a full in vitro analysis. Proc. Natl. Acad. Sci. U S A, Jun 22; 96(13): 7563-8. doi: 10.1073/pnas.96.13.7563. Erratum in: Proc Natl Acad Sci USA 1999 Aug 17; 96(17): 9666.
- 4. Kawaguchi Y., Ohshio Y., Watanabe A. et al. (2022) Depletion of tumor-associated macrophages inhibits the lung cancer growth and enhances the antitumor effect of cisplatin. Cancer Sci, Nov 21.
- 5. Liang Z., Liu J., Li L. et al. (2014) Effect of nimesulide on the growth of human laryngeal squamous cell carcinoma. Am. J. Otolaryngol., Mar-Apr; 35(2): 120–9.
- 6. Suleyman H., Cadirci E., Albayrak A. et al. (2008) Nimesulide is a selective COX-2 inhibitory, atypical non-steroidal anti-inflammatory drug. Curr. Med. Chem.; 15(3): 278–83.
- 7. Suleyman H., Halici Z., Cadirci E. et al. (2007) Indirect role of alpha2-adrenoreceptors in anti-ulcer effect mechanism of nimesulide in rats. Naunyn Schmiedebergs Arch. Pharmacol., May; 375(3): 189–98.
- 8. Bianchi M., Ferrario P., Balzarini P. et al. (2006) Plasma and synovial fluid concentrations of nimesulide and its main metabolite after a single or repeated oral administration in patients with knee osteoarthritis. J. Int. Med. Res.; 34: 348–54.
- 9. Bianchi M., Broggini M. (2002) Anti-hyperalgesic effects of nimesulide: studies in rats and humans. Int. J. Clin. Pract. Suppl. Jul; (128): 11–9.
- 10. Bianchi M., Broggini M. (2003) A randomised, double-blind, clinical trial comparing the efficacy of nimesulide, celecoxib and rofecoxib in osteoarthritis of the knee. Drug; 63, Suppl. 1: 37–46.
- 11. Castellsague J., Pisa F., Rosolen V. et al. (2013) Risk of upper gastrointestinal complications in a cohort of users of nimesulide and other nonsteroidal anti-inflammatory drugs in Friuli Venezia Giulia, Italy. Pharmacoepidemiol Drug Saf., Apr; 22(4): 365–75.
- 12. European Medicines Agency Assessment report for Nimesulide containing medicinal products-Procedure number: EMEA/H/A-31/1261- 20 January (2012) http://www.ema.europa.eu/docs/en_GB/document_library/Referrals_document/Nimesulide_31/WC500125574.pdf.
- 13. Basbaum A.I., Bautista D.M., Scherrer G. et al. (2009) Cellular and molecular mechanisms of pain. Cell; 139: 267–84.
- 14. Kress H.G., Baltov A., Basiński A. et al. (2016) Acute pain: a multifaceted challenge — the role of nimesulide. Curr. Med. Res. Opin.; 32(1): 23–36.
- 15. Manicourt D.H., Bevilacqua M., Righini V. et al. (2005)Comparative effect of nimesulide and ibuprofen on the urinary levels of collagen type II C-telopeptide degradation products and on the serum levels of hyaluronan and matrix metalloproteinases-3 and -13 in patients with flare-up of osteoarthritis. Drugs R D.; 6(5): 261–71.
- 16. Ding C. (2002) Do NSAIDs affect the progression of osteoarthritis? Inflammation. Jun; 26(3): 139–42.

Leave a comment